Similar presentations:
Химический элемент титан
1. Ti-титан
•План•Как
открыли?
•Нахождения в природе
• география место рождения
•Как обрабатывается
•История применения металла
•Где используется как применяется
•Физические свойства
•химические свойства
•Применения в военных целях
•Бытовое использования
•Использование в медицине
•Обобщение и вывод
•конец
2. Как открыли?
Титан открыл Христиан Гюйгенс
В 1795 г. немецкий химик Клапрот открыл в минерале рутиле
новый элемент и назвал его титаном.
Открытие TiO2 сделали практически одновременно и
независимо друг от друга англичанин У. Грегор и
немецкий химик М. Г. Клапрот. У. Грегор, исследуя
состав магнитного железистого песка, выделил новую
«землю» неизвестного металла, которую назвал
менакеновой. В 1795 г. немецкий химик Клапрот открыл
в минерале рутиле новый элемент и назвал его титаном.
Спустя два года Клапрот установил, что рутил и
менакеновая земля — окислы одного и того же элемента,
за которым и осталось название «титан», предложенное
Клапротом. Через 10 лет открытие титана состоялось в
третий раз. Французский учёный Л. Воклен обнаружил
титан в анатазе и доказал, что рутил и анатаз —
идентичные окислы титана.
3.
4. Нахождение в природе
Титан находится на 10-м месте по распространённости в природе.Содержание в земной коре 0,57 % по массе, в морской воде 0,001
мг/л. В ультраосновных породах 300 г/т, в основных — 9 кг/т, в
кислых 2,3 кг/т, в глинах и сланцах 4,5 кг/т. В земной коре титан
почти всегда четырёхвалентен и присутствует только в кислородных
соединениях. В свободном виде не встречается. Титан в условиях
выветривания и осаждения имеет геохимическое сродство с Al2O3.
Он концентрируется в бокситах коры выветривания и в морских
глинистых осадках. Перенос титана осуществляется в виде
механических обломков минералов и в виде коллоидов. До 30 %
TiO2 по весу накапливается в некоторых глинах. Минералы титана
устойчивы к выветриванию и образуют крупные концентрации в
россыпях. Известно более 100 минералов, содержащих титан.
Важнейшие из них: рутил TiO2, ильменит FeTiO3, титаномагнетит
FeTiO3 + Fe3O4, перовскит CaTiO3, титанит CaTiOSiO4. Различают
коренные руды титана — ильменит-титаномагнетитовые и
россыпные — рутил-ильменит-цирконовые.
5.
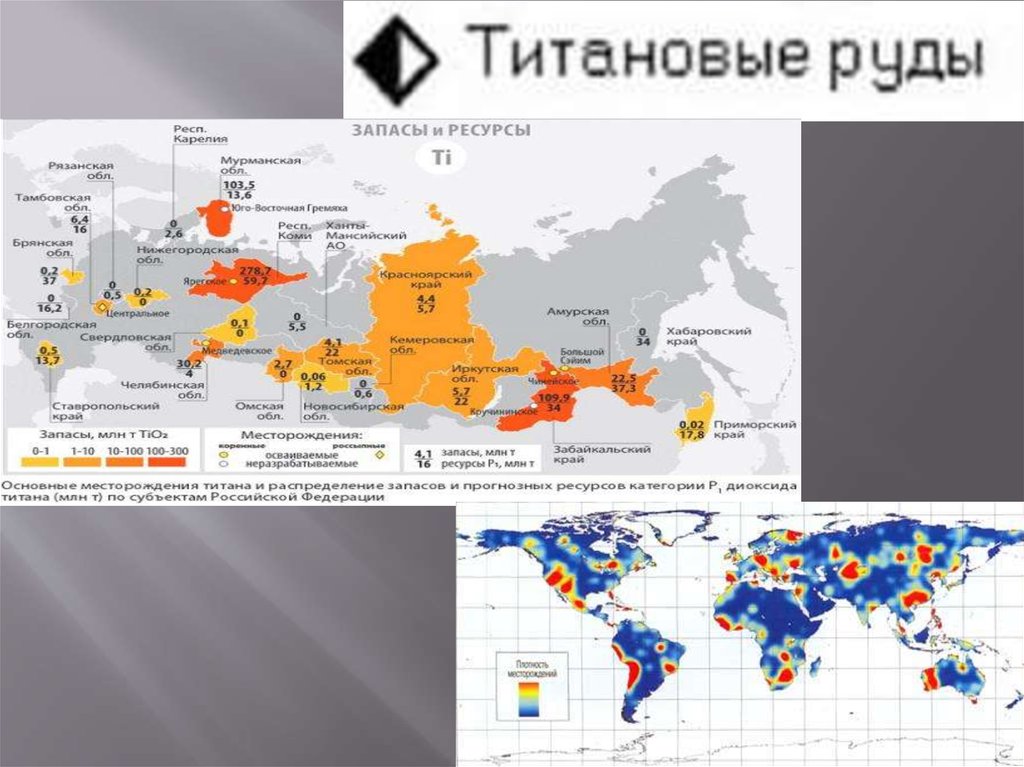
6. география место рождениф
Месторождения титана находятся на территорииЮАР, России, Украины, Китая, Японии, Австралии,
Индии, Цейлоне, Бразилии, Южной Кореи,
Казахстана.
Россия обладает вторыми в мире, после Китая,
запасами титана. Минерально-сырьевую базу титана
России составляют 20 месторождений, достаточно
равномерно рассредоточенных по территории
страны. Самое крупное из разведанных
месторождений находится в 25 км от города Ухта.
Запасы месторождения оцениваются в 2 миллиарда
тонн руды со средним содержанием диоксида титана
около 10 %.
7.
8. Как обрабатывается
Как правило, исходным материалом для производстватитана и его соединений служит диоксид титана со
сравнительно небольшим количеством примесей. В
частности, это может быть рутиловый концентрат,
получаемый при обогащении титановых руд. Однако
запасы рутила в мире весьма ограничены, и чаще
применяют так называемый синтетический рутил или
титановый шлак, получаемые при переработке
ильменитовых концентратов. Для получения титанового
шлака ильменитовый концентрат восстанавливают в
электродуговой печи, при этом железо отделяется в
металлическую фазу, а невосстановленные оксиды
титана и примесей образуют шлаковую фазу. Богатый
шлак перерабатывают хлоридным или сернокислотным
способом.
9.
Титановое литье выполняют в вакуумных печах в графитовые формы. Такжеиспользуется вакуумное литье по выплавляемым моделям. Из-за технологических
трудностей, в художественном литье используется ограниченно. Первой в
мировой практике монументальной литой скульптурой из титана является
памятник Юрию Гагарину на площади его имени в Москве.
Титан является легирующей добавкой в некоторых марках стали.
Нитинол — сплав, обладающий памятью формы, применяемый в медицине и
технике.
Алюминиды титана являются очень стойкими к окислению и жаропрочными, что
в свою очередь определило их использование в авиации и автомобилестроении в
качестве конструкционных материалов.
Титановое литье выполняют в вакуумных печах в графитовые формы. Также используется вакуумное литье по
выплавляемым моделям. Из-за технологических трудностей, в художественном литье используется ограниченно.
Первой в мировой практике монументальной литой скульптурой из титана является памятник Юрию Гагарину на
площади его имени в Москве.
Титан является легирующей добавкой в некоторых марках стали.
Нитинол — сплав, обладающий памятью формы, применяемый в медицине и технике.
Алюминиды титана являются очень стойкими к окислению и жаропрочными, что в свою очередь определило их
использование в авиации и автомобилестроении в качестве конструкционных материалов.
10.
В виде соединенийБелый диоксид титана используется в красках, а также при производстве бумаги и пластика. Пищевая
добавка E171.
Титанорганические соединения применяются в качестве катализатора и отвердителя в химической и
лакокрасочной промышленности.
Неорганические соединения титана применяются в химической электронной, стекловолоконной
промышленности в качестве добавки или покрытий.
Диборид титана — важный компонент сверхтвёрдых материалов для обработки металлов.
Нитрид титана применяется для покрытия инструментов.
Титанат бария BaTiO3, титанат свинца PbTiO3 и ряд других титанатов —- сегнетоэлектрики.
Анализ рынков потребления
В 2005 компания Titanium Corporation опубликовала следующую оценку потребления титана в мире:
60 % — краска;
20 % — пластик;
13 % — бумага;
7 % — машиностроение.
Цены
15-25 $ за килограмм, в зависимости от чистоты.
Чистота и марка чернового титана обычно определяется по степени её пластичности.
Цена ферротитана на 22.12.2010 $6,82 за килограмм. На 01.01.2010 цена была на уровне $5,00 за килограмм.
11.
12. История применения металла
13.
14. Где/как используется как применяется
https://www.youtube.com/watch?v=-wVfhEdWaDk1.Высокопрочные и конструкционные – прочные титановые сплавы,
которые обладают также достаточно высокой пластичностью. За
счет этого они могут применяться при изготовлении деталей, на
которые оказывается переменная нагрузка.
2.Жаропрочные с низкой плотностью применяются как более
дешевая альтернатива жаропрочным никелевым сплавам с учетом
определенного температурного интервала. Прочность подобного
титанового сплава может варьироваться в достаточно большом
диапазоне, что зависит от конкретного химического состава.
3.Титановые сплавы на основе химического соединения
представляют жаропрочную структуру с низкой плотностью. За счет
существенного снижения плотности вес также снижается, а
жаропрочность позволяет использовать материал при изготовлении
летательных аппаратов. Кроме этого с подобной маркой связывают
также высокую пластичность.
15.
16. Физические свойства
Титан — легкий серебристо-белый металл. Существует в двухкристаллических модификациях: α-Ti с гексагональной
плотноупакованной решёткой, β-Ti с кубической
объёмноцентрированной упаковкой, температура перехода
α↔β 883 °C, ΔH перехода 3,8 кДж/моль. Точка плавления
1660±20 °C, точка кипения 3260 °C, плотность α-Ti и β-Ti
соответственно равна 4,505 и 4,32 г/см³
Имеет высокую вязкость, при механической обработке
склонен к налипанию на режущий инструмент, и поэтому
требуется нанесение специальных покрытий на инструмент,
различных смазок.
При обычной температуре покрывается защитной
пассивирующей плёнкой оксида TiO2, благодаря этому
коррозионностоек в большинстве сред.
Титановая пыль имеет свойство взрываться. Температура
вспышки 400 °C. Титановая стружка пожароопасна.
17.
18. химические свойства
Устойчив к коррозии благодаря оксидной плёнке, но при измельчении в порошок, а также втонкой стружке или проволоке титан пирофорен.
Титан устойчив к разбавленным растворам многих кислот и щелочей.
Легко реагирует даже со слабыми кислотами в присутствии комплексообразователей, например, с
плавиковой кислотой HF он взаимодействует благодаря образованию комплексного аниона.
При нагревании на воздухе до 1200 °C Ti загорается с образованием оксидных фаз переменного
состава TiOx. Из растворов солей титана осаждается гидроксид TiO2·xH2O, осторожным
прокаливанием которого получают оксид TiO2. Гидроксид TiO2·xH2O и диоксид TiO2 амфотерны.
TiO2 взаимодействует с серной кислотой при длительном кипячении. При сплавлении с содой
Na2CO3 или поташом K2CO3 оксид TiO2 образует титанат: TiO2+K2CO3=K2TiO3+CO2.
При нагревании Ti взаимодействует с галогенами. Тетрахлорид титана TiCl4 при обычных
условиях — бесцветная жидкость, сильно дымящая на воздухе, что объясняется сильным
гидролизом TiCl4 содержащимися в воздухе парами воды и образованием мельчайших капелек
HCl и взвеси гидроксида титана.
Восстановлением TiCl4 водородом, алюминием, кремнием, другими сильными восстановителями,
получен трихлорид и дихлорид титана TiCl3 и TiCl2 — твёрдые вещества с сильно
восстановительными свойствами. Ti взаимодействует с Br2 и I2.
С азотом N2 выше 400 °C титан образует нитрид TiNx. При взаимодействии титана с углеродом
образуется карбид титана TiCx.
При нагревании Ti поглощает H2 с образованием соединения переменного состава TiHх. При
нагревании эти гидриды разлагаются с выделением H2. Титан образует сплавы со многими
металлами.
Титан — элемент побочной подгруппы четвёртой группы, четвёртого периода периодической
системы химических элементов Д. И. Менделеева, с атомным номером 22. Простое вещество
титан — лёгкий металл серебристо-белого цвета. Существует в двух кристаллических
модификациях: α-Ti с гексагональной плотноупакованной решёткой, β-Ti с кубической объёмноцентрированной упаковкой, температура полиморфного превращения α↔β 883 °C. Температура
плавления 1660±20 °C.
19.
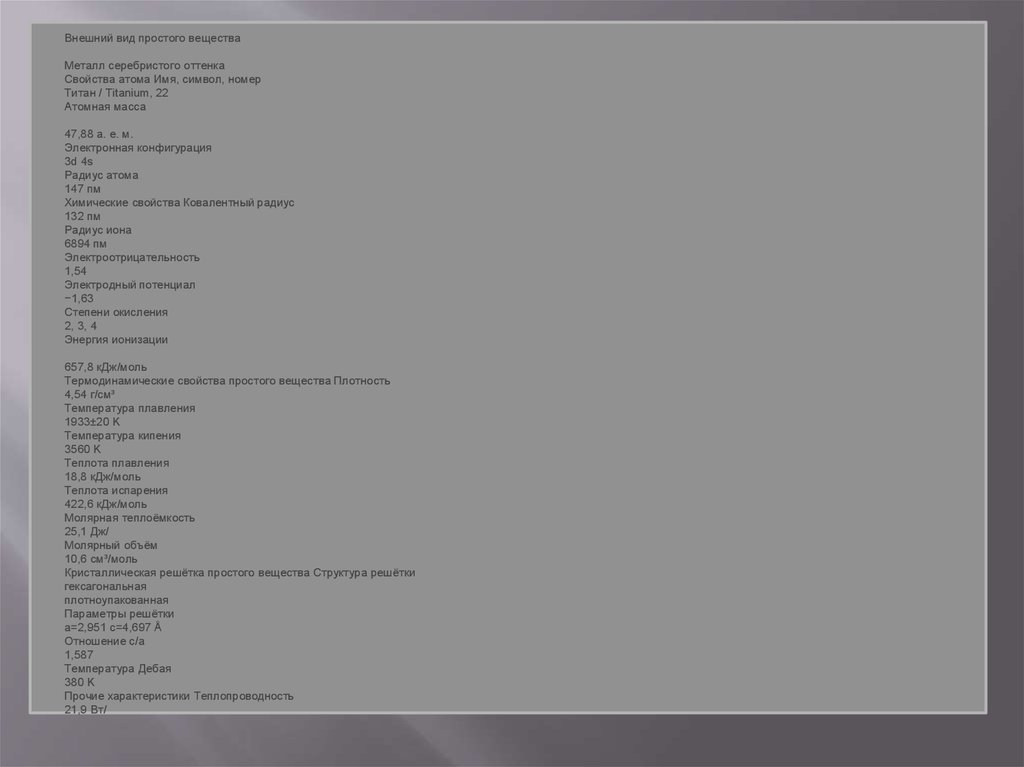
Внешний вид простого веществаМеталл серебристого оттенка
Свойства атома Имя, символ, номер
Титан / Titanium, 22
Атомная масса
47,88 а. е. м.
Электронная конфигурация
3d 4s
Радиус атома
147 пм
Химические свойства Ковалентный радиус
132 пм
Радиус иона
6894 пм
Электроотрицательность
1,54
Электродный потенциал
−1,63
Степени окисления
2, 3, 4
Энергия ионизации
657,8 кДж/моль
Термодинамические свойства простого вещества Плотность
4,54 г/см³
Температура плавления
1933±20 K
Температура кипения
3560 K
Теплота плавления
18,8 кДж/моль
Теплота испарения
422,6 кДж/моль
Молярная теплоёмкость
25,1 Дж/
Молярный объём
10,6 см³/моль
Кристаллическая решётка простого вещества Структура решётки
гексагональная
плотноупакованная
Параметры решётки
a=2,951 с=4,697 Å
Отношение c/a
1,587
Температура Дебая
380 K
Прочие характеристики Теплопроводность
21,9 Вт/
20. *применения*
военной промышленности, промышленныхпроцессах, автомобильной промышленности,
сельскохозяйственной промышленности,
пищевой промышленности, украшениях для
пирсинга, медицинской промышленности,
стоматологических и эндодонтических
инструментах, зубных имплантатах, спортивных
товарах, ювелирных изделиях, мобильных
телефонах, лёгких сплавах и т. д. Является
важнейшим конструкционным материалом в
авиа-, ракето-, кораблестроении.
21. Применения в военных целях
Самоолёты. Авиация. Малый удельный вес и высокая прочность (особенно приповышенных температурах) титана и его сплавов делают их весьма ценными
авиационными материалами. В области самолетостроения и производства авиационных
двигателей титан все больше вытесняет алюминий и нержавеющую сталь. С повышением
температуры алюминий быстро утрачивает свою прочность. С другой стороны, титан
обладает явным преимуществом в отношении прочности при температуре до 430° С, а
повышенные температуры такого порядка возникают при больших скоростях благодаря
аэродинамическому нагреванию.
Военно-морской флот. Коррозионная стойкость титана и его сплавов делает их весьма
ценным материалом на море. Военно-морское министерство США обстоятельно исследует
коррозионную стойкость титана против воздействия дымовых газов, пара, масла и морской
воды. Почти такое же значение в военно-морском деле имеет и высокое значение удельной
прочности титана. Малый удельный вес металла в сочетании с коррозионной стойкостью
повышает маневренность и дальность действия кораблей, а также снижает расходы по
уходу за материальной частью и ее ремонту.
Артиллерия. По-видимому, наиболее крупным потенциальным потребителем титана
может явиться артиллерия, где в настоящее время ведутся интенсивные исследования
различных опытных образцов. Тем не менее в этой области стандартизовано производство
лишь отдельных деталей и частей из титана. Весьма ограниченное использование титана в
артиллерии при большом размахе исследований объясняется его высокой стоимостью
22.
23. Бытовое использования
Титановым покрытием покрывают сверла пометаллу
Кухонная атрибутика
Ножи, ножницы, подводние ножи и инструменты
Титановая краска заминает золотую
Часы
Фильтры для воды
24.
25.
26.
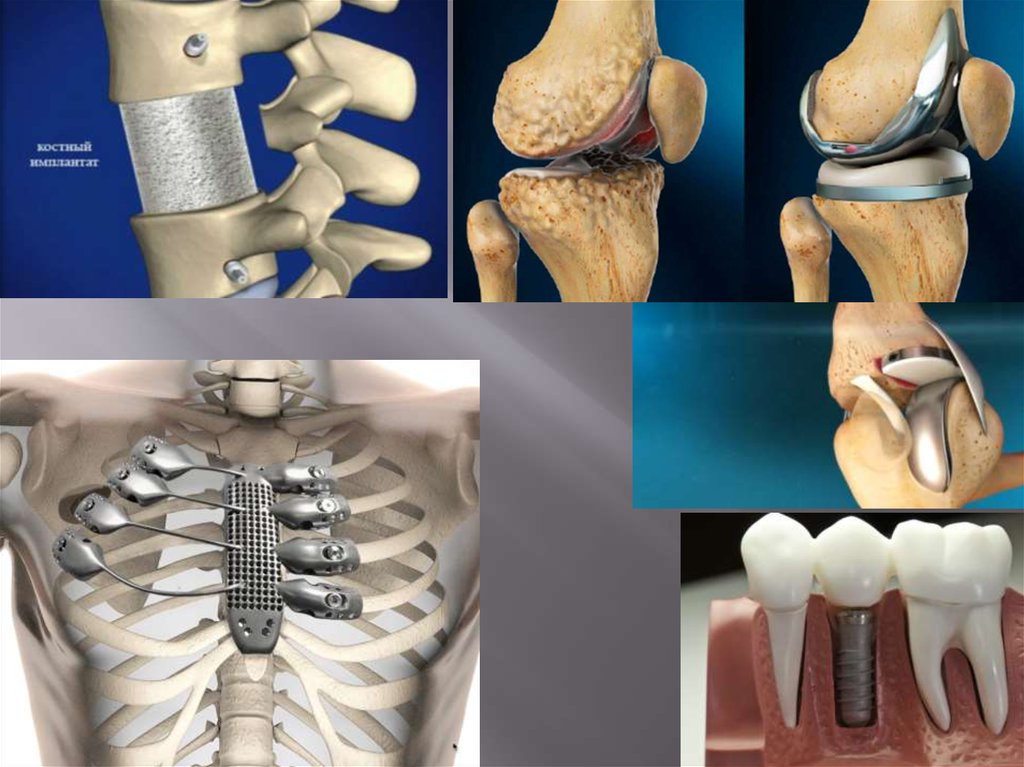
27. Использование в медицине
Из титана делают имплантанты(тмпланты) ипротэзы
28.
29. Обобщение и вывод
30.
31. ссылки
http://4108.ru/u/titan_element_-_istoriyahttps://www.youtube.com/watch?v=wVfhEdWaDk
https://stankiexpert.ru/spravochnik/material
ovedenie/titanovye-splavy.html
https://studfiles.net/preview/2899445/





























 chemistry
chemistry








