Similar presentations:
Идеальный газ
1.
ИДЕАЛЬНЫЙ ГАЗИзвестно, что частицы в газах, в отличие от
жидкостей и твердых тел, располагаются друг
относительно друга на расстояниях,
существенно превышающих их собственные
размеры. В этом случае взаимодействие
между молекулами пренебрежимо мало и
кинетическая энергия молекул много больше
энергии межмолекулярного взаимодействия.
Для выяснения наиболее общих свойств,
присущих всем газам, используют упрощенную
модель реальных газов идеальный газ
2.
Идеальный газ(модель)
1. Совокупность большого числа
молекул массой m0, размерами
молекул пренебрегают
(принимают молекулы за
материальные точки).
2. Молекулы находятся на
больших расстояниях друг от
друга и движутся хаотически.
3. Молекулы взаимодействуют по
законам упругих столкновений
, силами притяжения между
молекулами пренебрегают.
4. Скорости молекул
разнообразны, но при
определенной температуре
средняя скорость молекул
остается постоянной.
Реальный газ
1. Молекулы реального газа не
являются точечными
образованиями, диаметры
молекул лишь в десятки раз
меньше расстояний между
молекулами.
2. Молекулы не взаимодействуют по законам
упругих столкновений.
3.
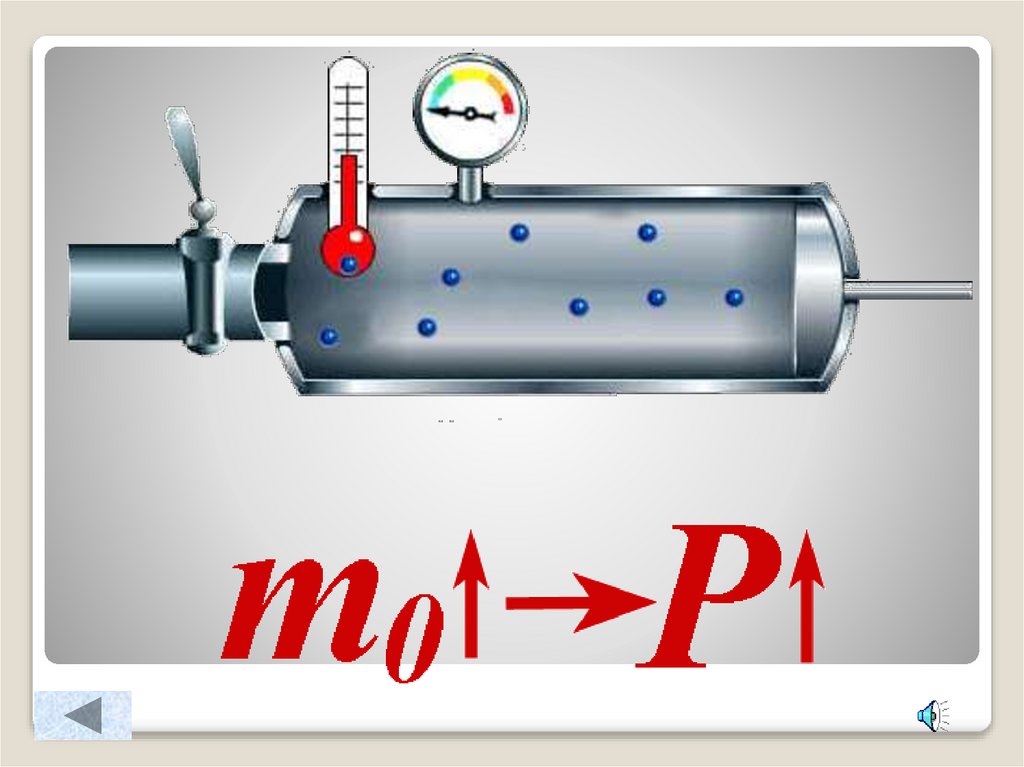
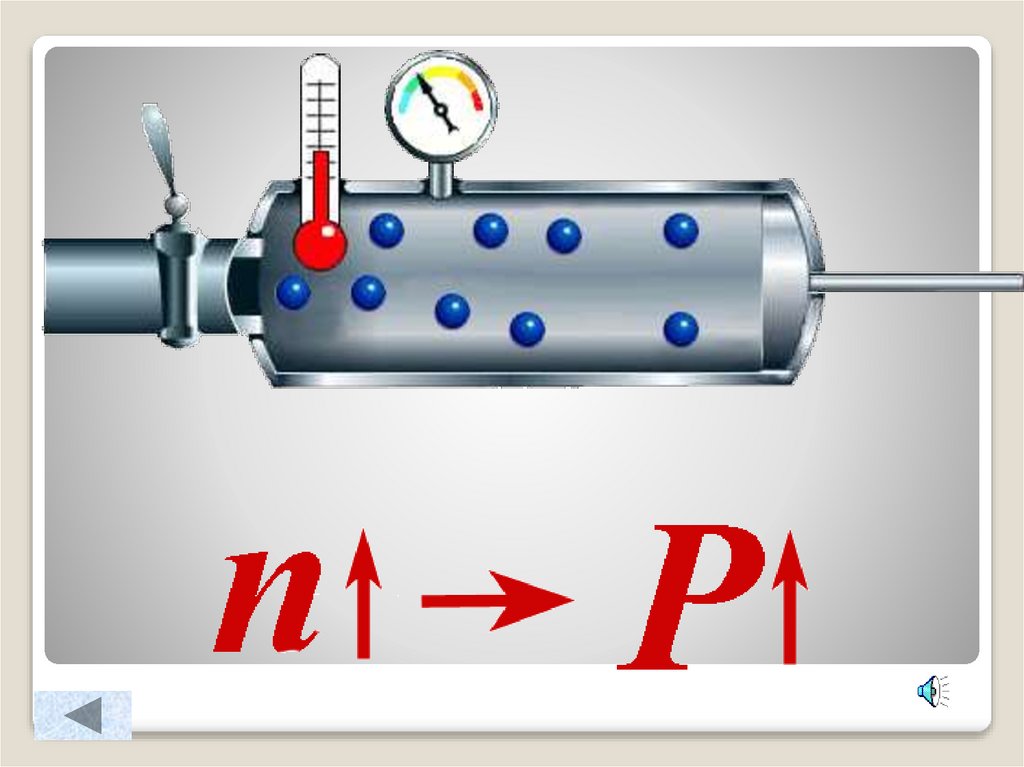
4. Зависимость давления идеального газа от:
Массы молекулКонцентрации
молекул
Скорости
движения молекул
5.
6.
7.
8.
9.
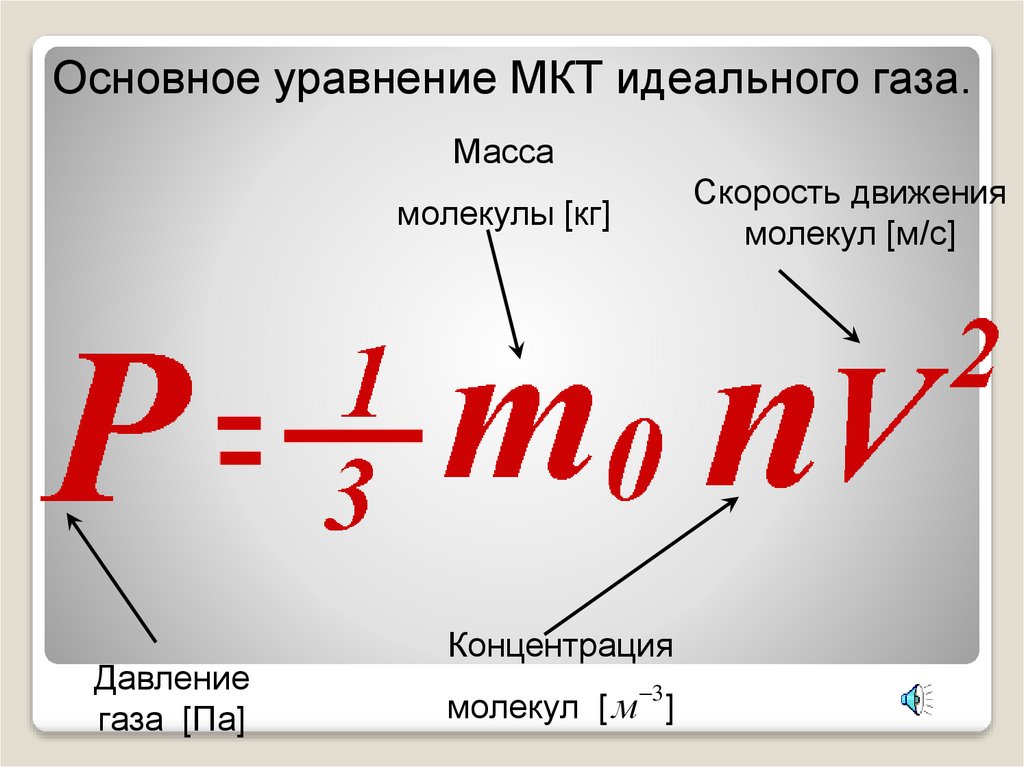
Основное уравнение МКТ идеального газа.Масса
Скорость движения
молекул [м/с]
молекулы [кг]
Давление
газа [Па]
Концентрация
3
молекул [ м ]
10. Как изменится давление газа на стенки сосуда, если:
масса молекулы увеличится в 3 разаконцентрация молекул уменьшится в 4 раза
скорость движения молекул увеличится в 2
раза
объем увеличится в 5 раз
масса молекулы уменьшится в 4 раза, а
концентрация увеличится в 2 раза
масса молекулы увеличится в 2 раза, а
скорость движения молекул увеличится в 3
раза
концентрация молекул увеличится в 3 раза,
скорость движения молекул уменьшится в 3
раза
Как изменится давление газа
на стенки сосуда, если:
11. Связь давления со средней кинетической энергией
12.
m0 VЕ
2
2
Средняя кинетическая
энергия
поступательного
движения молекулы
m
V
2
2
1
0
2
nE
n
P m0 nV
3
2
2
3
2
13.
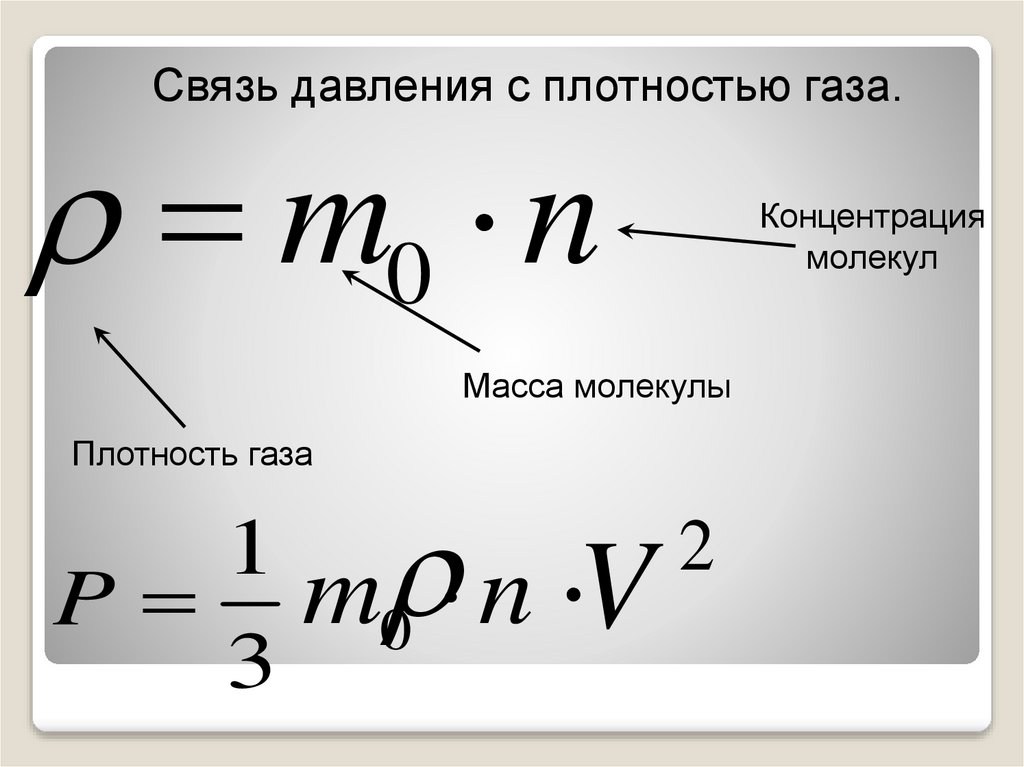
Связь давления с плотностью газа.m0 n
Масса молекулы
Плотность газа
2
1
P m0 n V
3
Концентрация
молекул
14. Задача.
№468Каково давление азота, если средняя
квадратичная скорость его молекул 500 м/с,
3
а его плотность 1,35 кг / м
?
подсказка
решение
•№469 Какова средняя квадратическая скорость
движения молекул газа, если имея массу 6 кг, он
3
занимает объем 5 м при давлении 200кПа?
подсказка
решение
15.
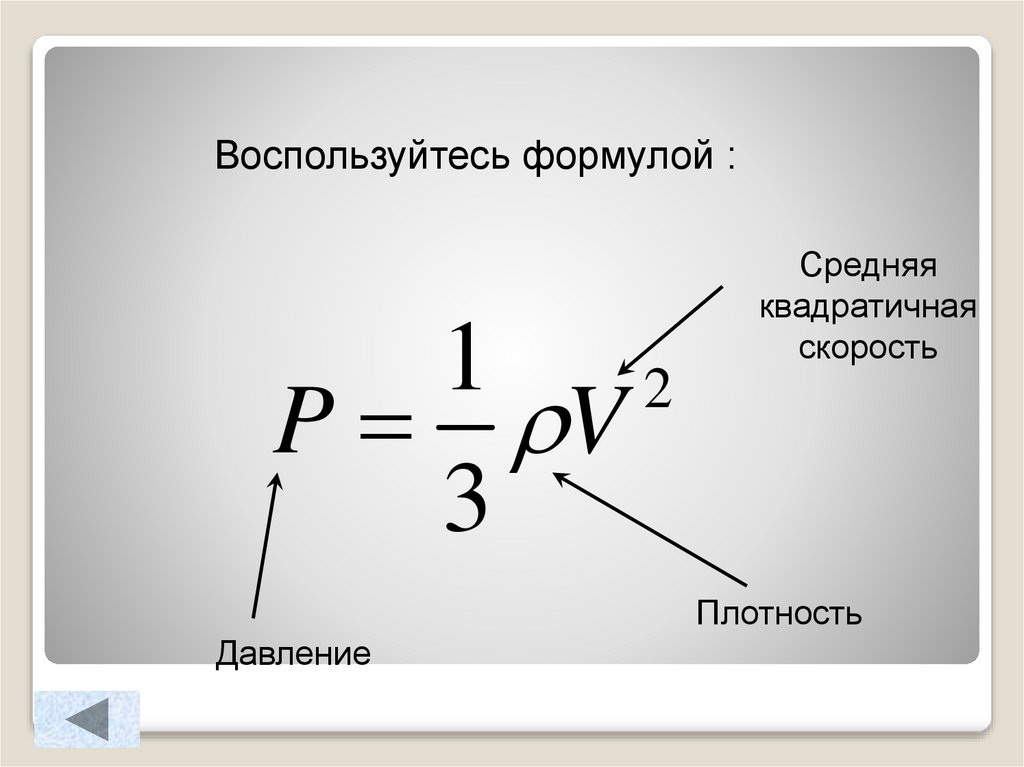
Воспользуйтесь формулой :1
2
P V
3
Средняя
квадратичная
скорость
Плотность
Давление
16.
Дано :V 500 м / с
1,35кг / м
Найти :
Р ?
Решение:
3
1
2
P V
3
1
2
P 1,35 500
3
112500 Па
112,5кПа
Ответ: 112,5кПа
17. Сначала найдите плотность газа по формуле:
mV
Масса газа
Объем газа
А потом выразите скорость движения молекул из формулы:
1
2
P V
3
18.
Решение:Дано :
m 6кг
V 5м
6
m
5
V
3
1, 2 кг / м
3
P 2 10 Па
Найти :
5
V=?
V=
3P
3 2 10
1, 2
707 м / с
Ответ: 707 м/с
5
19.
«Наибольшая или последняястепень холода»
(М.В. Ломоносов)
20. «термометрия» – наука об измерении температуры
Американский физик Д. Фаренгейттермоскоп
«термометрия» – наука об
измерении температуры
21.
Шведскийестествоиспытатель
Карл Линней
Шведский
ученый
Андерс
Цельсий
22.
Английский физикУильям Томсон (лорд Кельвин)
23.
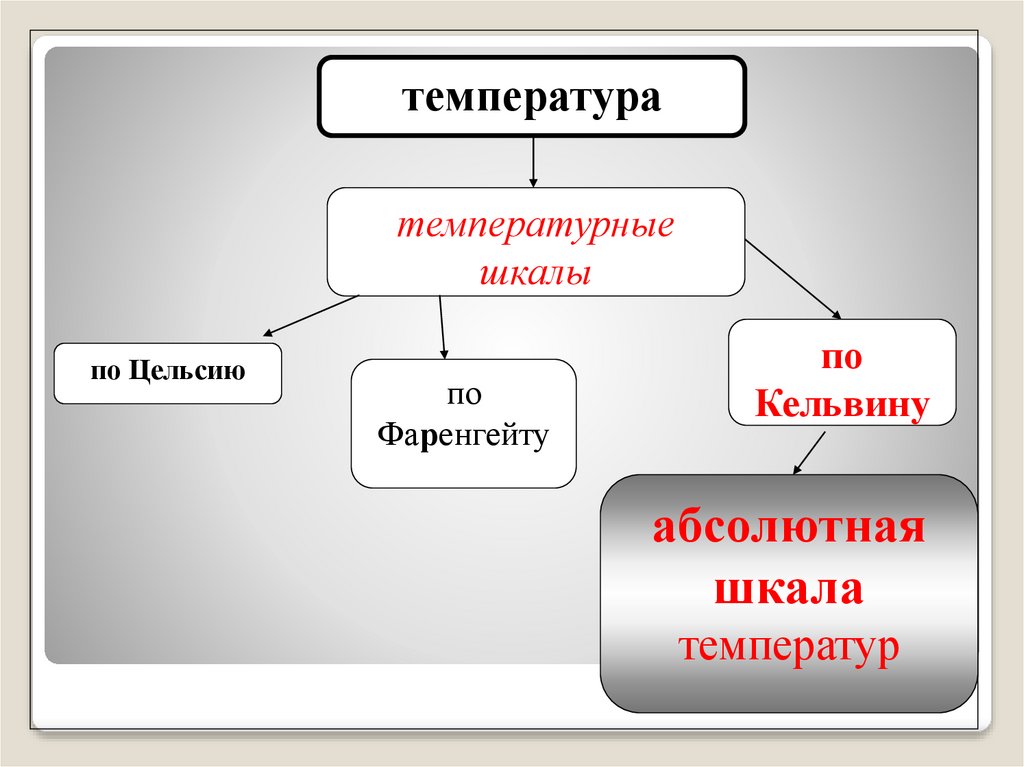
температуратемпературные
шкалы
по Цельсию
по
Фаренгейту
по
Кельвину
абсолютная
шкала
температур
24.
25.
Австрийский физикЛюдвиг Больцман
26. Уравнение Менделеева-Клапейрона
Уравнение МенделееваКлапейронаОсновным уравнением в термодинамике является
уравнение Менделеева-Клапейрона, где
p - давление, V – объем, m – масса газа, М – его
объем, R – универсальная газовая постоянная,
Т – абсолютная температура.
m
pV
RT
M



















 physics
physics








