Similar presentations:
Введение в квантовую физику
1. Занятие 1. Введение. Структура и содержание дисциплины
№Наименование и краткое содержание
п/
п
1 Лекции
2 Практические занятия, решение задач
3 Зачет
Кол-во
занятий10
10
5
Занятие 1. Введение. Структура и содержание
дисциплины
2. Вопросы к зачету
1.2.
3.
4.
5.
6.
7.
8.
9.
Основные этапы развития квантовой
теории. Главные тенденции в
10.
развитии квантовой химии.
11.
Современные возможности и
применение при решении
химических задач.
12.
Экспериментальные основы квантовой
механики. Квантовые свойства
13.
микрочастиц, опыты, демонстрирующие
14.
эти свойства.
Волновая функция и её статистический 15.
смысл
16.
Операторы квантовой механики.
Комутационные соотношения.
Собственные функциии собственные
значения операторов.
17.
Соотношение неопределенностей
Гейзенберга. Общее условие
18.
одновременной измеримости двух
физических величин.
19.
Постуланы квантовой механики.
Стационарное уравнение Шредингера.
Энергетический спектр.
Корпускулярно-волновой дуализм
Уравнение Шредингера для
атомаводорода и водородоподобных
атомов.
Атомные орбитали: классификация,
пространственная структура, свойства.
Кванотовые числа. Спин электрона.
Многоэлектронные атомыи молекулы.
Принцип супперпозиций квантового
состояния
Метод Хартри-Фока.Ограниченный и
неограниченный методы Хартри-Фока.
Квантовохимическая трактовка
решений уравнений Хартри-Фока.
Электронные конфигурации атомов с
точки зрения квантовой химии.
Приближение МО ЛКАО. Уравнения
Рутаана.
Полуэмпирические методы.
3. Учебно-методическое и информационное обеспечение дисциплины
а) базовый учебник (выделить жирным шрифтом)• Ермаков, Алексей Иванович. Квантовая механика и квантовая химия
[Текст] : учеб. пособие для студентов вузов, обучающихся по
специальности ВПО 020101.65 "Химия" / А. И. Ермаков. - Москва :
Юрайт, 2010. - 555 с
б) основная литература:
• Степанов, Николай Фёдорович. Квантовая механика и квантовая химия
[Текст] : учеб. для студентов хим. фак. ун-тов / Н. Ф. Степанов. - Москва :
Изд-во Моск. ун-та : Мир, 2009. - 519 с..
• Уманский, Станислав Яковлевич. Теория элементарных химических
реакций [Текст] : монография / С. Я. Уманский. - Долгопрудный :
Интеллект, 2009. - 407 с.
в) дополнительная литература
• Барановский В.И. Квантовая механика и квантовая химия. М.: Академия,
2008. 384 с.
• Бердетт Дж. Химическая связь. М.: Мир; Бином, 2008. 245 с.
4.
Раздел 1. Введение в квантовую химиюОбъект изучения и возможности квантовой химии. Успехи
квантовой химии как основного теоретического фундамента
современной химической науки.
Основные этапы развития квантовой теории. Гипотеза Планка
о квантовании энергии. Модель атома Бора. Корпускулярноволновой дуализм. Соотношение неопределенностей
Гейзенберга. Уравнение Шредингера. Сущность, предмет,
объект изучения квантовой химии. Место квантовой химии
среди других наук.
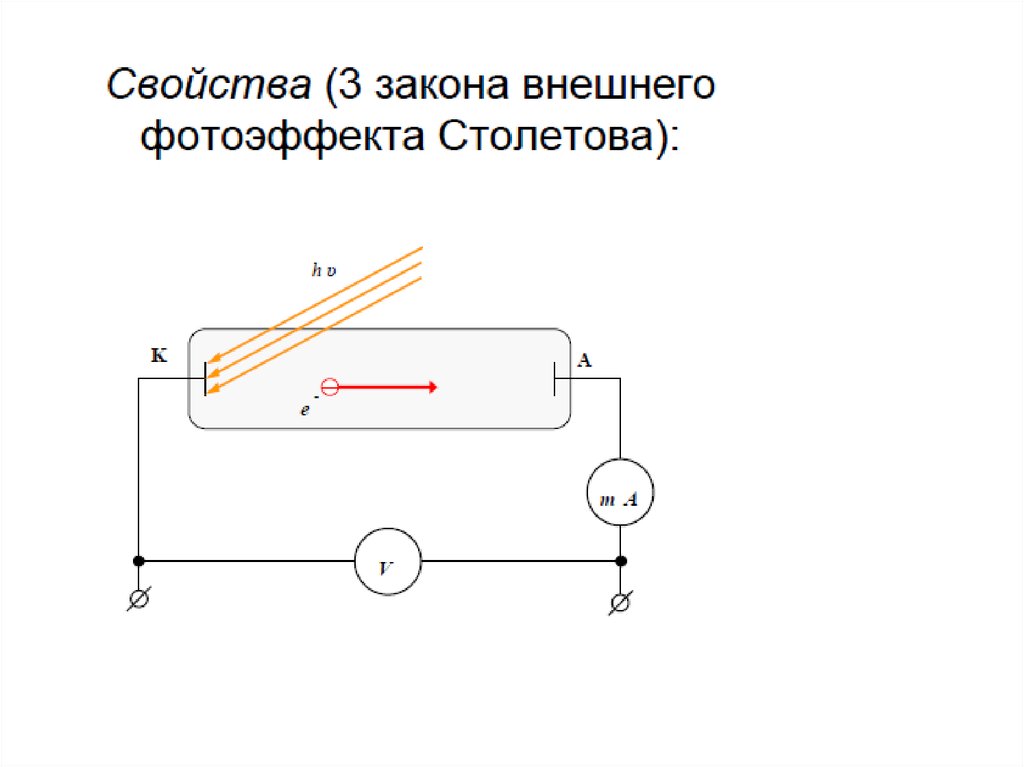
5.
• Одной из наиболее актуальных проблемраннего развития физики и химии было
изучение природы лучистой энергии. До
начала 19 века в науке господствовала
корпускулярная теория Ньютона,
предложенная им в 1675 году. И это
притом, что Гюйгенс в этот же период
предолжил волновую терию света, и она
была поддержана рядом ученых,
например Гуком. Согласно ей свет
подобен волнам на поверхности воды,
волне качающейся струны
6.
• Объяснениеинтерференции
Юнгом
–
сфокусированный в диафрагме на две щели
пучок монохроматического света дает за
щелями интерференционную картину, которая
объяснима тем, что свет распространяется как
волна и при совпадении двух волн в их
высших точках гребня, происходит усиление
волны и на экране мы наблюдаем яркую
линию. При совпадении же высшей точки
гребня одной волны с минимумом другой, мы
наблюдаем ослабление волны и темную
линию на экране.
Математически
яркая линия это nλ=sinφ
темная линия это (n+1/2)λ=sinφ
где n это число от 0 до ±n
7.
• И концу 19 века корпускулярная теория былаотметена и признана волновая теория света.
Множество подтверждающих экспериментов
проводимых учеными различных стран с уже
известными объектами исследования.
• Но в период 1895-1898 года были открыты Х
лучи Рентгена, явление радиоактивности
Беккерелем, электрон Томсоном. Начиная с
изучения теплового излучения на примере
абсолютно
черного
тела,
природы
электромагнитного излучения и ряда других
экспериментальных фактов уже волновая
теория не давала должного объяснения этим
явлениям
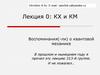
8.
9.
10.
11.
12.
13.
14.
15.
16.
17.
18.
19.
20.
21.
22.
23.
24.
25.
26.
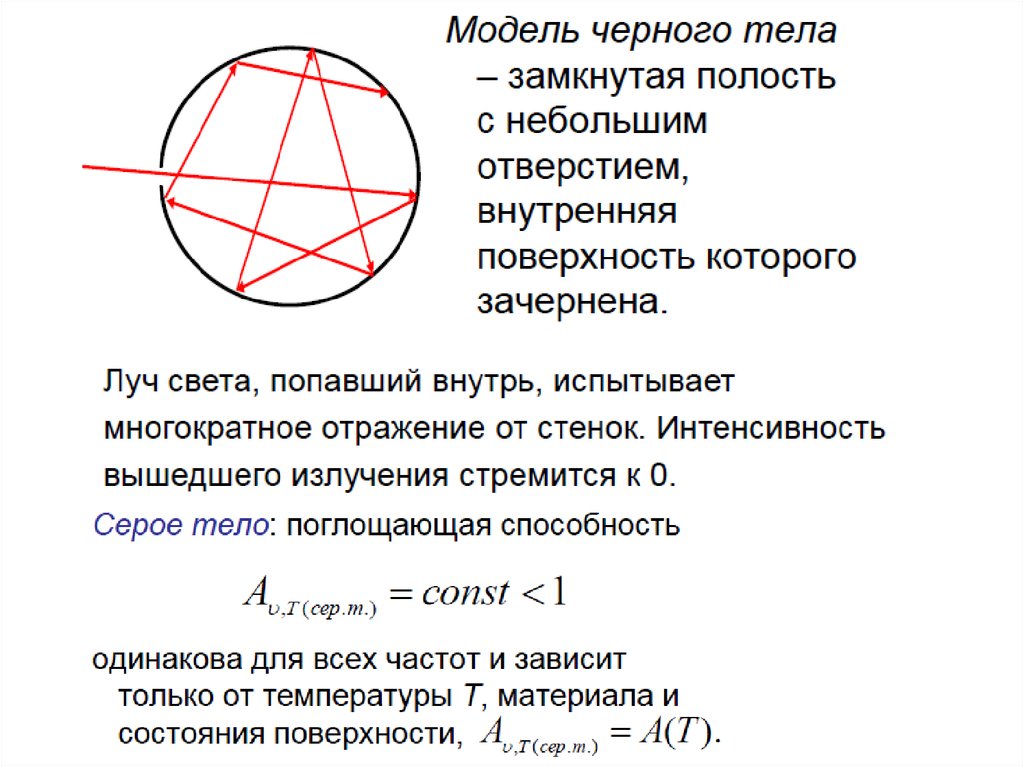
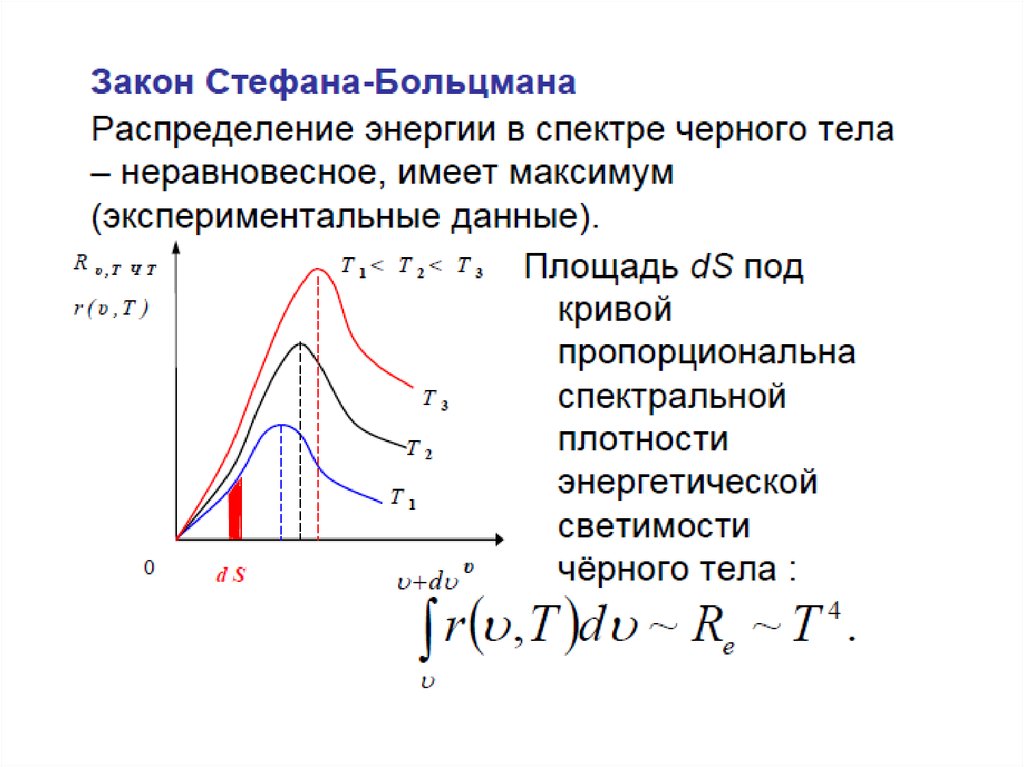
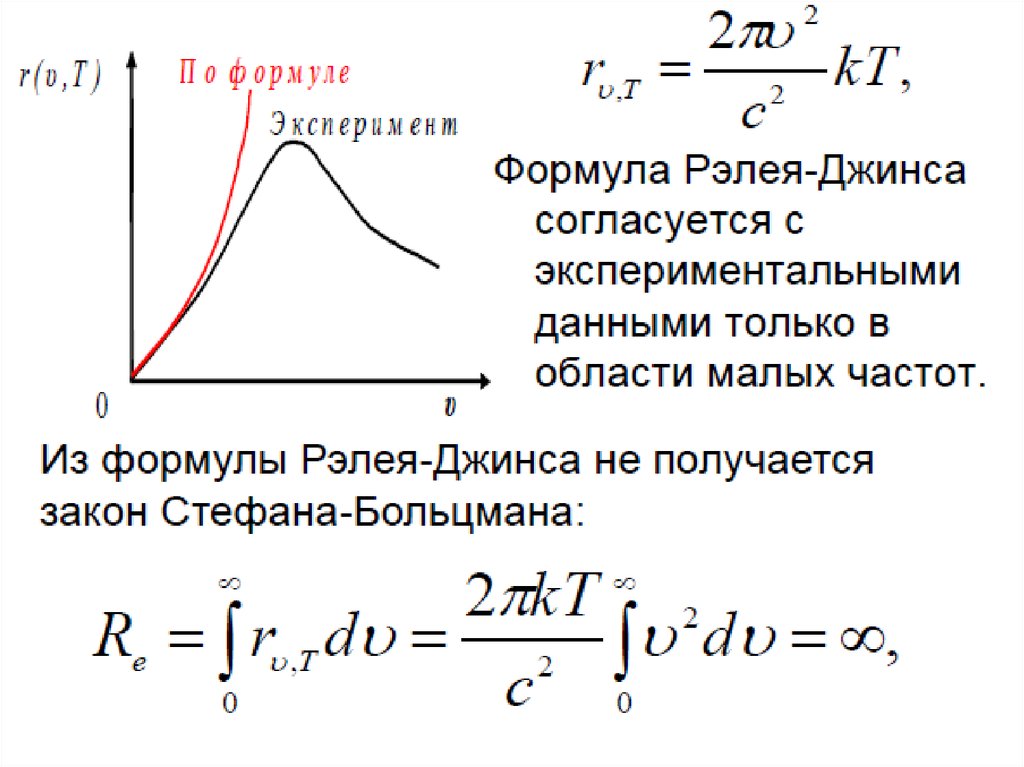
• Рассчитанные кривые по формулам Винаи Рэлея – Джинса описывали лишь участки
экспериментальных кривых: формула
Вина в области низких температур,
формула Рэлея – Джинса в области
высоких температур. Эти формулы были
получены на основе классического
принципа: осцилятор должен получать и
испускать энергию непрерывно (что
связано с законом сохранения энергии),
причем
количество
энергии
не
нормировано
27.
28.
29.
30.
31.
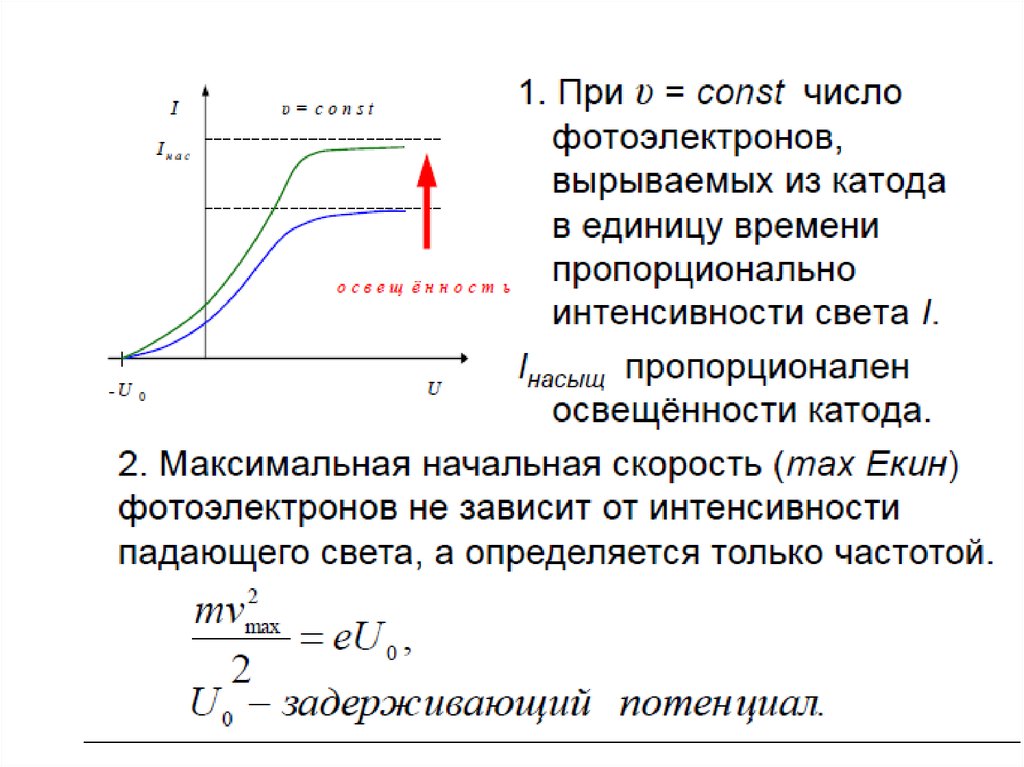
• Излучение может происходить лишьтогда, когда система переходит из одного
состояния в другое. Промежуточных
состояний между ними не существует, как
не существует 1,7 ε0, а есть только 1ε0 и 2ε0
32.
33.
34.
35.
36.
37.
38.
39.
40.
41.
42.
43.
44.
45.
46.
47.
48.
49.
50.
51.
• Длину волны такой частицы называют длиной волны деБройля. Для любой частицы массой m и известной
скоростью, длину волны можно рассчитать. Например,
для электрона с энергией 1,6·10-17 длина волны равна 1,2
ангстрема. Это значение соответствует параметрам
кристаллической решетки. Применяя кристалл никеля
как дифракционную решетку ученые получили
дифракционную картину, которую можно объяснить
волновым движением электронов. Трудно говорить об
истинности волн частиц микромира, подобны ли они
волнам на поверхности воды, волнам качающейся
струны. Возможно это сходство имеется только в
математическом описании. Но открытия и эксперименты
20 и 21 веков невозможно истолковать без применения
математических моделей и уравнений, на основе
классической науки, найти им аналоги в жизненном
опыте человечества, как это было принято
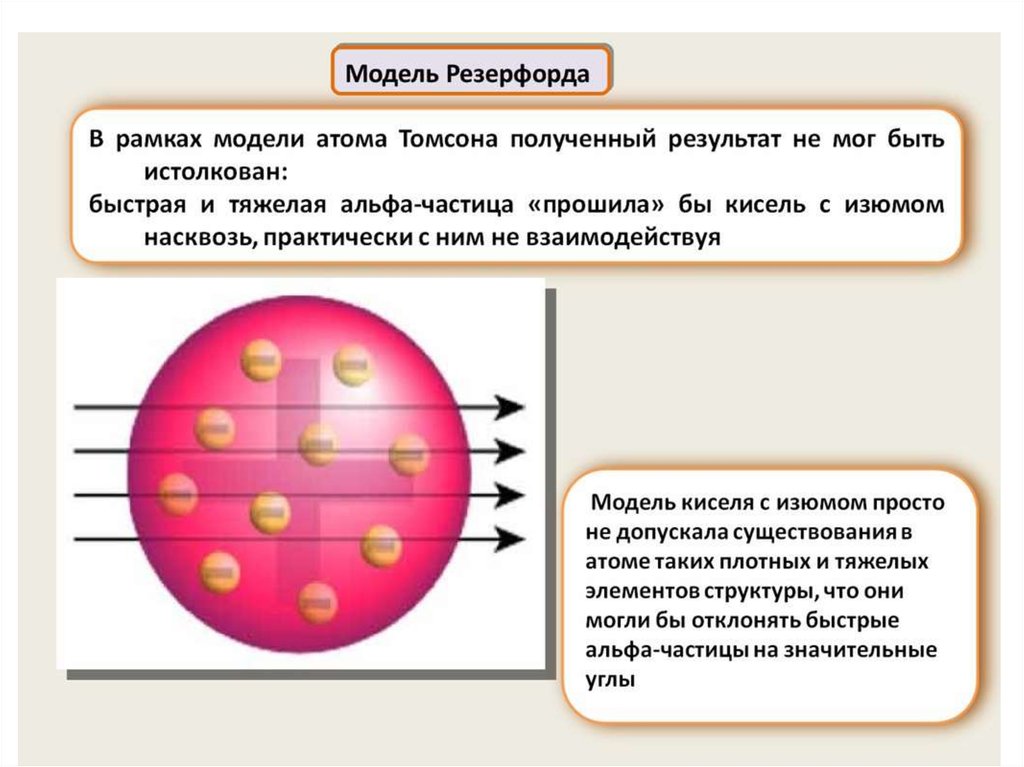
52. В это время уже были осуществлены попытки описать строение атома . Были предложены первые модели строения атома.
53.
54.
55.
56.
57.
58.
59.
60.
61.
62.
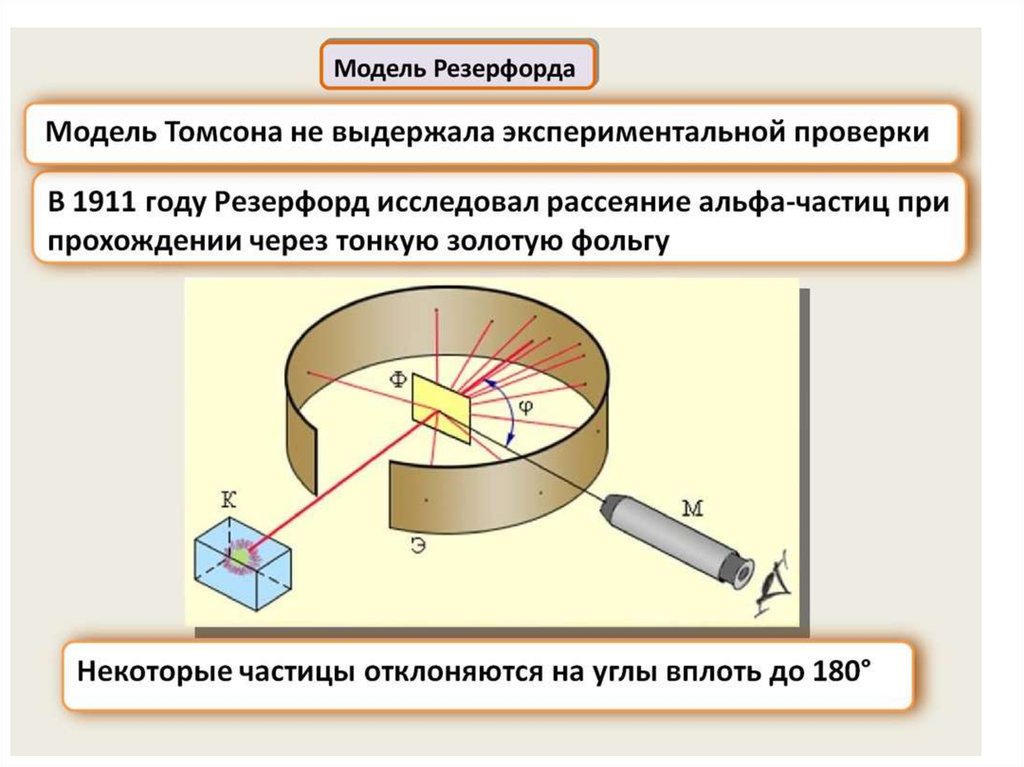
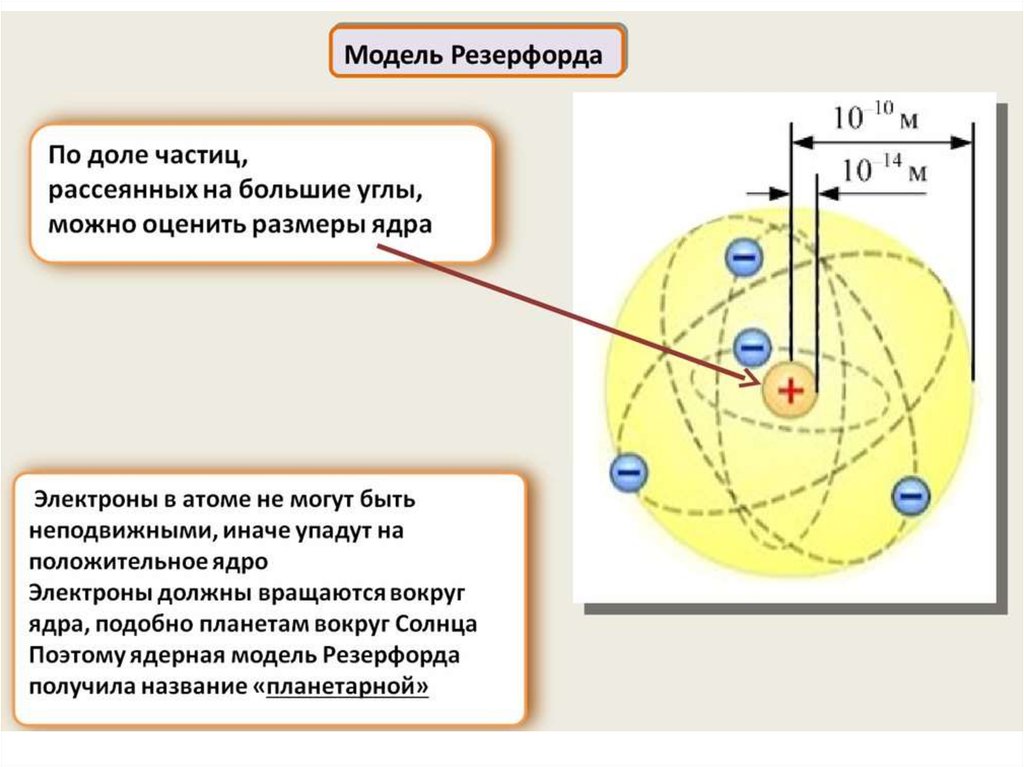
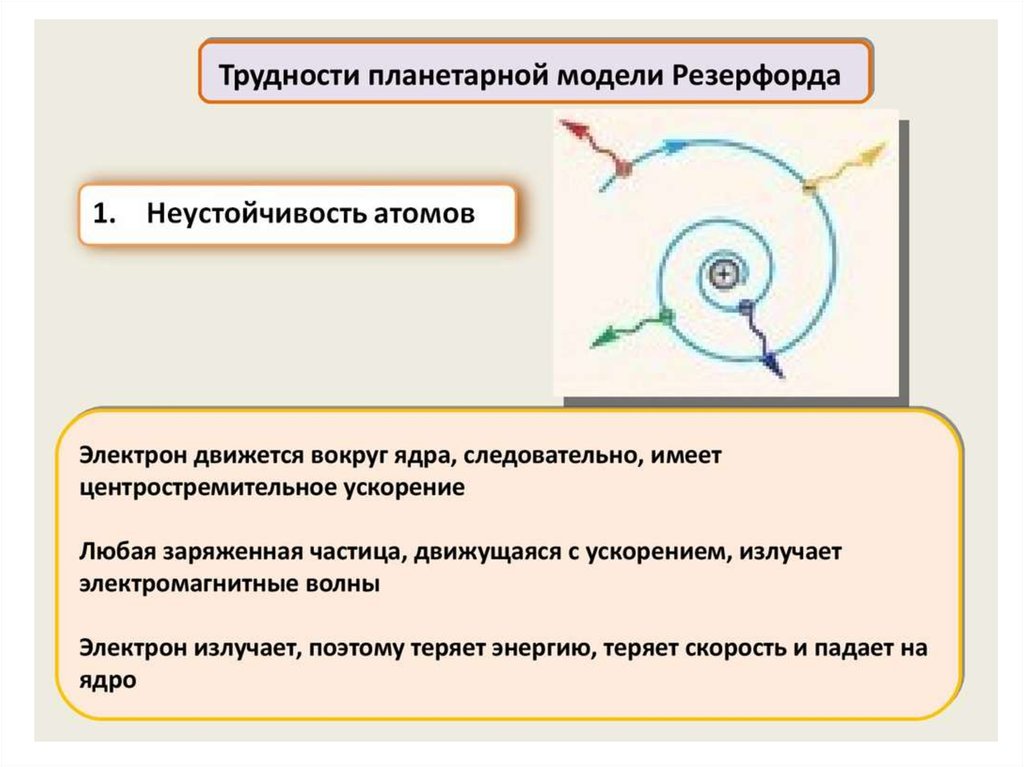
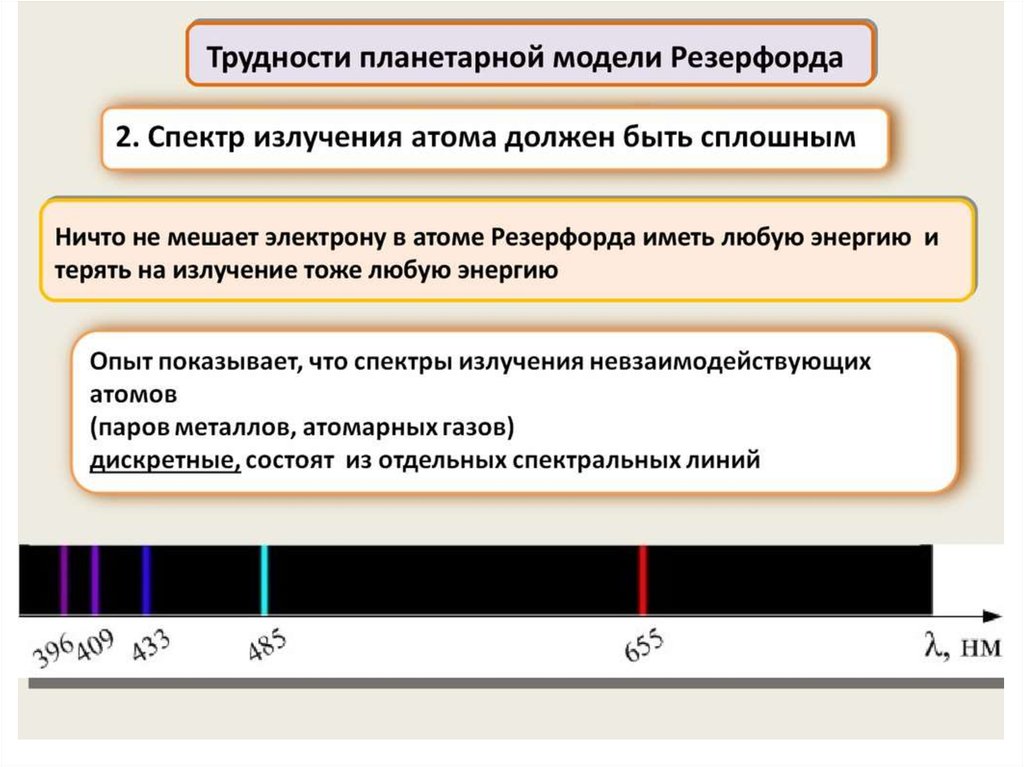
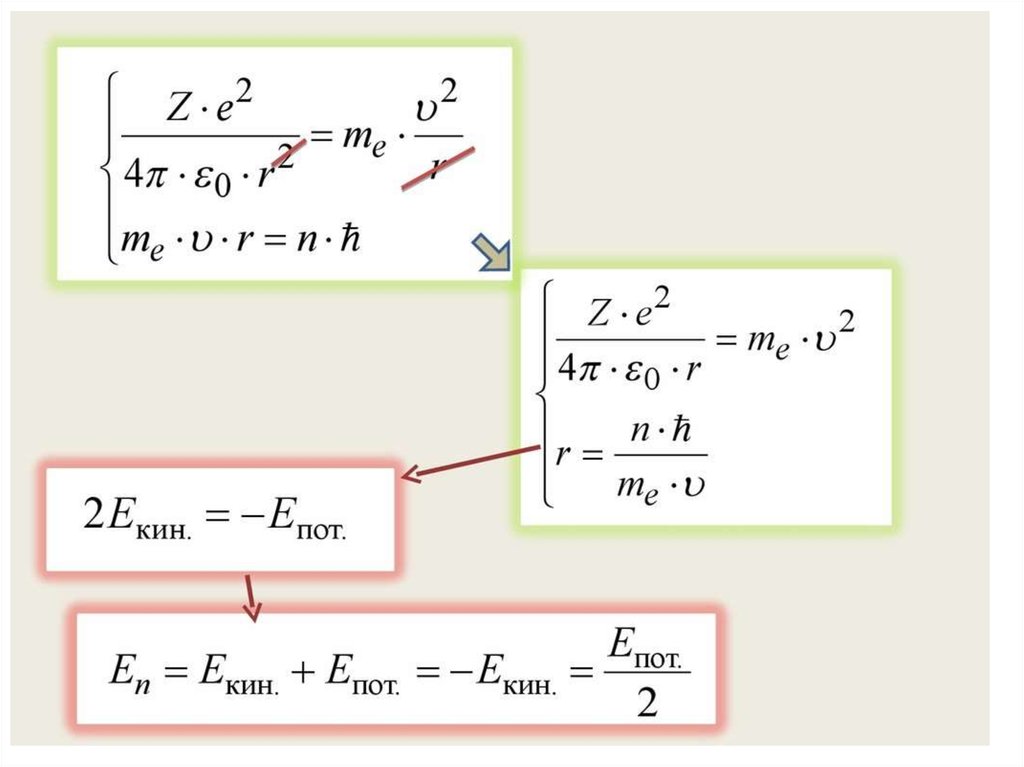
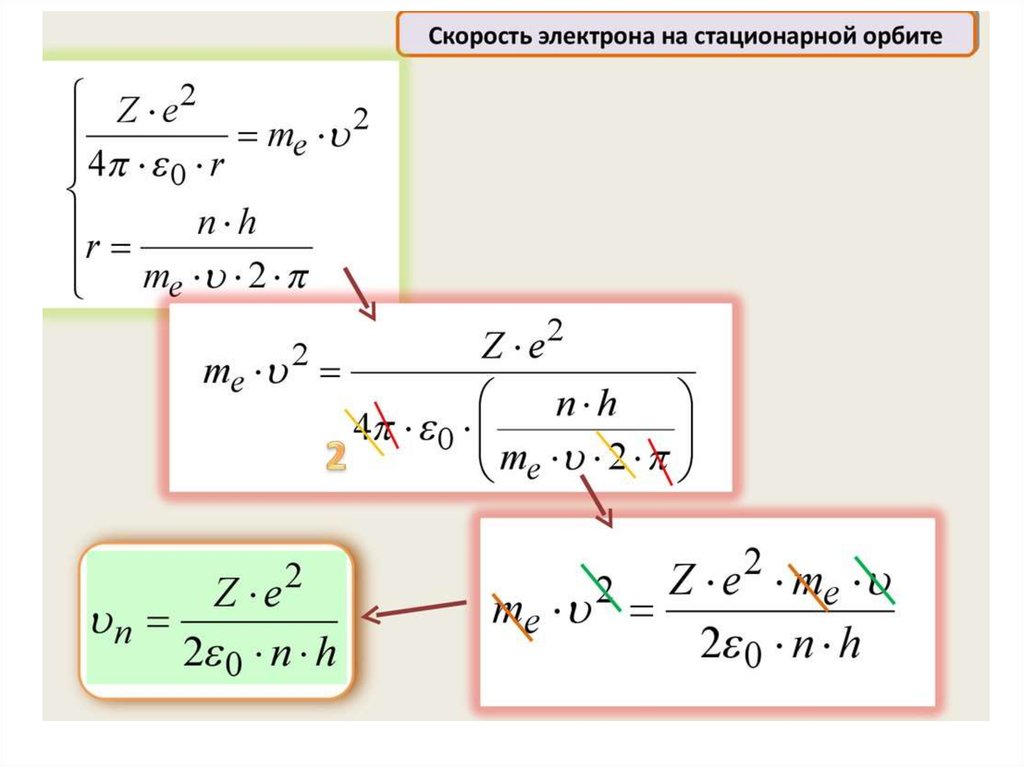
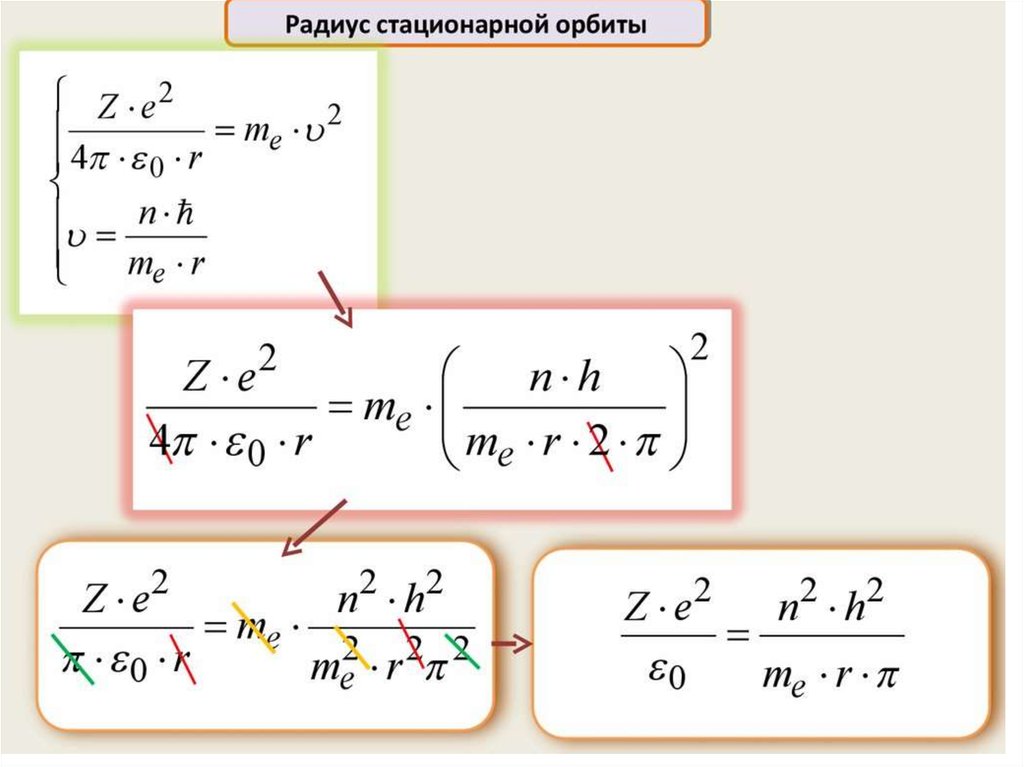
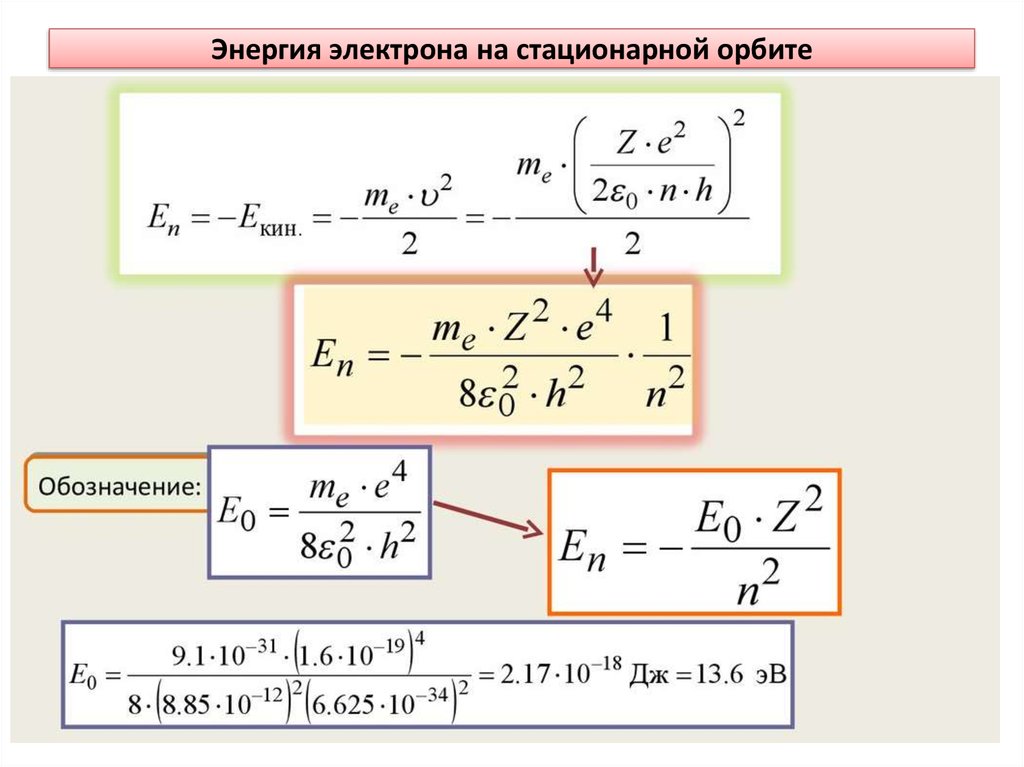
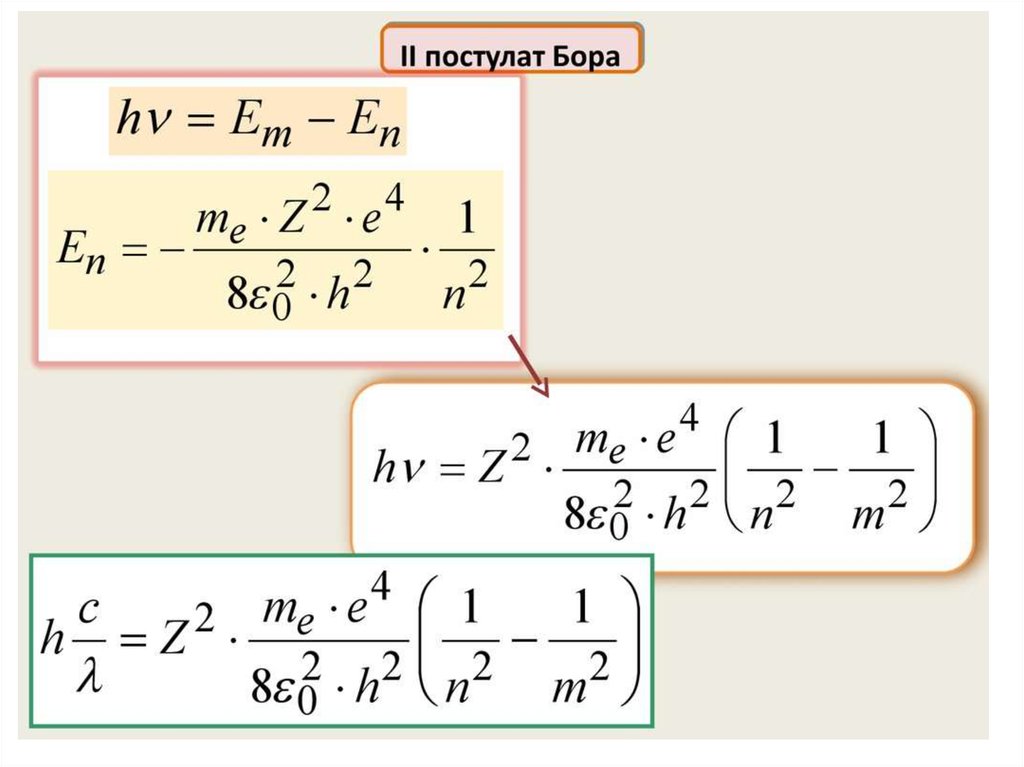
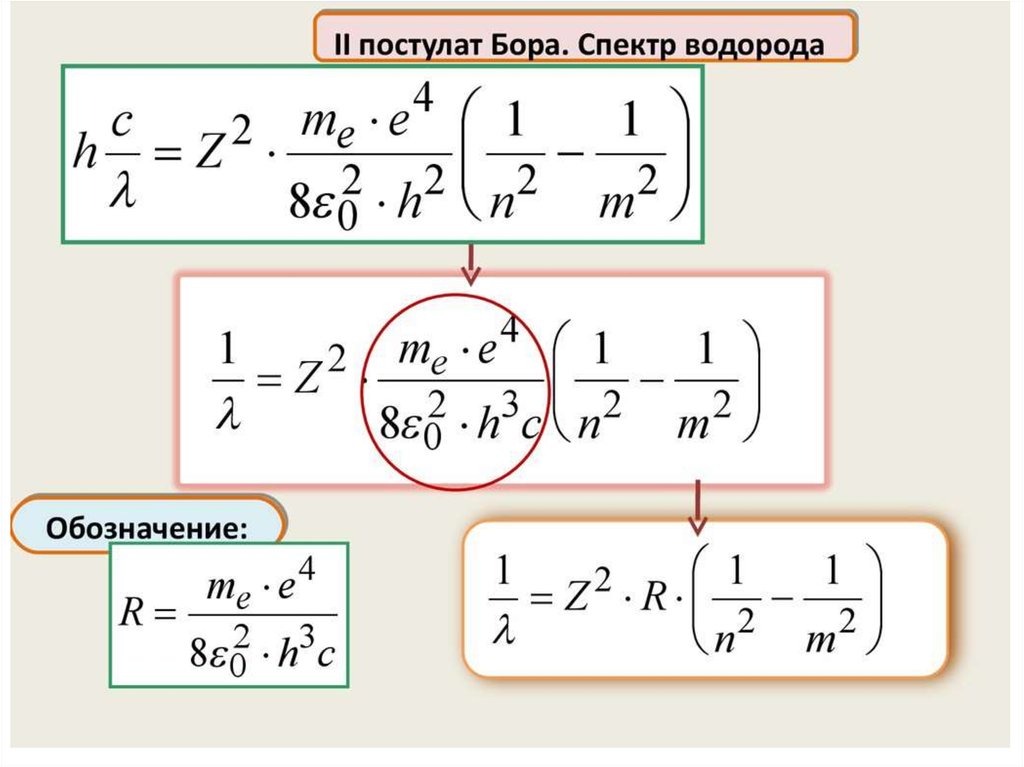
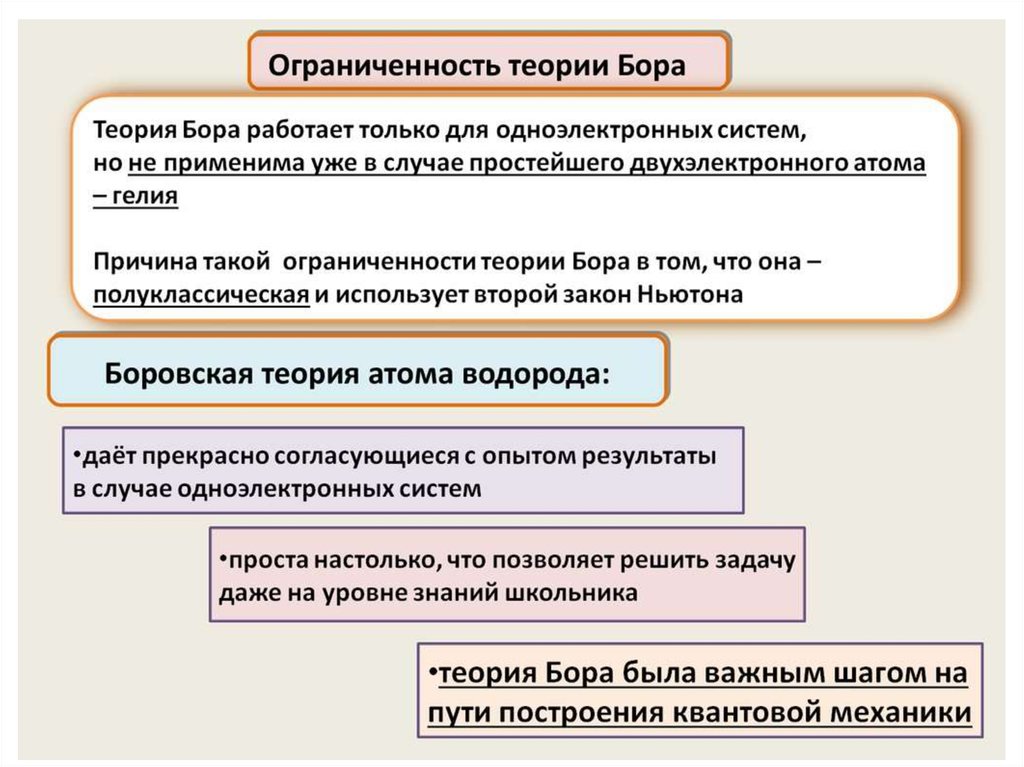
Нильс Бор ввел элементы квантовой теории в модель атомаРезерфорда и в 1913 г. создал неклассическую теорию атома. В
основе этой теории лежала идея связать в единое целое три
результата, полученные в физике к тому времени:
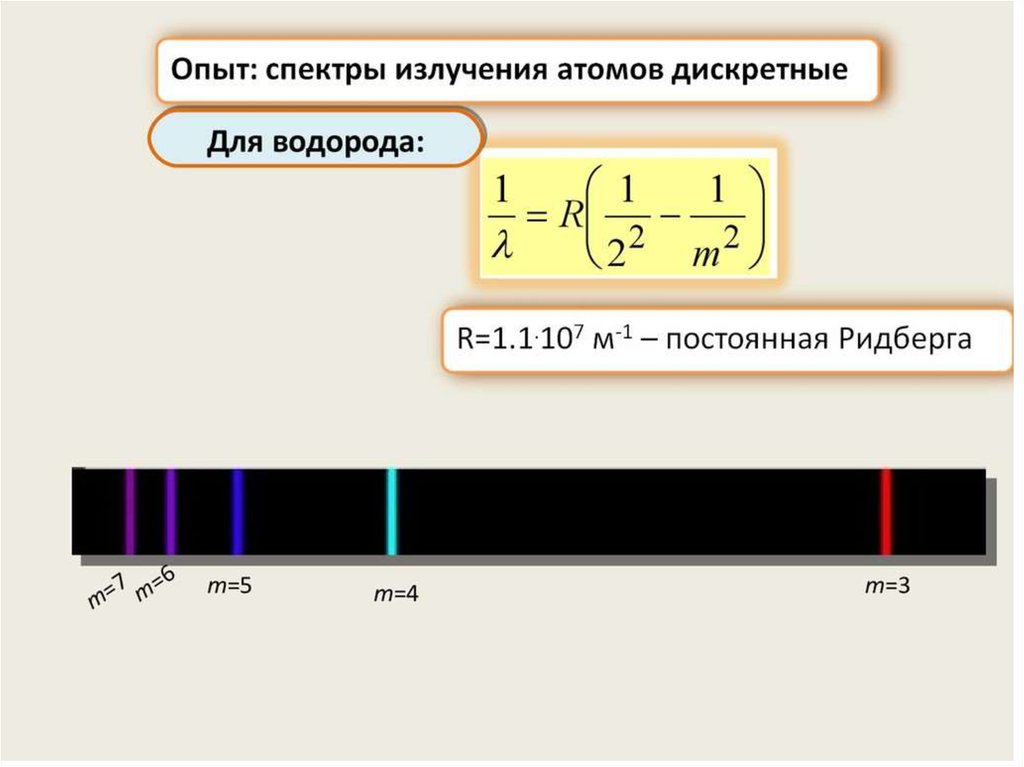
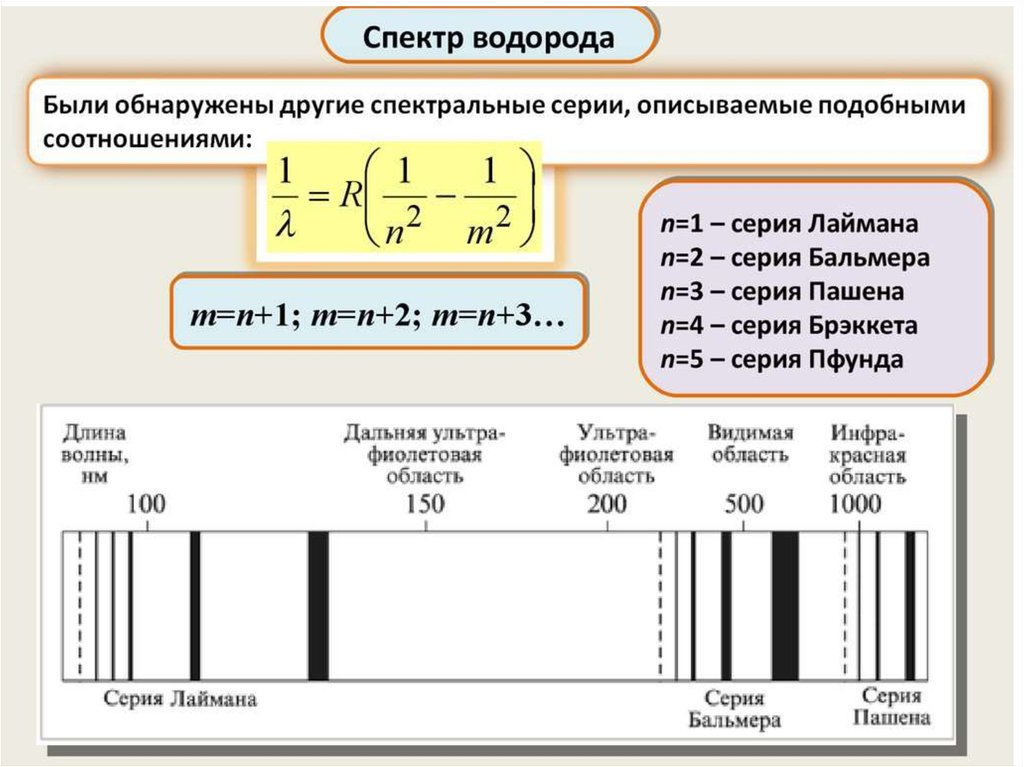
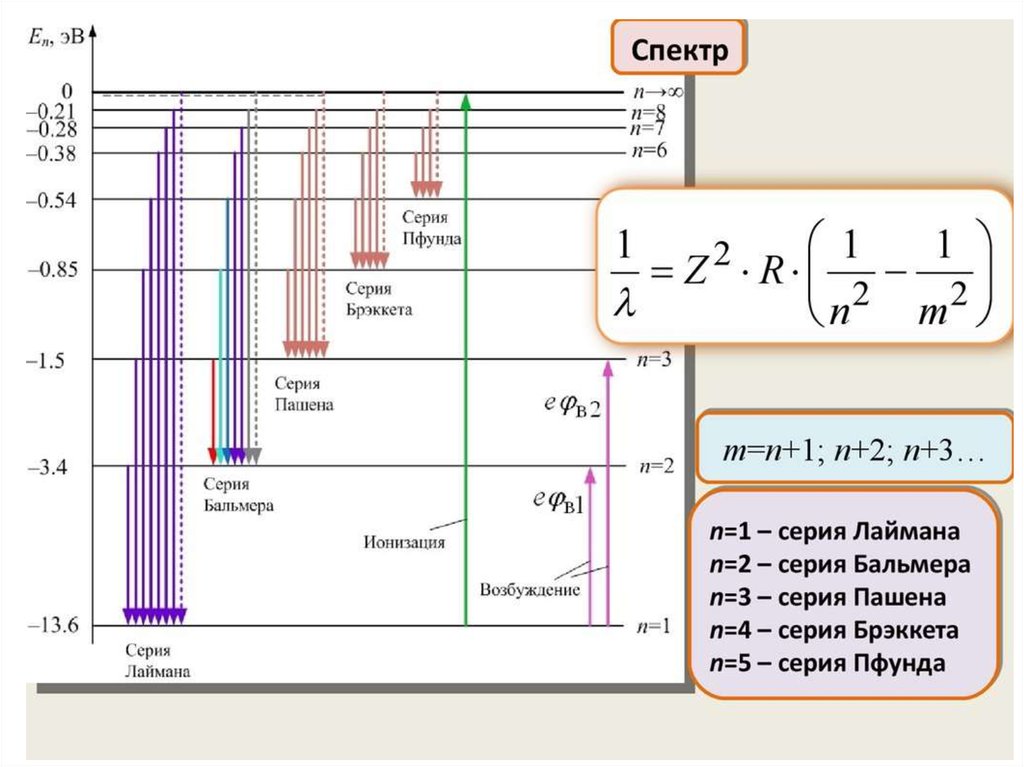
1) эмпирические закономерности линейчатого спектра атома
водорода;
2) ядерную модель атома Резерфорда, не допускающую
классического истолкования;
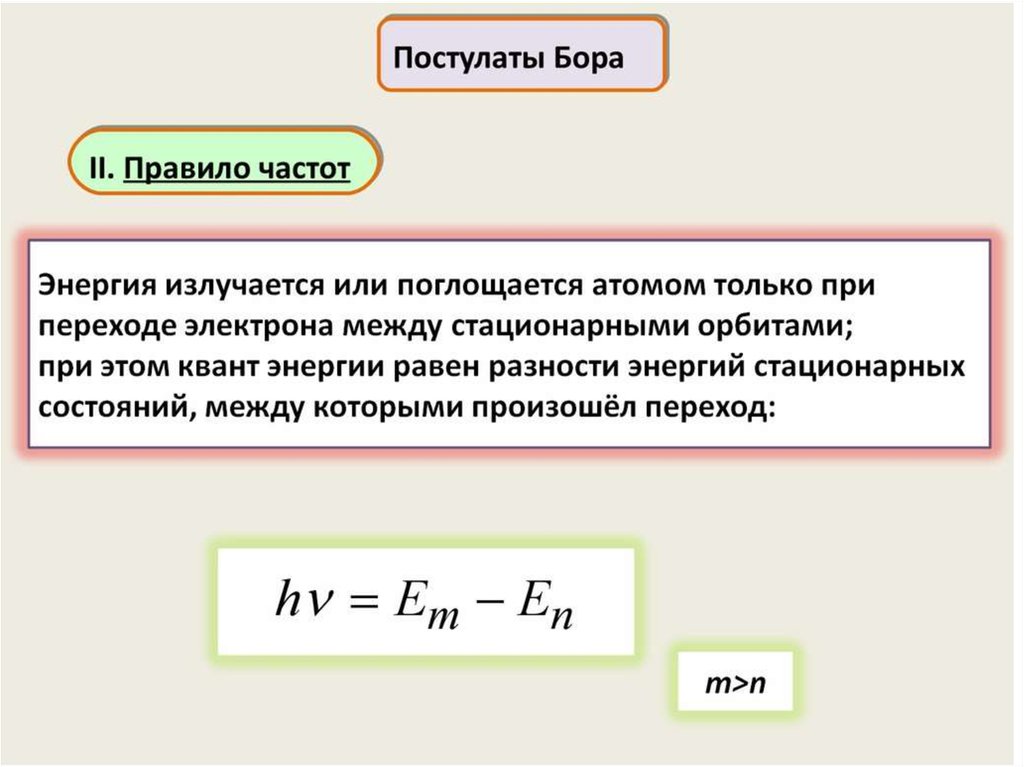
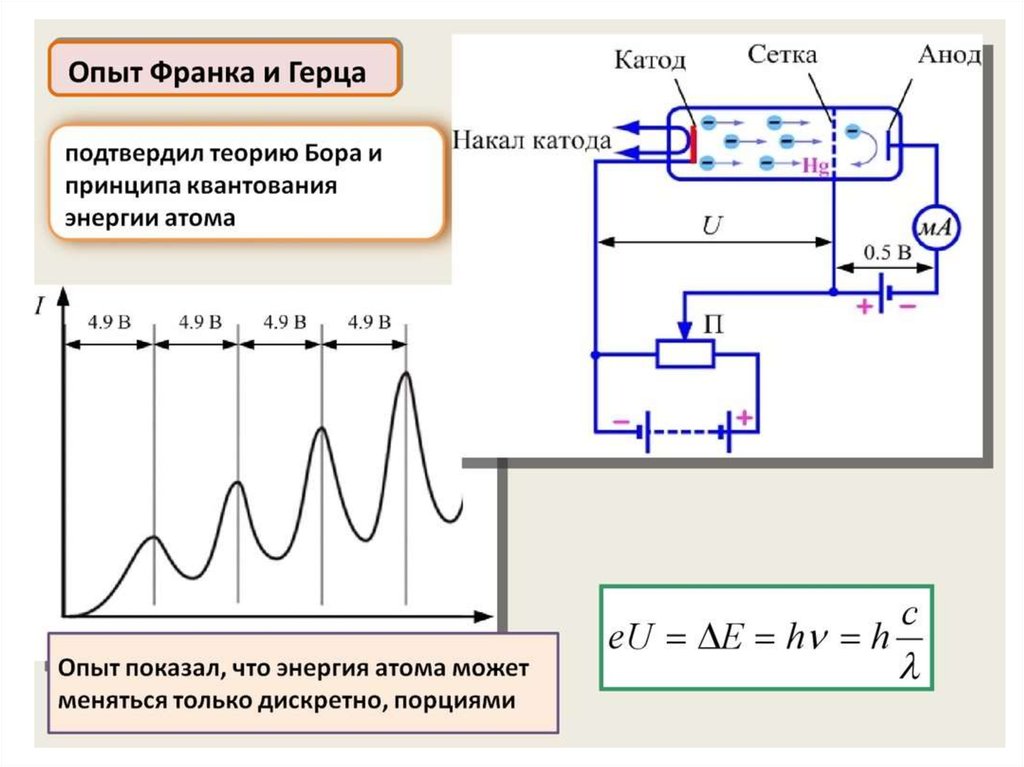
3) квантовый характер излучения и поглощения.
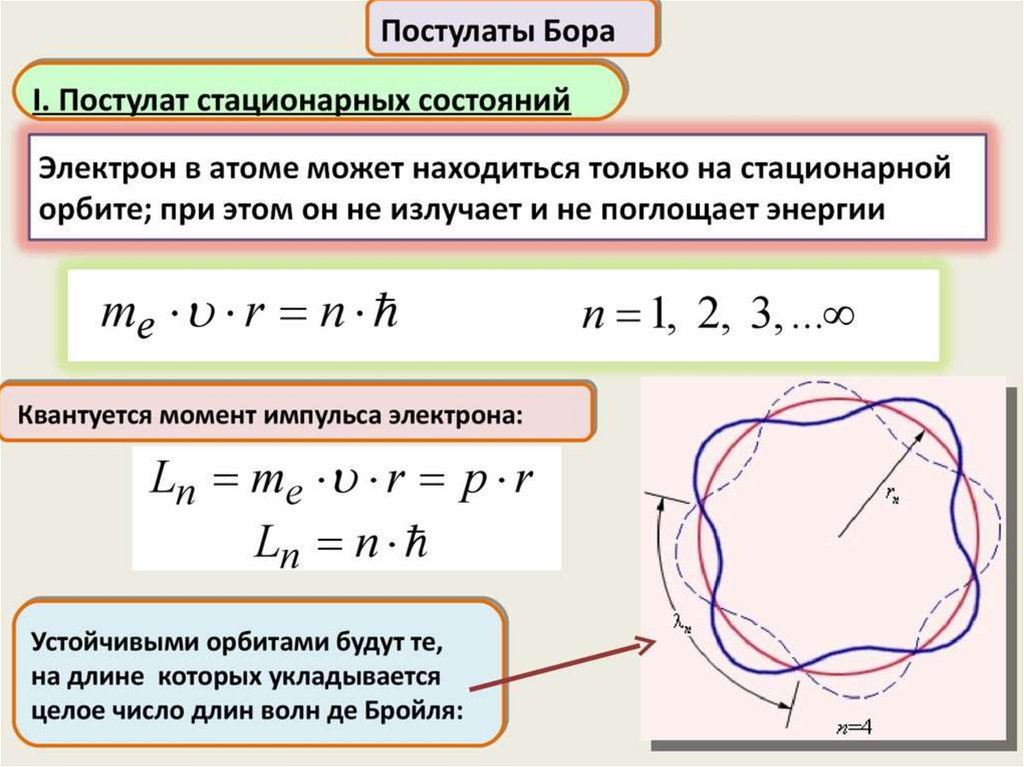
Для решения этой задачи Бор, сохраняя классический подход к
описанию поведения электрона в атоме, выдвинул два постулата,
которые называются постулатами Бора.





















































 physics
physics