Similar presentations:
Заседание Комитета по фармацевтике и медицине Палаты юридических консультантов «КазБАР» и Евразийской школы бизнеса
1.
Заседание Комитета по фармацевтике и медицинеПалаты юридических консультантов «КазБАР»
и Евразийской школы бизнеса и предпринимательства
16
ноября
2023
2.
ПОВЕСТКА ДНЯПраво ЕАЭС
1. 31.12.2025
2. Стратегически
важные ЛС
3. ЕАЭС
и локальная
регистрация
Новости
Практика
1. Запрет
рекламы ЛС
1. Аутсорсинг
продвижения
2. «Онлайн»
2. Кредит-нота
3. Другие
3.
Положения Соглашения ЕАЭС (ЛС)
о ПРИВЕДЕНИИ В СООТВЕТСТВИЕ
с требованиями ЕАЭС
до 31.12.2025 –
применимы ли ко всем ЛС?
4.
1.1 ► Соглашение ЛС и Соглашение МИСоглашение о единых
принципах и правилах
обращения
лекарственных средств
в рамках ЕАЭС
Соглашение о единых
принципах и правилах
обращения медицинских
изделий
в рамках ЕАЭС
(г. Москва, 23 декабря 2014 г.)
вступили в силу 12 февраля 2016 года
5.
1.1 ► Соглашение ЛССтатья 20 Переходные положения
1. ЛС, зарегистрированные в государствахчленах ДО ВСТУПЛЕНИЯ в силу Соглашения,
должны быть приведены в соответствие с
требованиями и правилами ЕАЭС
до 31 декабря 2025 года в соответствии с
процедурой, установленной в правилах
регистрации и экспертизы лекарственных
средств, указанных в статье 7 Соглашения.
6.
1.1 ► ВопросВсе ли ЛС подлежат приведению
в соответствие с правилами ЕАЭС
до 31 декабря 2025 года
или только те,
которые были зарегистрированы
по национальным правилам
до вступления в силу Соглашения
(то есть до 12 февраля 2016 года)?
7.
1.1 ► Другие акты права ЕАЭСРешение Комиссии ЕАЭС от 3 ноября 2016 года № 78
Правила регистрации и экспертизы лекарственных
средств для медицинского применения
(вступили в силу 7 мая 2017 года)
Решение Комиссии ЕАЭС от 10 июня 2022 года № 96
О временных мерах по установлению
особенностей обращения ЛС
8.
1.1 ► Правила регистрации ЕАЭСРешение Комиссии ЕАЭС от 3 ноября 2016 года № 78
(п. 2)
до 31 декабря 2025 года
с 1 января 2026 года
приведение ЛС,
зарегистрированных по
национальному законодательству
в соответствие с требованиями
права ЕАЭС
(международных договоры и акты)
прекращение
действующих РУ,
выданных по
национальному
законодательству
9.
1.1 ► Временные меры ЕАЭСРешение Комиссии ЕАЭС от 10 июня 2022 года № 96
(подп. а) п. 1)
Уполномоченные органы государств-членов в сфере
обращения
ЛС
вправе
устанавливать ВРЕМЕННЫЙ
ПОРЯДОК
ОБРАЩЕНИЯ
ЛС
(включая
регистрацию
лекарственных препаратов и внесение изменений в
регистрационное
досье
лекарственных
препаратов),
действующий до 31 декабря 2023 года, сохранив
возможность
осуществления
регистрации
ЛС
в
соответствии с Правилами регистрации и экспертизы ЛС
для медицинского применения, утвержденными Решением
Совета ЕЭК от 3 ноября 2016 г. № 78.
10.
1.1 ► Временные меры ЕАЭСРешение Комиссии ЕАЭС от 10 июня 2022 года
№ 96 о временных мерах по установлению
особенностей обращения ЛС
до 31 декабря 2023 года
временное действие национального
порядка параллельно с Правилами ЕАЭС
РЕГИСТРАЦИЯ ЛС
(внесения изменений в досье)
ОБРАЩЕНИЕ ЛС
11.
1.1 ► ВопросыРазличные сроки и условия в Соглашении ЛС и
в Решениях Комиссии ЕАЭС (№78 и №96).
Какой из указанных актов будет иметь приоритет?
Являются ли Решения Комиссии ЕАЭС
международными договорами?
Обязательны ли требования Решений Комиссии
ЕАЭС для исполнения в Казахстане?
12.
1.1 ► Статус решений Комиссии ЕЭКСтатья 4 Конституции РК
Дополнительное постановление Конституционного Суда
Республики Казахстан от 22 мая 2023 года № 17-НП
Об истолковании пунктов 2 и 4 постановляющей части
нормативного постановления Конституционного Совета
Республики Казахстан от 5 ноября 2009 года № 6
"Об официальном толковании норм статьи 4 Конституции
Республики Казахстан применительно к порядку
исполнения решений международных организаций и их
органов".
13.
1.1 ► Конституционный Суд РКРешения международных организаций и их органов,
участником которых является Республика Казахстан (в том
числе Коллегии Евразийской экономической комиссии), могут
приобретать юридические СВОЙСТВА РАТИФИЦИРОВАННОГО
РЕСПУБЛИКОЙ МЕЖДУНАРОДНОГО ДОГОВОРА в случае
непосредственного указания на обязательный характер для
Казахстана данных решений в международном договоре,
ратифицированном Республикой Казахстан, и при условии,
что порядок их принятия и вступления в силу обеспечивает
на основе консенсуса полный учет интересов Казахстана с
возможностью рассмотрения спорного вопроса высшим
органом соответствующей международной организации.
14.
1.1 ► Статус решений Комиссии ЕЭКСоглашение ЕАЭС
Статья 7 Регистрация и экспертиза лекарственных
средств
1. Государства-члены осуществляют регистрацию
и экспертизу лекарственных средств,
предназначенных для обращения на общем рынке
лекарственных средств в рамках Союза, в
соответствии с правилами регистрации и
экспертизы лекарственных средств,
утверждаемыми Комиссией.
15.
ПЕРЕЧЕНЬ СТРАТЕГИЧЕСКИ
ВАЖНЫХ ЛС:
Освобождает ли регистрация ЛС
по Перечню СВ ЛС
от регистрации по правилам
ЕАЭС?
16.
1.2 ► Национальный порядок или право ЕАЭС?Решение № 96 - национальный
порядок регистрации может
действовать
до 31 декабря 2023 года
17.
1.2 ► Правила регистрации ЕАЭСРешение Комиссии ЕАЭС от 3 ноября 2016 года № 78
3. Требования настоящих Правил не применяются в отношении:
а) ЛС, которые предназначены для применения в условиях военных действий, ЧС, для
профилактики и лечения заболеваний и поражений, полученных в результате
воздействия химических, биологических, радиационных факторов, разработаны по
заданию уполномоченных в области безопасности и обороны органов
государственной власти государств-членов и обращение которых регулируется
законодательством государств-членов;
а1) ЛС, которые предназначены для применения в условиях ЧС, угрозы их
возникновения или возникновения ЧС, для профилактики и лечения заболеваний и
поражений, представляющих опасность для окружающих, полученных в результате
воздействия химических, биологических, радиационных факторов, обращение
которых регулируется законодательством государств-членов.
18.
1.2 ► Стратегически важные ЛС (Кодекс о здоровье)Предназначенные для медицинского применения В УСЛОВИЯХ:
военных действий и ликвидации их последствий;
возникновения, предупреждения и ликвидации последствий ЧС;
угрозы возникновения, распространения новых особо опасных
инфекционных заболеваний и ликвидации их последствий;
профилактики, диагностики, лечения заболеваний и поражений,
полученных в результате воздействия неблагоприятных химических,
биологических, радиационных факторов, а также ликвидации их
последствий;
отсутствия или угрозы отсутствия ЛС на рынках государств - членов
ЕАЭС в условиях введения ограничительных экономических мер в
отношении хотя бы одного из государств-членов
19.
1.2 ► ВопросОсвобождает ли включение в Перечень
стратегических ЛС от регистрации
по Правилам ЕАЭС?
20.
ПРИМЕНИМОСТЬ ТРЕБОВАНИЙ
ПРАВА ЕАЭС
(за исключением процедурных) к
ЛС и МИ, зарегистрированным по
национальным правилам
21.
1.3 ► Соглашение ЛСОптовая реализация, транспортирование и
хранение ЛС на территориях государств-членов
осуществляются в соответствии с правилами
надлежащей дистрибьюторской практики,
утверждаемыми Комиссией ЕАЭС (ст.11).
Действие Соглашения распространяется на
правоотношения, возникающие
в сфере обращения ЛС,
находящихся в обращении в рамках Союза
(ст. 2).
22.
1.3 ► Соглашение МИпункт 3 статьи 6 Соглашения (МИ)
В случае прекращения производства МИ
производитель или его уполномоченный
представитель в течение 30 календарных дней с
даты принятия решения о прекращении
производства МИ обязан представить
соответствующую информацию в уполномоченный
орган, выдавший регистрационное удостоверение
МИ.
23.
1.1 ► ВопросПрименимы ли требования ЕАЭС к ЛС и МИ,
зарегистрированным по национальному
законодательству?
Мнение НЦЭЛС
24.
ЗАПРЕТ РЕКЛАМЫ ЛС:
влияние на фармацевтический
бизнес –
риски и рекомендации
25.
2.1 ► Планируемый запрет рекламыСтатья 56. Реклама в области здравоохранения
3. Запрещается:
2) реклама ЛС рецептурного отпуска в СМИ;
4. Распространение и размещение рекламы
услуг, ЛС и МИ допускаются в СМИ,
электронных информационных ресурсах в
организациях здравоохранения.
26.
2.1 ► Закон о СМИСМИ - периодическое печатное издание,
теле-, радиоканал, кинодокументалистика,
аудиовизуальная запись и иная форма
периодического или непрерывного
публичного распространения массовой
информации, включая интернет-ресурсы
27.
2.1 ► Закон о СМИ (запрет на владение СМИ)П. 2 ст. 5. Запрещается иностранцам и иностранным юридическим
лицам, лицам без гражданства прямо и (или) косвенно владеть,
пользоваться, распоряжаться и (или) управлять более 20
процентами акций (долей, паев) юридического лица собственника СМИ в Республике Казахстан или осуществляющего
деятельность в этой сфере.
Положение части первой настоящего пункта не распространяется
на интернет-ресурсы, предназначенные для электронной
коммерции.
28.
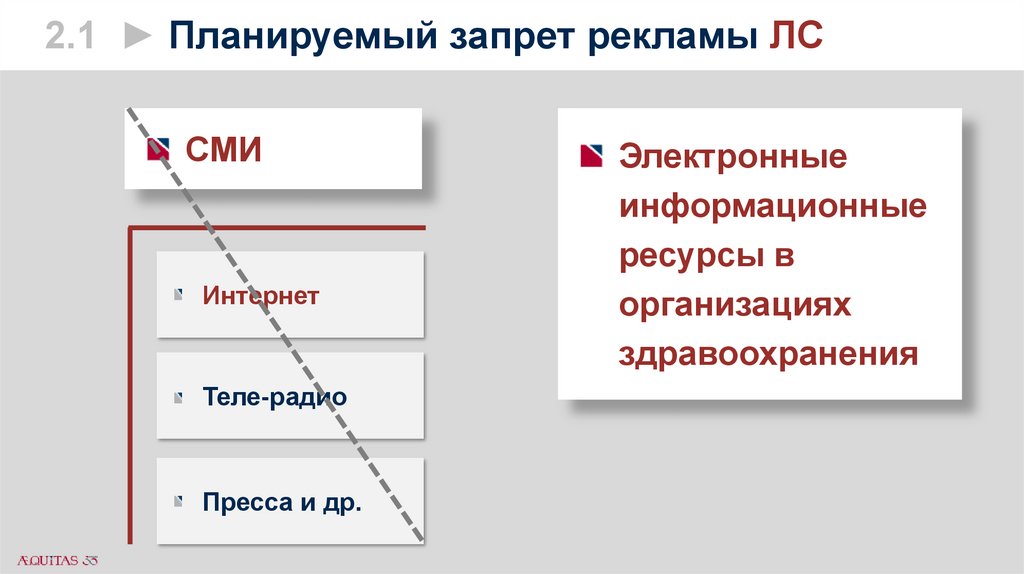
2.1 ► Планируемый запрет рекламы ЛССМИ
Интернет
Теле-радио
Пресса и др.
Электронные
информационные
ресурсы в
организациях
здравоохранения
29.
2.1 ► Закон об информатизацииЭлектронные информационные ресурсы данные в электронно-цифровой форме,
содержащиеся на электронном носителе
и в объектах информатизации
(ПО, интернет-ресурс, сети телекоммуникаций и др.)
30.
2.1 ► ВОЗФармацевтическое продвижение - это все
информационные и побуждающие действия,
производимые производителями и
дистрибьюторами, эффект которых направлен
на стимулирование назначения, поставки,
покупки и/или использования
лекарственных препаратов
31.
2.1 ► Формы продвижения ЛСРеклама СМИ
Не-рекламная информация
ЭИ Ресурсы в ОЗ
Товарные формы
(мерчендайзинг, упаковка...)
Маркетинговые
акции
Связь с
общественностью
Ежедневные врачебные
конференции, научнопрактические конференции,
специализированные
семинары
32.
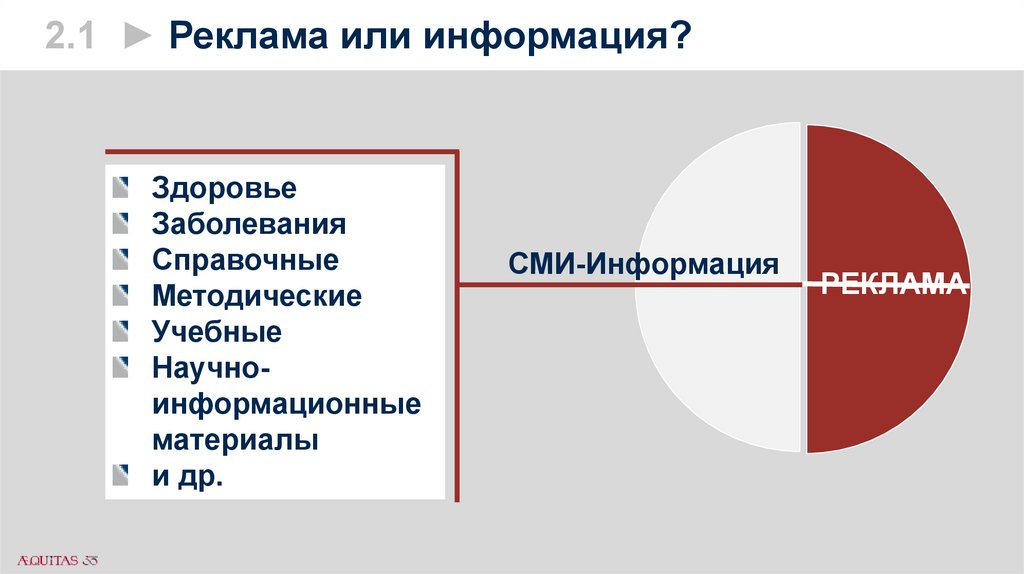
2.1 ► Реклама или информация?Здоровье
Заболевания
Справочные
Методические
Учебные
Научноинформационные
материалы
и др.
СМИ-Информация
РЕКЛАМА
33.
ЗАКОН ОБ ОНЛАЙН ПЛАТФОРМАХ
И ОНЛАЙН РЕКЛАМЕ:
влияние на фармацевтический
бизнес –
риски и рекомендации
34.
2.2 ► Вопросы для фармбизнесаКогда применяется?
Контент: реклама и др. информация
Дополнительные обязанности
35.
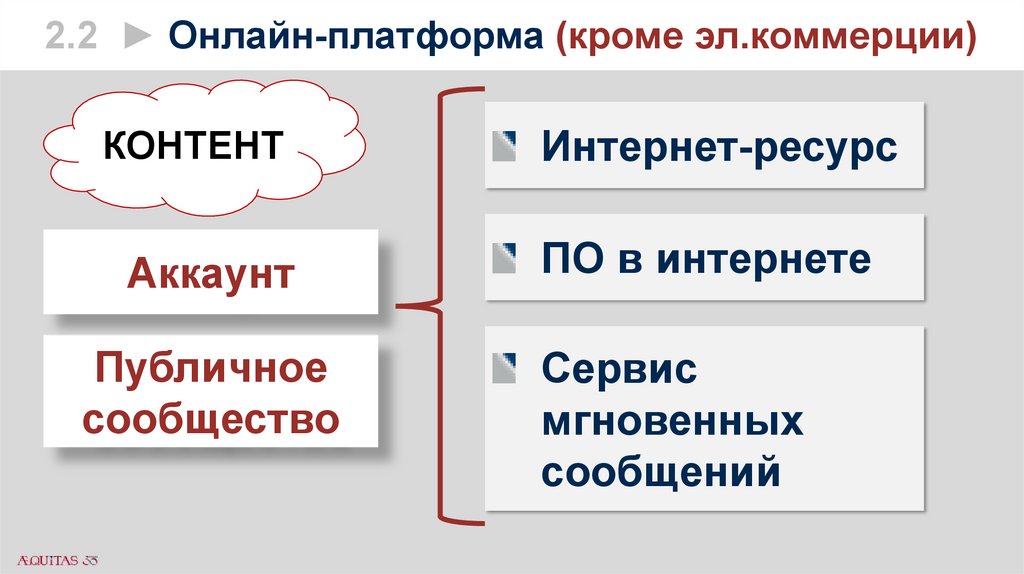
2.2 ► Онлайн-платформа (кроме эл.коммерции)КОНТЕНТ
Интернет-ресурс
Аккаунт
ПО в интернете
Публичное
сообщество
Сервис
мгновенных
сообщений
36.
2.2 ► Действие по кругу лицСобственник ОНП
Пользователь
Субъекты
Блогер
(предприниматель)
Другие
37.
2.2 ► Онлайн-платформаФункции и документы
Казахский язык
Подача
жалобы
Подсчёт
пользователей
Отключение профайлинга и
ограничение показа неинтересующего контента
Пользовательское соглашение
политика конфиденциальности
Ежегодный
отчет
38.
2.2 ► Онлайн-рекламаЛюбая реклама на онлайн-платформе
Таргетированная
Спонсорский контент
Иная информация
(неопределённому кругу лиц)
39.
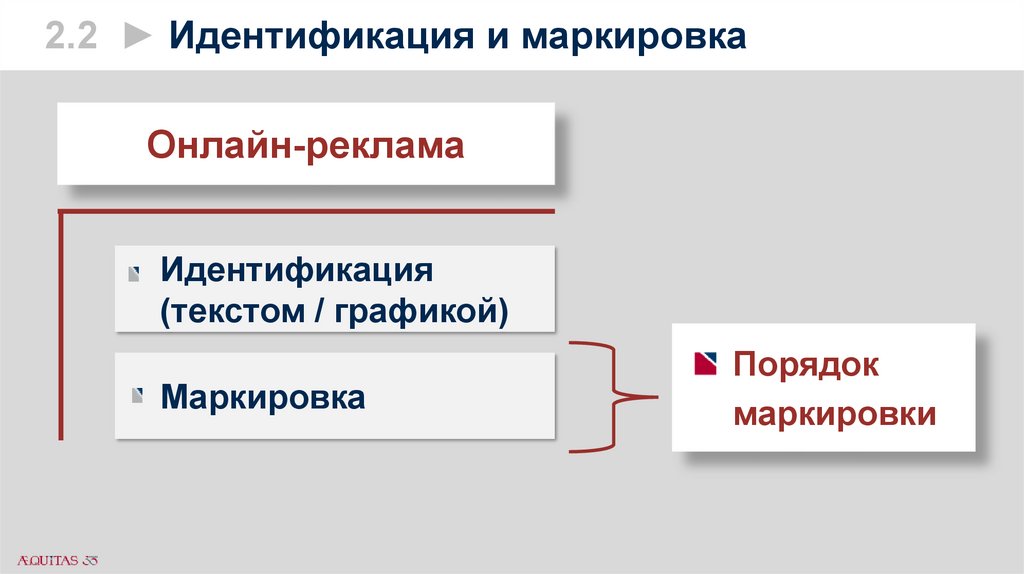
2.2 ► Идентификация и маркировкаОнлайн-реклама
Идентификация
(текстом / графикой)
Маркировка
Порядок
маркировки
40.
2.2 ► Проект Правил маркировки ОНРИнфлюенсеры (блогеры)
Коммерческая или договорная
основа рекламы
Маркировка текстом
Конкретные формулировки
текстовой маркировки
41.
2.2 ► ЗАПРЕЩЕНЫПРОФАЙЛИНГ на основе данных о состоянии
здоровья пользователя
ССЫЛКИ НА МНЕНИЯ третьих лиц в спонсорском
контенте без их согласия
42.
ДРУГИЕ НОВОСТИ
законодательства
43.
ВНЕШНИЕ ПОСТАВЩИКИ УСЛУГ В
СФЕРЕ ПРОДВИЖЕНИЯ
фармацевтической продукции
(не-медицинские посредники во
взаимоотношениях
с врачами, аптеками и пациентами) –
правовой режим
44.
3.1 ► «Медицинский маркетинг»«Технический»
«Взаимодействие»
Аналитика
Визиты
Изготовление
Мероприятия
Тренинги
Реклама
45.
3.1 ► Аутсорсинг продвиженияИмеет ли право на продвижение?
Подчиняется ли Правилам этики
продвижения?
46.
3.1 ► Ограничение взаимодействияП. 4 ст. 265 КоЗ: В медицинских организациях и
организациях образования в области
здравоохранения
запрещается продвижение ЛС и МИ
представителями производителей и (или)
дистрибьюторов,
за исключением проведения ежедневных
врачебных конференций, научно-практических
конференций и (или) специализированных
семинаров.
47.
3.1 ► Ограничение взаимодействияП. 13 Правил этики:
Исключаются индивидуальные контакты
производителей, дистрибьюторов или
уполномоченных представителей,
а также иных субъектов в сфере обращения ЛС и
МИ, наделённых полномочиями по продвижению
ЛС и МИ, с медицинскими и фармацевтическими
работниками в их рабочее время и на рабочем
месте с целью продвижения ЛС и МИ.
48.
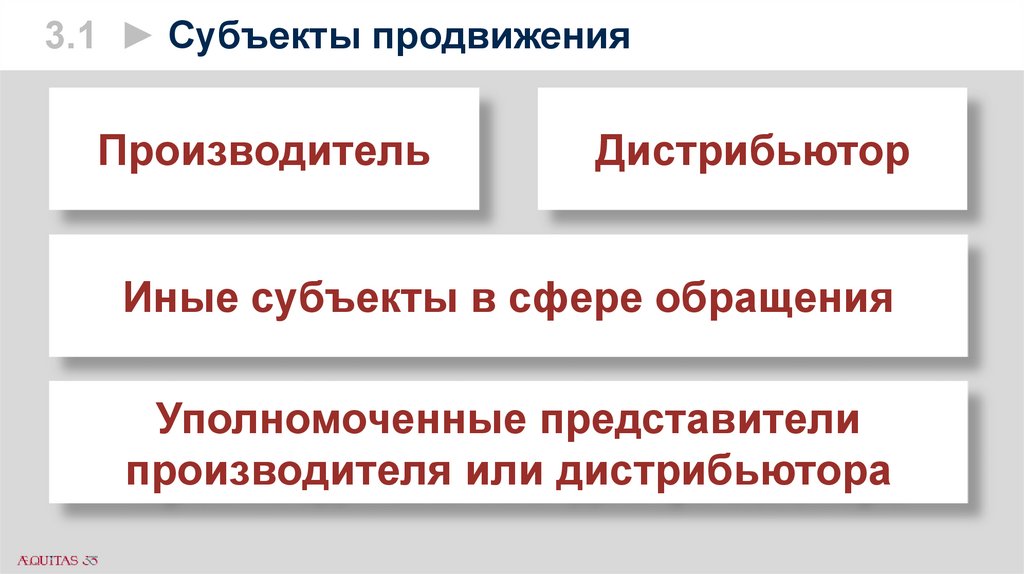
3.1 ► Субъекты продвиженияП. 13 Правил этики: Продвижение ЛС и МИ
осуществляет производитель, дистрибьютор
или их уполномоченные представители, а также
иные субъекты в сфере обращения
лекарственных средств и медицинских изделий,
наделённые соответствующими полномочиями
по продвижению ЛС и МИ, путём взаимодействия
субъектов в сфере обращения ЛС и МИ между
собой, а также с субъектами здравоохранения и
членами профессиональных ассоциаций.
49.
3.1 ► Субъекты продвиженияПроизводитель
Дистрибьютор
Иные субъекты в сфере обращения
Уполномоченные представители
производителя или дистрибьютора
50.
3.1 ► Уполномоченные представители (МИ)Уполномоченный представитель
производителя – юридическое или физическое
лицо, зарегистрированное в качестве ИП,
являющееся резидентом Республики Казахстан,
уполномоченные доверенностью производителя
МИ представлять его интересы по вопросам
обращения МИ на территории РК в соответствии с
законодательством РК…
(Правила фармаконадзора № ҚР ДСМ-320/2020)
51.
3.1 ► Уполномоченные лица – представители?Уполномоченное лицо производителя ЛС лицо, отвечающее за обеспечение и контроль
качества ЛС, произведённых производителем в
соответствии с законодательством Республики
Казахстан в области здравоохранения, и
вошедшее в реестр уполномоченных лиц
производителей ЛС
52.
3.1 ► Уполномоченные представителиУполномоченные представители
производителя МИ
Уполномоченные лица производителя ЛС
Уполномоченные представители
дистрибьютора ЛС и МИ
53.
3.1 ► Представительство от имени …Доверенность
Законодательство
Решение суда
Адм.акт
54.
3.1 ► Представителем не является (п.4 ст.163 ГК)Лица, хотя и действующие в чужом
интересе, но от собственного имени, а
также уполномоченные на вступление в
переговоры относительно возможных в
будущем сделок
55.
3.1 ► От имени дистрибьютораДоверенность
56.
3.1 ► Допустим ли аутсорсинг продвижения?По доверенности производителя
Коммерческое представительство
Реклама
Внутригрупповой аутсорсинг
57.
Правовой статус КРЕДИТ-НОТЫ во
взаимоотношениях
фармацевтических компаний с
дистрибьюторами, преимущества
и потенциальные риски,
влияние на регистрируемые цены
при импортных поставках
58.
3.2 ► Кредит-нота: основное применениеБанки (за рубежом)
Коммерция
Кредитный
дериватив
Взаиморасчёты
Обеспечение
Лимит закупа
Ценная бумага
59.
3.2 ► Кредит-нота: примерИсточник: http://www.glavbyh.ru/showthread.php?t=91850
60.
3.2 ► Кредит-нота: примерМы уменьшаем вашу задолженность…
Скидка (бонус) покупателю на сумму…
Мы кредитуем вашу задолженность…
Оплату производим кредит-нотой…
61.
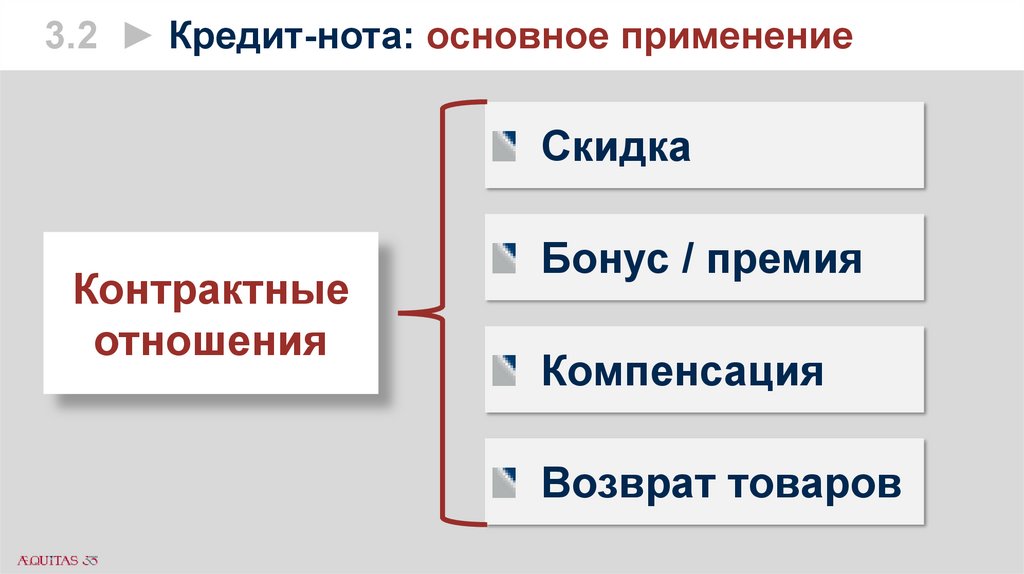
3.2 ► Кредит-нота: основное применениеСкидка
Контрактные
отношения
Бонус / премия
Компенсация
Возврат товаров
62.
3.2 ► Кредит-нота: сущностьЭкономическая
Юридическая
ДЕНЕЖНОЕ
ОБЯЗАТЕЛЬСТВО
Возникает
Уменьшается
63.
3.2 ► Кредит-нота: взаиморасчётыТекущие
Будущие
Прощение долга
Обещание скидки
Зачёт встречных
требований
Обязательство
по уплате денег
64.
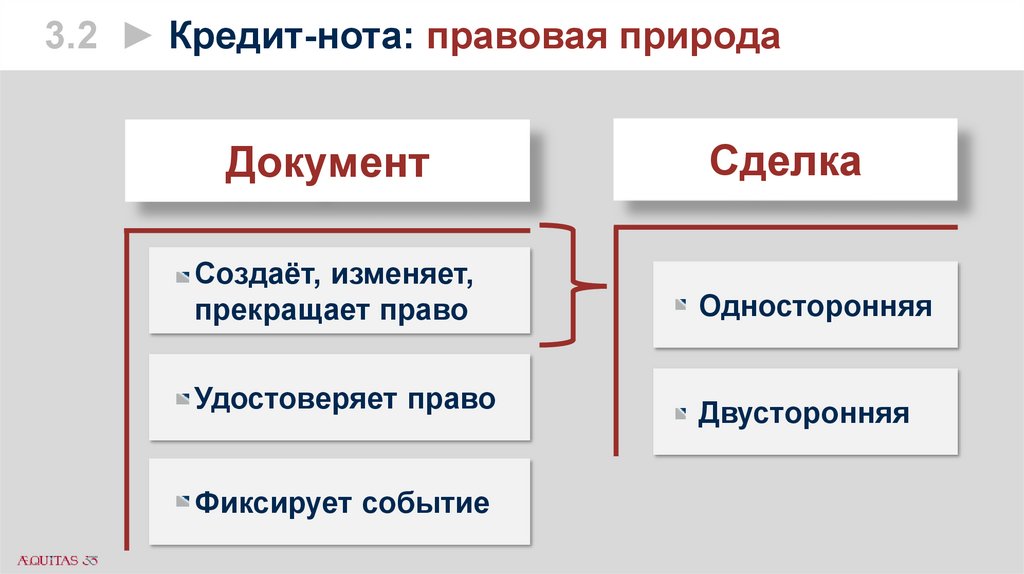
3.2 ► Кредит-нота: правовая природаДокумент
Сделка
Создаёт, изменяет,
прекращает право
Односторонняя
Удостоверяет право
Двусторонняя
Фиксирует событие
65.
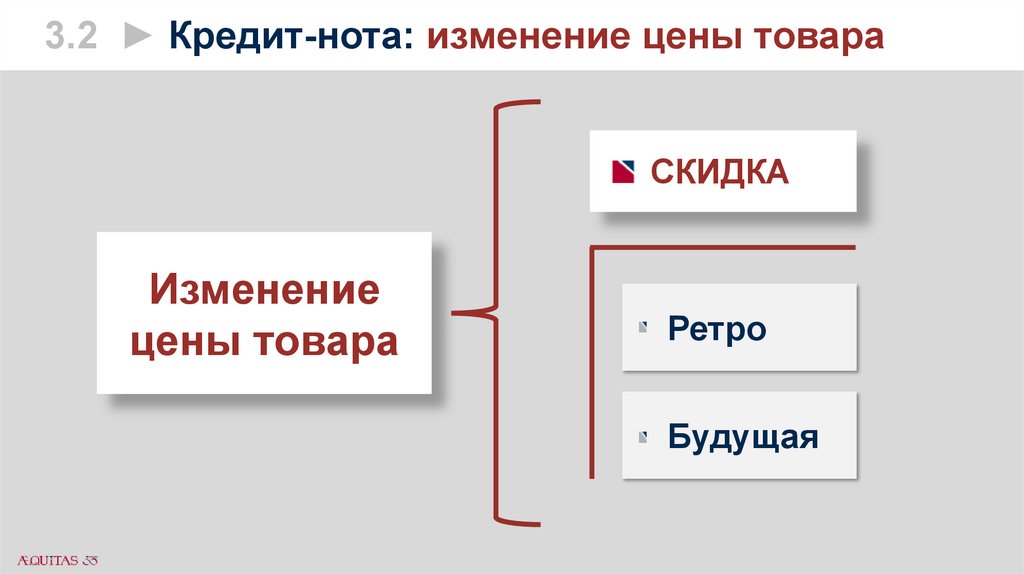
3.2 ► Кредит-нота: изменение цены товараСКИДКА
Изменение
цены товара
Ретро
Будущая
66.
3.2 ► Кредит-нотаБОНУС / ПРЕМИЯ
Выплата за
результат
Услуга
Подарок
Скидка
67.
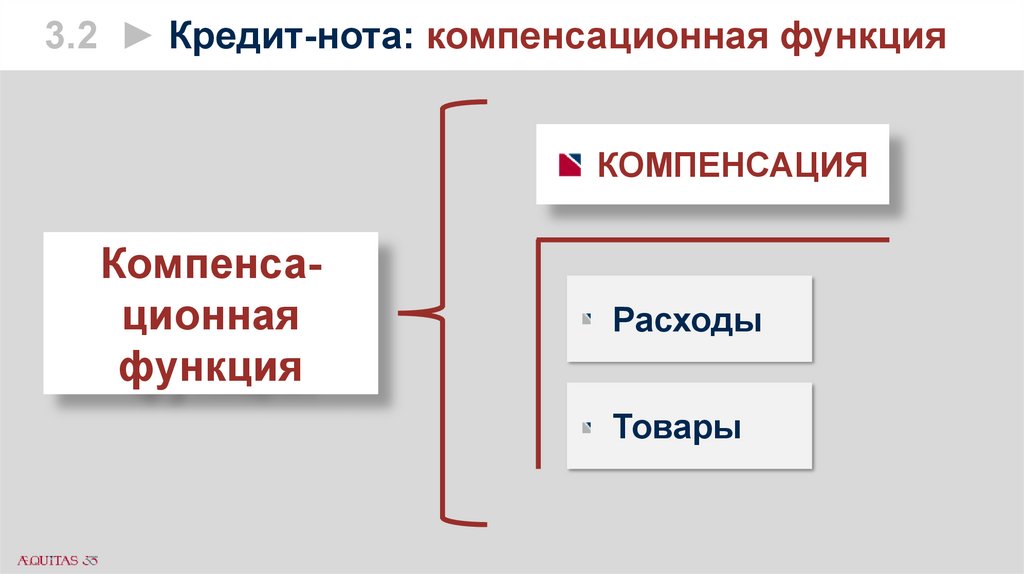
3.2 ► Кредит-нота: компенсационная функцияКОМПЕНСАЦИЯ
Компенсационная
функция
Расходы
Товары
68.
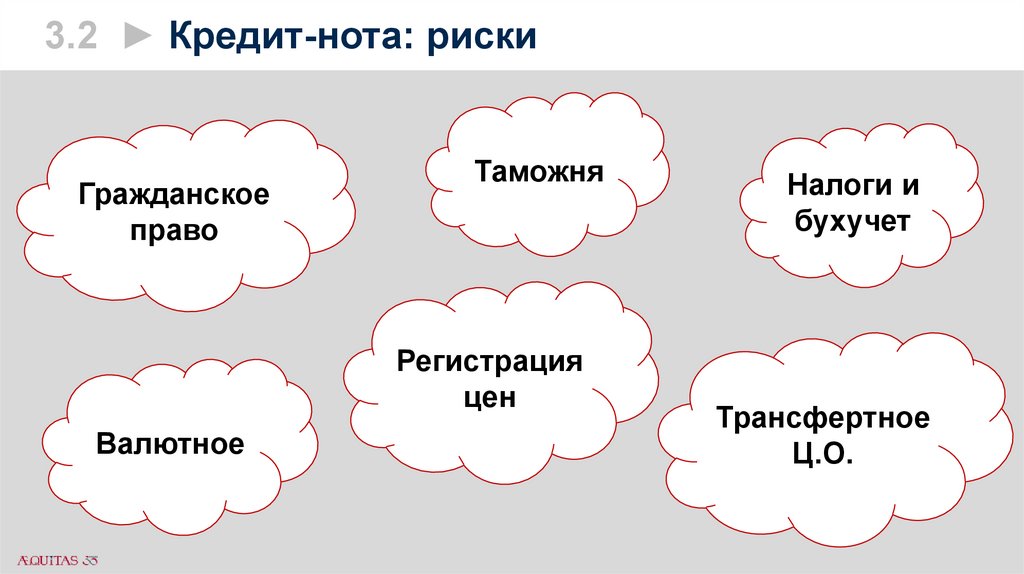
3.2 ► Кредит-нота: рискиГражданское
право
Таможня
Регистрация
цен
Валютное
Налоги и
бухучет
Трансфертное
Ц.О.


























































 business
business








