Similar presentations:
Методы титриметрии
1.
Методы титриметрииКислотно-основное титрование
Комплексометрическое титрование
Окислительно-восстановительное титрование
Осадительное титрование
2.
В основе метода нейтрализации лежиткислотно-основное взаимодействие:
• Взаимодействие протекает быстро и стехиометрично.
• Реакция практически необратима.
Константу равновесия, характеризующую процесс
диссоциации электролита, называют константой
диссоциации (KД).
Методом нейтрализации можно определять вещества,
вступающие в реакцию с кислотами или с основаниями,
если в результате образуются слабые электролиты для
которых
3.
Определяемые вещества:сильные и слабые кислоты, сильные и слабые основания,
гидролизующиеся соли.
Реактивы и рабочие растворы: кислоты, щёлочи, соли.
В качестве стандартных веществ используют
щавелевую кислоту Н2С2О4∙2Н2О,
тетраборат натрия Na2B4O7∙10H2O (бура),
карбонат натрия Na2CO3 (сода),
фиксанальные растворы HCl, H2SO4, HNO3, NaOH, KOH.
Порядок титрования.
«от кислоты к щёлочи» - это титрование кислот
растворами щелочей. Такой метод называют
.
«от щёлочи к кислоте» - это титрование щелочных
растворов кислотами. Такой метод называют
.
При выборе порядка титрования в качестве титранта
всегда используют более сильный электролит.
4.
• Определение конечной точки титрования в методенейтрализации.
Индикаторы – органические вещества, меняющие окраску
при резкой смене состава раствора (рН).
Основные индикаторы
IndOH + H+
Ind+ + H2O
Кислотные индикаторы
HInd + OH¯
Ind¯ + H2O
Перемена цвета индикатора – результат изменения его
внутреннего строения.
Областью перехода окраски индикатора (
)
называют интервал рН в котором происходит переход от
одной формы индикатора к другой.
Показателем титрования индикатора ( ) называют
значение рН раствора, при котором наблюдается отчётливое
изменение цвета.
В конечной точке титрования наблюдается избыток
титранта, поэтому индикатор должен менять окраску
как можно ближе к т.э.
5.
Характеристики некоторых кислотно-основныхиндикаторов
Индикатор
Метиловый
оранжевый
(м-о)
Метиловый
красный
(м-к)
Лакмус
Фенолфталеин
(ф-ф)
Тимолфталеин
ΔрН,
цвет
индикатора
рТ
Цвет индикатора при
разном значении рН
3.1 – 4.4
оранжевый
4.0
██████████████
0
4.0
14
4.4 – 6.2
оранжевый
5.5
███████████████
0
5.5
14
5.0 – 8.0
фиолетовый
8.0 – 10.0
розовый
9.4 – 10.6
голубой
███████████████
0
7
14
██████
9.0
0
9.0
14
█████
10.0
0
10.0 14
7.0
6.
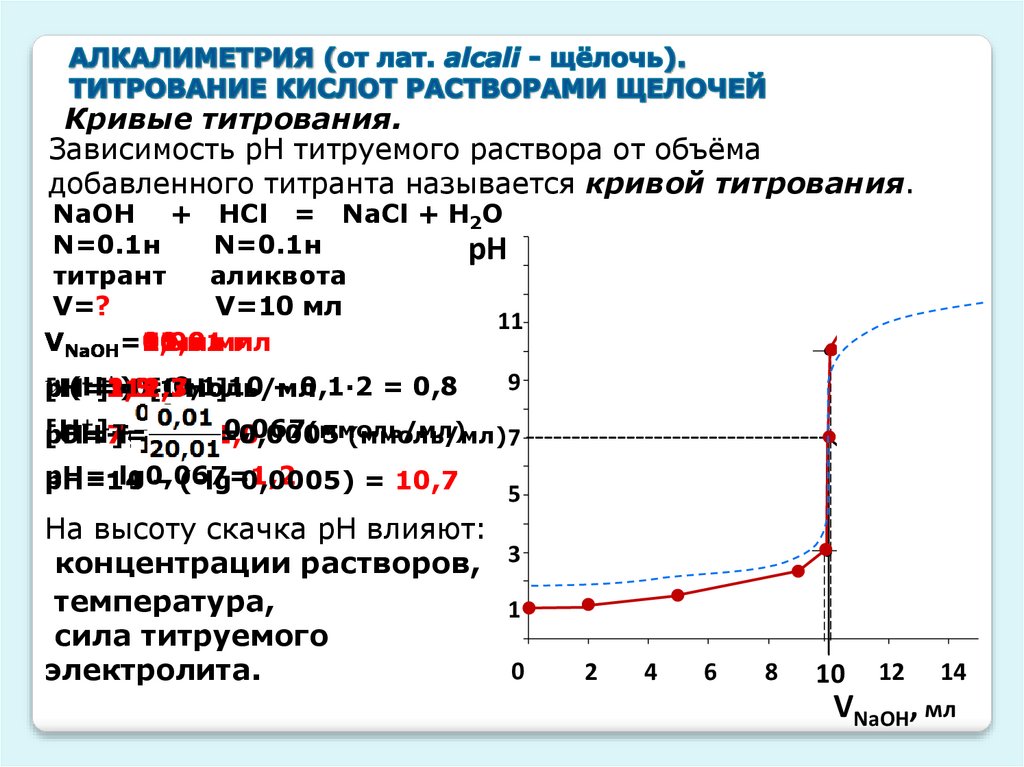
Кривые титрования.Зависимость рН титруемого раствора от объёма
добавленного титранта называется кривой титрования.
NaOH + HCl = NaCl + H2O
N=0.1н
N=0.1н
рН
титрант
аликвота
V=?
V=10 мл
11
VNaOH=15
=0 мл
=2
=5
=9
=9,99
=10,01
=11
млмл
мл
=10
+) = 0,1·10
+=
-]
ν[H(Н
– 0,1·2 = 0,8
рН=1,5
рН=2,3
рН=3,3
[Н
рН
]=0,1
]
<
11,7
12,3
[ОН
моль/мл
=
9
скачок рН
-]=
[H+]=
= =0,0005
0,067(ммоль/мл)
[ОН
рН=-lg0,1=1,0
(ммоль/мл)7
рН=7
рН=-lg0,067=1,2
рН=14 – (-lg 0,0005) = 10,7
тэ
5
На высоту скачка рН влияют:
концентрации растворов, 3
температура,
1
сила титруемого
0
электролита.
2
4
6
8
14
VNaOH, мл
10
12
7.
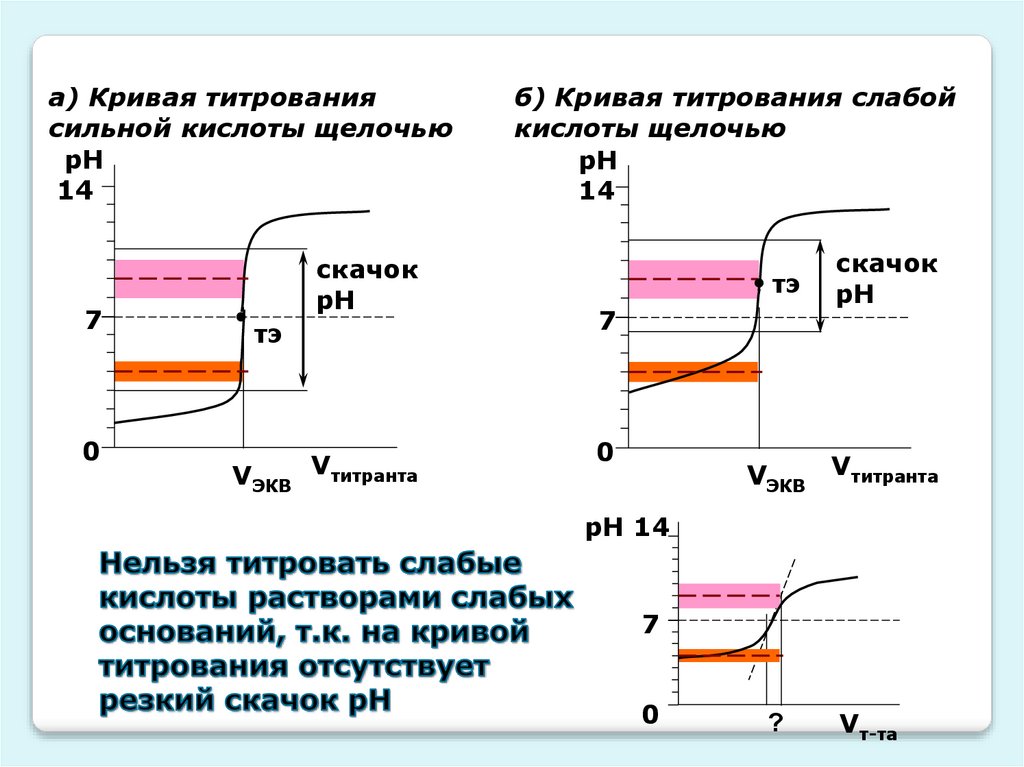
а) Кривая титрованиясильной кислоты щелочью
рН
14
7
0
скачок
рН
тэ
VЭКВ
Vтитранта
б) Кривая титрования слабой
кислоты щелочью
рН
14
тэ
скачок
рН
VЭКВ
Vтитранта
?
Vт-та
7
0
рН 14
7
0
8.
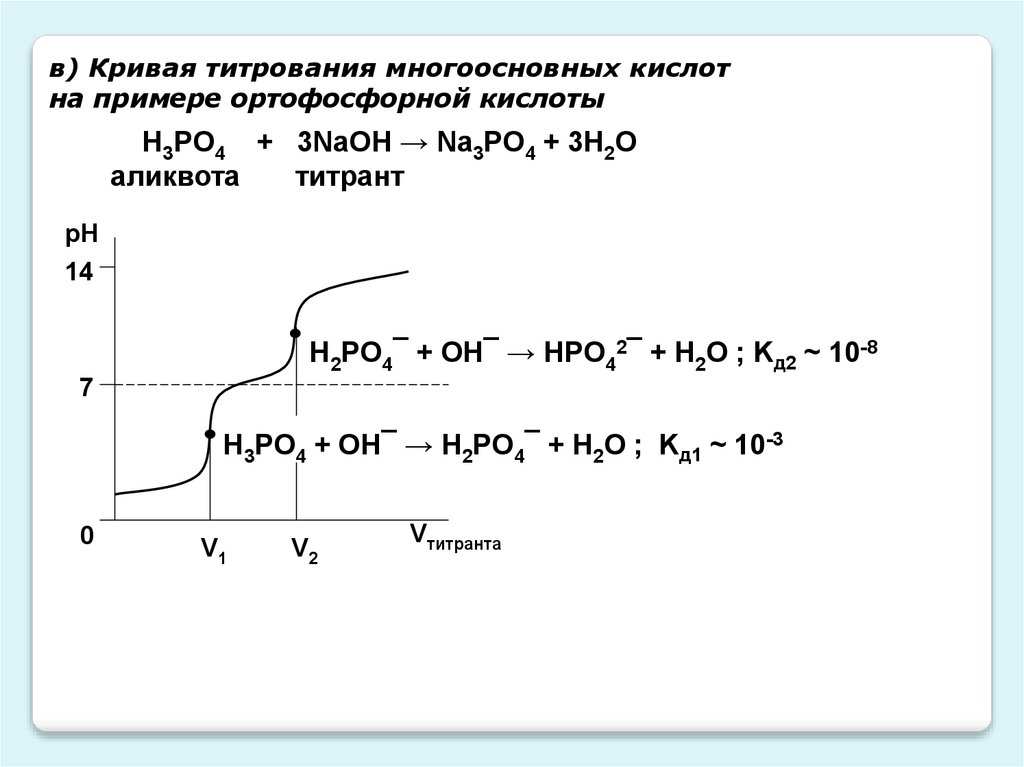
в) Кривая титрования многоосновных кислотна примере ортофосфорной кислоты
H3PO4 + 3NaOH → Na3PO4 + 3H2O
аликвота
титрант
рН
14
Н2PO4¯ + OH¯ → НPO42¯ + H2О ; Kд2 ~ 10-8
7
H3PO4 + OH¯ → Н2PO4¯ + H2О ; Kд1 ~ 10-3
0
V1
V2
Vтитранта
9.
Определение содержания сильных и слабых кислот врастворах при:
• стандартизации растворов,
• определении общей кислотности плодов или овощей,
кисломолочных продуктов и других продуктов питания;
• определении содержания кислот в образцах
химической или фармацевтической продукции.
Определение содержания солей:
• солей cлабых оснований (Кд < 10-5) и сильных кислот
(соли аммония или соли органических оснований);
Определение азота в органических веществах по
Кьельдалю.
10.
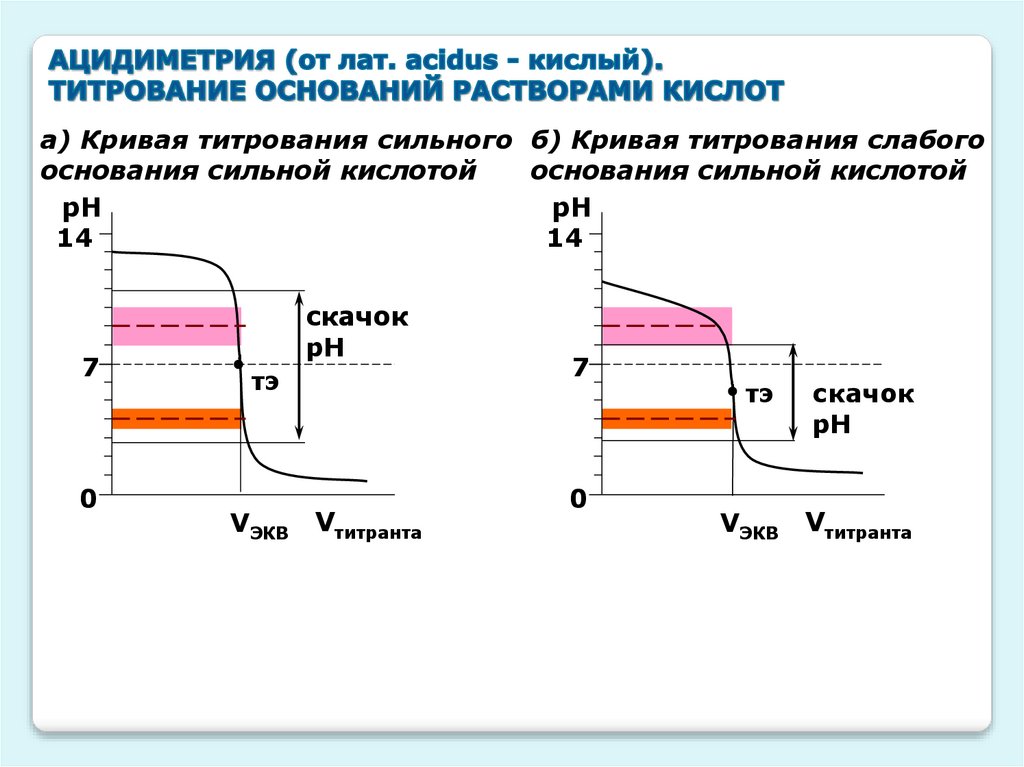
а) Кривая титрования сильного б) Кривая титрования слабогооснования сильной кислотой
основания сильной кислотой
рН
рН
14
14
7
0
скачок
рН
тэ
VЭКВ
Vтитранта
7
0
тэ
скачок
рН
VЭКВ
Vтитранта
11.
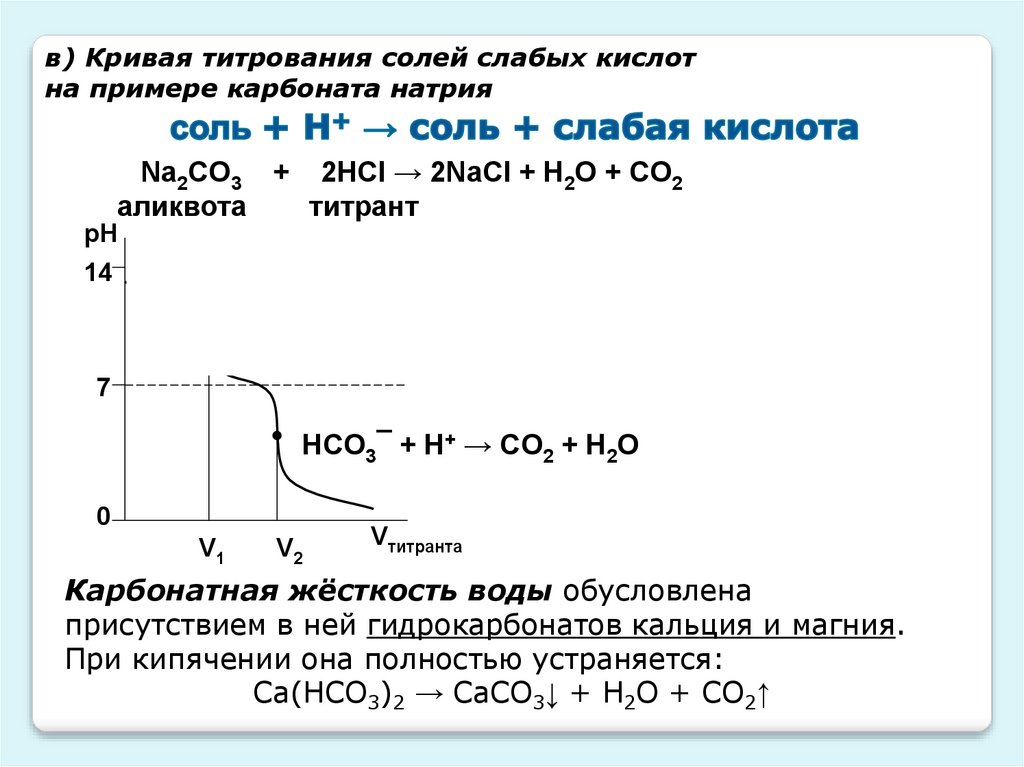
в) Кривая титрования солей слабых кислотна примере карбоната натрия
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
аликвота
титрант
рН
14
CO32¯ + H+ → НCO3¯
7
HCO3¯ + H+ → CO2 + H2О
0
V1
V2
Vтитранта
Карбонатная жёсткость воды обусловлена
присутствием в ней гидрокарбонатов кальция и магния.
При кипячении она полностью устраняется:
Са(НСО3)2 → СаСО3↓ + Н2О + СО2↑
12.
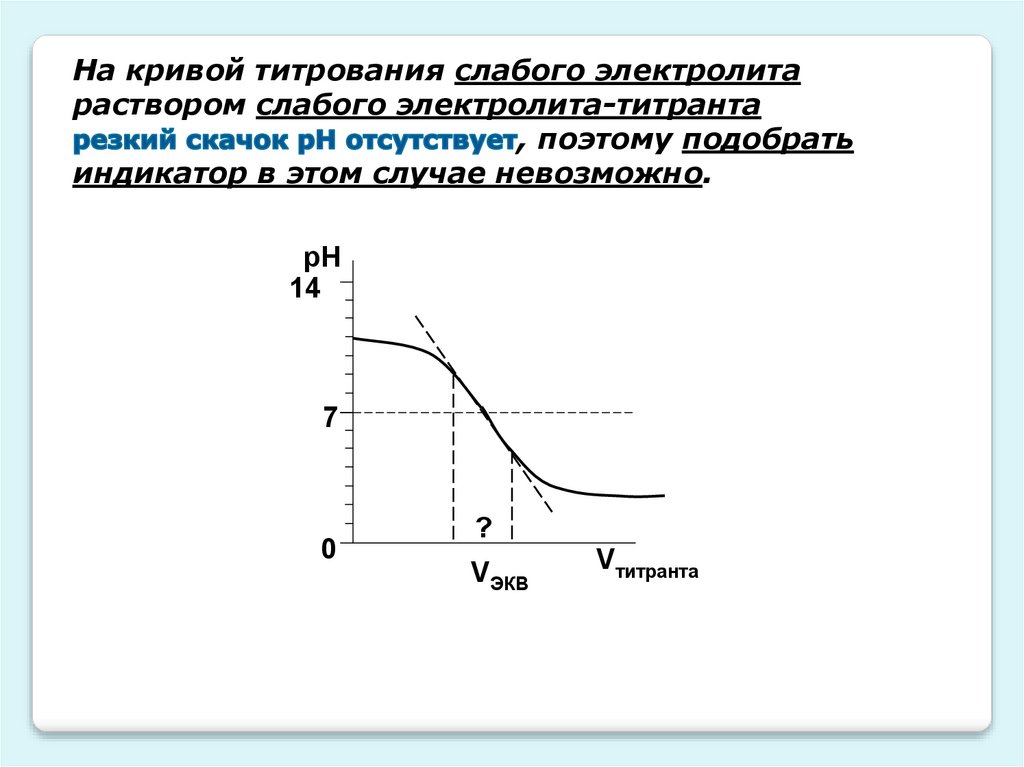
На кривой титрования слабого электролитараствором слабого электролита-титранта
, поэтому подобрать
индикатор в этом случае невозможно.
рН
14
7
0
?
VЭКВ
Vтитранта
13.
Определение содержания сильных и слабых основанийв растворах при:
• стандартизации растворов,
• определении общей щёлочности воды, продуктов
питания и других объектов;
• определении содержания органических оснований в
образцах природного или промышленного
происхождения.
Определение содержания
солей слабых кислот (Кд < 10-5) и сильных оснований –
карбонатов, фосфатов, солей органических кислот и
т.д.
14.
Ионное произведение воды: [H+]·[OH-] = 10-14-lg([H+]·[OH-]) = -lg10-14
-lg[H+] + (-lg[OH-]) = 14
Введем обозначения:
1=100 моль/л
10-7моль/л
0
7
3-4
кислая среда
10-11
10-14моль/л
14
щелочная среда
нейтральная среда
назад








 chemistry
chemistry








