Similar presentations:
Методы нейтрализации
1.
Методы нейтрализацииИсабаева Манар
Амангельдиевна
к.х.н., профессор
Павлодар,
2022 г.
2.
Кислотноосновное титрование (метод нейтрализации)Методом нейтрализации называют метод объемного анализа основанный на применении реакции
взаимодействия ионов «Н+» и «ОН-»
HCl + NaOH → NaCl + H2O
Н+ + ОН- → H2O
Рабочими растворами в методе нейтрализации являются растворы сильных кислот и щелочей: HCl, Н2SO4,
NaOH, КОН. Индикаторами в методе ней-ии служат – метилоранжевый, метилкрасный, фенолфтамин, лакмус и
т.д.
Методом нейтрализации определяют общую жесткость воды, количественное содержание кислоты и
щелочи. Карбонатную жесткостьH2O и т.д.
Индикаторы метода нейтрализации: индикаторы применяемые в методе нейтрализации представляют
собой органические соединения, окраска которых меняется в зависимости от концентрации ионов «Н» в
растворе. Такие индикаторы называют кислотно-основными индикаторами или рН-индикатором. Для
индикаторов применяемых в методе нейтрализации характерен интервал перехода индикатора - он
определяется значением рН раствора, в котором происходит заметное изменение окраски индикатора.
Например: область перехода метилоранжевого находится при рН от 3,1-4,4. При рН больше 4,4
метилоранжевый желтого цвета, при pH меньше 3,1 розового цвета.
3.
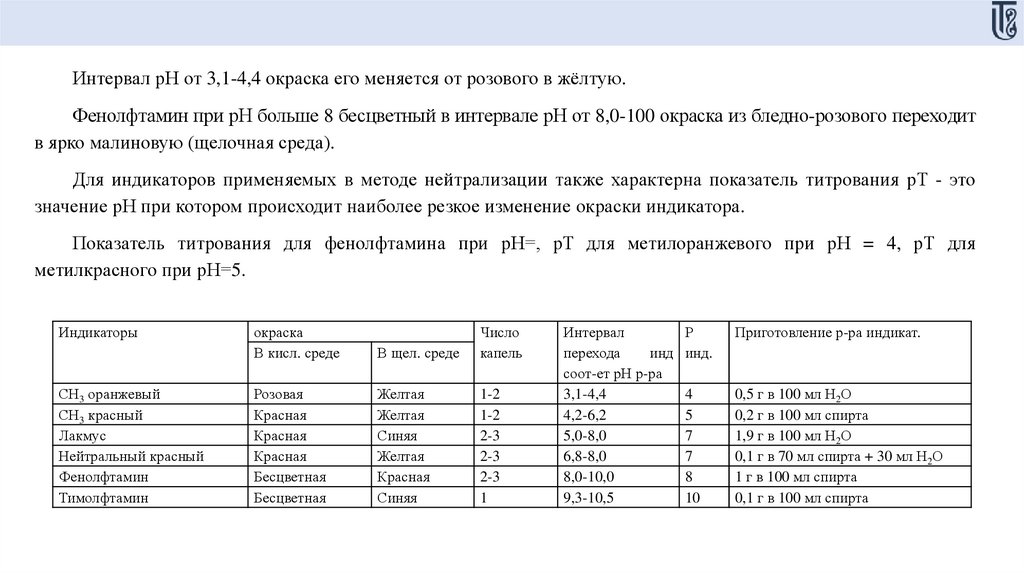
Интервал рН от 3,1-4,4 окраска его меняется от розового в жёлтую.Фенолфтамин при рН больше 8 бесцветный в интервале рН от 8,0-100 окраска из бледно-розового переходит
в ярко малиновую (щелочная среда).
Для индикаторов применяемых в методе нейтрализации также характерна показатель титрования рТ - это
значение рН при котором происходит наиболее резкое изменение окраски индикатора.
Показатель титрования для фенолфтамина при рН=, рТ для метилоранжевого при рН = 4, рТ для
метилкрасного при рН=5.
Индикаторы
СН3 оранжевый
СН3 красный
Лакмус
Нейтральный красный
Фенолфтамин
Тимолфтамин
окраска
В кисл. среде
В щел. среде
Число
капель
Розовая
Красная
Красная
Красная
Бесцветная
Бесцветная
Желтая
Желтая
Синяя
Желтая
Красная
Синяя
1-2
1-2
2-3
2-3
2-3
1
Интервал
перехода
инд
соот-ет рН р-ра
3,1-4,4
4,2-6,2
5,0-8,0
6,8-8,0
8,0-10,0
9,3-10,5
Р
инд.
Приготовление р-ра индикат.
4
5
7
7
8
10
0,5 г в 100 мл Н2О
0,2 г в 100 мл спирта
1,9 г в 100 мл Н2О
0,1 г в 70 мл спирта + 30 мл Н2О
1 г в 100 мл спирта
0,1 г в 100 мл спирта
4.
Выборы индикатора в методе кислотно-основного титрования.При выборе индикатора нужно учитывать, то что интервал рН, в котором меняется окраска индикатора
должен лежать по возможности ближе к рН раствора в точке эквивалентности.
Условия титрования и применимые индикаторы.
Условия титрования
Сильную кислоту титруют сильной
щелочью
Сильную щелочь титруют сильной
кислотой
Слабую щелочь титруют сильной
кислотой
Слабую кислоту титруют сильной
щелочью
рН в момент эквивалентности
7
Применяемый индикатор
фенолфтамин
7
То же
< 7 (слабокис. ср.)
Метилоранжевый, метилкрасный
>7 (слабощелочная среда)
Фенолфтамин
5.
Титрование сильной кислоты сильной щелочи.Если титровать сильную кислоту сильной щелочью NaOHконцентрации которых одинаковы (0,1). В
момент эквивалентности в титруемом растворе образуется NaCl. Эта соль не подвергается гидролизу, поэтому
рН=7. Также можно применять индикатор в пределах pH от 4 до 10 и ошибка не должна превышать 0,125%,
поэтому можно применять все индикаторы.
Титрование слабой кислоты сильной щелочью.
Например: титруем СН3СООН сильной щелочью. В момент эквивалентности в растворе присутствуют
соли СН3СООNa образованная слабой кислотой и сильным основанием. В результате гидролиза соли раствор
имеет щелочную реакцию. Поэтому при титровании слабой кислоты сильной щелочью, необходимо
применять индикаторы, которые меняют окраску при pH больше 7 (фенолфтамин) рН=8,87.
6.
Титрование слабого основания сильной кислотой.Например: Титруют NH4OH с соляной кислотой HCl. В момент эквивалентности в растворе находится
сольNH4Cl образованная сильной кислотой и слабым основанием.
В следствии гидролиза соли реакция раствора в момент эквивалентности кислая поэтому нужно
применять такие индикаторы, которые меняют окраску при pH меньше 7, такими индикаторами являются
метиловый оранжевый и метилово красный. (pH = 5,28).
Кривые титрования по методу нейтрализации.
По мере приливания к кислоте раствора щелочи степень кислотности титруемого раствора изменяется и
реакция среды переходит из кислой в нейтральную, а затем в щелочную → pH титр. раствора зависит от
объема прилитого рабочего раствора и его концентрации. Этузависимость можно выразить графически
откладывая по одной оси значения pH, а по другой объема прилитого рабочего раствора.
Кривая выражающая изменение значения pH титруемого раствора в зависимости от объема прилитого
рабочего раствора называется кривой титрования.
7.
Построить кривую титрования - это значит нанести на график следующие точки:1. Исходную точку титрования, соответствующую значению pH титруемого раствора до начала титрования. Эта
точка находится всегда на вертикальной линии соответствующей рабочего раствора.
2. Точку эквивалентности показывающую, при каком значении pH должно быть закончено титрование. Эта
точка всегда лежит на линии эквивалентности.
3. Промежуточные точки кривой, показывающие как измеряется pH рабочего раствора в процессе титрования.
8.
Вычисления рН растворов сильныхкислот и оснований слабых кислот и
оснований, буферных р-ов, растворов смеси
кислот гидролизующихся солей.
[H] в водном растворе зависит от конц.
кислоты,
щелочи,
соли,
от
константы
диссоциации сл. кислот и оснований, и от
ионного произведения воды.
9.
Задача: Вычислить рН каждую из следующих растворова) 0,1н НСl б) 0,1н CH3COOH в) 0,1н H3PO4 а)1; б)2,87;1,48









 chemistry
chemistry








