Similar presentations:
Использование рекомбинантных микроорганизмов в производстве коммерческих продуктов
1.
«ИСПОЛЬЗОВАНИЕ РЕКОМБИНАНТНЫХМИКРООРГАНИЗМОВ В ПРОИЗВОДСТВЕ
КОММЕРЧЕСКИХ ПРОДУКТОВ»
Выполнил: ст. гр. МТБ02-23-01
Перерва В.В.
Принял: проф., д-р хим. наук
Зорин В.В.
1
2.
Разработка модулей устойчивости к воздействию синтетических кислот,которые повышают рост и продуктивность по лизину промышленной кишечной
палочки при ферментации с низком pH
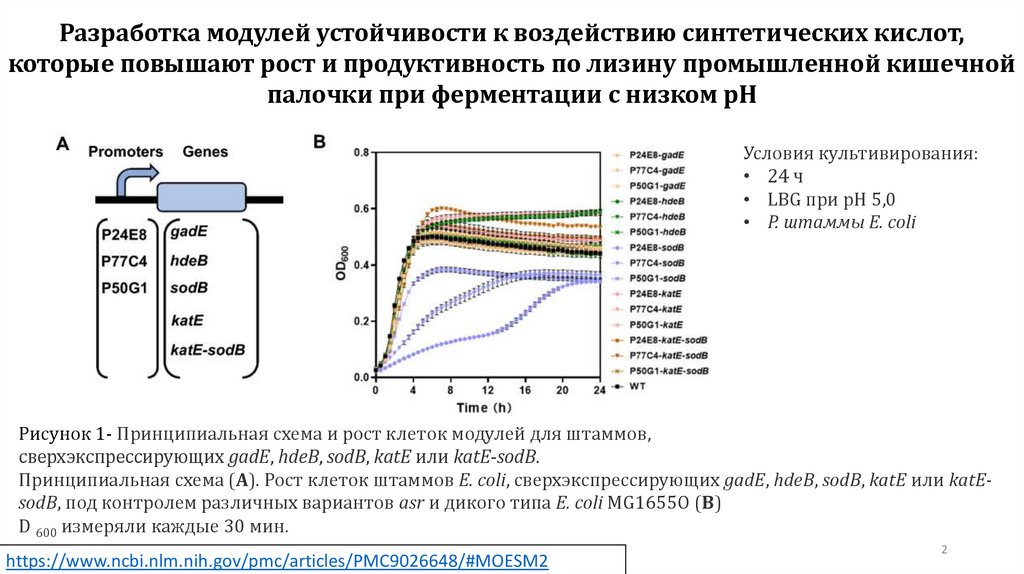
Условия культивирования:
• 24 ч
• LBG при pH 5,0
• Р. штаммы E. coli
Рисунок 1- Принципиальная схема и рост клеток модулей для штаммов,
сверхэкспрессирующих gadE, hdeB, sodB, katE или katE-sodB.
Принципиальная схема (A). Рост клеток штаммов E. coli, сверхэкспрессирующих gadE, hdeB, sodB, katE или katEsodB, под контролем различных вариантов asr и дикого типа E. coli MG1655O (B)
D 600 измеряли каждые 30 мин.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9026648/#MOESM2
2
3.
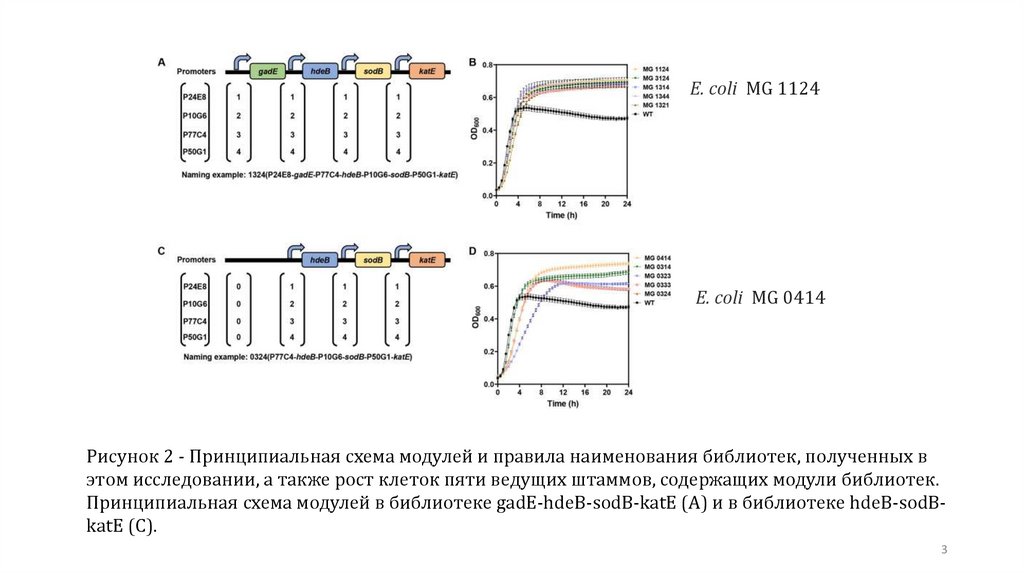
E. coli MG 1124E. coli MG 0414
Рисунок 2 - Принципиальная схема модулей и правила наименования библиотек, полученных в
этом исследовании, а также рост клеток пяти ведущих штаммов, содержащих модули библиотек.
Принципиальная схема модулей в библиотеке gadE-hdeB-sodB-katE (A) и в библиотеке hdeB-sodBkatE (C).
3
4.
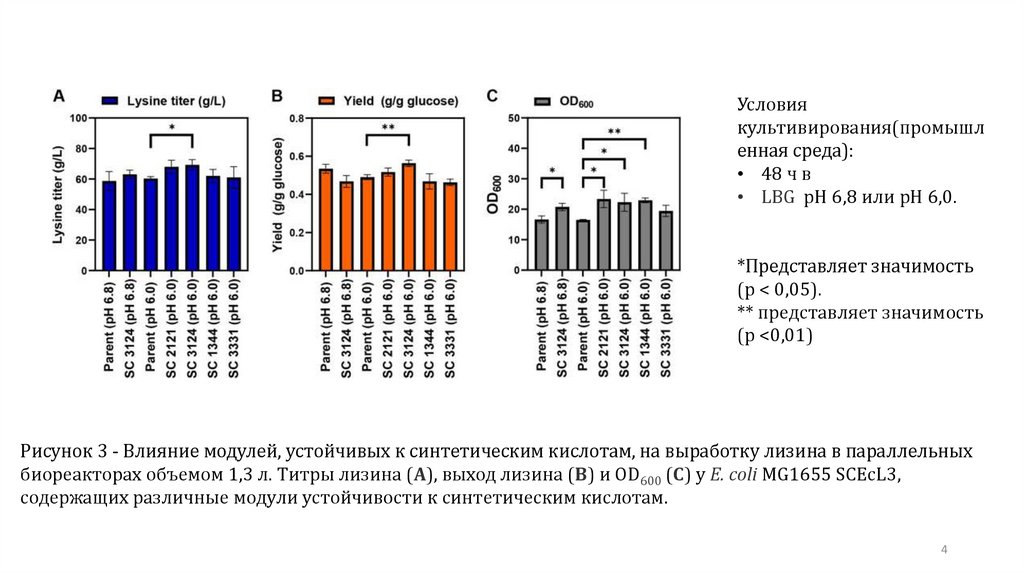
Условиякультивирования(промышл
енная среда):
• 48 ч в
• LBG pH 6,8 или pH 6,0.
*Представляет значимость
(p < 0,05).
** представляет значимость
(p <0,01)
Рисунок 3 - Влияние модулей, устойчивых к синтетическим кислотам, на выработку лизина в параллельных
биореакторах объемом 1,3 л. Титры лизина (A), выход лизина (B) и OD600 (C) у E. coli MG1655 SCEcL3,
содержащих различные модули устойчивости к синтетическим кислотам.
4
5.
Инструментарий клонирования на основе Golden Gate для созданиябиблиотек путей виолацеина в Yarrowia lipolytica
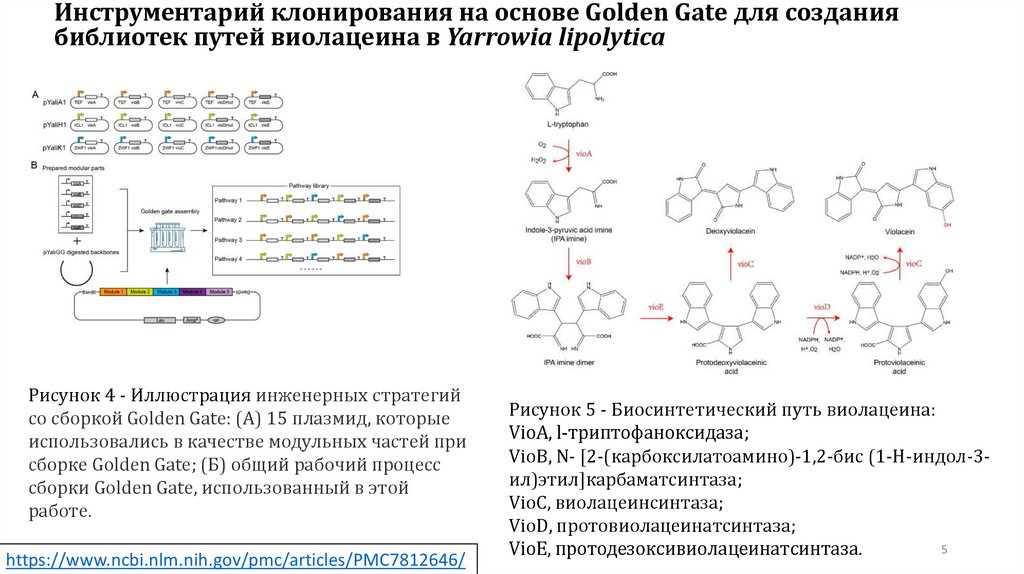
Рисунок 4 - Иллюстрация инженерных стратегий
со сборкой Golden Gate: (А) 15 плазмид, которые
использовались в качестве модульных частей при
сборке Golden Gate; (Б) общий рабочий процесс
сборки Golden Gate, использованный в этой
работе.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7812646/
Рисунок 5 - Биосинтетический путь виолацеина:
VioA, l-триптофаноксидаза;
VioB, N- [2-(карбоксилатоамино)-1,2-бис (1-H-индол-3ил)этил]карбаматсинтаза;
VioC, виолацеинсинтаза;
VioD, протовиолацеинатсинтаза;
5
VioE, протодезоксивиолацеинатсинтаза.
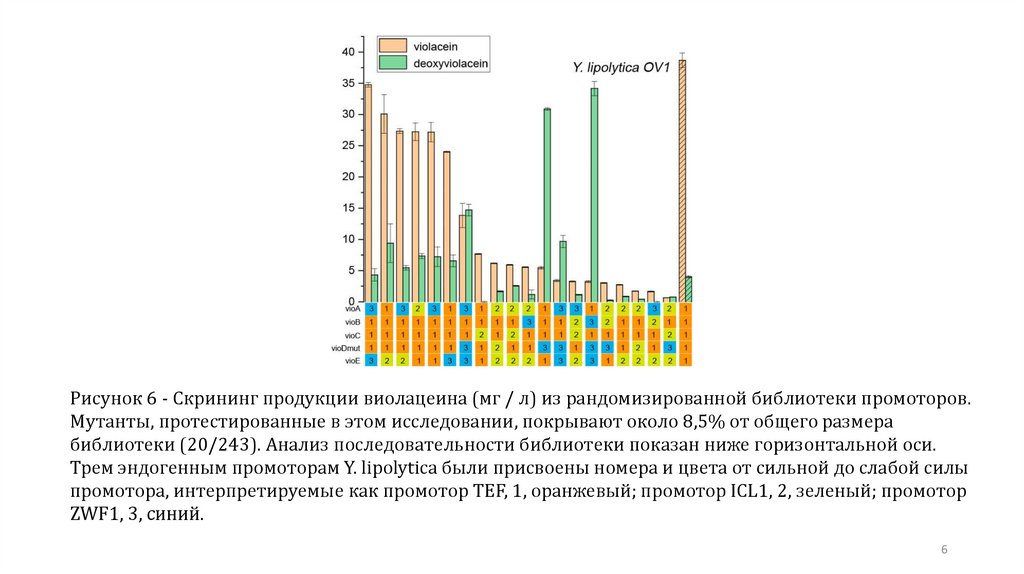
6.
Рисунок 6 - Скрининг продукции виолацеина (мг / л) из рандомизированной библиотеки промоторов.Мутанты, протестированные в этом исследовании, покрывают около 8,5% от общего размера
библиотеки (20/243). Анализ последовательности библиотеки показан ниже горизонтальной оси.
Трем эндогенным промоторам Y. lipolytica были присвоены номера и цвета от сильной до слабой силы
промотора, интерпретируемые как промотор TEF, 1, оранжевый; промотор ICL1, 2, зеленый; промотор
ZWF1, 3, синий.
6
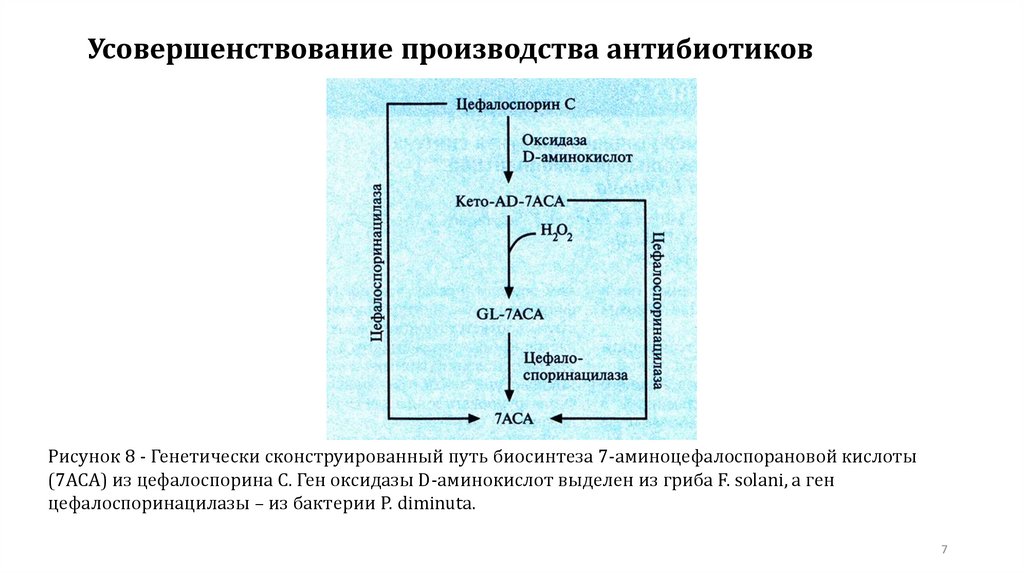
7.
Усовершенствование производства антибиотиковРисунок 8 - Генетически сконструированный путь биосинтеза 7-аминоцефалоспорановой кислоты
(7АСА) из цефалоспорина С. Ген оксидазы D-аминокислот выделен из гриба F. solani, а ген
цефалоспоринацилазы – из бактерии P. diminuta.
7
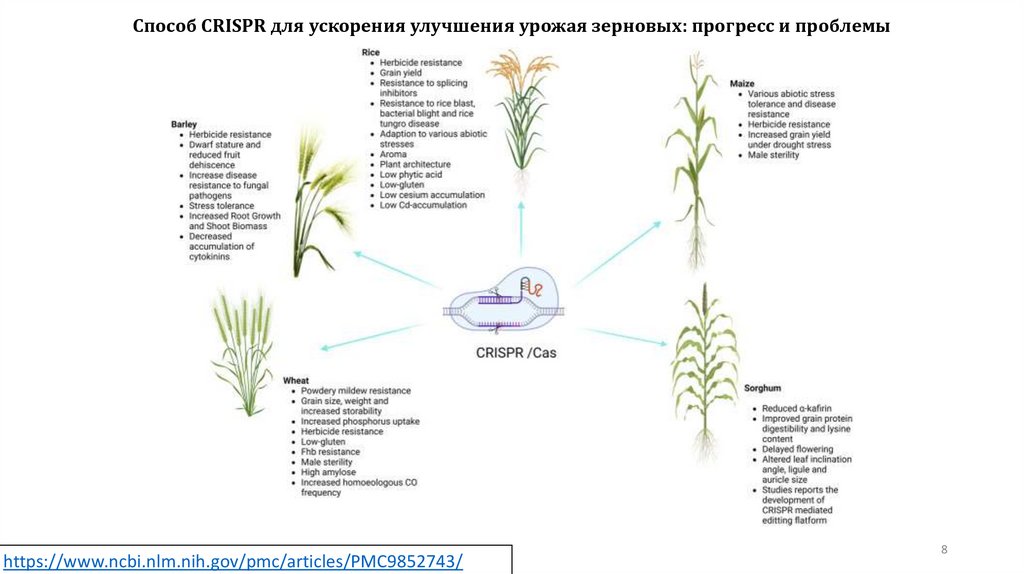
8.
Способ CRISPR для ускорения улучшения урожая зерновых: прогресс и проблемыhttps://www.ncbi.nlm.nih.gov/pmc/articles/PMC9852743/
8

 biology
biology








