Similar presentations:
Электролитическая диссоциация
1.
Муниципальное общеобразовательное учреждение«Средняя общеобразовательная школа № 11»
г. Алатыря.
«Электролитическая
диссоциация»
2.
Цели урока:1. Познакомиться с новыми понятиями:
• электролиты,
• неэлектролиты,
• электролитическая диссоциация.
2. Рассмотреть механизм электролитической диссоциации.
3. Рассмотреть вопрос:
• электролитическая диссоциация и жизнь человека,
3.
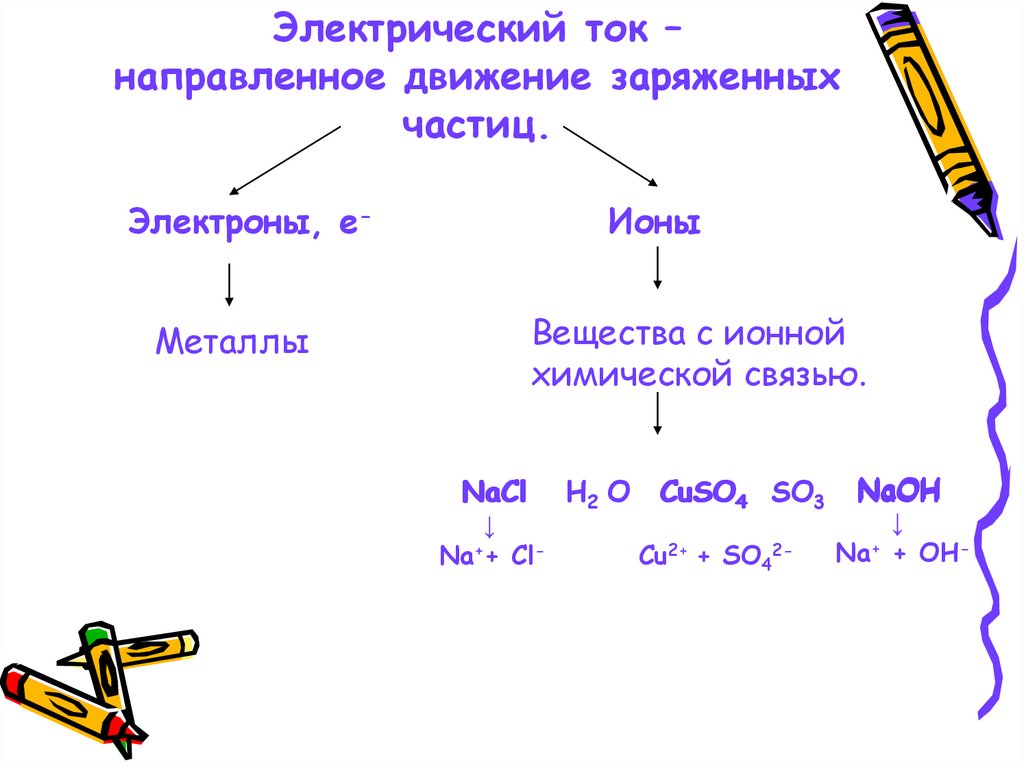
Электрический ток –направленное движение заряженных
частиц.
Электроны, е-
Ионы
Вещества с ионной
химической связью.
Металлы
NaCl
↓
Na++ Cl-
H2 О
CuSO4 SO3
Cu2+ + SO42-
NaOH
↓
Na+ + OH-
4.
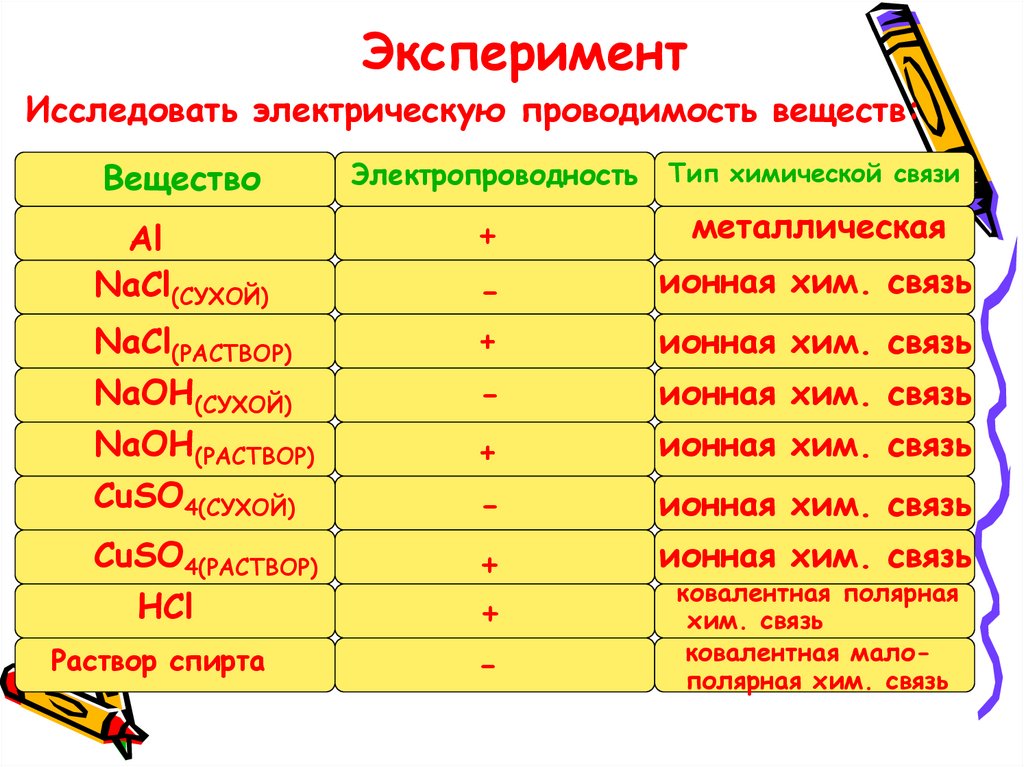
ЭкспериментИсследовать электрическую проводимость веществ:
Вещество
Электропроводность
Тип химической связи
Al
NaCl(СУХОЙ)
+
металлическая
CuSO4(РАСТВОР)
HCl
Раствор спирта
+
+
+
NaCl(РАСТВОР)
NaOH(СУХОЙ)
NaOH(РАСТВОР)
CuSO4(СУХОЙ)
+
-
ионная хим. связь
ионная хим. связь
ионная хим. связь
ионная хим. связь
ионная хим. связь
ионная хим. связь
ковалентная полярная
хим. связь
ковалентная малополярная хим. связь
5.
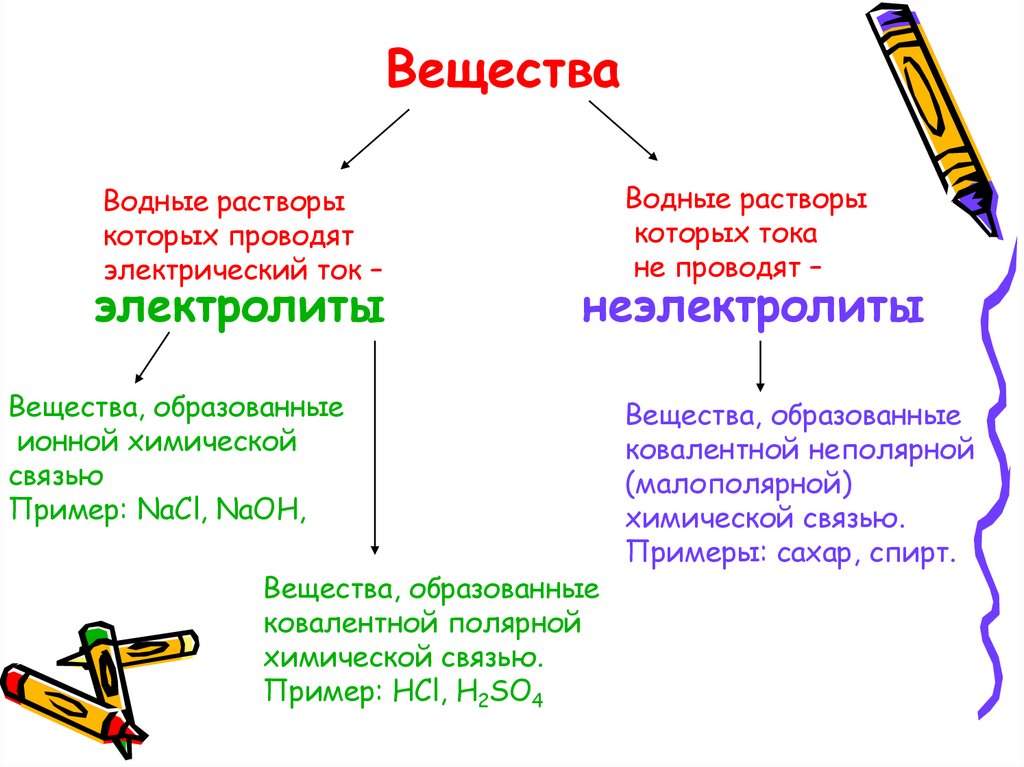
ВеществаВодные растворы
которых проводят
электрический ток –
электролиты
Водные растворы
которых тока
не проводят –
неэлектролиты
Вещества, образованные
ионной химической
связью
Пример: NaCl, NaOH,
Вещества, образованные
ковалентной полярной
химической связью.
Пример: HCl, H2SO4
Вещества, образованные
ковалентной неполярной
(малополярной)
химической связью.
Примеры: сахар, спирт.
6.
Почему же растворы электролитов проводятэлектрический ток ?
Причина электропроводности – ионы,
которые образуются при растворении
электролита в воде.
Каблуков
Кистяковский
Иван Алексеевич
Владимир Александрович
При растворении электролита происходит химическое взаимодействие
растворенного вещества с водой, которое приводит к образованию
гидратов, а затем они диссоциируют на ионы.
Процесс распада электролита
на ионы называется
электролитической диссоциацией
7.
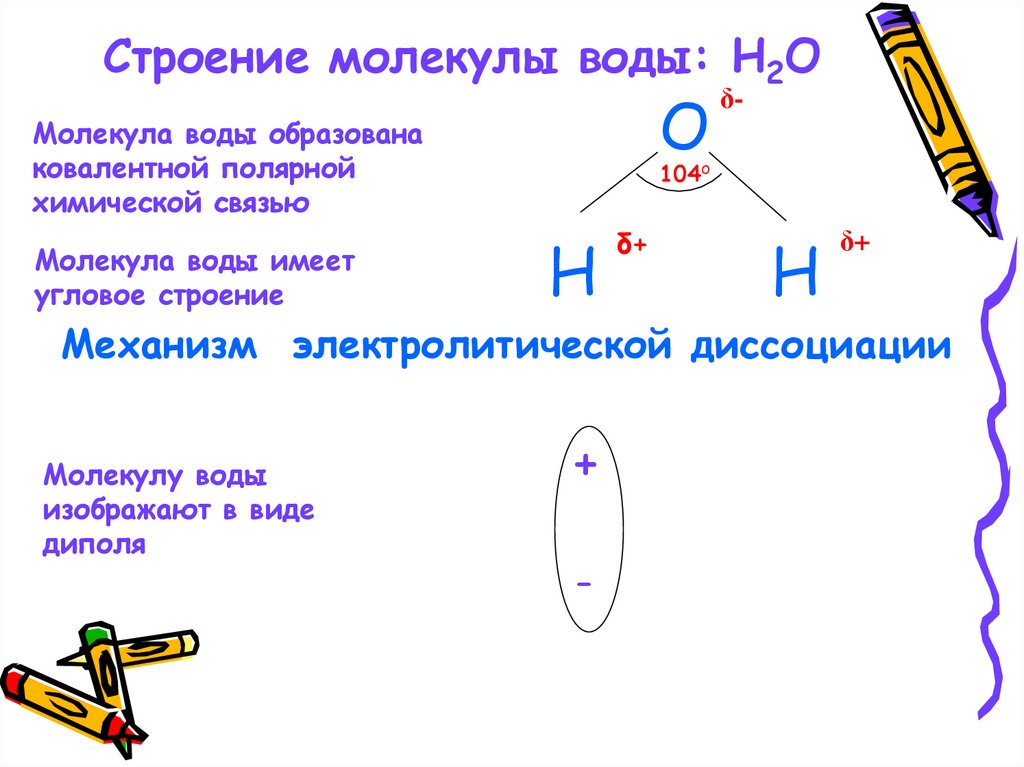
Строение молекулы воды: H2OO
Молекула воды образована
ковалентной полярной
химической связью
Молекула воды имеет
угловое строение
δ-
104o
H
δ+
H
δ+
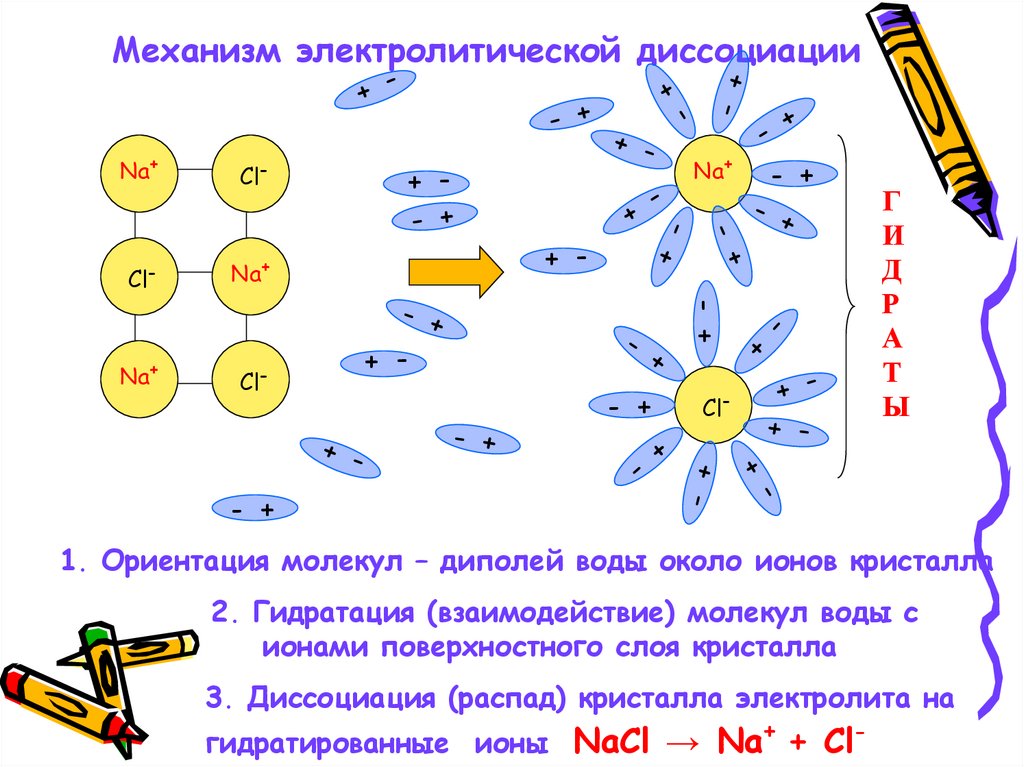
Механизм электролитической диссоциации
Молекулу воды
изображают в виде
диполя
+
-
8.
Механизм электролитической диссоциацииNa+
Na+
Cl-
- +
- +
Cl-
Na+
- +
Cl-
- +
Na+
- +
Cl-
Г
И
Д
Р
А
Т
Ы
- +
- +
1. Ориентация молекул – диполей воды около ионов кристалла
2. Гидратация (взаимодействие) молекул воды с
ионами поверхностного слоя кристалла
3. Диссоциация (распад) кристалла электролита на
гидратированные ионы NaCl → Na+ + Cl-
9.
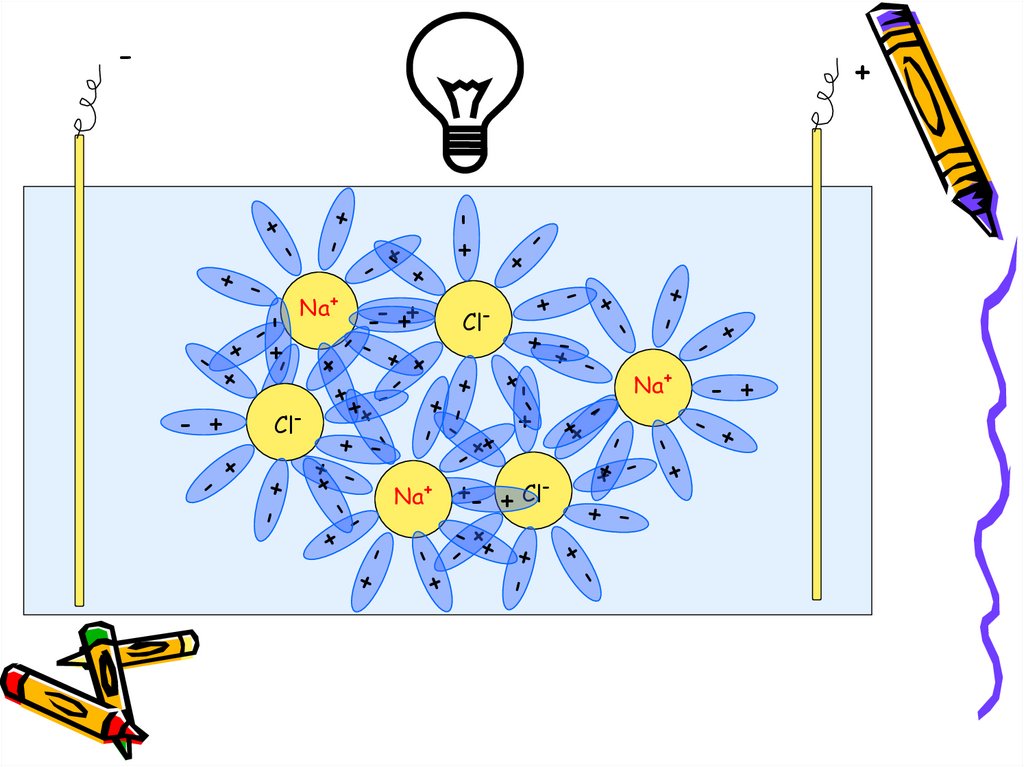
-+
- +
- +
-- ++
Cl-
- +
- +
Na+
ClNa+-
+- + Cl-
Na+
- +
10.
Домашнее задание• §35 (перессказ)
• вопросы 1,2,4,5
Спасибо за внимание




 chemistry
chemistry








