Similar presentations:
Недостаточность кровообращения
1. ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ «БАШКИРСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ
УНИВЕРСИТЕТ» МИНИСТЕРСТВАЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КАФЕДРА ПАТОФИЗИОЛОГИИ
НЕДОСТАТОЧНОСТЬ КРОВООБРАЩЕНИЯ
Профессор Байбурина Г.А.
УФА-2023
2.
По данным ВОЗ в экономически развитыхстранах сердечно-сосудистые заболевания
являются
• причиной смерти людей в 45-52% случаев
• 20% населения больны ИБС
• каждый 15 житель болен гипертонией
3.
Недостаточность кровообращения –состояние, при котором система
кровообращения не обеспечивает
органы и ткани кровью и кислородом
в соответствии с их метаболическими
потребностями.
4.
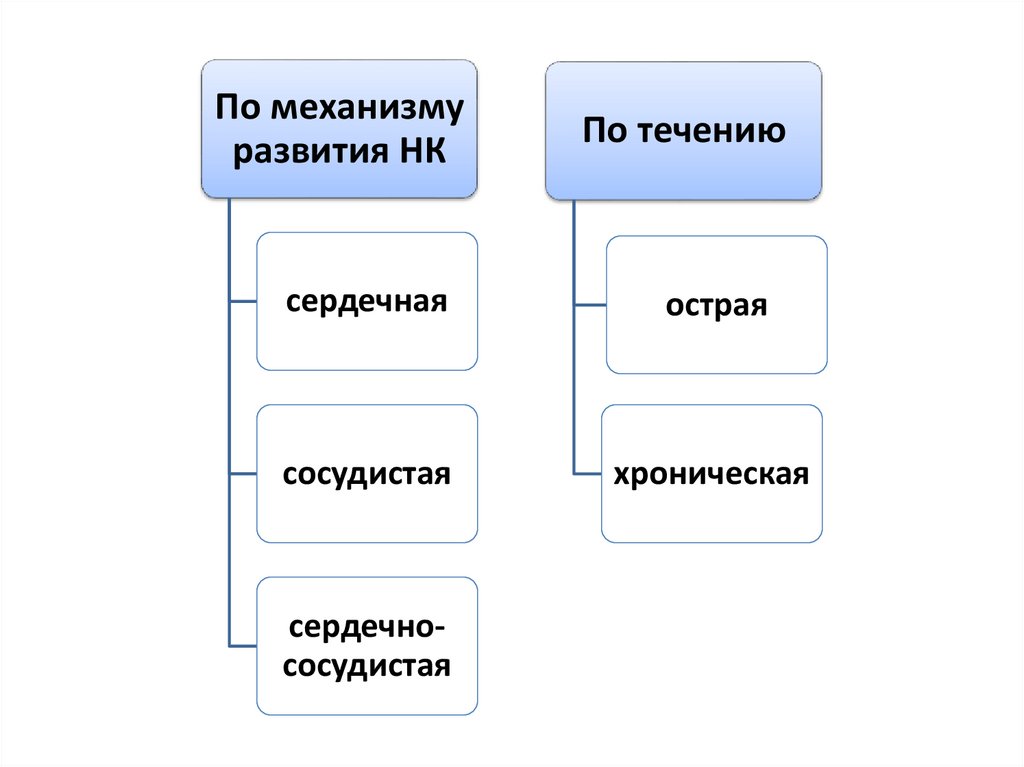
По механизмуразвития НК
По течению
сердечная
острая
сосудистая
хроническая
сердечнососудистая
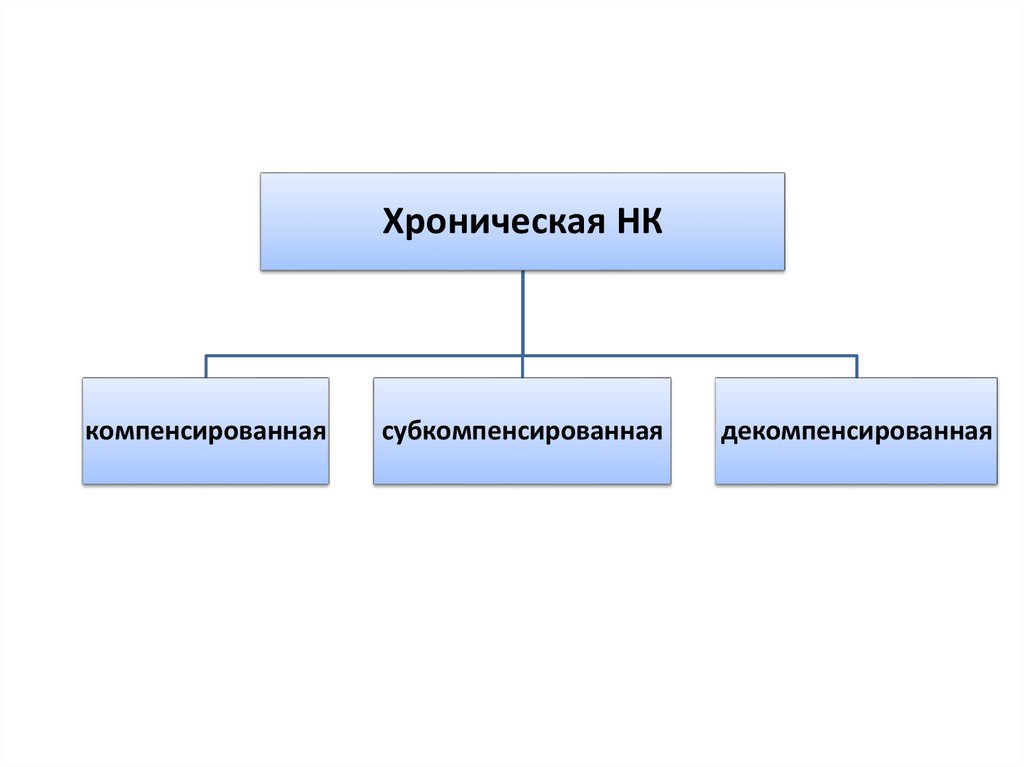
5.
Хроническая НКкомпенсированная
субкомпенсированная
декомпенсированная
6.
СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬэто состояние, характеризующееся
снижением резервных
возможностей сердца.
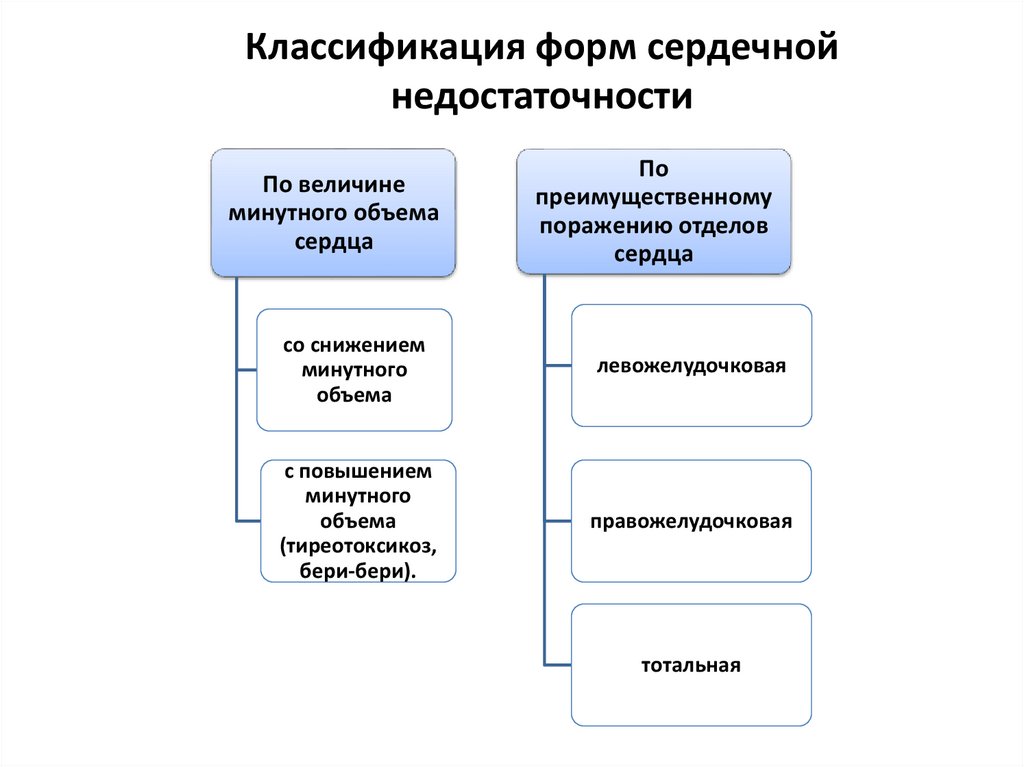
7. Классификация форм сердечной недостаточности
По величинеминутного объема
сердца
По
преимущественному
поражению отделов
сердца
со снижением
минутного
объема
левожелудочковая
с повышением
минутного
объема
(тиреотоксикоз,
бери-бери).
правожелудочковая
тотальная
8.
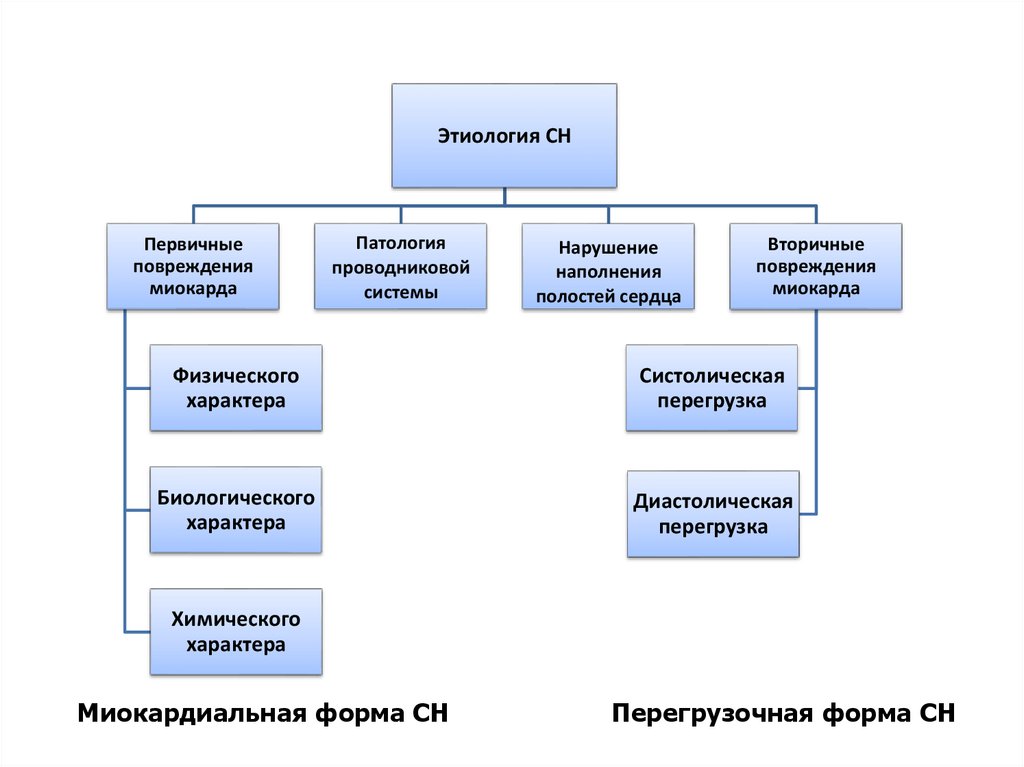
Этиология СНПервичные
повреждения
миокарда
Патология
проводниковой
системы
Нарушение
наполнения
полостей сердца
Вторичные
повреждения
миокарда
Физического
характера
Систолическая
перегрузка
Биологического
характера
Диастолическая
перегрузка
Химического
характера
Миокардиальная форма СН
Перегрузочная форма СН
9.
ПОКАЗАТЕЛИ ГЕМОДИНАМИКИ ПРИСЕРДЕЧНОЙ
НЕДОСТАТОЧНОСТИ
10.
1.Минутный объём сердца (МОС)МОС = УО х ЧСС
в покое составляет 5 литров в
минуту, при нагрузке – 20-30
литров в минуту.
11.
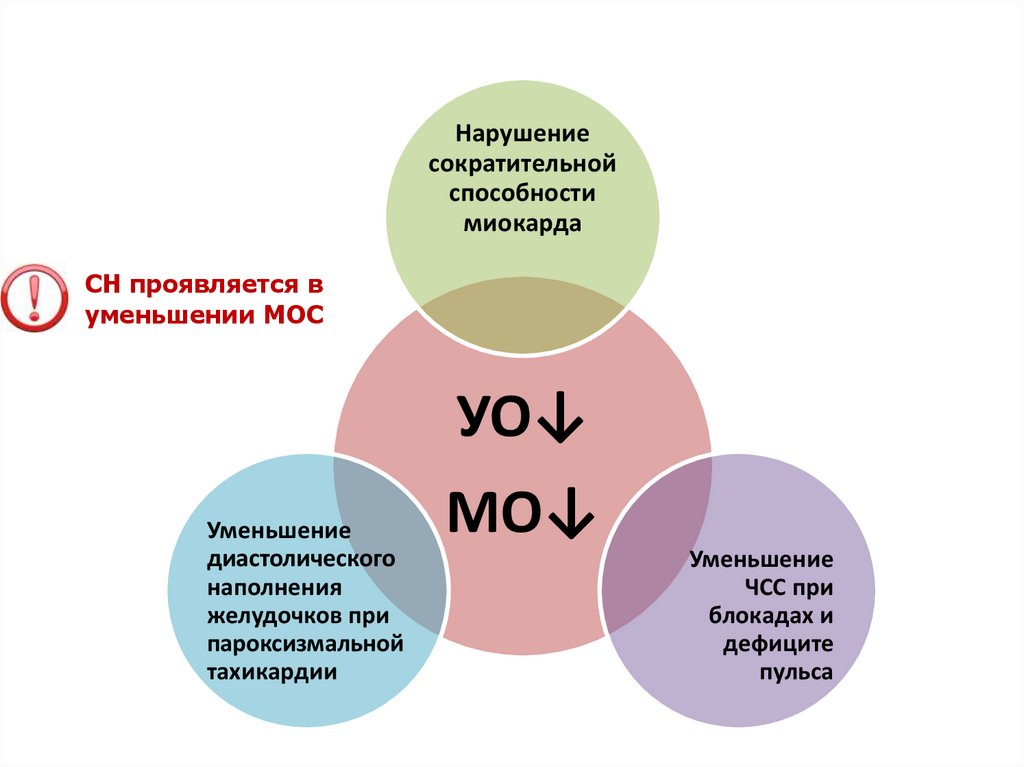
Нарушениесократительной
способности
миокарда
СН проявляется в
уменьшении МОС
УО↓
Уменьшение
диастолического
наполнения
желудочков при
пароксизмальной
тахикардии
МО↓
Уменьшение
ЧСС при
блокадах и
дефиците
пульса
12.
Поддержание МОС при нарушенияхсократительной способности
миокарда и понижении ударного
объёма может быть за счет
увеличения ЧСС.
Таким образом, тахикардия – это
механизм компенсации.
13.
2. ОбъемыКонечный диастолический объем (КДО), в норме
составляет в среднем 65-130 мл – максимальный
V крови в полости желдочка перед систолой
• Ударный объем ≈60-70 мл.
• Конечный систолический объем (КСО) – остается
после систолы, т.н. «резервный» объем – 40-60 мл
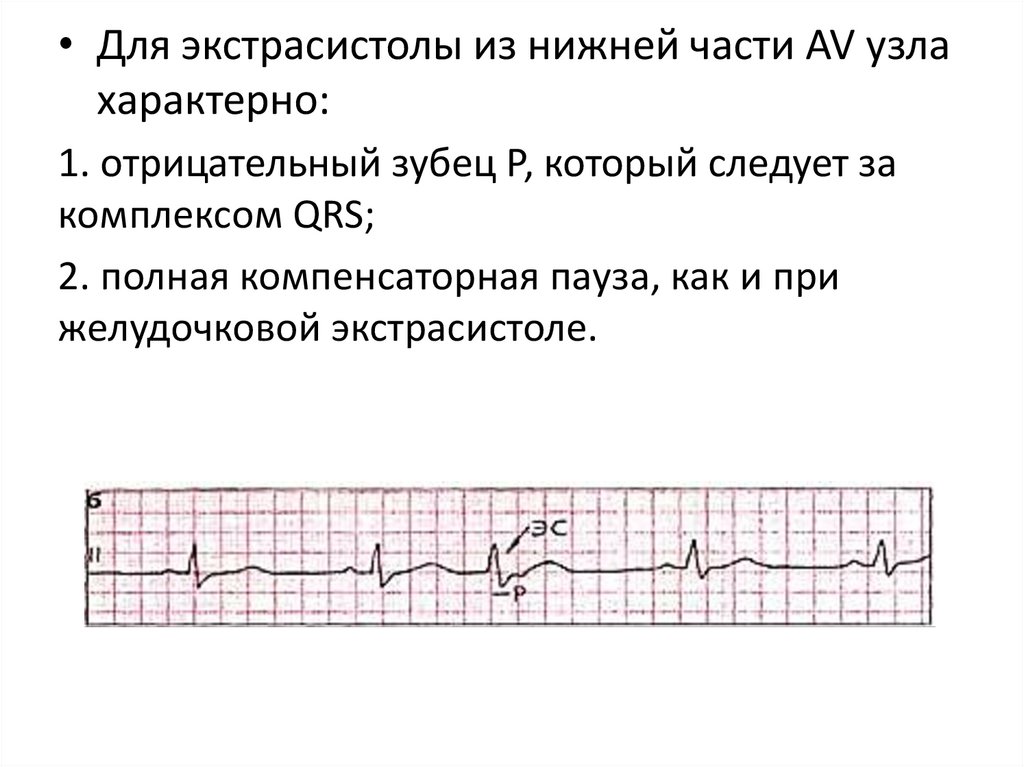
• Фракция выброса крови
ФВ= УО/КДО х100%
В покое составляет 50-75%, при нагрузке ↑ до 85%
ФВ < 50% свидетельствует о существенных
нарушениях сократительной способности
14.
3. Сердечный индексСИ=МОС/S поверхности тела
Норма - 2,6 до 4,2 л/мин∙м2
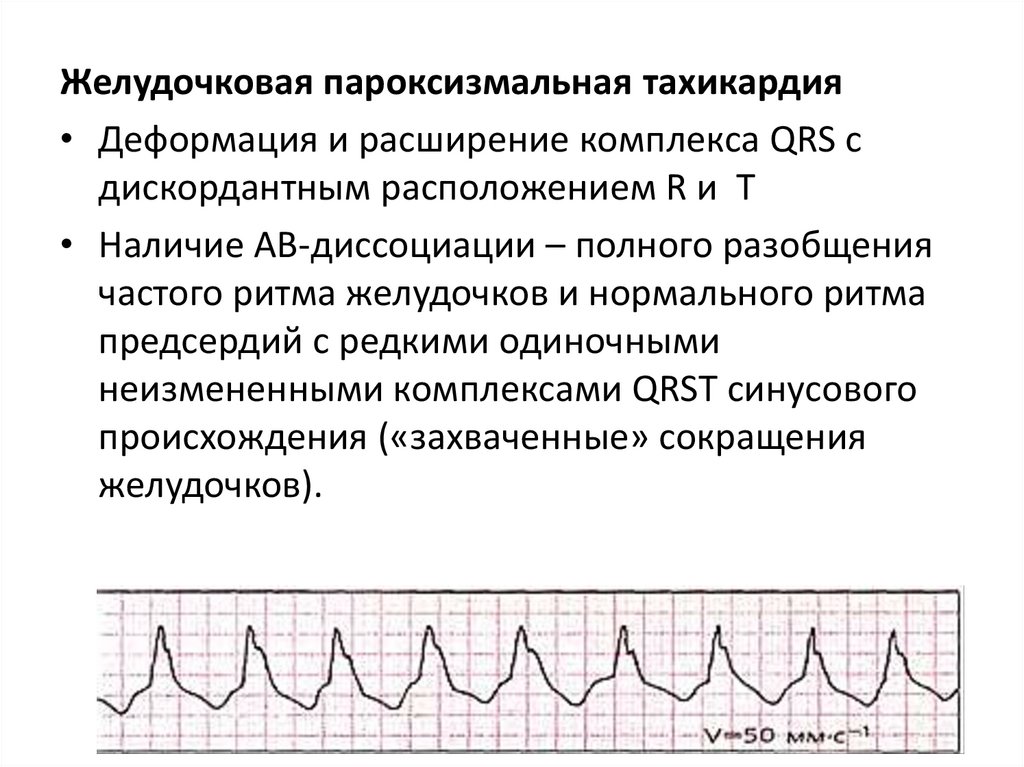
СИ повышается при: гипоксии тканей миокарда;
повышении содержания СО2 в крови; гиперволемии;
тахикардии; повышении температуры тела; ускорении
метаболизма; стрессовом состоянии; в начальной
стадии шока.
СИ снижается при: шоковом состоянии 3-й и более
стадии; тахикардии свыше 150 ударов за минуту;
глубоком наркозе; снижении температуры тела;
большой острой кровопотере; гиповолемии.
15.
4. Артериальное давлениеПри сосудистой недостаточности
кровообращения артериальное
давление снижено значительно, при
сердечной снижено умеренно,
преимущественно систолическое как
результат ослабления сократительной
способности сердечной мышцы.
16.
5. Венозное давлениеВ норме составляет 5-9 мм рт.ст. При
нарушении насосной функции сердца и
развитии сердечной недостаточности
происходит повышение венозного
давления вследствие застоя крови в
венозной системе.
• При сосудистой недостаточности
венозное давление обычно понижено.
17.
6. Скорость кровотока.• Движущей силой кровотока является
артерио-венозная разность давлений. При
СН скорость кровотока резко снижается.
• Время кровотока, напрямую зависящее от
его скорости, увеличивается.
18.
• В результате замедления кровотокаувеличивается артерио-венозная
разность по кислороду.
• Именно это определяет развитие
гипоксии в тканях при ССН.
19.
• Содержание СО2 в венозной кровипри СН увеличивается, что в
сочетании с повышением
венозного давления и
расширением сосудов создает
картину цианоза – одного из
обязательных клинических
проявлений сердечной
недостаточности.
20.
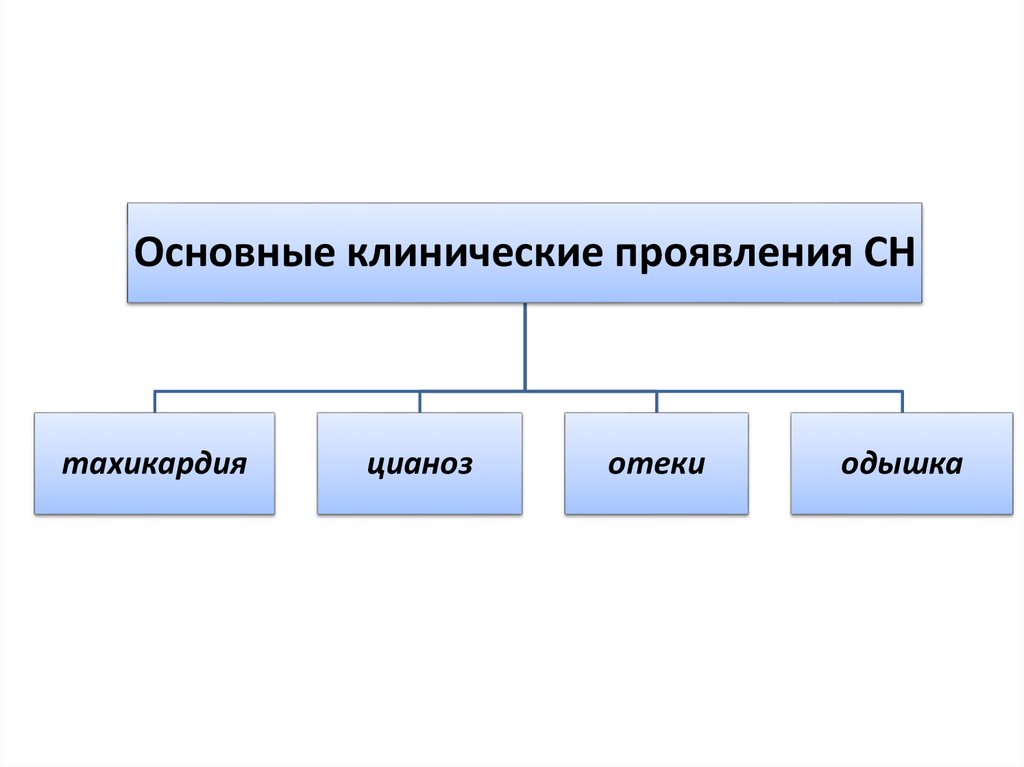
Основные клинические проявления СНтахикардия
цианоз
отеки
одышка
21.
ПЕРЕГРУЗОЧНАЯ ФОРМА СЕРДЕЧНОЙНЕДОСТАТОЧНОСТИ
22.
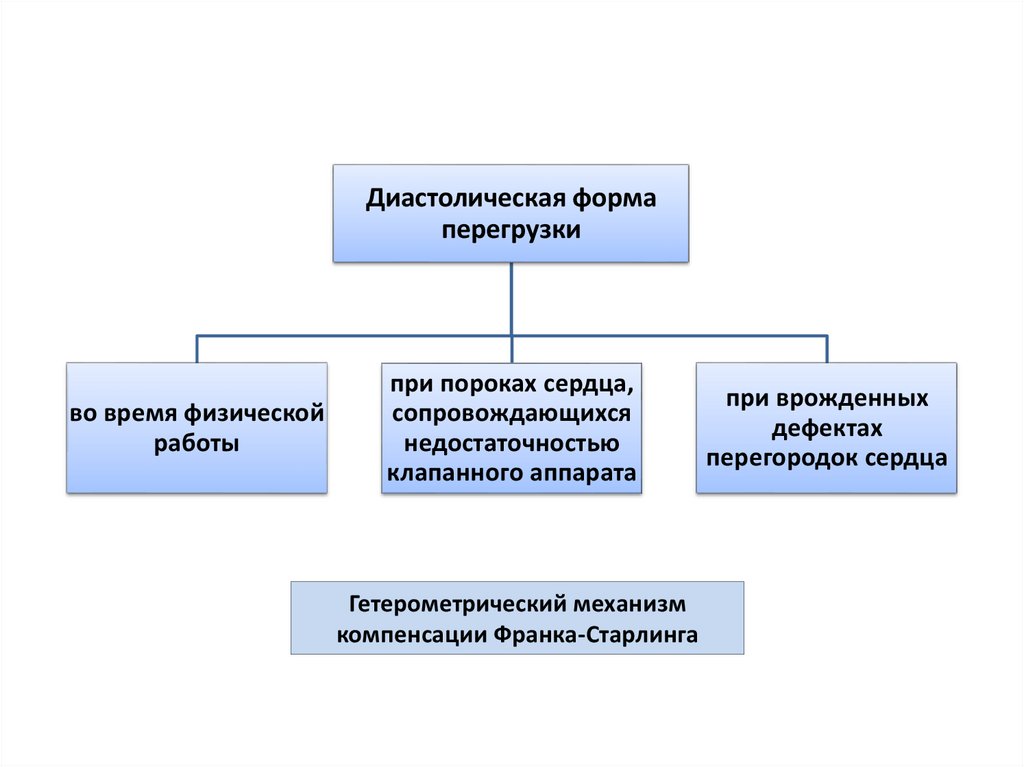
Диастолическая формаперегрузки
во время физической
работы
при пороках сердца,
сопровождающихся
недостаточностью
клапанного аппарата
Гетерометрический механизм
компенсации Франка-Старлинга
при врожденных
дефектах
перегородок сердца
23. Гетерометрический механизм компенсации (Франка-Старлинга)
• Во время диастолы увеличивается кровенаполнение полостей(или одной полости) сердца, сопровождающееся увеличением
растяжения мышечных волокон. Следствием этого является
более сильное сокращение сердца во время диастолы.
• До определенной нагрузки между количеством притекающей
крови и силой сокращения имеется линейная зависимость. Если
степень растяжения мышечного волокна превышает
допустимые границы (для полости левого желудочка на 100%),
то сила сокращения падает.
• При перегрузках линейные размеры сердца увеличиваются,
происходит расширение полостей сердца, сопровождающееся
увеличением ударного объема. Это называется тоногенной
дилатацией.
24.
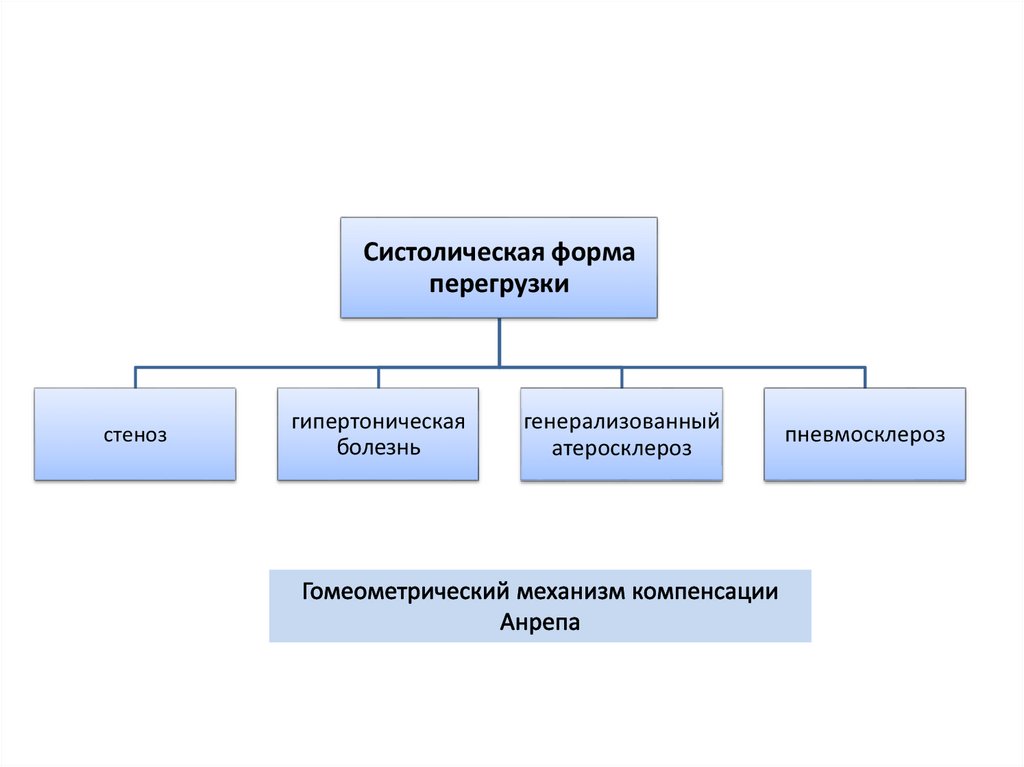
Систолическая формаперегрузки
стеноз
гипертоническая
болезнь
генерализованный
атеросклероз
пневмосклероз
25. Гомеометрический механизм компенсации (Анрепа)
• В этом случае длина мышечного волокна увеличивается не так резко,но повышаются давление и напряжение, возникшие при сокращении
мышцы в конце диастолы.
• Повышение силы сердечных сокращений происходит не сразу, а
увеличивается постепенно с каждым последующим сокращением
сердца.
• Для преодоления повышенного сопротивления оттоку необходимо
значительное повышение систолического давления за счет
повышения величины и скорости развития напряжения мышечного
волокна, сопровождающееся большим расходом АТФ.
• Поэтому, гомеометрический механизм компенсации является менее
выгодным для организма, чем гетерометрический.
26.
• При длительной нагрузке в миокардеразвиваются специфические обменные и
структурные изменения, приводящие к
увеличению массы и работоспособности сердца –
развивается гипертрофия миокарда. Это
позволяет сердцу длительное время
преодолевать повышенную нагрузку, а с другой
стороны – создаются условия для возникновения
патологических изменений.
• Гипертрофия – увеличение массы сердца,
обусловленное увеличением объема каждого
кардиомиоцита, но не их числа.
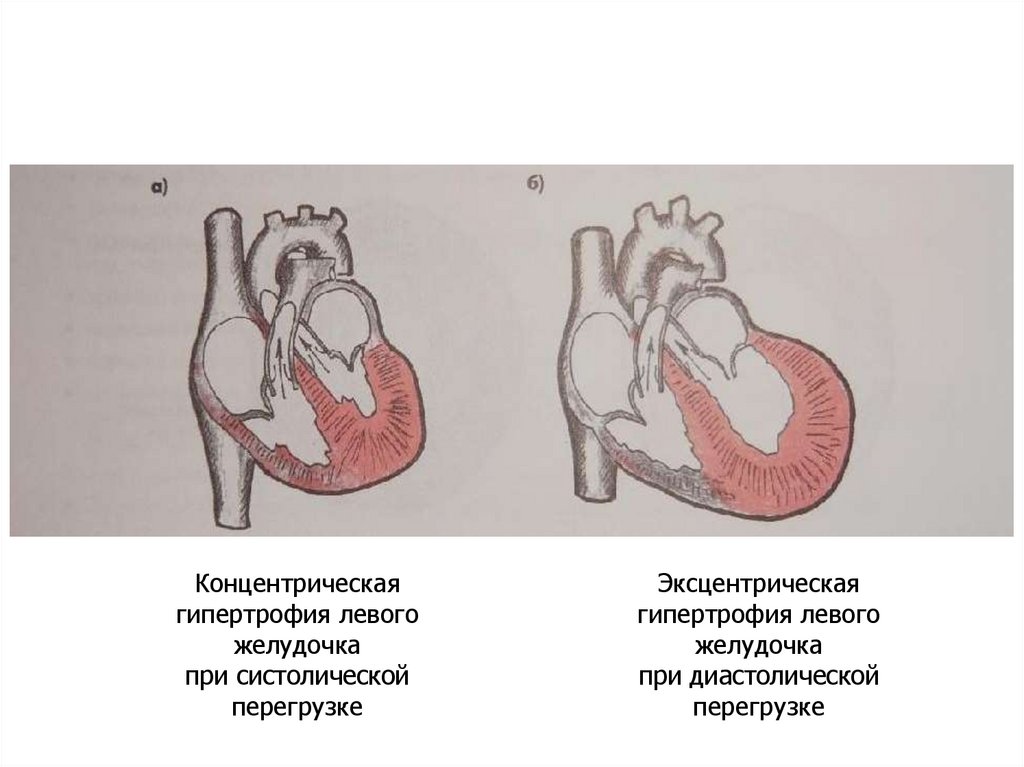
27.
Концентрическаягипертрофия левого
желудочка
при систолической
перегрузке
Эксцентрическая
гипертрофия левого
желудочка
при диастолической
перегрузке
28. 1 стадия гипертрофии миокарда - аварийная
1 стадия гипертрофии миокарда аварийная• Представляет собой компенсаторную гиперфункцию еще не
гипертрофированного сердца, при которой механическая
работа, приходящаяся на единицу массы миокарда,
увеличивается.
• Это закономерно влечет за собой одновременную
активацию энергообразования, синтеза нуклеиновых кислот
и белка.
• Вначале увеличивается масса энергообразующих структур
(митохондрий), а затем - масса функционирующих структур
(миофибрилл).
• Метаболические изменения - исчезновение гликогена в
миокарде, снижение уровня креатинфосфата, уменьшение
содержания внутриклеточного калия и повышение
содержания натрия, мобилизация гликогена, накопление
лактата.
29. Вторая стадия - завершившейся гипертрофии
• Эта стадия совпадает с длительным периодом клинической компенсации.• Характеризуется нормальной интенсивностью функционирования
структур миокарда и соответственно нормальным уровнем
энергообразования и синтеза нуклеиновых кислот и белков в мышце
сердца.
• Потребление кислорода на единицу массы миокарда остается в границах
нормы, а потребление кислорода сердечной мышцей в целом
увеличено пропорционально возрастанию массы сердца. Содержание
АТФ и гликогена в кардиомиоцитах также соответствует норме.
• Увеличение массы миокарда происходит за счет активации синтеза
нуклеиновых кислот и белков.
• Эта гиперфункция относительно устойчива, тем не менее исподволь
развиваются нарушения обмена и структуры миокарда.
• Наиболее ранние признаки таких нарушений: значительное увеличение
концентрации лактата в миокарде и умеренно выраженный
кардиосклероз
30. Третья стадия - прогрессирующего кардиосклероза и декомпенсации
• В результате нарушения синтеза РНК, ДНК и белка вкардиомиоцитах наблюдается относительное уменьшение
массы митохондрий, что ведет к торможению синтеза АТФ
на единицу массы ткани, снижению насосной функции
сердца и прогрессированию хронической сердечной
недостаточности.
• Развиваются дистрофические и склеротические процессы,
что способствует появлению признаков декомпенсации и
тотальной сердечной недостаточности, завершающейся
гибелью пациента.
• Компенсаторная гиперфункция, гипертрофия и
последующая декомпенсация сердца - это звенья единого
процесса.
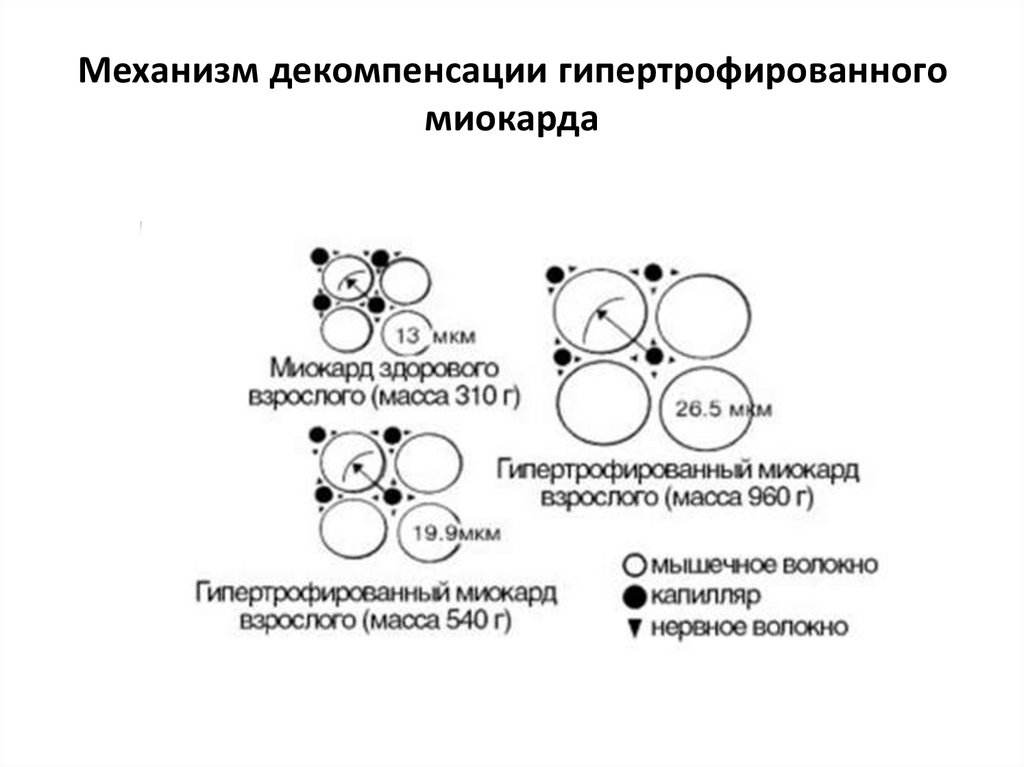
31. Механизм декомпенсации гипертрофированного миокарда
1. Если процесс гипертрофии несопровождается адекватным
ростом капиллярной сети, то
она становится
несбалансированной,
кровоснабжение сердечной
мышцы оказывается
недостаточным для
выполнения механической
работы.
2.
Вследствие увеличения
объема
гипертрофированных
мышечных волокон
уменьшается удельная
поверхность клеток, т.е.
создаются условия для
нарушения поступления в
клетки питательных веществ
и выделения из
кардиомиоцитов продуктов
метаболизма.
32. Механизм декомпенсации гипертрофированного миокарда
33. Механизм декомпенсации гипертрофированного миокарда
3. Нарушается соотношение между объемами внутриклеточныхструктур. Увеличение массы митохондрий и
саркоплазматического ретикулума (СПР) отстает от увеличения
размеров миофибрилл, что способствует ухудшению
энергоснабжения кардиомиоцитов и сопровождается
нарушением аккумуляции Са2+ в СПР. Возникает Са2+-перегрузка
кардиомиоцитов, что обеспечивает формирование контрактуры
сердца и способствует уменьшению ударного объема. Са2+перегрузка клеток миокарда повышает вероятность
возникновения аритмий.
4. Проводящая система сердца и вегетативные нервные волокна,
иннервирующие миокард, не подвергаются гипертрофии, что
также способствует возникновению дисфункции
гипертрофированного сердца.
34. Механизм декомпенсации гипертрофированного миокарда
5. Активируется апоптоз отдельных кардиомиоцитов, чтоспособствует постепенному замещению мышечных волокон
соединительной тканью (кардиосклероз). Кардиосклероз
сдавливает мышечные волокна, нарушая в них еще больше
обменные процессы.
6. Дистрофические изменения, сопровождающиеся расширением
полостей сердца, снижением его сократимости вызывают
возникновение миогенной дилатации. Она характеризуется
увеличением остающейся крови в полостях сердца во время
систолы и переполнением вен.
7. Эти нарушения вызывают тахикардию (прямое действие на
синусный узел и рефлекс Бейнбриджа), которая еще больше
усугубляет нарушение обмена веществ в миокарде.
Миогенная дилатация и тахикардия- грозные симптомы
начинающейся декомпенсации
35.
Тахикардия - энергетически невыгодныймеханизм компенсации.
1. Повышение потребности миокарда в кислороде.
2. Укорочение диастолы - уменьшение периода
отдыха миокарда.
3. Укорочение диастолы - желудочек не успевает
заполниться кровью.
4. Неполное заполнение кровью желудочков делает
невозможным реализацию гетерометрического
механизма компенсации.
5. Менее полноценная систола.
36. Миокардиальная форма сердечной недостаточности
МИОКАРДИАЛЬНАЯ ФОРМАСЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
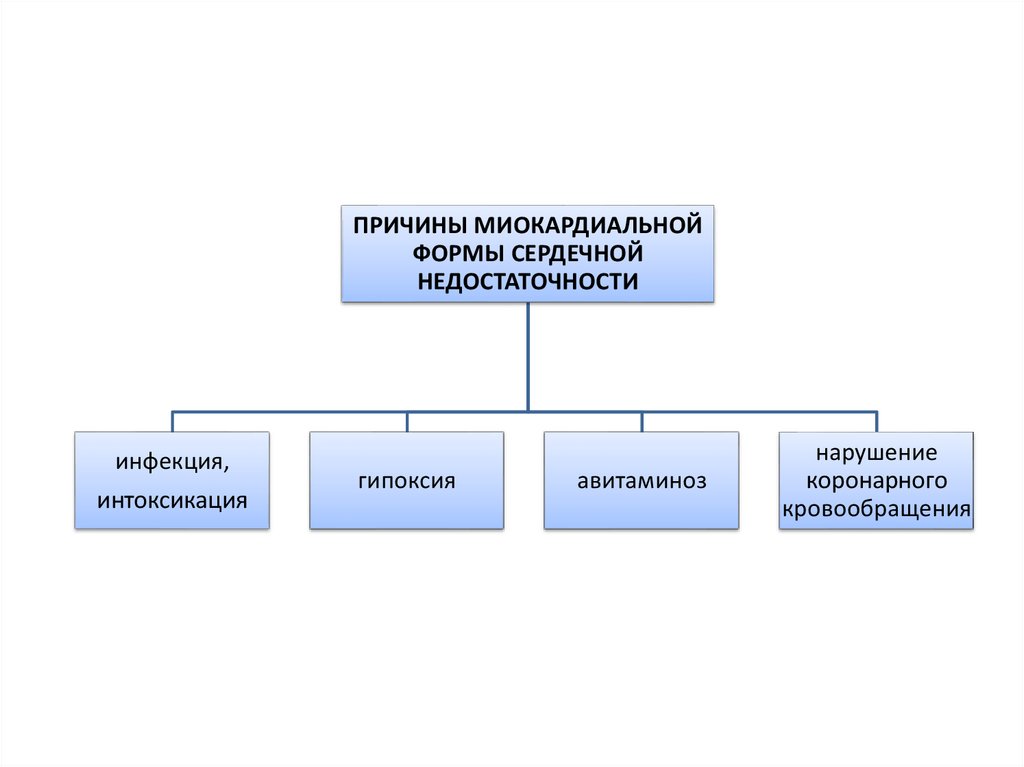
37.
ПРИЧИНЫ МИОКАРДИАЛЬНОЙФОРМЫ СЕРДЕЧНОЙ
НЕДОСТАТОЧНОСТИ
инфекция,
интоксикация
гипоксия
авитаминоз
нарушение
коронарного
кровообращения
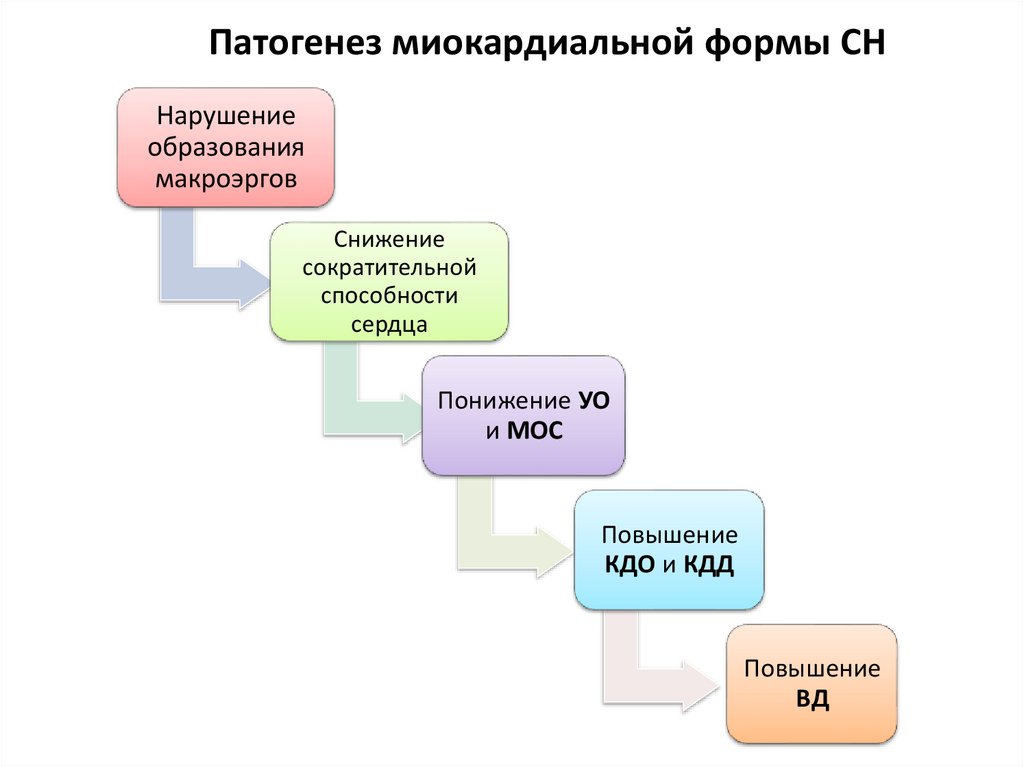
38. Патогенез миокардиальной формы СН
Нарушениеобразования
макроэргов
Снижение
сократительной
способности
сердца
Понижение УО
и МОС
Повышение
КДО и КДД
Повышение
ВД
39.
• Таким образом, всякая СН ведет кпонижению МОС и повышению ВД.
• Это два главных признака и
последствия сердечной
недостаточности.
40. Внесердечные механизмы компенсации
ВНЕСЕРДЕЧНЫЕ МЕХАНИЗМЫКОМПЕНСАЦИИ
41. Внесердечные механизмы компенсации
• Снижение МОС• Снижение давления крови в аорте
• Раздражение барорецепторов дуги аорты
• Повышение импульсации с барорецепторов
• Повышение тонуса симпатических нервов
• Клинические проявления: тахикардия, цианоз, отеки, одышка
42. Эффекты катехоламинов
Тахикардия• Участие катехоламинов в осуществлении срочной
адаптации сердца к повышенным нагрузкам
связано со способностью адреналина и
норадреналина непосредственно увеличивать
силу сердечных сокращений – с положительным
инотропным эффектом
43.
Тахикардия• Под влиянием катехоламинов увеличивается количество
Са-каналов сарколеммы, способных открываться во время
потенциала действия (катехоламины через цАМФопосредованный механизм вызывают фосфорилирование
белков Са-каналов).
• В результате увеличивается поступление ионов кальция
в саркоплазму, где повышается их концентрация, и, как
следствие, увеличивается сила сокращений
кардиомиоцитов, поскольку возрастает количество
образующихся кальций-тропониновых комплексов.
• Именно инотропное действие катехоламинов (а не
закон Франка-Старлинга) является ведущим
механизмом адаптации сердца к физическим
нагрузкам.
44.
Тахикардия• В патогенезе тахикардии участвует и другой
механизм: под влиянием симпатических
импульсов происходит сокращение вен, которые
в норме содержат до 50% всей циркулирующей
крови. Это приводит к повышению венозного
давления, увеличению венозного возврата. По
закону Старлинга возрастает сила сердечных
сокращений, а р. Бейнбриджа (с устьев полых
вен) проявляется в увеличении частоты сердечных
сокращений
45. Эффекты катехоламинов
Стимуляция симпатических влияний проявляется и вповышении тонуса артериол периферических
органов:
•возбуждение α-адренорецепторов проявляется
спазмом периферических сосудов (печени, ЖКТ,
почек, отчасти скелетной мускулатуры). Исключение
составляют сосуды сердца и головного мозга, так
как в них мало α-адренорецепторов.
•При этом происходит перераспределение крови в
пользу этих жизненно-важных органов –
централизация кровообращения.
46. Эффекты катехоламинов
• Под влиянием симпатических импульсов происходиттакже изменение функций желез внутренней секреции.
Это проявляется в увеличении секреции адреналина и
усилении влияния симпатической н.с. на αадренорецепторы, а также
• Под влиянием симпатических импульсов включается
ренин-ангиотензин-альдостероновая
система.
Известно, что ангиотензин, как и катехоламины, обладает
констрикторным воздействием на периферические
сосуды. Кроме того, активируется корковое вещество
надпочечников, продуцирующих альдостерон. Он
способствует задержке натрия, далее воды в сосудистом
русле. Это увеличивает венозный возврат и, как уже было
сказано, стимулирует работу сердца.
47. Эффекты катехоламинов
• При возбуждении симпатической н.с. происходитпоступление АДГ в кровь. Он воздействует на
эпителий петли Генле и собирающих трубочек,
делая их более проницаемыми для воды,
усиливая ее реабсорбцию.
• В результате этого также возрастает ОЦК,
венозный
возврат,
повышается
УО,
т.е.
происходит компенсация СН.
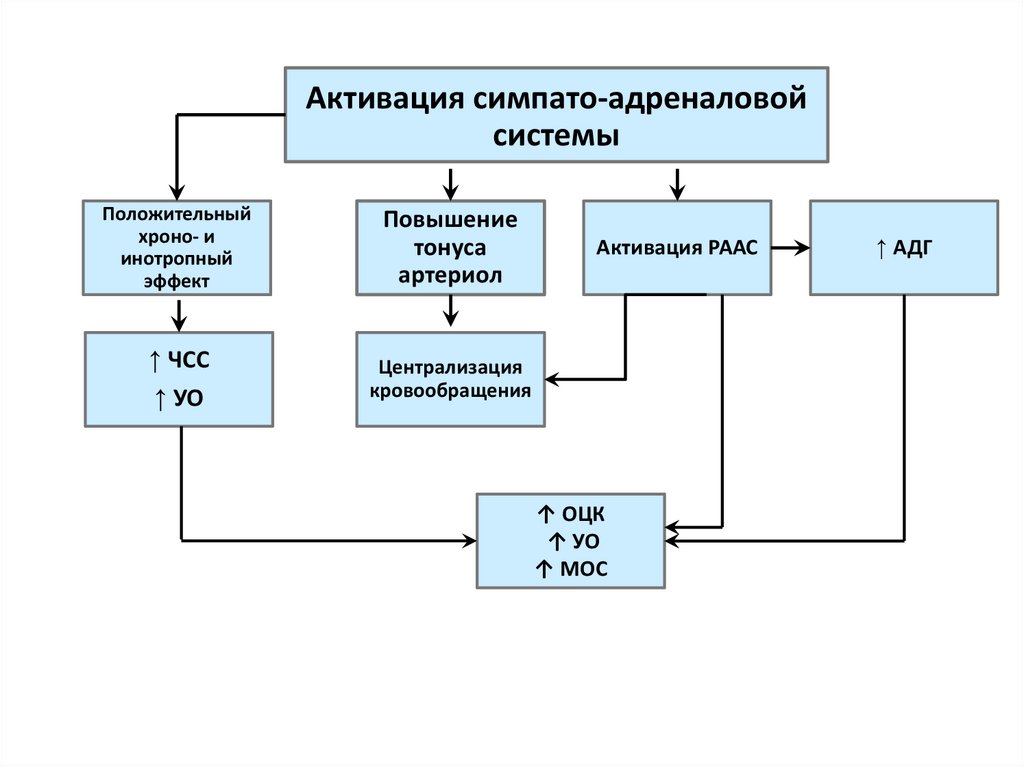
48.
Активация симпато-адреналовойсистемы
Положительный
хроно- и
инотропный
эффект
Повышение
тонуса
артериол
↑ ЧСС
↑ УО
Централизация
кровообращения
Активация РААС
↑ ОЦК
↑ УО
↑ МОС
↑ АДГ
49.
• В филогенезе все эти механизмы сформировалиськак компенсаторная реакция на кровопотерю,
поэтому здоровый организм может выдержать
25-30% (от ОЦК) кровопотерю. При выключении
симпатической н.с. фармакологическими
средствами смертельной оказывается потеря
10-15% крови.
• Но включение всей этой системы компенсации в
условиях поврежденного сердца приводит к
замыканию порочных кругов и формированию
клинических проявлений СН: тахикардии,
одышки, отеков и цианоза.
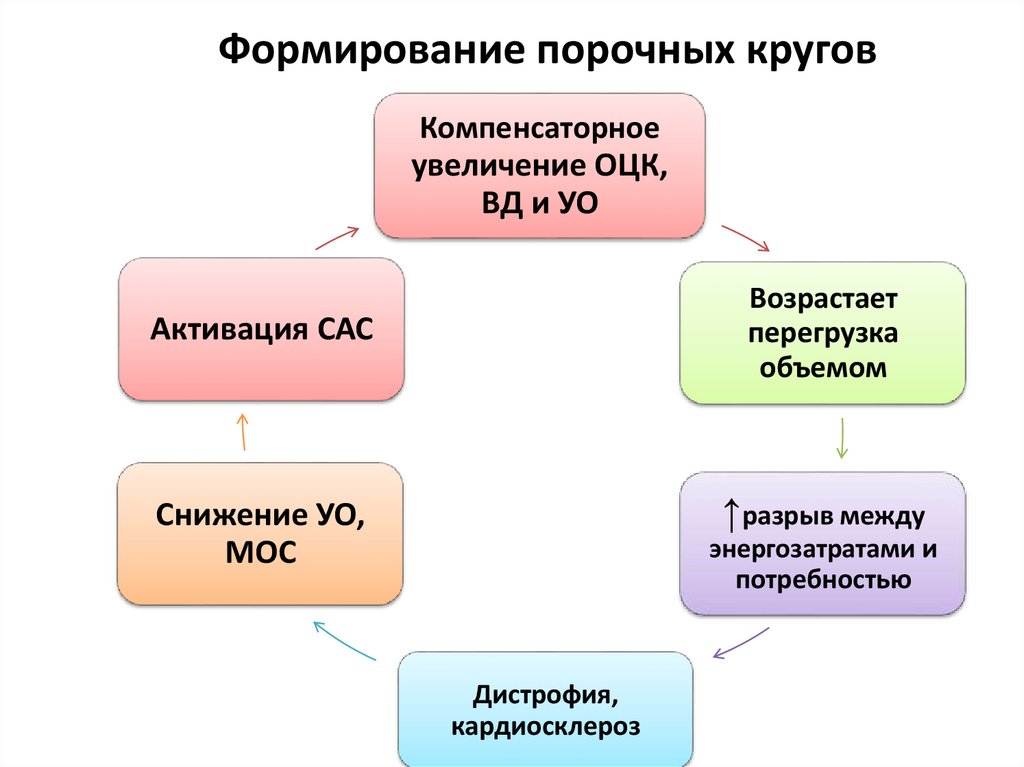
50. Порочные круги
Поскольку компенсаторные механизмы при СН направленына увеличение ОЦК, ВД и УО, то в результате их включения
еще более возрастает перегрузка объемом поврежденного
сердца. Увеличивается разрыв между его энергозатратами и
потребностью в них, нарастает дистрофия, усугубляется
декомпенсация.
51. Формирование порочных кругов
Компенсаторноеувеличение ОЦК,
ВД и УО
Возрастает
перегрузка
объемом
Активация САС
↑разрыв между
Снижение УО,
МОС
энергозатратами и
потребностью
Дистрофия,
кардиосклероз
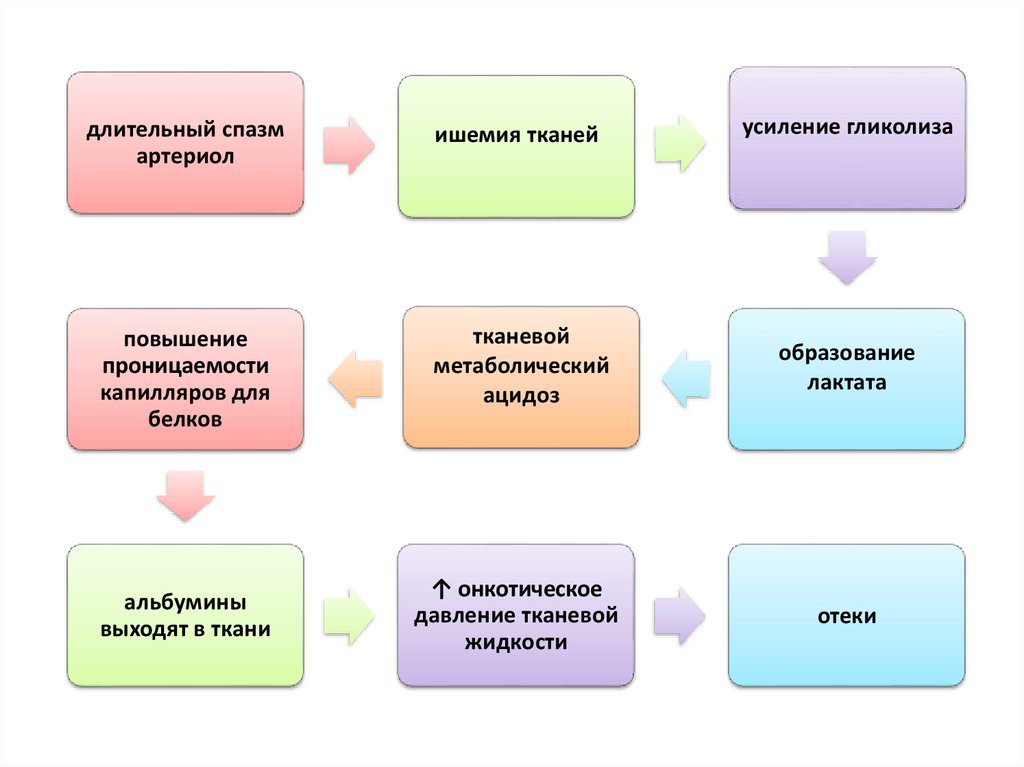
52. Порочные круги
• Длительный спазм артериол вызывает ишемию тканей, азначит усиление гликолиза с образованием лактата и
развитием тканевого метаболического ацидоза. Это
повышает проницаемость капилляров для белков
(альбуминов), которые выходят в ткань, повышая
онкотическое давление тканевой жидкости. Таким
образом, несмотря на все усилия организма,
направленные на поддержание ОЦК, жидкость в
сосудистом русле не задерживается, возникают отеки.
53.
длительный спазмартериол
ишемия тканей
усиление гликолиза
повышение
проницаемости
капилляров для
белков
тканевой
метаболический
ацидоз
образование
лактата
↑ онкотическое
давление тканевой
жидкости
отеки
альбумины
выходят в ткани
54.
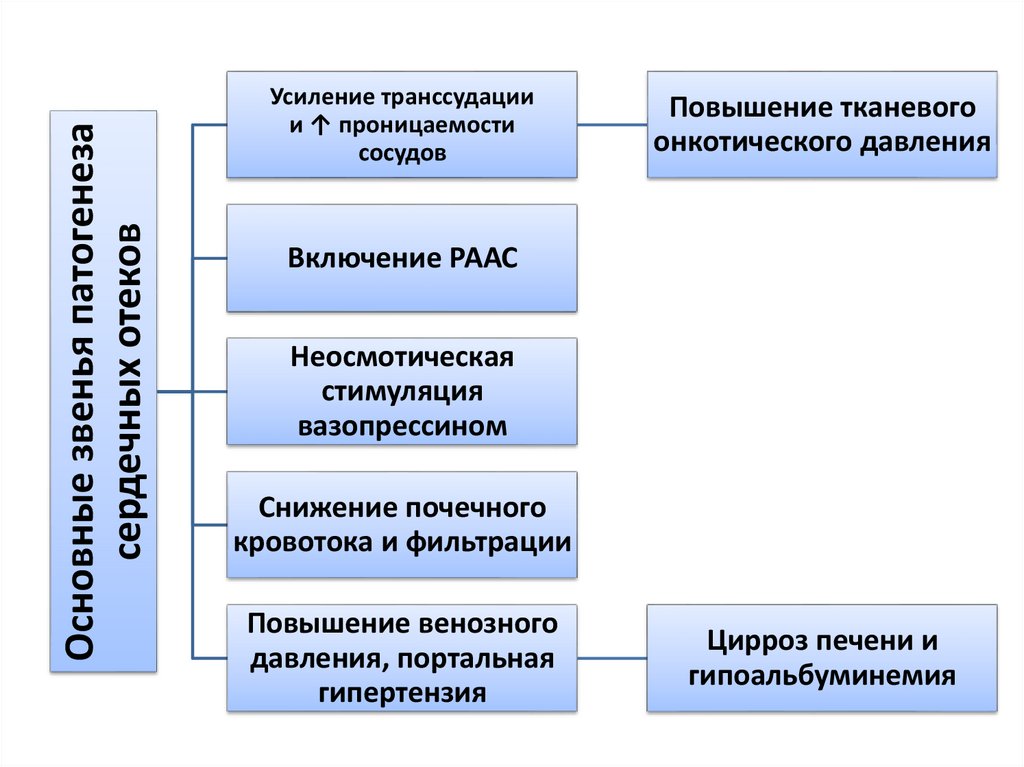
Основные звенья патогенезасердечных отеков
Усиление транссудации
и ↑ проницаемости
сосудов
Повышение тканевого
онкотического давления
Включение РААС
Неосмотическая
стимуляция
вазопрессином
Снижение почечного
кровотока и фильтрации
Повышение венозного
давления, портальная
гипертензия
Цирроз печени и
гипоальбуминемия
55.
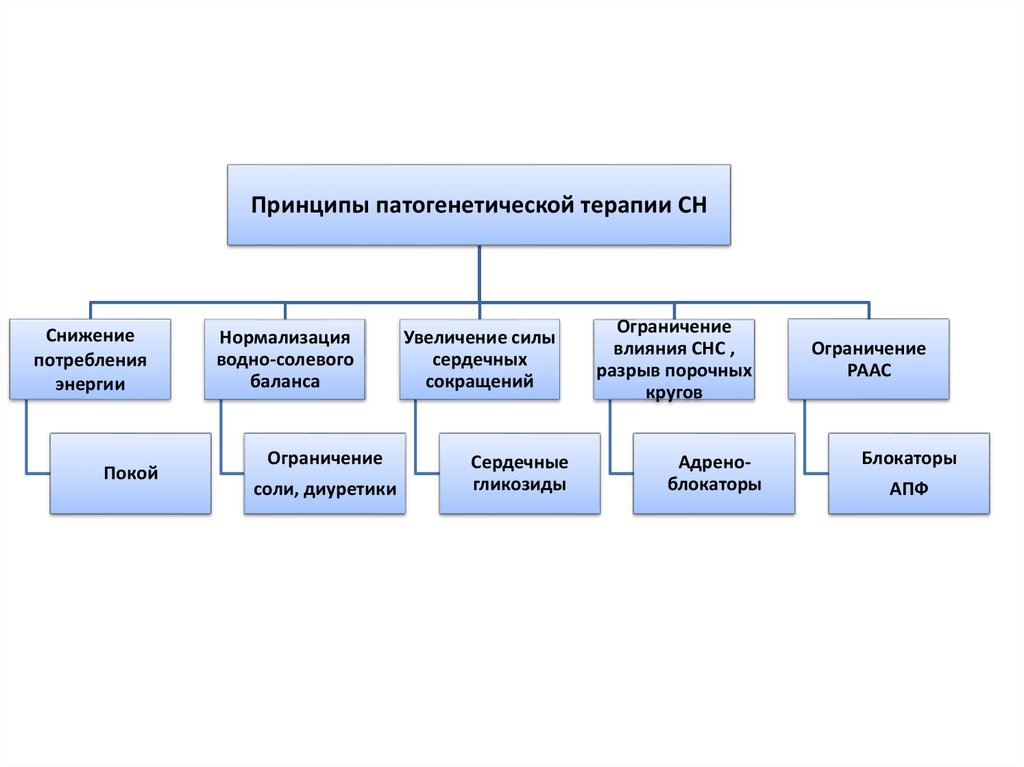
Принципы патогенетической терапии СНСнижение
потребления
энергии
Покой
Нормализация
водно-солевого
баланса
Ограничение
соли, диуретики
Увеличение силы
сердечных
сокращений
Ограничение
влияния СНС ,
разрыв порочных
кругов
Сердечные
гликозиды
Адреноблокаторы
Ограничение
РААС
Блокаторы
АПФ
56.
• Коронарная недостаточность – типоваяформа патологии сердца,
характеризующаяся превышением
потребности миокарда в кислороде и
субстратах метаболизма над их
притоком по коронарным артериям, а
также нарушением оттока от миокарда
промежуточных метаболитов, БАВ и
других агентов.
57.
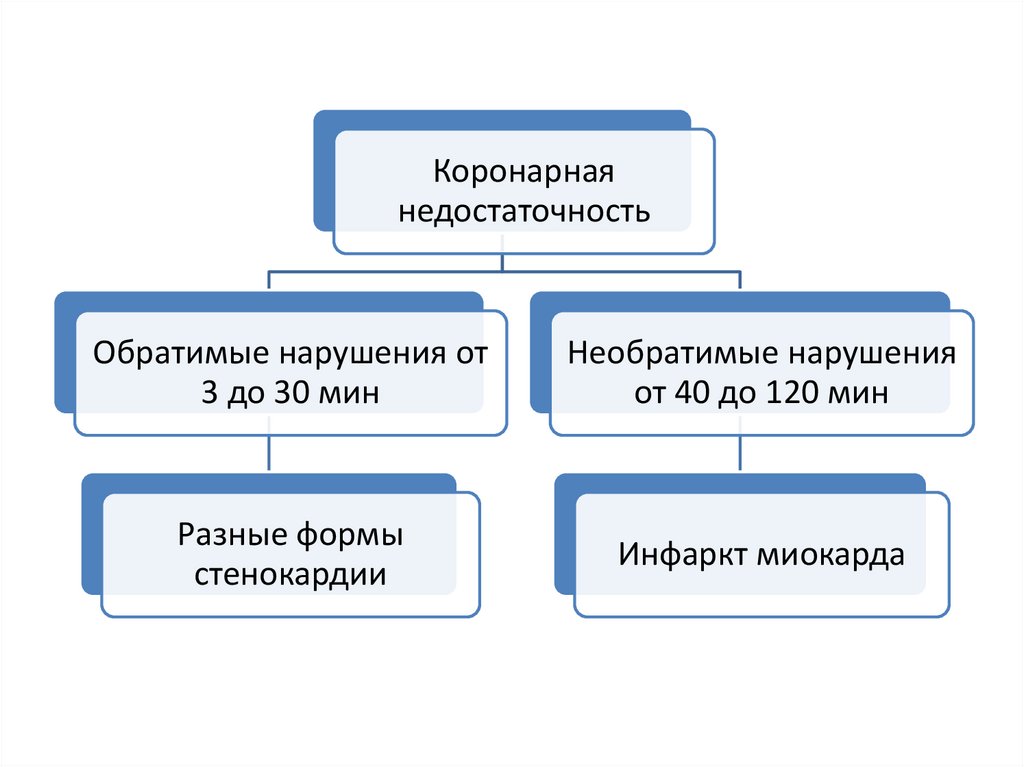
Коронарнаянедостаточность
Обратимые нарушения от
3 до 30 мин
Необратимые нарушения
от 40 до 120 мин
Разные формы
стенокардии
Инфаркт миокарда
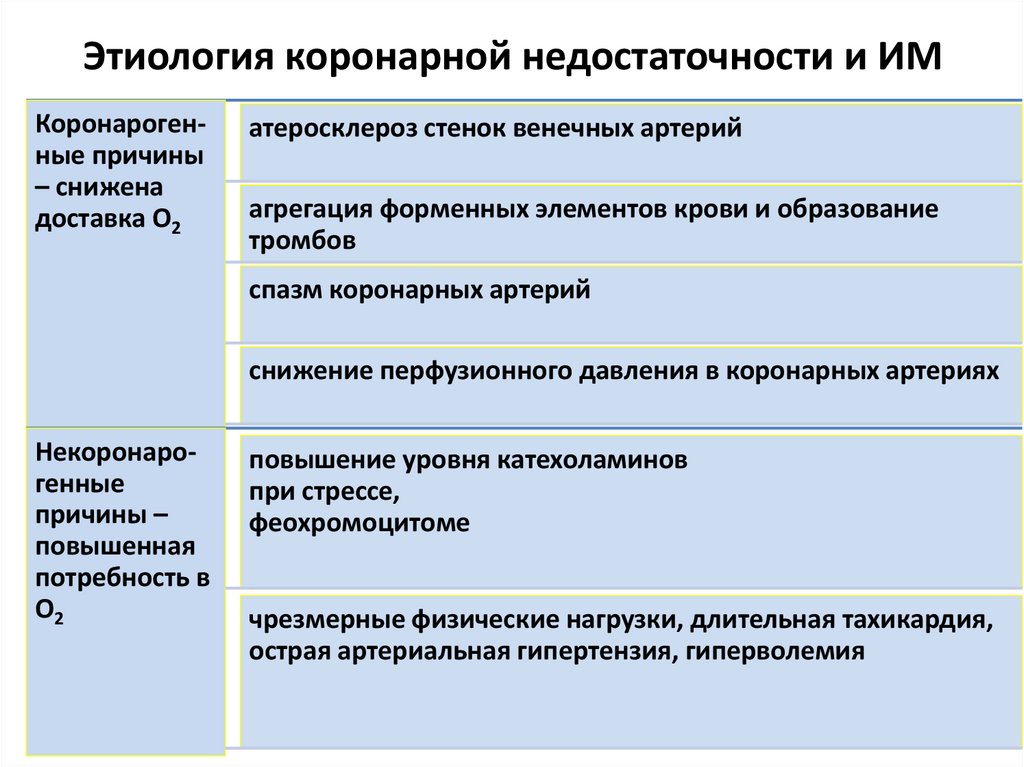
58. Этиология коронарной недостаточности и ИМ
Коронарогенные причины– снижена
доставка О2
атеросклероз стенок венечных артерий
агрегация форменных элементов крови и образование
тромбов
спазм коронарных артерий
снижение перфузионного давления в коронарных артериях
Некоронарогенные
причины –
повышенная
потребность в
О2
повышение уровня катехоламинов
при стрессе,
феохромоцитоме
чрезмерные физические нагрузки, длительная тахикардия,
острая артериальная гипертензия, гиперволемия
59.
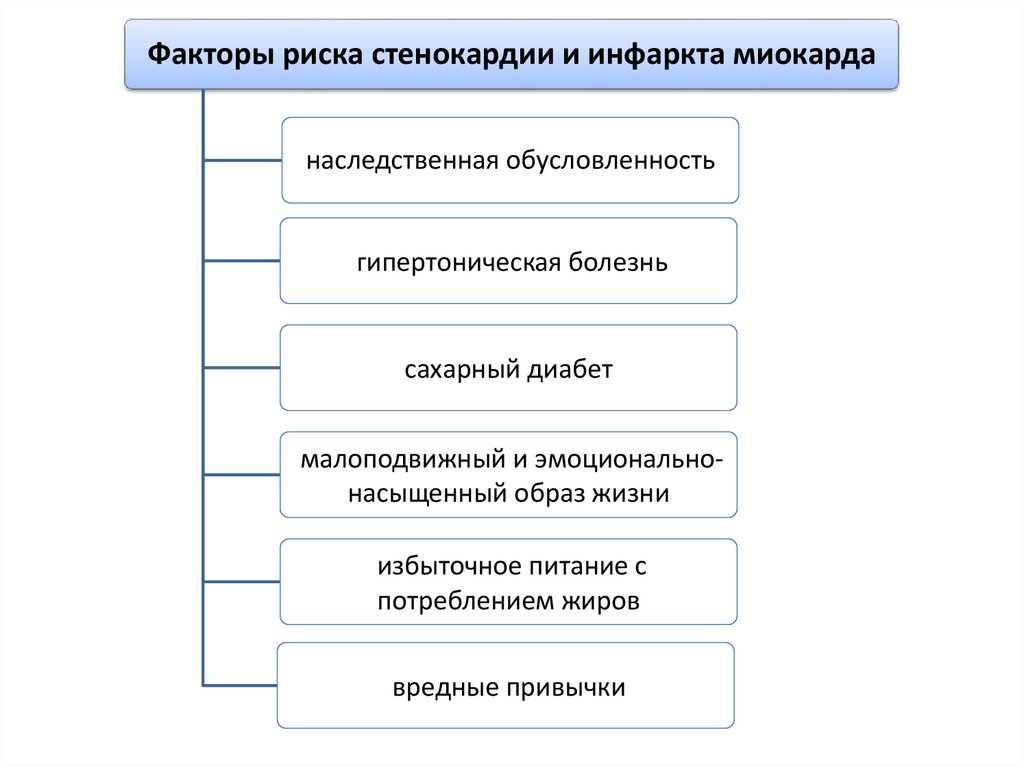
Факторы риска стенокардии и инфаркта миокарданаследственная обусловленность
гипертоническая болезнь
сахарный диабет
малоподвижный и эмоциональнонасыщенный образ жизни
избыточное питание с
потреблением жиров
вредные привычки
60.
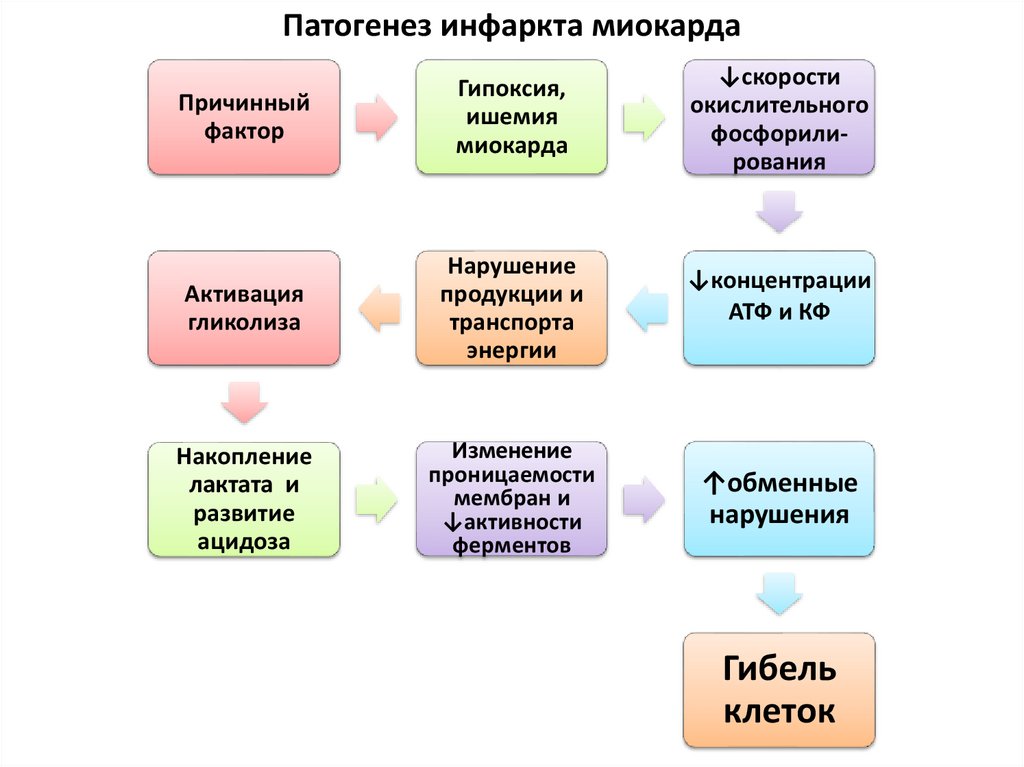
Патогенез инфаркта миокардаПричинный
фактор
Гипоксия,
ишемия
миокарда
↓скорости
окислительного
фосфорилирования
Активация
гликолиза
Нарушение
продукции и
транспорта
энергии
↓концентрации
АТФ и КФ
Накопление
лактата и
развитие
ацидоза
Изменение
проницаемости
мембран и
↓активности
ферментов
↑обменные
нарушения
Гибель
клеток
61.
Для инфаркта миокардахарактерны синдромы
•болевой
•резорбционно-некротический
•снижение сократительной
способности миокарда
•биоэлектрические изменения
62.
63.
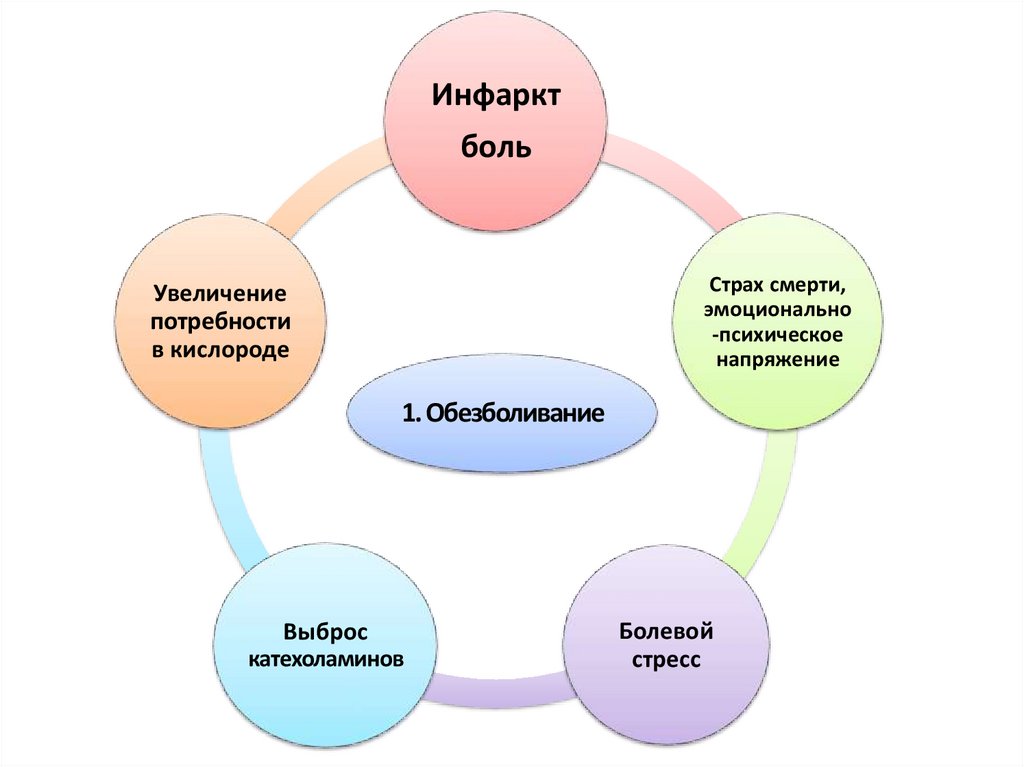
Инфарктболь
Страх смерти,
эмоционально
-психическое
напряжение
Увеличение
потребности
в кислороде
1. Обезболивание
Выброс
катехоламинов
Болевой
стресс
64.
Резорбционно-некротический синдром• В крови обнаруживаются внутриклеточные
ферменты КФК, АСТ, сердечные
изоферменты ЛДГ, а также миоглобин, что
используется в диагностических целях.
• Резорбция белков острой фазы
сопровождается лейкоцитозом,
лихорадкой, ускорением СОЭ.
65.
Резорбционно-некротический синдром• Появление в кровотоке миокардиальных белков
может сопровождаться аутоиммунизацией,
которая усугубляет поражение миокарда,
способствуя развитию вторичных некрозов.
• Аутоантитела и сенсибилизированные
лимфоциты могут вызвать развитие
постинфарктного синдрома Дресслера, для
которого характерны генерализованные
поражения серозных и синовиальных оболочек,
возникающие через 2-6 недель после инфаркта.
66.
Снижение сократительной способности миокардаМетаболические
нарушения, ИМ
Вторичное
уменьшение
коронарного
кровотока
Нарушение
образования
АТФ
2
Снижение
сократительной
способности
миокарда
Сердечная
недостаточность
Снижение
МОС
67.
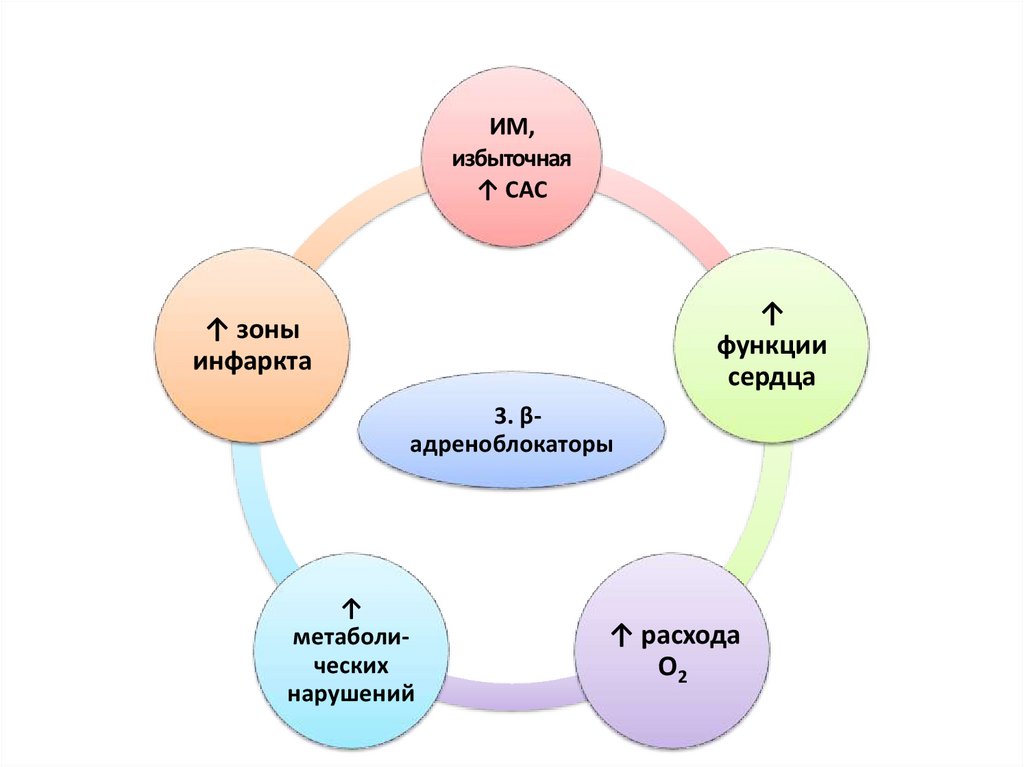
ИМ,избыточная
↑ САС
↑
функции
сердца
↑ зоны
инфаркта
3. βадреноблокаторы
↑
метаболических
нарушений
↑ расхода
О2
68.
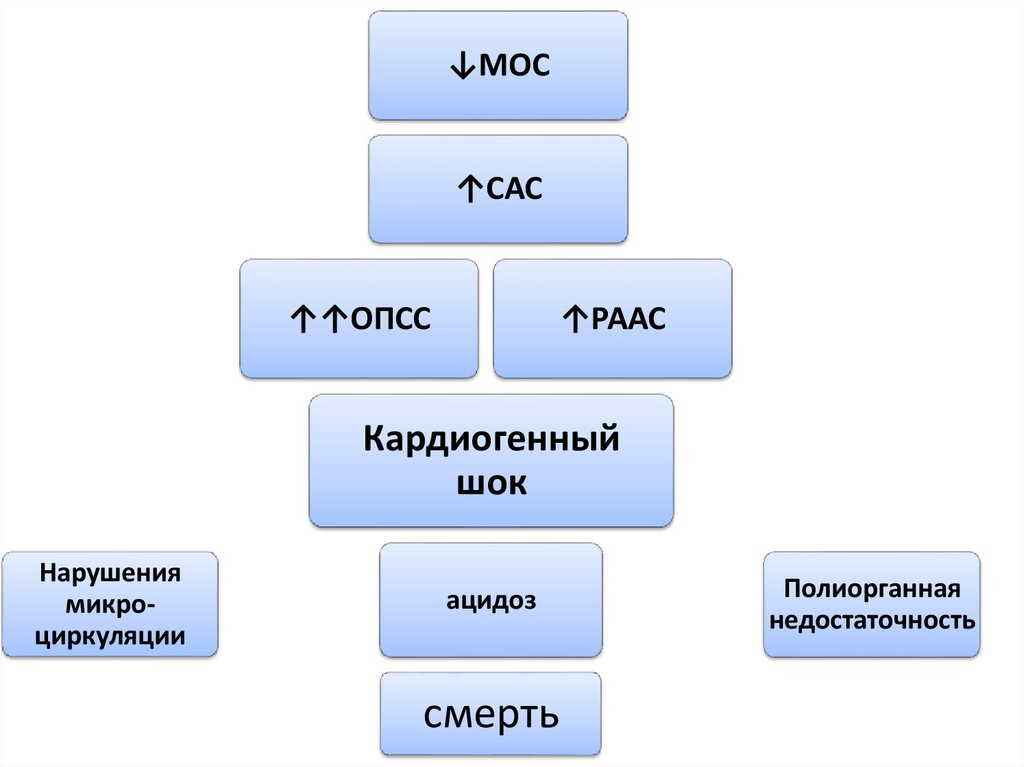
↓МОС↑САС
↑↑ОПСС
↑РААС
Кардиогенный
шок
Нарушения
микроциркуляции
ацидоз
смерть
Полиорганная
недостаточность
69. Биоэлектрические изменения в очаге инфаркта
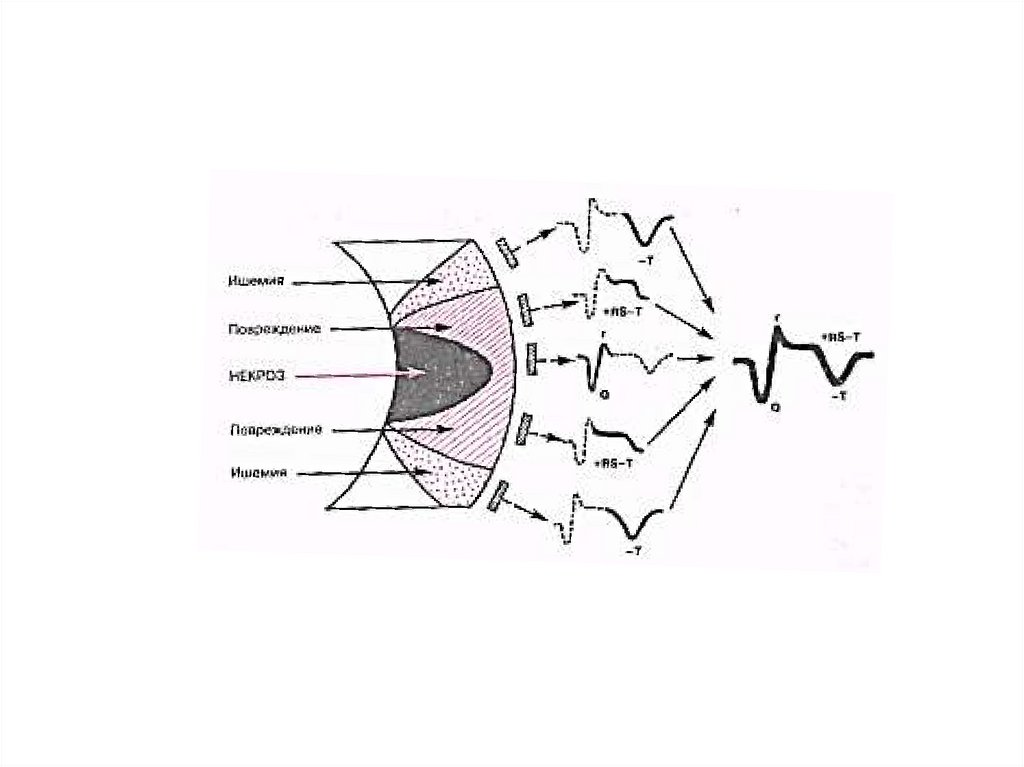
• В зоне ишемии резко нарушаются биоэлектрическиесвойства миокардиальных клеток, очаг поражения источник эктопической активности.
• Разность потенциалов между волокнами, находящимися в
зоне ишемии и вне ее, ведет к возникновению
гетеротопных очагов автоматизма. Это основа
возникновения фибрилляции желудочков сердца наиболее частой причины смертности при инфаркте
миокарда.
• Но даже несмертельные аритмии (экстрасистолия,
пароксизмальная тахикардия), давая дополнительную
нагрузку на поврежденный миокард, могут привести к
расширению зоны некроза и усилению нарушения
сердечного ритма. Замыкается порочный круг.
70.
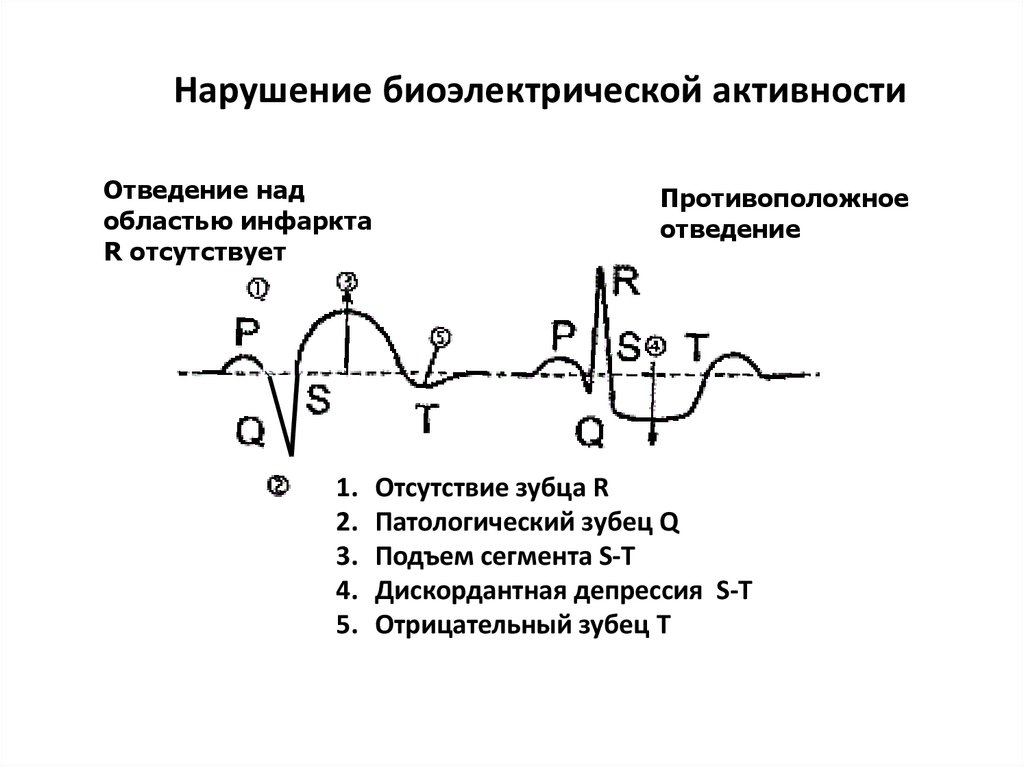
Нарушение биоэлектрической активностиОтведение над
областью инфаркта
R отсутствует
Противоположное
отведение
1. Отсутствие зубца R
2. Патологический зубец Q
3. Подъем сегмента S-T
4. Дискордантная депрессия S-T
5. Отрицательный зубец T
71.
72. Саногенетические механизмы при инфаркте
Усиление коллатерального кровообращения за счет• а) расширения других ветвей этой же коронарной
артерии;
• б) за счет расширения других коронарных артерий;
• в) вследствие ослабления сократительной способности
увеличивается остаточный систолический объем крови
в желудочках и повышается давление внутри полостей
сердца. Это приводит к тому, что по сосудам ВьесеннаТебезия кровь может идти ретроградно из сердца в
коронарные сосуды.
Усиление парасимпатических влияний - это снижает
потребность миокарда в кислороде.
73.
НАРУШЕНИЯ СИСТЕМНОГОАРТЕРИАЛЬНОГО ДАВЛЕНИЯ
74.
Факторы риска ГБ75.
Факторы риска ГБНаследственная предрасположенность
Гиподинамия
Ожирение
Избыточное потребление поваренной соли
Дефицит кальция и магния
Чрезмерное потребление алкоголя
Гиперлипидемия и атеросклероз сосудов
большого круга кровообращения
Курение
Возраст
76.
Стадии ГБ (ВОЗ, 1996).Степень повышения АД не учитывается (любое
≥140/90), учитывается поражение органовмишеней (сердце, головной мозг, сетчатка, почки,
крупные артерии)
• 1 стадия – поражение органов-мишеней отсутствует
• 2 стадия – гипертонические кризы с типичной
симптоматикой, на ЭКГ и R-графии выраженная
гипертрофия левого желудочка. Изменения органов
мишеней без нарушения функций.
• 3 стадия – часты гипертонические кризы, возможен исход
в инфаркты и инсульты. Выраженный распространенный
атеросклероз, полиорганная недостаточность.
77.
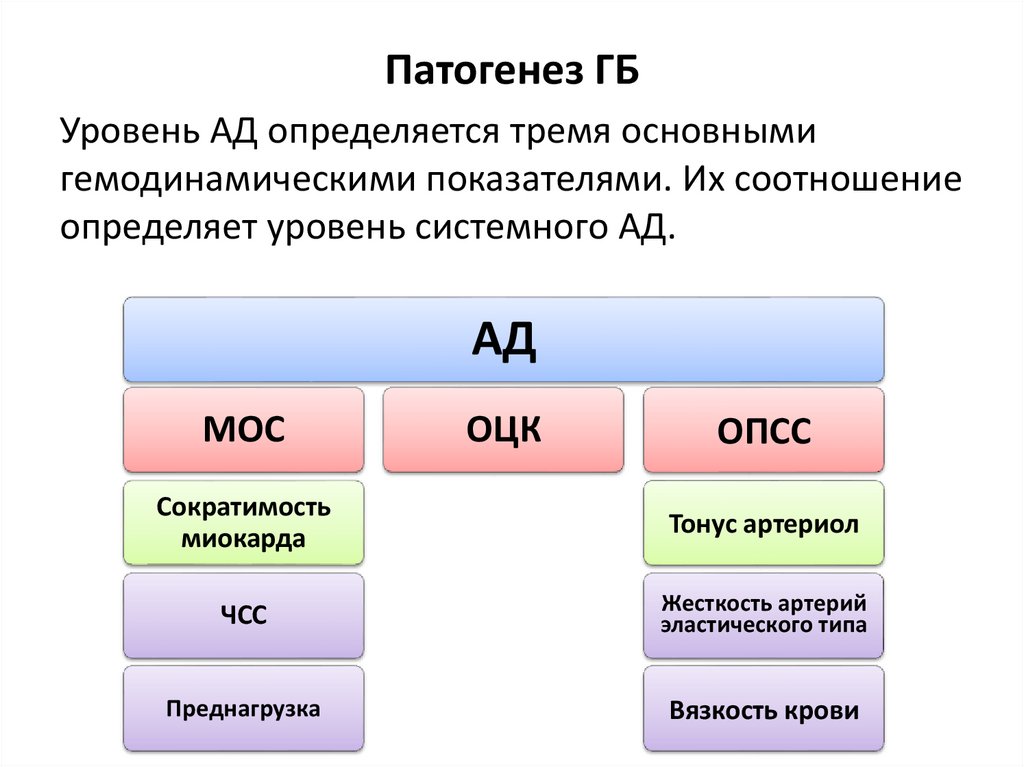
Патогенез ГБУровень АД определяется тремя основными
гемодинамическими показателями. Их соотношение
определяет уровень системного АД.
АД
МОС
ОЦК
ОПСС
Сократимость
миокарда
Тонус артериол
ЧСС
Жесткость артерий
эластического типа
Преднагрузка
Вязкость крови
78.
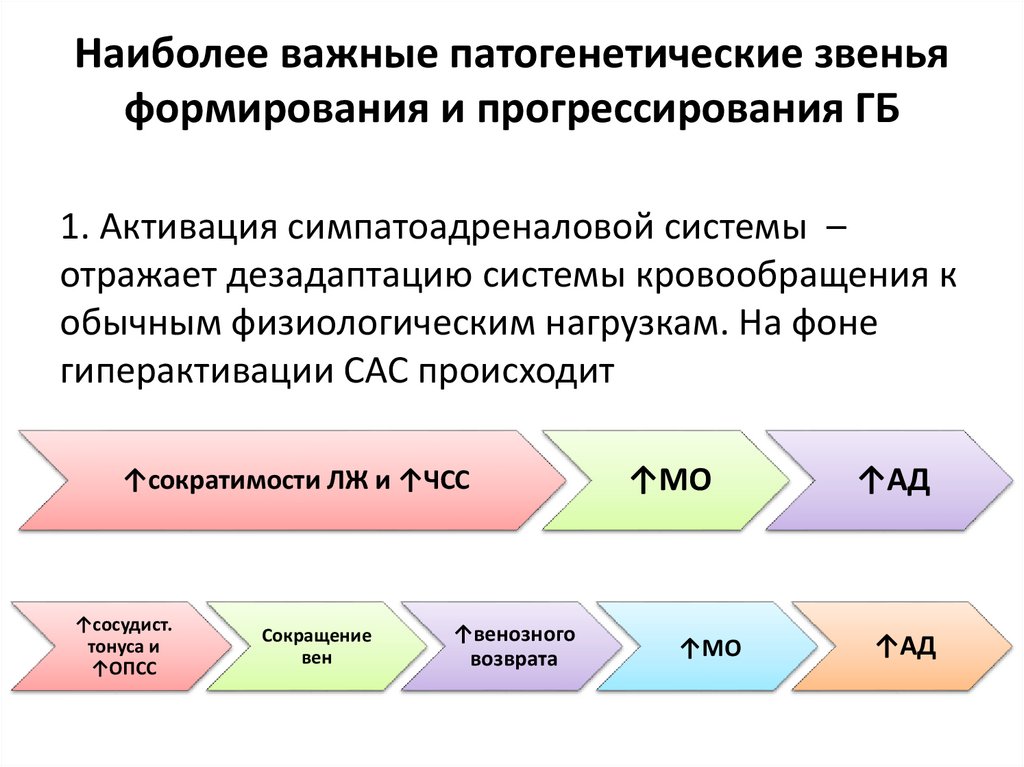
Наиболее важные патогенетические звеньяформирования и прогрессирования ГБ
1. Активация симпатоадреналовой системы –
отражает дезадаптацию системы кровообращения к
обычным физиологическим нагрузкам. На фоне
гиперактивации САС происходит
↑сократимости ЛЖ и ↑ЧСС
↑сосудист.
тонуса и
↑ОПСС
Сокращение
вен
↑венозного
возврата
↑МО
↑МО
↑АД
↑АД
79.
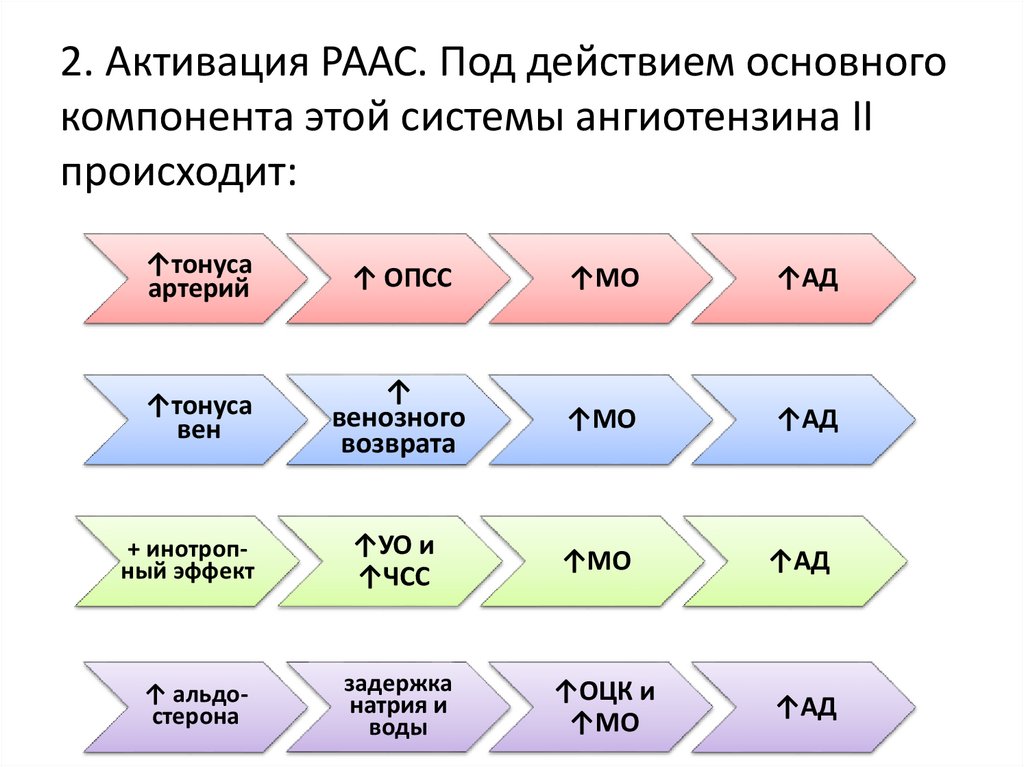
2. Активация РААС. Под действием основногокомпонента этой системы ангиотензина II
происходит:
↑тонуса
артерий
↑ ОПСС
↑МО
↑АД
↑тонуса
вен
↑
венозного
возврата
↑МО
↑АД
+ инотропный эффект
↑УО и
↑ЧСС
↑МО
↑АД
↑ альдостерона
задержка
натрия и
воды
↑ОЦК и
↑МО
↑АД
80.
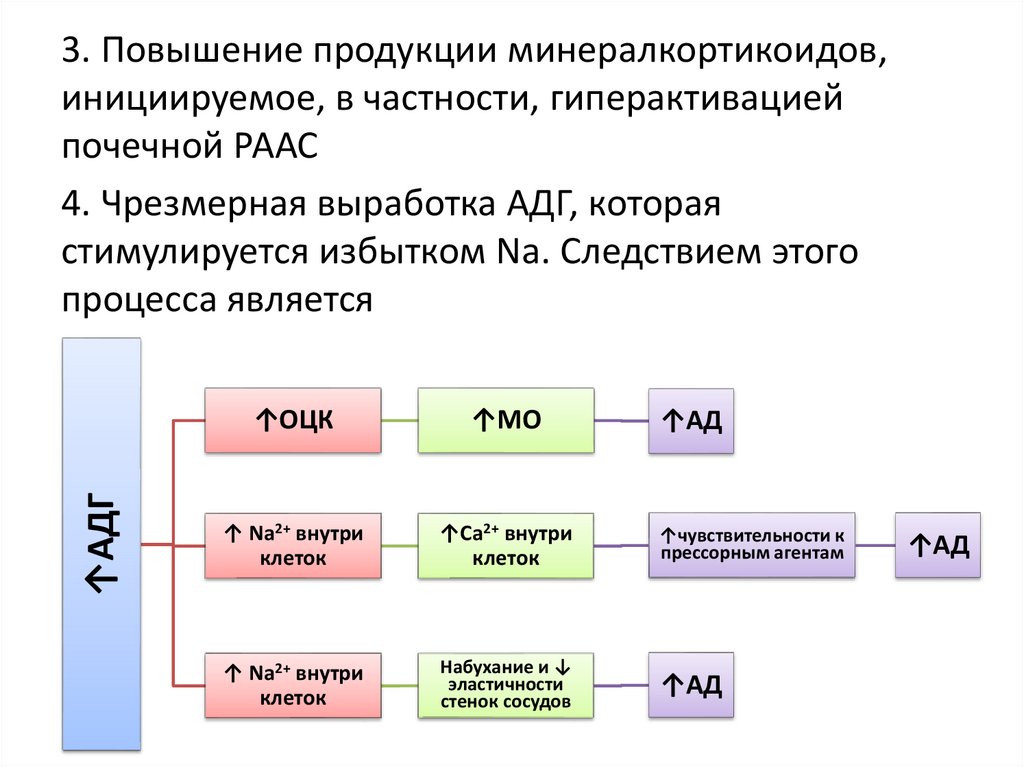
↑АДГ3. Повышение продукции минералкортикоидов,
инициируемое, в частности, гиперактивацией
почечной РААС
4. Чрезмерная выработка АДГ, которая
стимулируется избытком Na. Следствием этого
процесса является
↑ОЦК
↑МО
↑ Na2+ внутри
клеток
↑Ca2+ внутри
клеток
↑чувствительности к
прессорным агентам
↑ Na2+ внутри
клеток
Набухание и ↓
эластичности
стенок сосудов
↑АД
↑АД
↑АД
81.
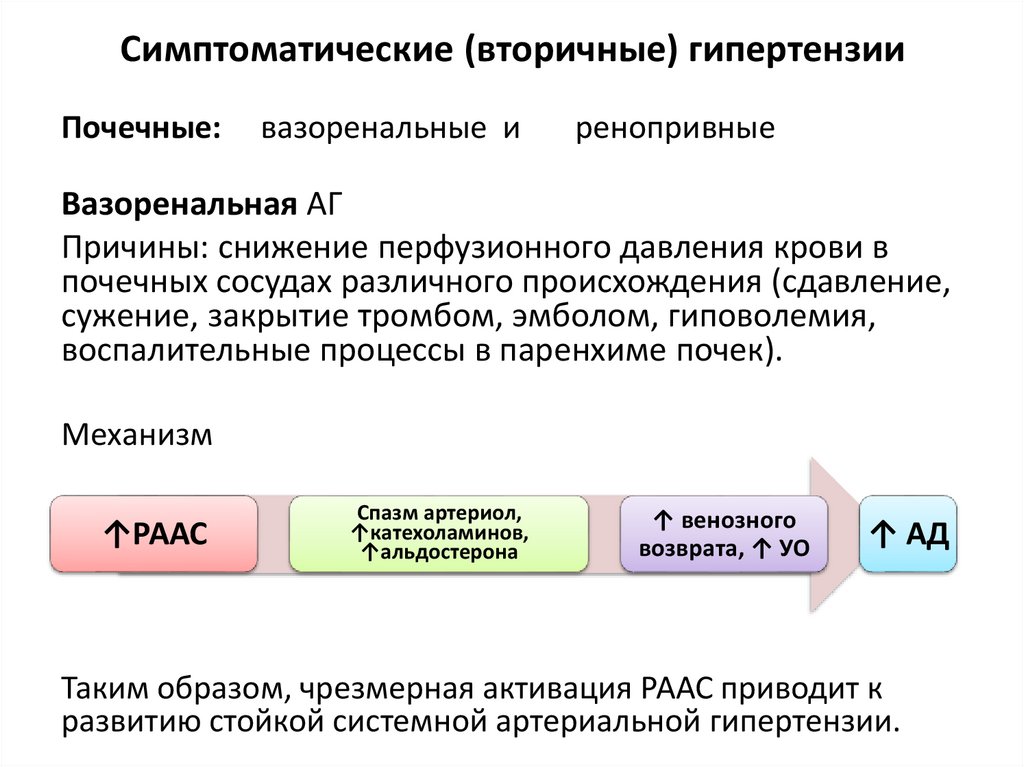
Симптоматические (вторичные) гипертензииПочечные:
вазоренальные и
ренопривные
Вазоренальная АГ
Причины: снижение перфузионного давления крови в
почечных сосудах различного происхождения (сдавление,
сужение, закрытие тромбом, эмболом, гиповолемия,
воспалительные процессы в паренхиме почек).
Механизм
↑РААС
Спазм артериол,
↑катехоламинов,
↑альдостерона
↑ венозного
возврата, ↑ УО
↑ АД
Таким образом, чрезмерная активация РААС приводит к
развитию стойкой системной артериальной гипертензии.
82.
Ренопривная АГ.Причины: уменьшение массы паренхимы почек,
вырабатывающих сосудорасширяющие агенты
(простагландины, кинины и др.), вследствие
• удаления части почки, одной или обеих почек,
• нефросклероза,
• некроза почки и т.д.
Указанные вещества являются
физиологическими антагонистами РААС.
Уменьшение их влияния приводит к
доминированию почечной прессорной системы
и развитию АГ.
83.
Эндокринные артериальные гипертензии.Эндокринопатии надпочечников
1. кортикостероидные АГ.
• минералкортикоидные (гиперальдостеронизм)
• глюкокортикоидные (синдром Иценко-Кушинга).
– Глюкокортикоиды оказывают
непосредственное гипертензивное действие
– Повышают чувствительность сосудистой стенки
к констрикторному действию катехоламинов
– Частично обладают минералкортикоидным
(подобным альдостерону) действием.
2. катехоламиновые АГ (феохромоцитома) –
повышенный тонус сосудов приводит к увеличению
работы сердца и повышению АД.
84.
Гипертиреоидные АГКардиотонический эффект тироксина
приводит к увеличению сердечного
выброса и тахикардии. Систолическое
АД высокое, диастолическое
нормальное или пониженное
(компенсаторное расширение
резистивных сосудов, непосредственное
повреждение тироксином сосудистой
стенки).
85.
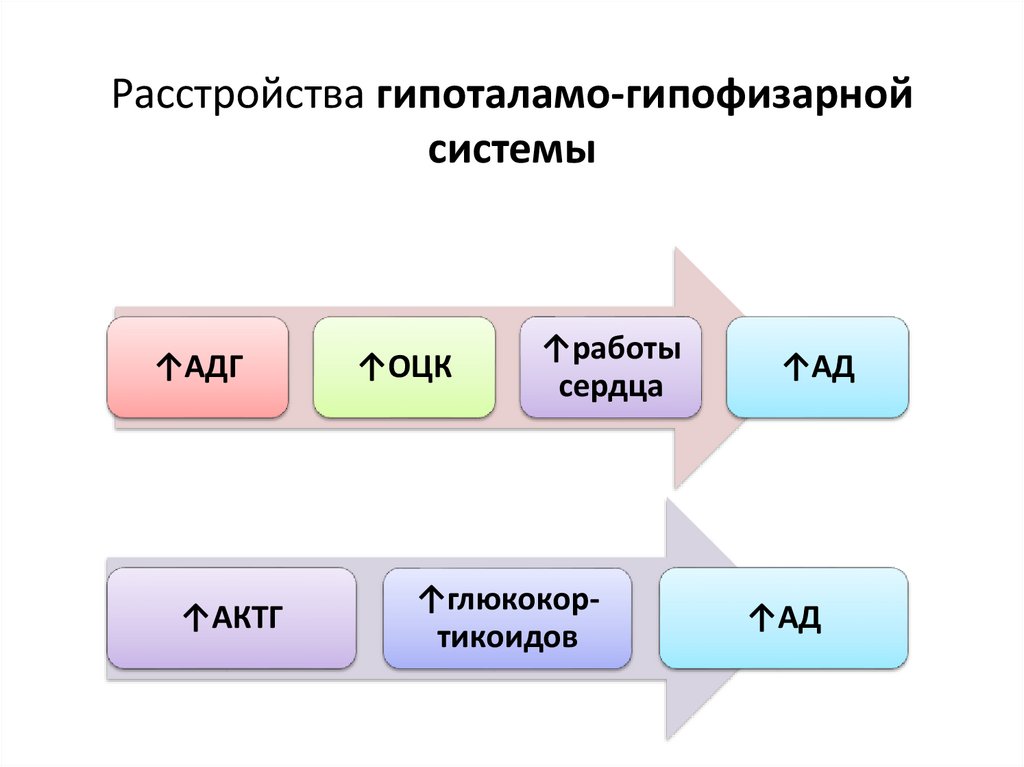
Расстройства гипоталамо-гипофизарнойсистемы
↑АДГ
↑АКТГ
↑ОЦК
↑работы
сердца
↑глюкокортикоидов
↑АД
↑АД
86.
Принципы лечения АГ• диета: ограничение потребления соли – менее 6 г/сутки,
но не менее 2г/сутки, углеводов и жиров, увеличение
потребления ионов калия, отказ от приема алкоголя.
• физическая активность при отсутствии противопоказаний
со стороны ССС.
• психотерапия, аутогенная тренировка, акупунктура,
массаж и пр.
• препараты: блокаторы медленных кальциевых каналов,
диуретики, β-адреноблокаторы, ингибитор АПФ,
антагонисты ангиотензина II, α-адреноблокаторы.
87.
АРТЕРИАЛЬНЫЕ ГИПОТЕНЗИИАртериальная гипотензия – снижение АД ниже 100/60
мм рт.ст. у мужчин и 95/60 мм рт.ст. у женщин (при
хорошем самочувствии и полной работоспособности).
• Артериальная гипотензия
• Физиологическая
• Патологическая
Физиологическая артериальная гипотензия:
• индивидуальный вариант нормы
• спортивная артериальная гипотензия (результат
тренированности)
• компенсаторная адаптивная АГ (жители
высокогорья, тропиков, Заполярья)
88.
Патологическая артериальная гипотензия:• острая (коллапс, шок)
• хроническая
По механизму различают
• нейрогенные артериальные гипотензии
• метаболические артериальные гипотензии
• эндокринные артериальные гипотензии
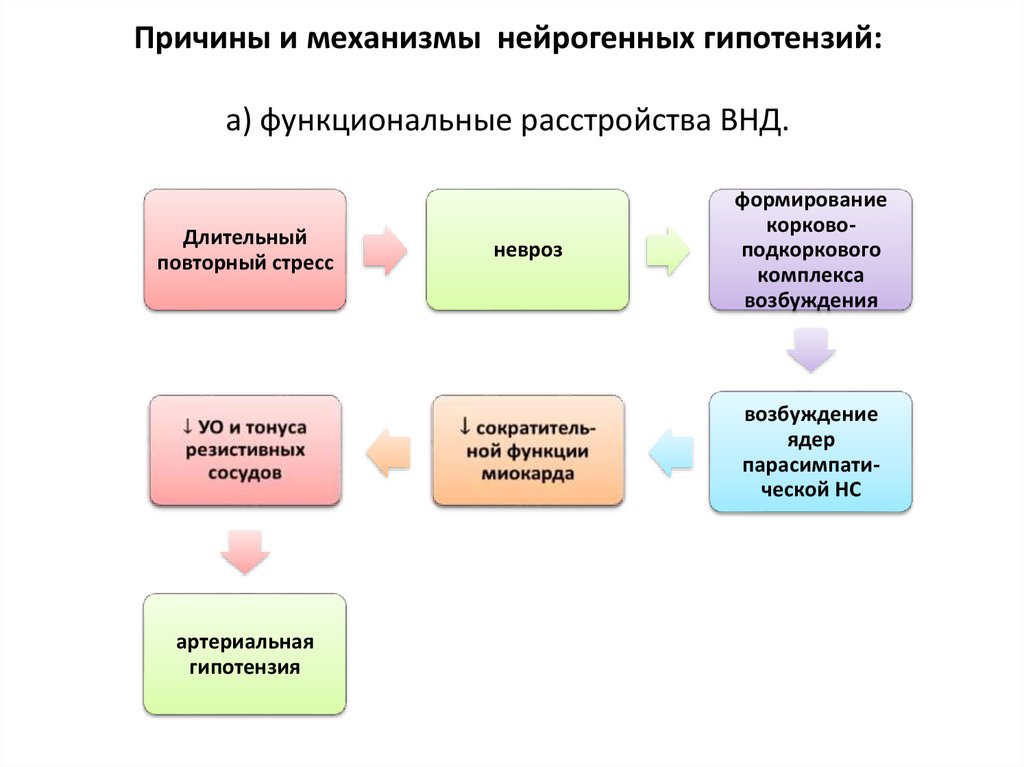
89. Причины и механизмы нейрогенных гипотензий: а) функциональные расстройства ВНД.
Длительныйповторный стресс
невроз
формирование
корковоподкоркового
комплекса
возбуждения
возбуждение
ядер
парасимпатической НС
артериальная
гипотензия
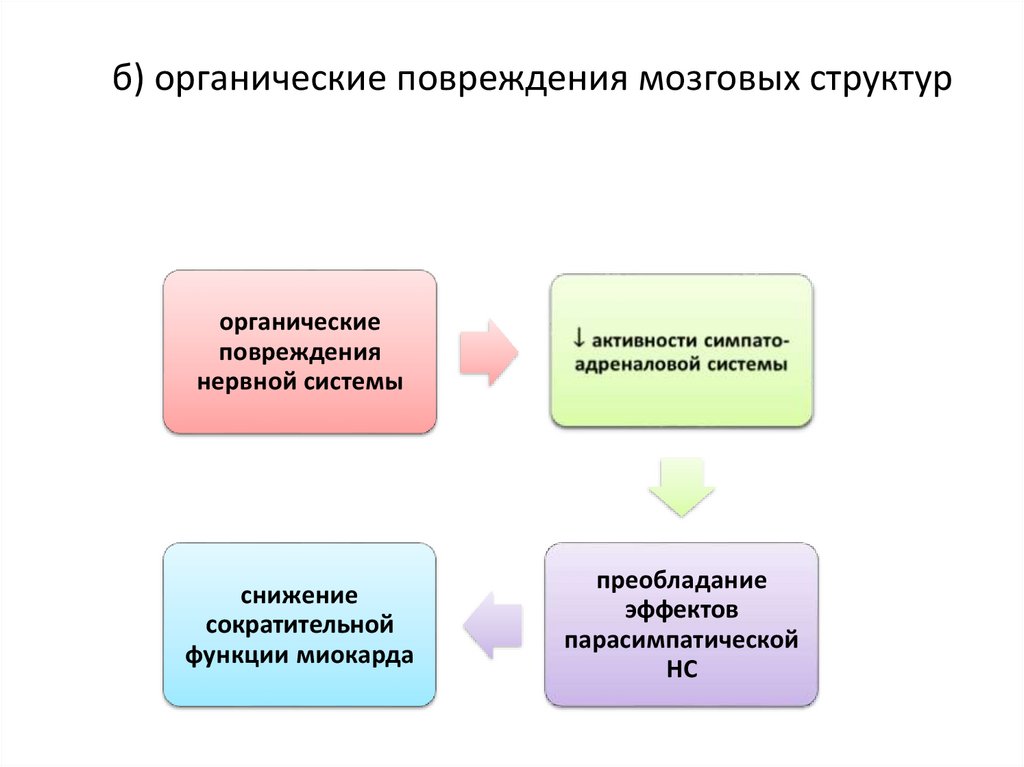
90. б) органические повреждения мозговых структур
органическиеповреждения
нервной системы
снижение
сократительной
функции миокарда
преобладание
эффектов
парасимпатической
НС
91. Метаболические артериальные гипотензии
• Встречаются редко при дистрофическихизменениях в организме (интоксикации,
инфекции, голодание), при гипогидратациях.
Связаны с уменьшением выработки метаболитов
с гипертензивным действием – эндотелина, ПгF,
тромбоксана А2, ангиотензиногена. Основные
звенья патогенеза: снижение тонуса стенок
сосудов, ОППС, снижение сократительной
способности → ↓УО → ↓содержания воды в
организме → ↓ОЦК → стойкое снижение АД.
92. Эндокринные артериальные гипотензии
• Снижение синтеза и инкреции гормонов сгипертензивным действием (вазопрессина,
АКТГ, ТТГ, СТГ, тиреоидных гормонов,
гормонов коры надпочечников) в
совокупности со снижением
чувствительности рецепторов сосудов и
сердца к их действию приводит к снижению
ОПСС, ОЦК, УО и приводит к стойкому
снижению АД.
93.
АРИТМИИ СЕРДЦА В РЕЗУЛЬТАТЕ НАРУШЕНИЯАВТОМАТИЗМА
• Под автоматизмом понимают способность
ткани сердца спонтанно генерировать
электрические импульсы.
• Нарушение свойства автоматизма сердца
проявляется изменением частоты и
регулярности его сокращений.
• При этом импульсы могут генерироваться как
синусно-предсердным узлом (номотопный,
синусовый ритм), а также водителями ритма
2-го или 3-го порядка (гетеротопный ритм).
94.
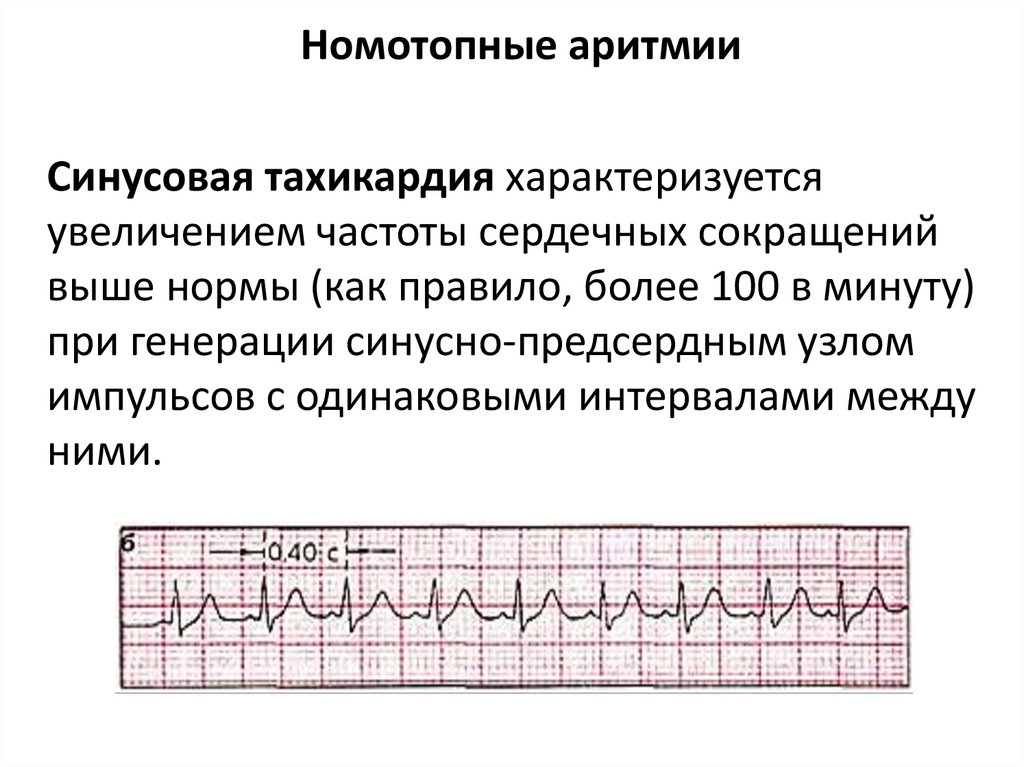
Номотопные аритмииСинусовая тахикардия характеризуется
увеличением частоты сердечных сокращений
выше нормы (как правило, более 100 в минуту)
при генерации синусно-предсердным узлом
импульсов с одинаковыми интервалами между
ними.
95.
Ведущий электрофизиологический механизм ускорение процесса спонтанной диастолическойдеполяризации клеток синусно-предсердного узла. Это
может быть обусловлено следующими факторами:
1. Активацией влияния на сердце симпатоадреналовой
системы
– при эмоциональном стрессе, физических нагрузках,
неврозах;
– при острой артериальной гипотензии, сопровождающейся
активацией афферентной импульсации от барорецепторов;
– при сердечной недостаточности (вследствие повышения
притока крови к правому предсердию и включению
рефлекса Бейнбриджа);
– при гипертермии и лихорадке и др.
96.
2. Снижение влияния на сердце парасимпатическойнервной системы
• при повреждении центральных нервных
образований
(подкорковых ядер, ретикулярной формации, ядер
продолговатого мозга)
• при поражении проводящих путей, парасимпатических
ганглиев и нервных стволов;
• при снижении холинореактивных свойств миокарда.
3. Прямым действием факторов различной природы
(физических, химических, биологических) на клетки
синусно-предсердного узла
• при миокардитах, инфаркте миокарда, перикардитах,
механической травме, кардиосклерозе.
97.
• Синусовая брадикардия проявляетсяуменьшением частоты сердечных сокращений
ниже нормы (между 40 и 60 в минуту) при генерации синусовым узлом импульсов с одинаковыми
интервалами между ними. Урежение ритма
обусловлено в основном удлинением диастолы.
98.
Электрофизиологический механизм - замедлениеспонтанной диастолической деполяризации клеток
синусно-предсердного узла.
Причины:
1. Активация влияния на сердце парасимпатической
нервной системы:
– при раздражении ядер блуждающего нерва, что
связано с повышением внутричерепного давления при
менингитах, энцефалитах, опухолях и сотрясениях
головного мозга, мозговых кровоизлияниях и т.п.;
– при раздражении окончаний вагуса, например при
повышении внутрижелудочкового давления и тонуса
миокарда (рефлекс Бецольда—Яриша), надавливании
на глазные яблоки (рефлекс Даньини — Ашнера),
надавливании в зоне проекции бифуркации сонной
артерии (рефлекс Геринга), чревного («солнечного»)
сплетения и др.
99.
2.Снижение симпатоадреналовых воздействий насердце:
– при срыве высшей нервной деятельности
– повреждении мозговых структур (например,
гипоталамуса), проводящих путей, нервных ганглиев и
окончаний симпатической нервной системы
– а также вследствие снижения адренореактивности сердца.
3.Непосредственное воздействие повреждающих
факторов физического, химического или
биологического генеза на клетки синуснопредсердного узла
– механическая травма, кровоизлияние, инфаркт в зоне
синусно-предсердного узла;
– токсины, лекарственные препараты (хинин, препараты наперстянки, опиаты, холиномиметики);
– метаболиты (непрямой билирубин, желчные кислоты).
100.
Синусовая аритмия (дыхательная)проявляется чередованием периодов
нормального ритма с тахи- и брадикардией.
101.
Основные факторы развития синусовойаритмии:
– колебание парасимпатических влияний на сердце;
– нарушение соотношения симпатоадреналовых и
парасимпатических воздействий на миокард;
– колебание содержания в крови газов (О2 и CO2), метаболитов (лактат, пируват, желчные кислоты), лекарственных препаратов (наперстянка, опиаты, холино- и
симпатолитики и холино- и симпатомиметики);
– изменение холино- и адренореактивных свойств сердца;
– действие агентов механического и физического характера
непосредственно на клетки синусно-предсердного узла
(травма, кровоизлияние и т.п.).
102.
Гетеротопные аритмииВозникают при снижении или прекращении
активности синусно-предсердного узла. При
этом эктопический очаг принимает на себя
функцию пейсмекера.
103.
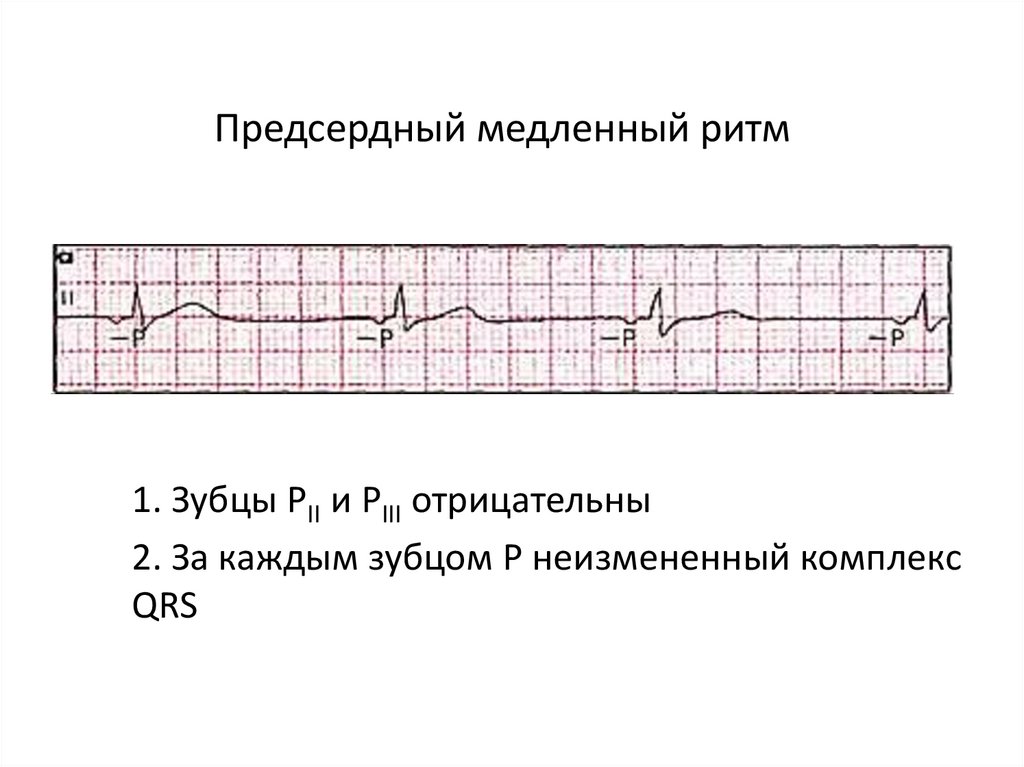
Предсердный медленный ритмхарактеризуется редкими сокращениями
сердца (как правило, менее 70—80 в минуту). Он может наблюдаться
• при неврозах,
• приобретенных (ревматических) или
врожденных пороках сердца
• миокардиопатиях.
Эктопический водитель ритма находится,
как правило, на территории левого
предсердия.
104.
Предсердный медленный ритм1. Зубцы РII и РIII отрицательны
2. За каждым зубцом Р неизмененный комплекс
QRS
105.
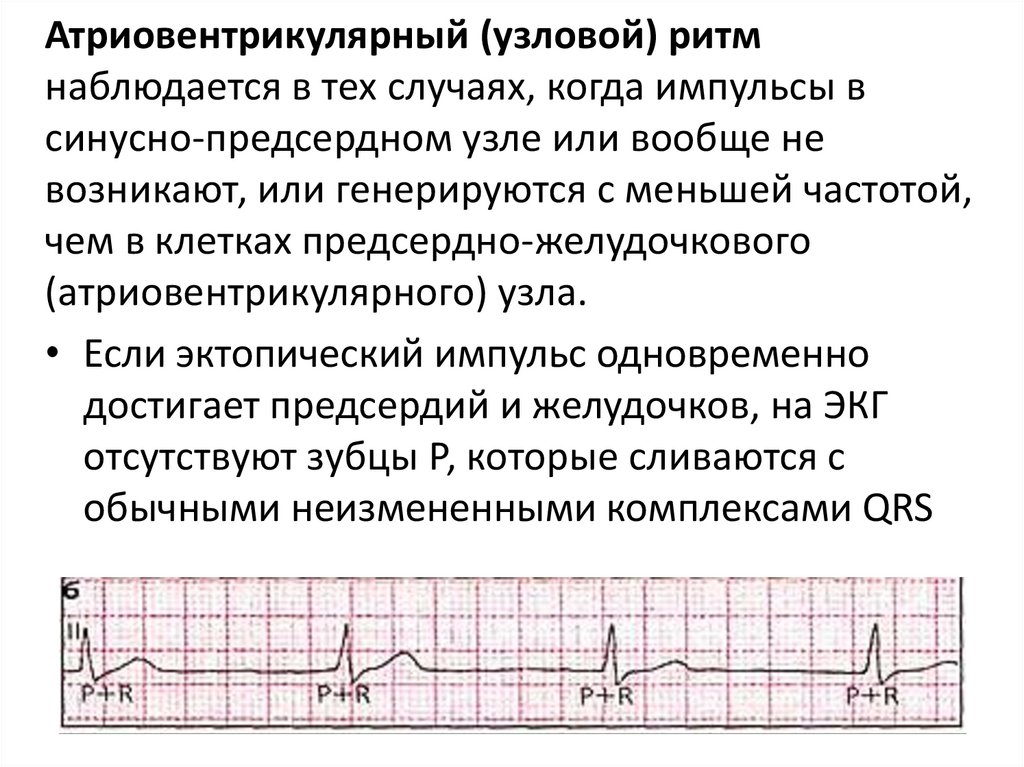
Атриовентрикулярный (узловой) ритмнаблюдается в тех случаях, когда импульсы в
синусно-предсердном узле или вообще не
возникают, или генерируются с меньшей частотой,
чем в клетках предсердно-желудочкового
(атриовентрикулярного) узла.
• Если эктопический импульс одновременно
достигает предсердий и желудочков, на ЭКГ
отсутствуют зубцы Р, которые сливаются с
обычными неизмененными комплексами QRS
106.
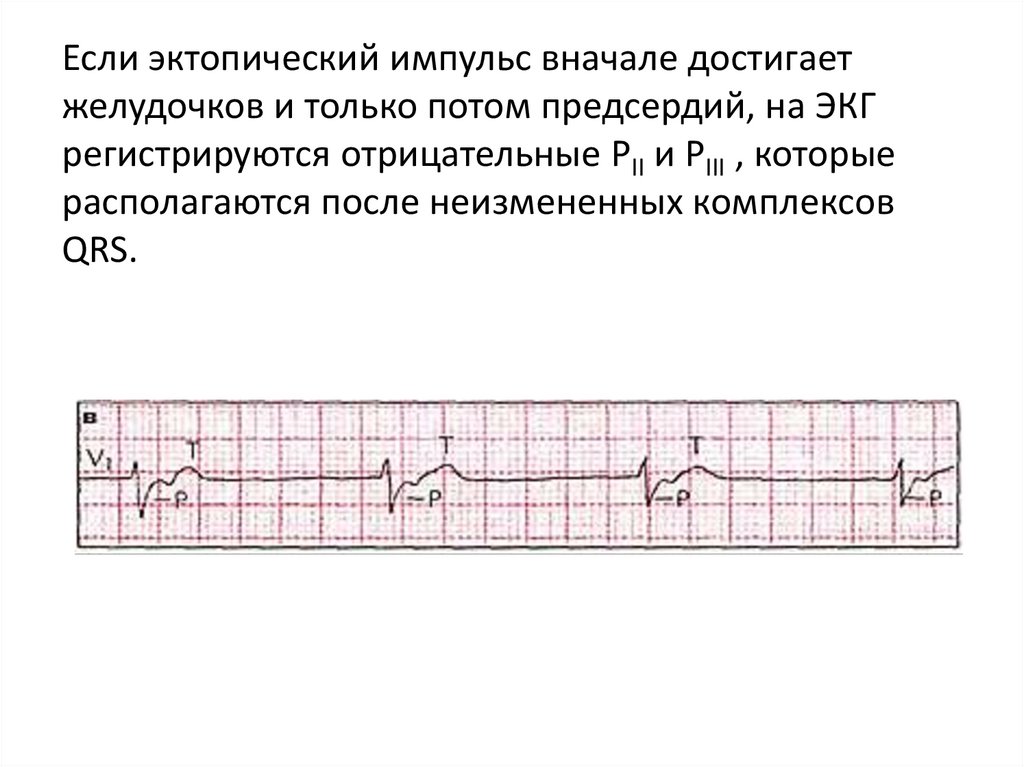
Если эктопический импульс вначале достигаетжелудочков и только потом предсердий, на ЭКГ
регистрируются отрицательные РII и РIII , которые
располагаются после неизмененных комплексов
QRS.
107.
• Идиовентрикулярный (желудочковый) ритм развивается как замещающий при подавлении активностицентров 1-го и 2-го порядка.
1. Все комплексы QRS расширены и деформированы
2. Отсутствует закономерная связь комплексов QRS и
зубцов Р
3. ЧСС не превышает 40-60 в мин.
108.
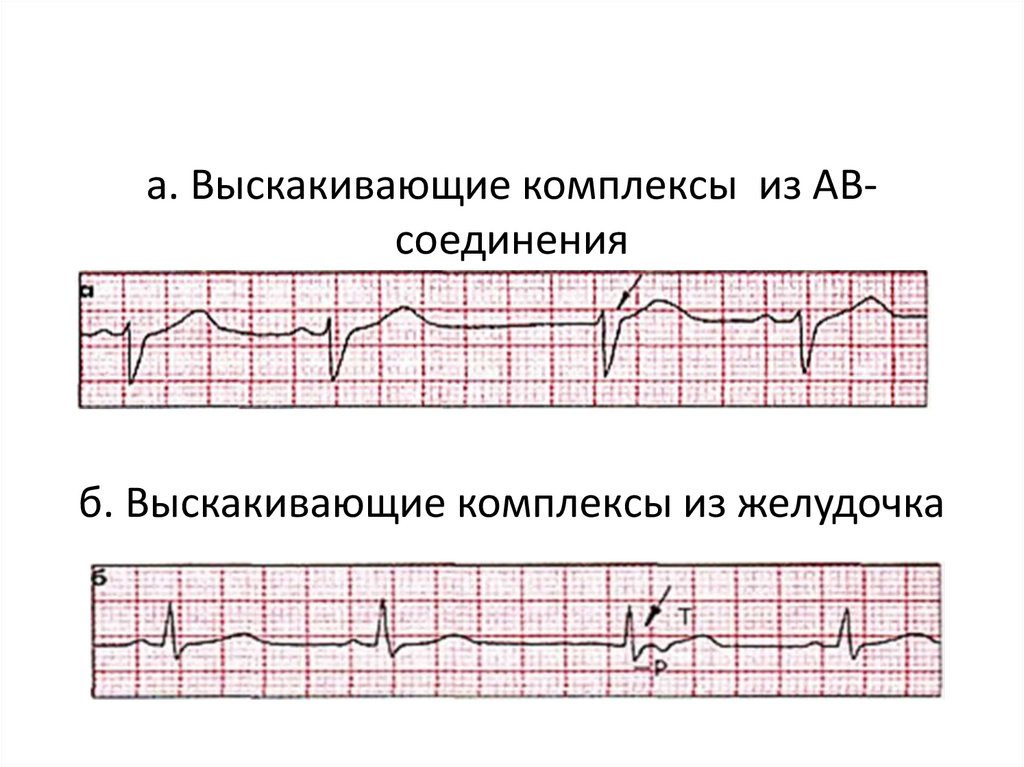
• «Выскакивающие» сокращения(комплексы) заключаются в появлении
отдельных (замещающих) сокращений
сердца под влиянием импульсов,
генерируемых центрами автоматизма 2-го
или 3-го порядка при условии снижения
автоматической функции синуснопредсердного узла.
109.
а. Выскакивающие комплексы из АВсоединенияб. Выскакивающие комплексы из желудочка
110.
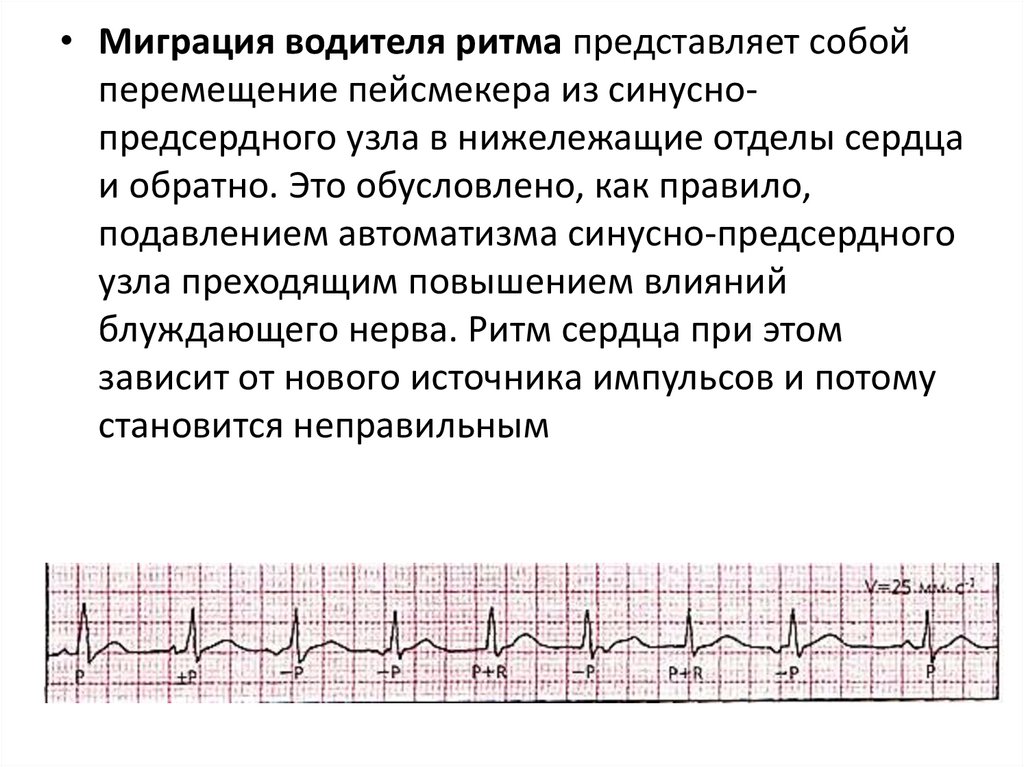
• Миграция водителя ритма представляет собойперемещение пейсмекера из синуснопредсердного узла в нижележащие отделы сердца
и обратно. Это обусловлено, как правило,
подавлением автоматизма синусно-предсердного
узла преходящим повышением влияний
блуждающего нерва. Ритм сердца при этом
зависит от нового источника импульсов и потому
становится неправильным
111.
АРИТМИИ ВСЛЕДСТВИЕ СОЧЕТАННОГОНАРУШЕНИЯ ВОЗБУДИМОСТИ И
ПРОВОДИМОСТИ МИОКАРДА
112.
Развитию данных аритмий предшествуютопределенные нарушения метаболизма:
• Увеличение внеклеточной концентрации ионов калия. При
этом
а) уменьшается амплитуда потенциала покоя,
б) снижается порог возбудимости кардиомиоцитов,
в) замедляется проведение импульса,
г) укорачивается рефрактерный период клеток,
д) возникает электроток повреждения.
• Снижение РН в клетках миокарда. Происходит в
результате активации анаэробного гликолиза и
торможения аэробного тканевого дыхания. Увеличение
содержания лактата сочетается со снижением потенциала
покоя, укорочением потенциала действия, ускорением
деполяризации.
113.
• Накопление в кардиомиоцитах избыткацАМФ. В результате стимулируется так
называемый «медленный, входящий в
клетку ток ионов Са»
• Повышение содержания высших жирных
кислот в клетках миокарда в результате
увеличения содержания катехоламинов при
ишемии и др. При увеличении содержания
ВЖК разобщается окисление и
фосфорилирование, подавляется ресинтез
АТФ и пр.
114.
Электрофизиологические механизмы развития.1. Циркуляция возбуждения может развиться на
базе трех основных феноменов:
• замедление или блокада проведения импульса в
одном направлении с сохранением возможности
его проведения в ретроградном направлении
• продольная диссоциация проведения импульса.
• суммация импульсов возбуждения.
Предпосылкой является наличие участка с
замедленной проводимостью.
115.
2. Механизмы формированиягетеротопных очагов автоматизма
также разнообразны. Среди них следует
выделить три основных:
1. осцилляция трансмембранного
потенциала;
2. остаточный (следовой) потенциал;
3. местный электрический ток
повреждения.
116.
Электрокардиографическиеособенности
117.
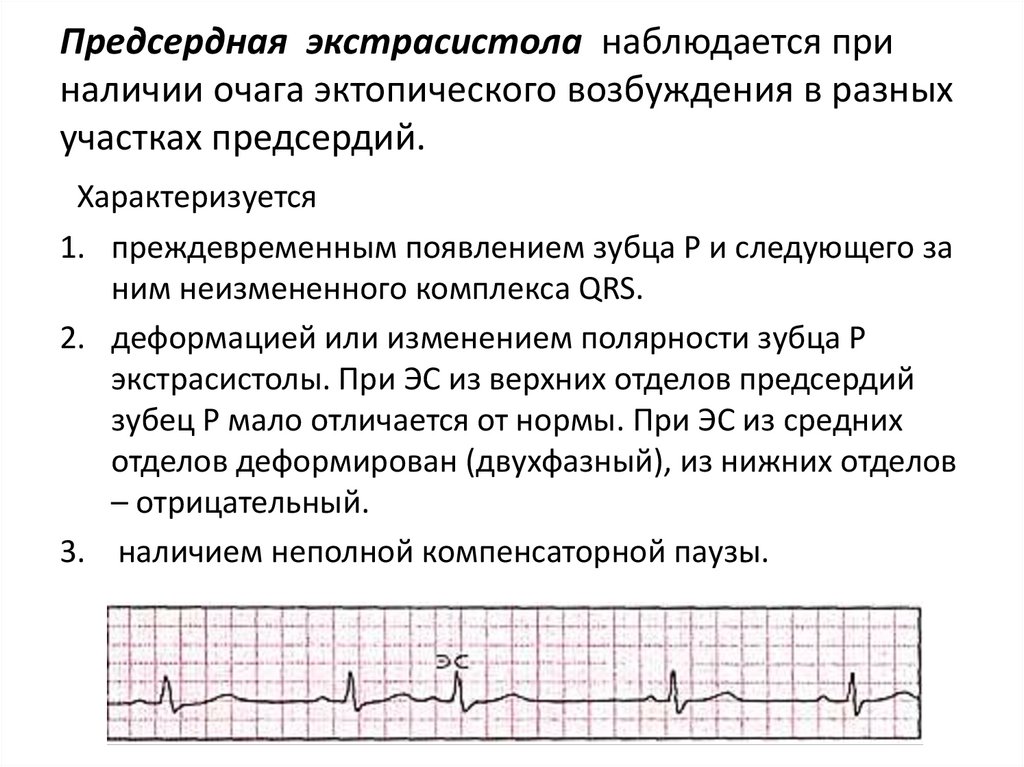
Предсердная экстрасистола наблюдается приналичии очага эктопического возбуждения в разных
участках предсердий.
Характеризуется
1. преждевременным появлением зубца Р и следующего за
ним неизмененного комплекса QRS.
2. деформацией или изменением полярности зубца Р
экстрасистолы. При ЭС из верхних отделов предсердий
зубец Р мало отличается от нормы. При ЭС из средних
отделов деформирован (двухфазный), из нижних отделов
– отрицательный.
3. наличием неполной компенсаторной паузы.
118.
Предсердно-желудочковаяэкстрасистола или экстрасистола из
АВ-соединения может исходить из
верхней и средней части и из нижней
части атриовентрикулярного узла.
119.
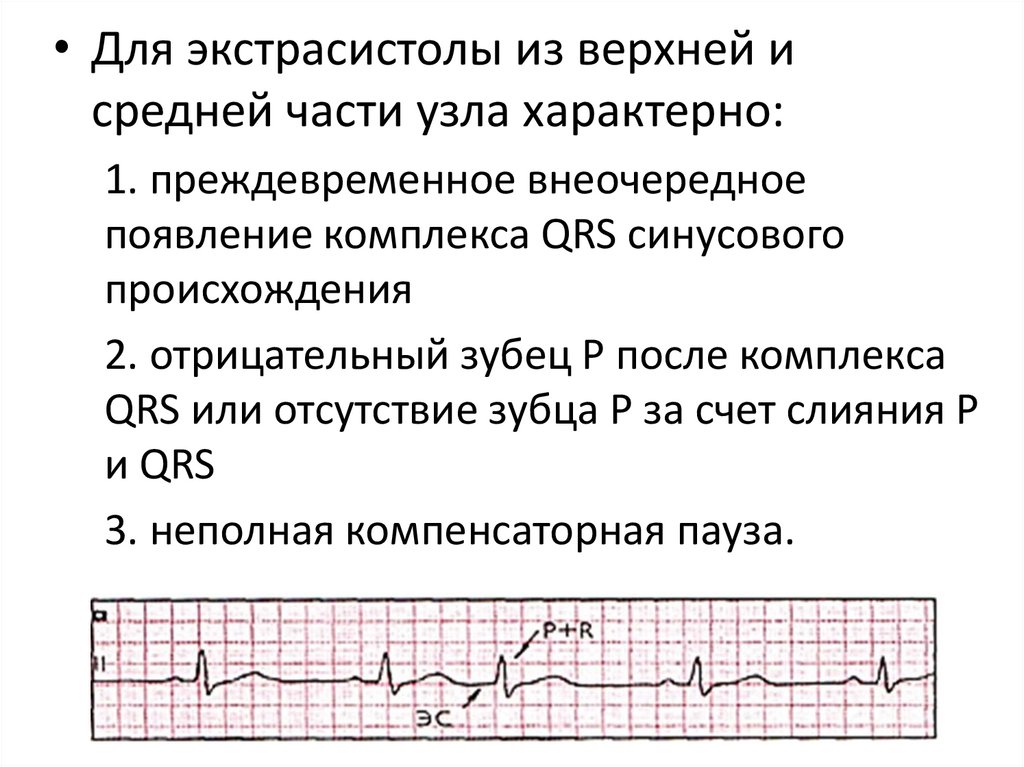
• Для экстрасистолы из верхней исредней части узла характерно:
1. преждевременное внеочередное
появление комплекса QRS синусового
происхождения
2. отрицательный зубец Р после комплекса
QRS или отсутствие зубца Р за счет слияния Р
и QRS
3. неполная компенсаторная пауза.
120.
• Для экстрасистолы из нижней части AV узлахарактерно:
1. отрицательный зубец Р, который следует за
комплексом QRS;
2. полная компенсаторная пауза, как и при
желудочковой экстрасистоле.
121.
Полная компенсаторная пауза – пауза,возникающая после желудочковой
экстрасистолы, длительность которой равна
удвоенному интервалу R-R основного ритма.
122.
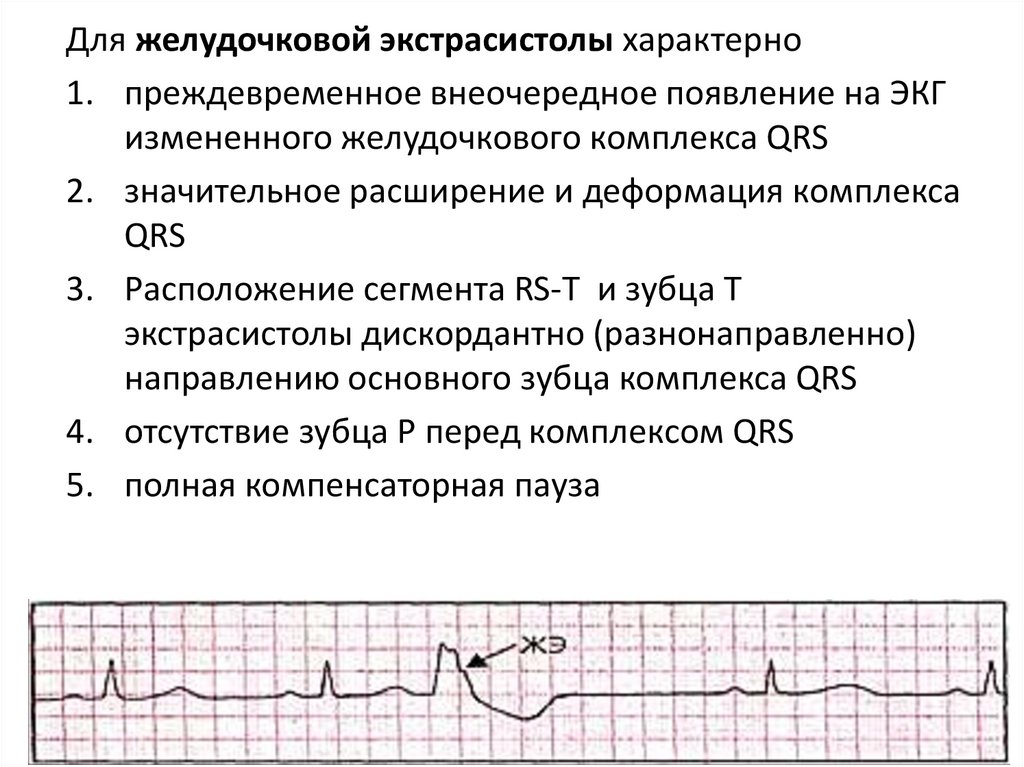
Для желудочковой экстрасистолы характерно1. преждевременное внеочередное появление на ЭКГ
измененного желудочкового комплекса QRS
2. значительное расширение и деформация комплекса
QRS
3. Расположение сегмента RS-T и зубца Т
экстрасистолы дискордантно (разнонаправленно)
направлению основного зубца комплекса QRS
4. отсутствие зубца Р перед комплексом QRS
5. полная компенсаторная пауза
123.
Под пароксизмальной тахикардиейпонимается внезапно возникающий приступ
резкого учащения сердечного ритма (до 180200 сокращений сердца в минуту), который
может длиться от нескольких секунд до
нескольких часов, и столь же резко
обрывающийся.
124.
Причины: электрическая негомогенностьразличных участков сердца и его проводящей
системы, возникающая в результате
1. органических повреждений сердечной
мышцы при остром ИМ, хронической ИБС,
миокардитах и т.д.,
2. наличия дополнительных аномальных
путей проведения (синдром WPW и др.),
3. выраженных вегетативно-гуморальных
расстройств у больных с НЦД.
125.
Механизмы:1. re-entry
2. повышение автоматизма клеток
эктопических центров 2 и 3 порядка.
В зависимости от локализации эктопического
очага повышенного автоматизма или
постоянно циркулирующей волны
возбуждения различают
• предсердную,
• атриовентрикулярную
• желудочковую форму ПТ.
126.
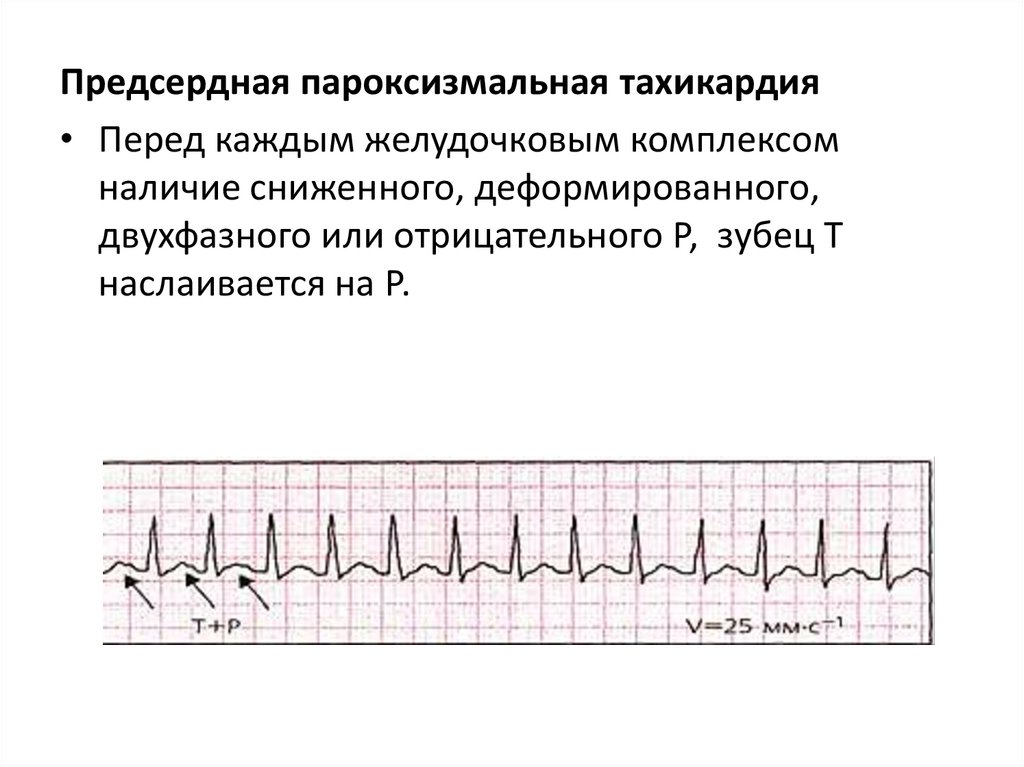
Предсердная пароксизмальная тахикардия• Перед каждым желудочковым комплексом
наличие сниженного, деформированного,
двухфазного или отрицательного Р, зубец Т
наслаивается на Р.
127.
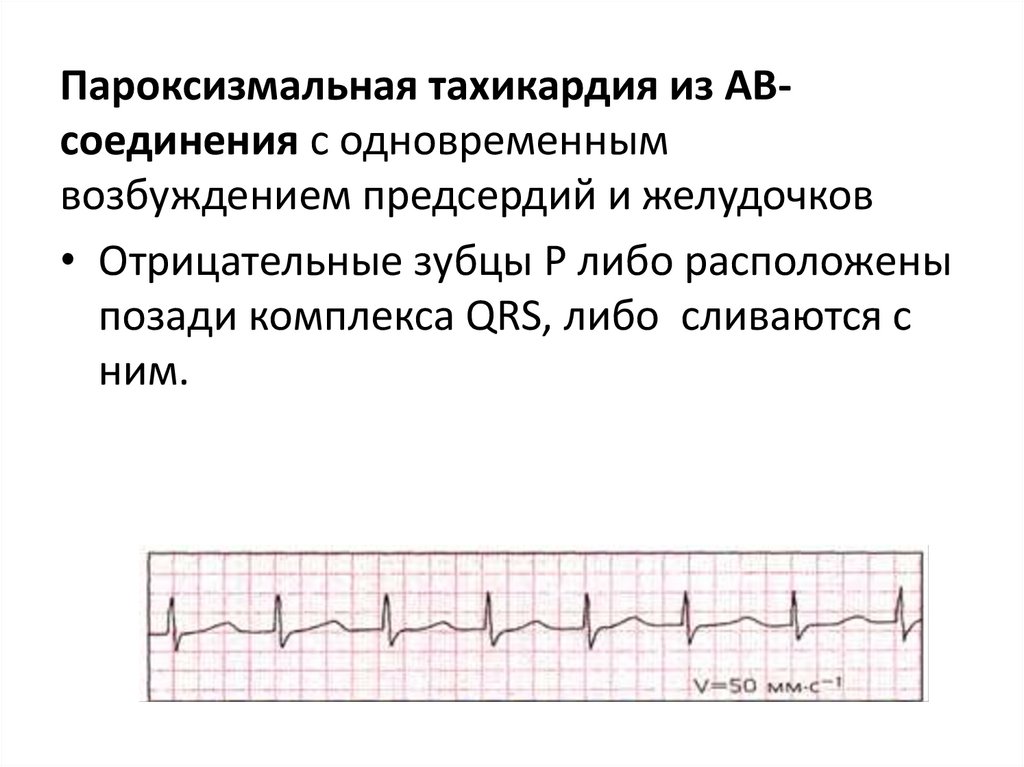
Пароксизмальная тахикардия из АВсоединения с одновременнымвозбуждением предсердий и желудочков
• Отрицательные зубцы Р либо расположены
позади комплекса QRS, либо сливаются с
ним.
128.
Желудочковая пароксизмальная тахикардия• Деформация и расширение комплекса QRS с
дискордантным расположением R и T
• Наличие АВ-диссоциации – полного разобщения
частого ритма желудочков и нормального ритма
предсердий с редкими одиночными
неизмененными комплексами QRST синусового
происхождения («захваченные» сокращения
желудочков).
129.
Трепетание предсердий.Механизм:
1. re-entry
2. повышение автоматизма клеток эктопических
центров 2 и 3 порядка.
Причины:
ревматизм, миокардиты, митральные пороки
сердца, острый ИМ, хроническая ИБС, фиброзные
изменения в области СА-узла, дилатация
предсердий, интоксикация препаратами хинидина,
наперстянки.
130.
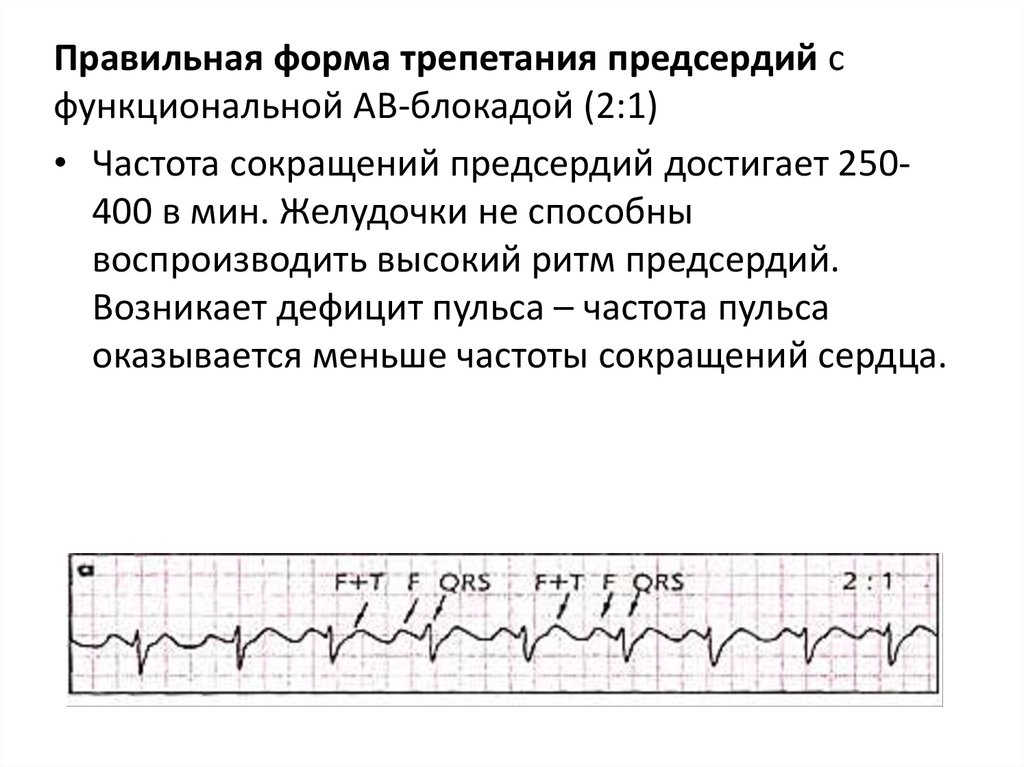
Правильная форма трепетания предсердий сфункциональной АВ-блокадой (2:1)
• Частота сокращений предсердий достигает 250400 в мин. Желудочки не способны
воспроизводить высокий ритм предсердий.
Возникает дефицит пульса – частота пульса
оказывается меньше частоты сокращений сердца.
131.
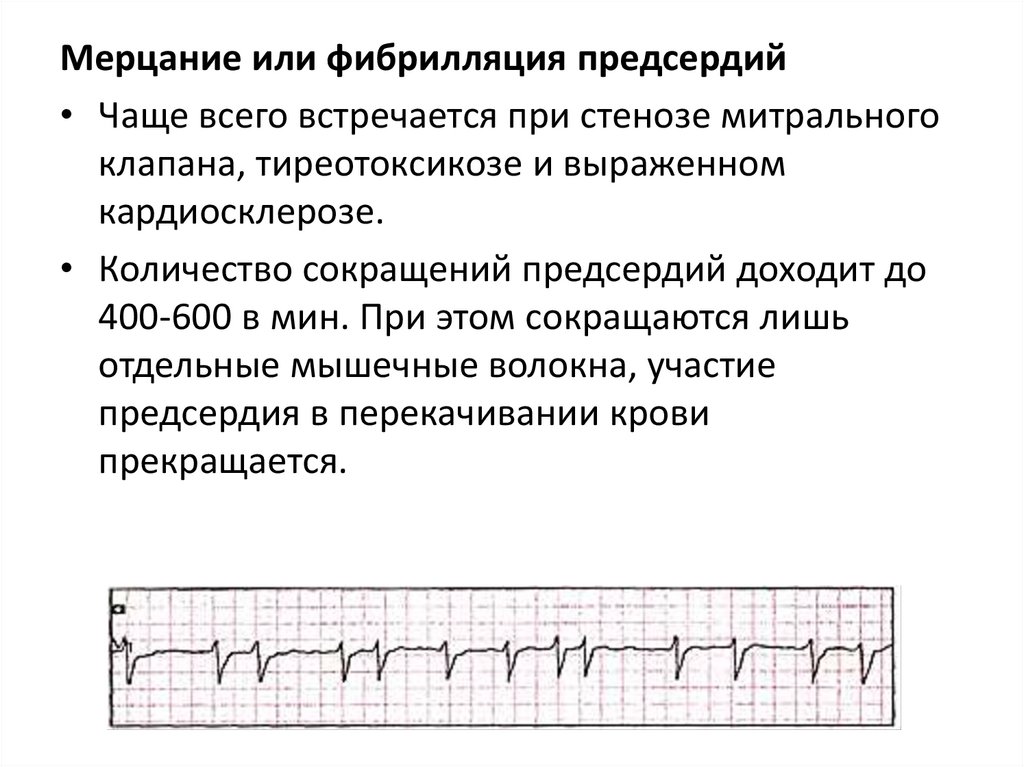
Мерцание или фибрилляция предсердий• Чаще всего встречается при стенозе митрального
клапана, тиреотоксикозе и выраженном
кардиосклерозе.
• Количество сокращений предсердий доходит до
400-600 в мин. При этом сокращаются лишь
отдельные мышечные волокна, участие
предсердия в перекачивании крови
прекращается.
132.
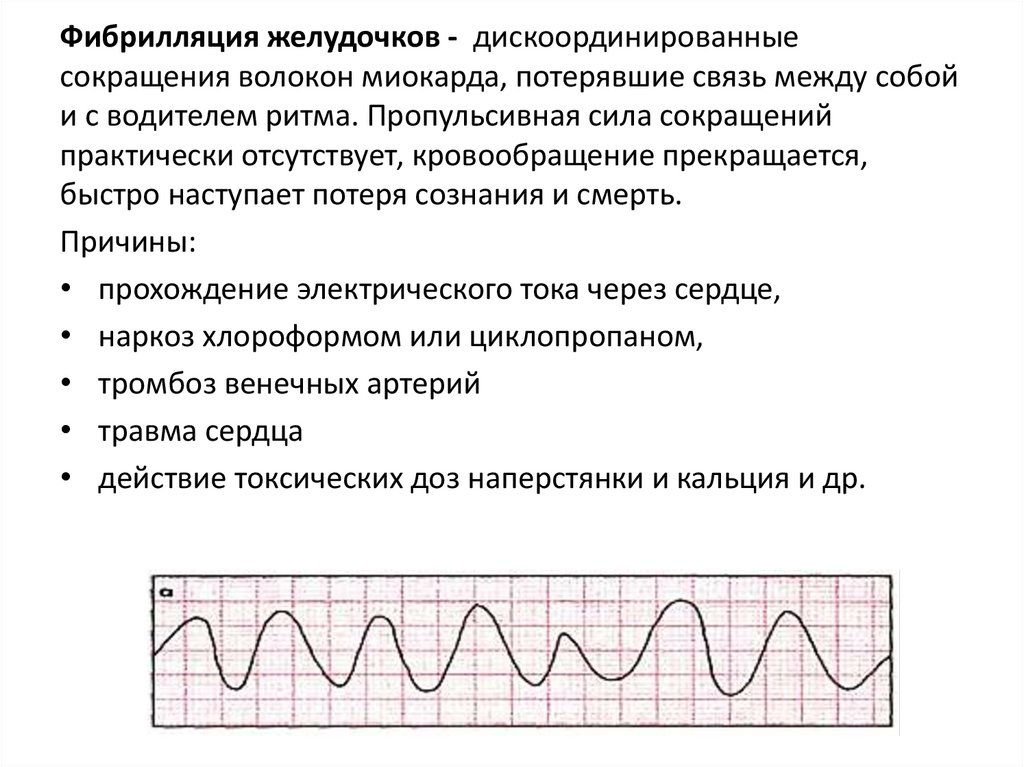
Фибрилляция желудочков - дискоординированныесокращения волокон миокарда, потерявшие связь между собой
и с водителем ритма. Пропульсивная сила сокращений
практически отсутствует, кровообращение прекращается,
быстро наступает потеря сознания и смерть.
Причины:
• прохождение электрического тока через сердце,
• наркоз хлороформом или циклопропаном,
• тромбоз венечных артерий
• травма сердца
• действие токсических доз наперстянки и кальция и др.
133.
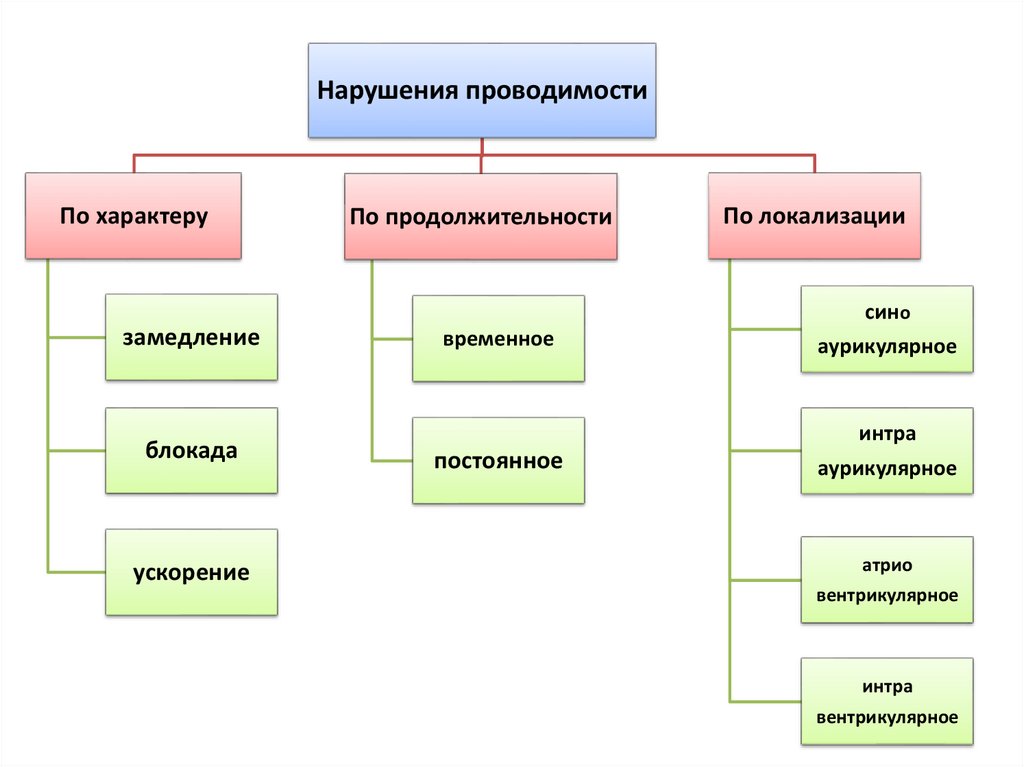
Нарушения проводимостиПо характеру
По продолжительности
По локализации
сино
замедление
блокада
ускорение
временное
аурикулярное
интра
постоянное
аурикулярное
атрио
вентрикулярное
интра
вентрикулярное
134.
Замедление и блокада проведения импульсов возбуждения развиваются в результате действияследующих основных факторов:
• повышения парасимпатических влияний на сердце и (или)
его холинореактивности, что существенно замедляет скорость «пробега» волны возбуждения по проводящей
системе, особенно на уровне атриовентрикулярного узла
(отрицательный дромотропный эффект ацетилхолина);
• непосредственного повреждения клеток проводящей
системы сердца
– некроз, кровоизлияние, операционные
(кардиохирургические) травмы, опухоли, соединительнотканные рубцы, перерастяжение сердечной
мышцы
– интоксикация алкоголем, никотином, медикаментами
(препаратами наперстянки, хинидина, блокаторами бетаадренорецепторов и др.);
– действие бактериальных ядов (при дифтерии, скарлатине,
брюшном тифе), вирусной инфекции;
– гиперкалиемия
135.
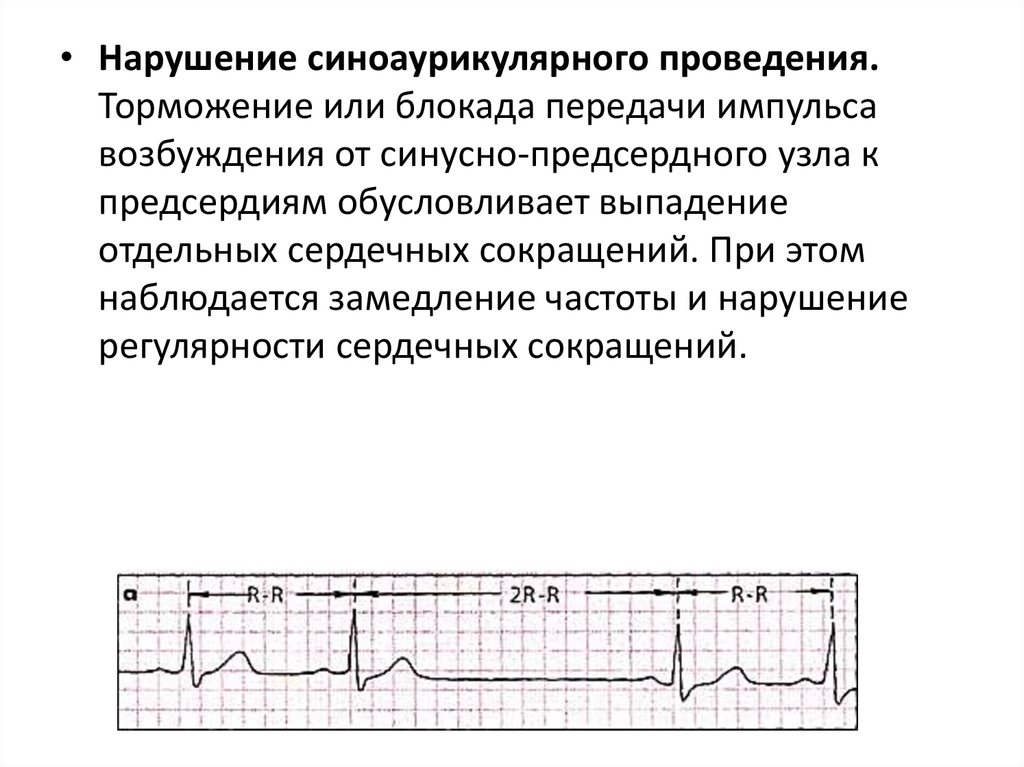
• Нарушение синоаурикулярного проведения.Торможение или блокада передачи импульса
возбуждения от синусно-предсердного узла к
предсердиям обусловливает выпадение
отдельных сердечных сокращений. При этом
наблюдается замедление частоты и нарушение
регулярности сердечных сокращений.
136.
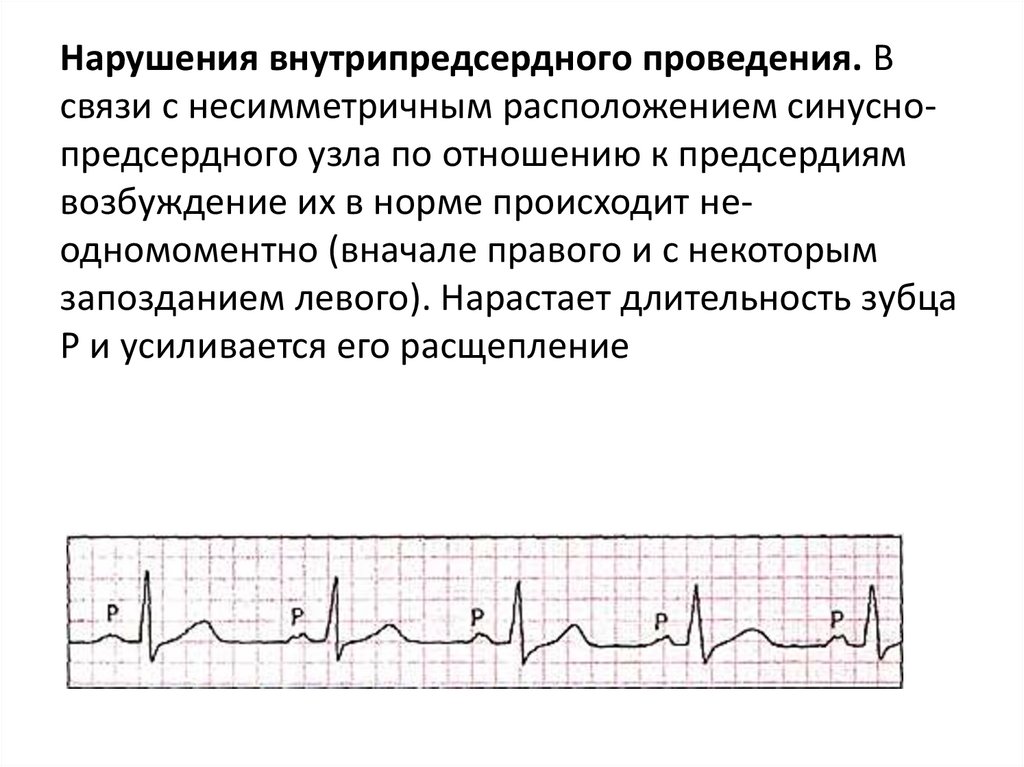
Нарушения внутрипредсердного проведения. Всвязи с несимметричным расположением синуснопредсердного узла по отношению к предсердиям
возбуждение их в норме происходит неодномоментно (вначале правого и с некоторым
запозданием левого). Нарастает длительность зубца
Р и усиливается его расщепление
137.
Предсердно-желудочковая блокада I степенихарактеризуется:
А)
– удлинение интервала Р–Q более чем на 0,2 с.
– длительность Р нормальная
138.
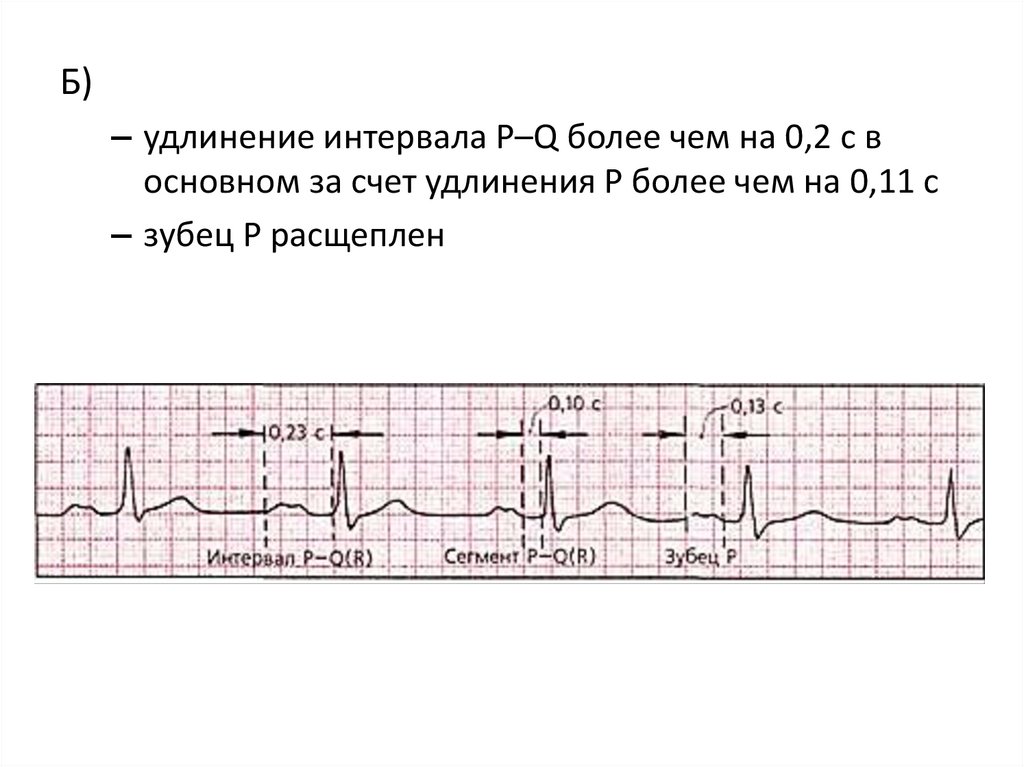
Б)– удлинение интервала Р–Q более чем на 0,2 с в
основном за счет удлинения Р более чем на 0,11 с
– зубец Р расщеплен
139.
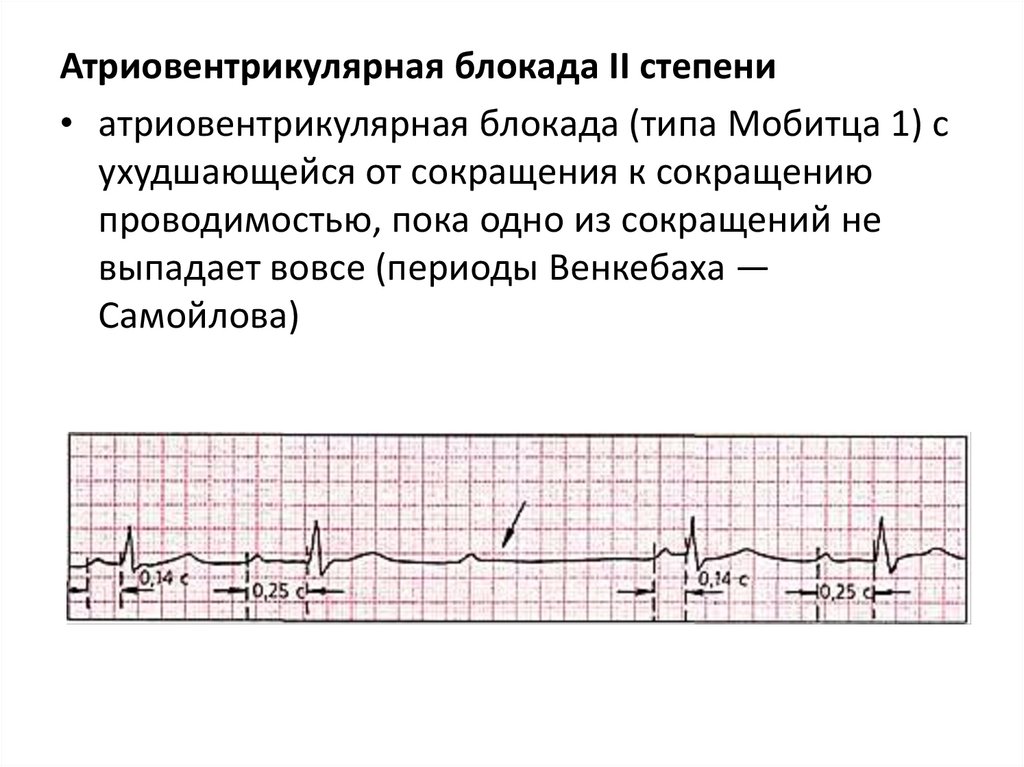
Атриовентрикулярная блокада II степени• атриовентрикулярная блокада (типа Мобитца 1) с
ухудшающейся от сокращения к сокращению
проводимостью, пока одно из сокращений не
выпадает вовсе (периоды Венкебаха —
Самойлова)
140.
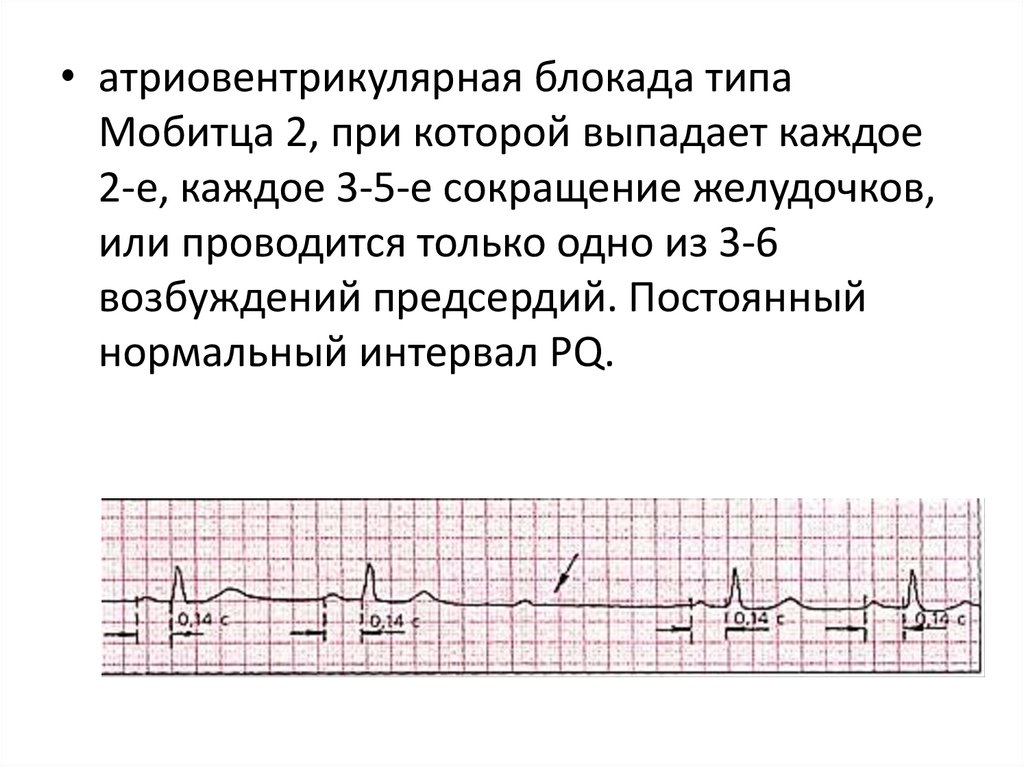
• атриовентрикулярная блокада типаМобитца 2, при которой выпадает каждое
2-е, каждое 3-5-е сокращение желудочков,
или проводится только одно из 3-6
возбуждений предсердий. Постоянный
нормальный интервал PQ.
141.
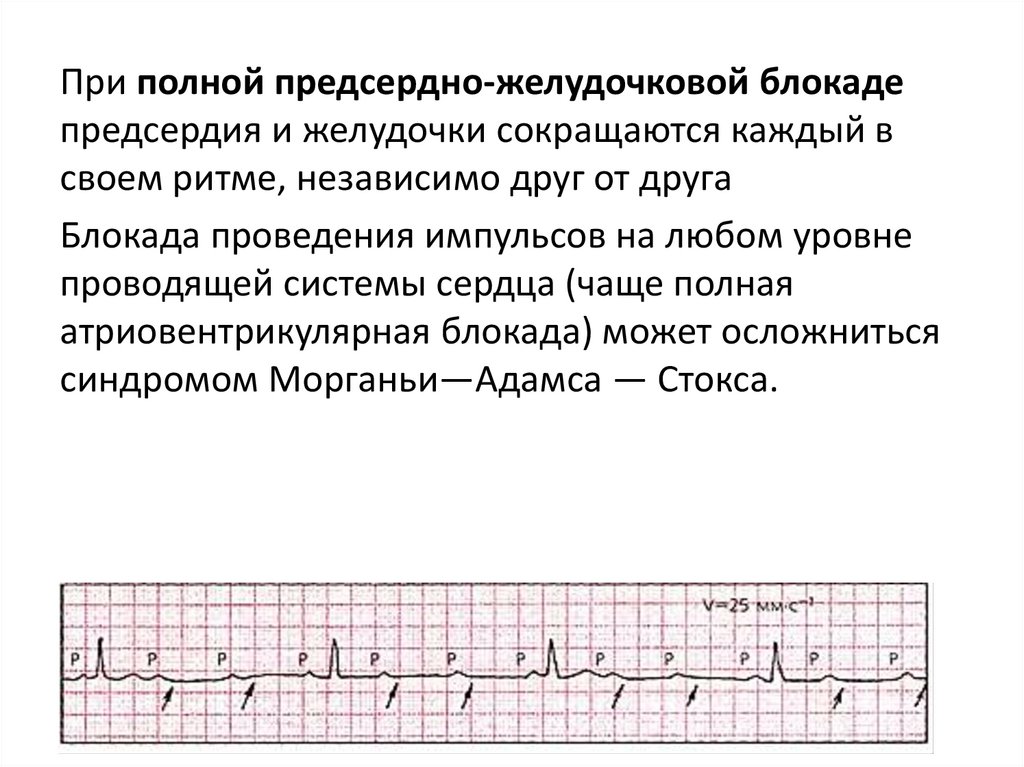
При полной предсердно-желудочковой блокадепредсердия и желудочки сокращаются каждый в
своем ритме, независимо друг от друга
Блокада проведения импульсов на любом уровне
проводящей системы сердца (чаще полная
атриовентрикулярная блокада) может осложниться
синдромом Морганьи—Адамса — Стокса.
142.
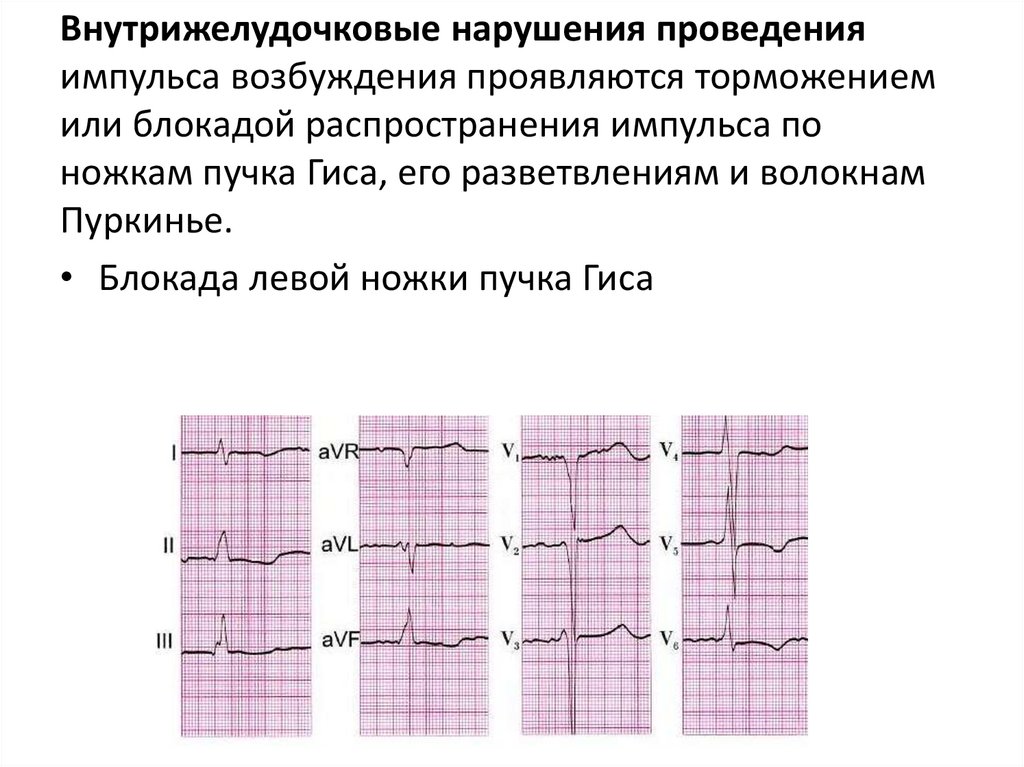
Внутрижелудочковые нарушения проведенияимпульса возбуждения проявляются торможением
или блокадой распространения импульса по
ножкам пучка Гиса, его разветвлениям и волокнам
Пуркинье.
• Блокада левой ножки пучка Гиса
143.
Ускорение проведения возбужденияхарактеризуется развитием синдрома Вольфа—
Паркинсона — Уайта (синдром WPW). Врожденна
аномалия, но клинически может проявиться в
любом возрасте, спонтанно или после какого-либо
заболевания.
144.
Механизм синдрома WPW.• Сразу после деполяризации предсердий
электрический импульс проводится по
аномальному пучку Кента и вызывает
активацию части миокарда одного из
желудочков. Остальные участки желудочков
возбуждаются за счет импульса,
распространяющего по обычному пути.
145.
Принципы терапии нарушений ритма сердца.1. Этиотропный – направлен на устранение или
снижение патогенного эффекта причин аритмий –
лечение нарушений коронарного кровотока,
микардиодистрофий, интоксикаций и т.д.
2. Патогенетический
– Коррекция механизмов энергообеспечения
– Устранение альтерации мембран и ферментов миокарда
– Уменьшение степени дисбаланса ионов
Для этого назначают препараты аденозина, органические
нитраты, мембраностабилизаторы, средства, блокирующие
ионные каналы кардиомиоцитов, бета-адреноблокаторы и др.
3. Симптоматическая терапия – устранение болей,
страха смерти и т.д.






















































































 medicine
medicine