Similar presentations:
Хлор. Общая характеристика галогенов на основе строения их атомов
1.
Хлор2.
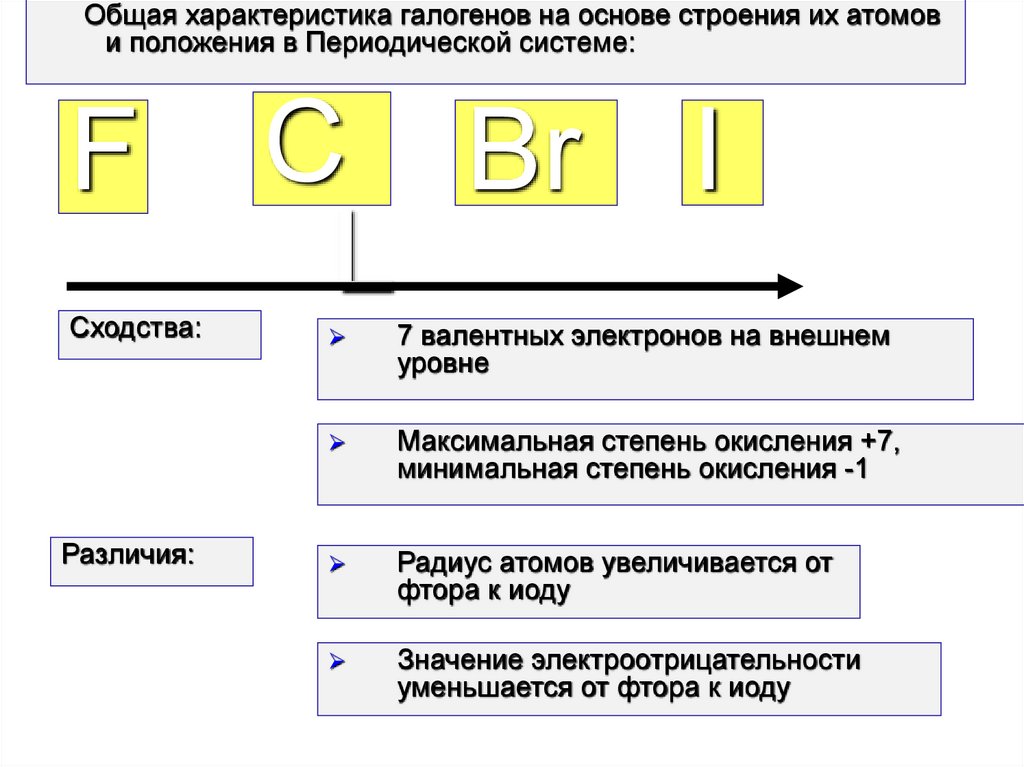
Общая характеристика галогенов на основе строения их атомови положения в Периодической системе:
F
Сходства:
Различия:
C Br I
L
7 валентных электронов на внешнем
уровне
Максимальная степень окисления +7,
минимальная степень окисления -1
Радиус атомов увеличивается от
фтора к иоду
Значение электроотрицательности
уменьшается от фтора к иоду
3.
Cl + ClCl
Cl Cl
Cl
Молекула двухатомная.
Тип связи – ковалентная неполярная.
Кристаллическая решетка – молекулярная.
Какие физические свойства можно предположить?
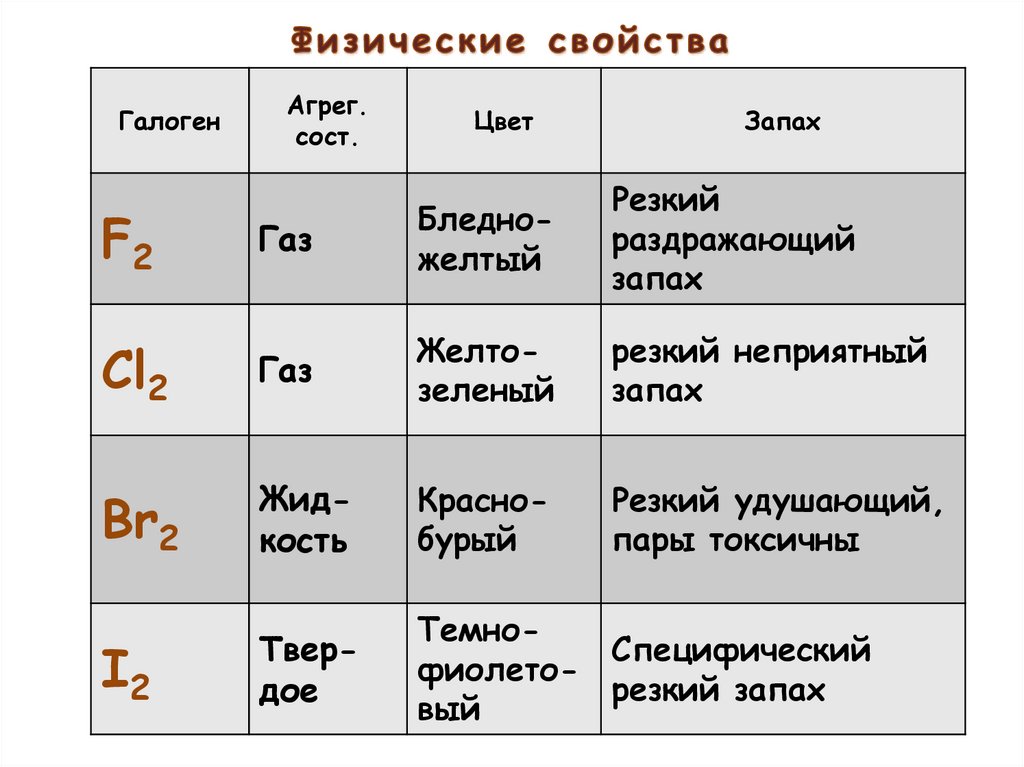
4.
ГалогенАгрег.
сост.
Цвет
Запах
Газ
Бледножелтый
Резкий
раздражающий
запах
Cl2
Газ
Желтозеленый
резкий неприятный
запах
Br2
Жидкость
Краснобурый
Резкий удушающий,
пары токсичны
I2
Твердое
ТемноСпецифический
фиолеторезкий запах
вый
F2
5. 1. кислородом (кроме фтора) 2. оксидами 3. кислотами 4. с солями за исключением галагенидов.
Галаген не реагируют с :1. кислородом (кроме фтора)
2. оксидами
3. кислотами
4. с солями за исключением
галагенидов.
6.
1. Взаимодействие с металлами.При взаимодействии галогенов с металлами
образуются соли – галогениды.
Zn + F2 = ZnF2
фторид цинка
2Fe + 3Cl2 − 2FeCl3 хлорид железа
2Al + 3Br2 − 2AlBr3
бромид алюминия
2Al + 3I2 − 2AlI3
йодид алюминия
7.
2. Взаимодействие с водородом.При взаимодействии галогенов с водородом
образуются галогеноводороды (при растворении в
воде галогеноводороды образуют кислоты)
H2 + F2 − 2HF
H2 + Cl2 − 2HCl
фтороводород (со взрывом)
хлороводород (со взрывом при
ярком солнечном освещении)
H2 + Br2 − 2HBr бромоводород (при нагревании)
H2 + I2 − 2HI
иодоводород (при нагревании,
медленно)
8.
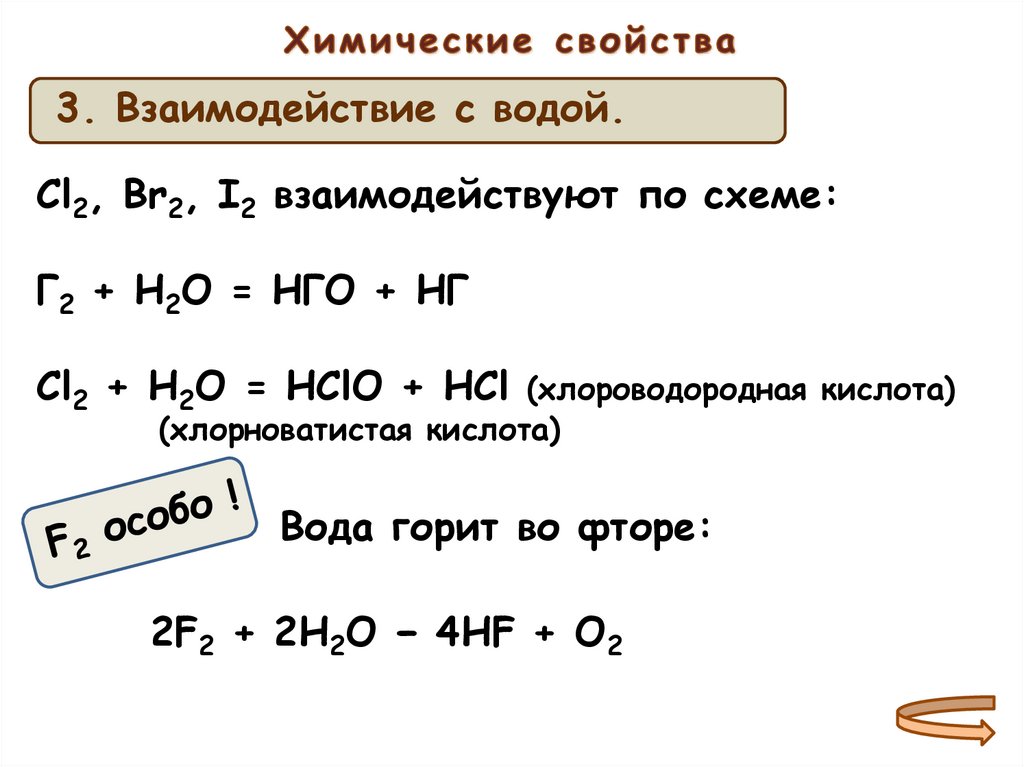
3. Взаимодействие с водой.Cl2, Br2, I2 взаимодействуют по схеме:
Г2 + H2O = HГО + НГ
Cl2 + H2O = HClO + HCl (хлороводородная кислота)
(хлорноватистая кислота)
Вода горит во фторе:
2F2 + 2H2O − 4HF + O2
9.
4. Взаимодействие со сложными веществами.Более активный галоген вытесняет менее активный из
растворов солей.
F2 > Cl2 > Br2 > I2 активность уменьшается
2КBr + Cl2 − 2KCl + Br2
Почему для этой реакции не используют фтор?






 chemistry
chemistry








