Similar presentations:
Азотная кислота и ее соли. Физические свойства
1.
Азотная кислота и еесоли.
2.
Физические свойства:• дымится на воздухе
• с едким запахом
• кипит при температуре 860С, а при -410С
превращается в твердую кристаллическую
массу
• гигроскопична и хорошо растворима
• бесцветная жидкость (концентрированная
азотная кислота окрашена в желтый цвет)
!!! Хранят в бутылках из темного
стекла в прохладных и темных местах.
3.
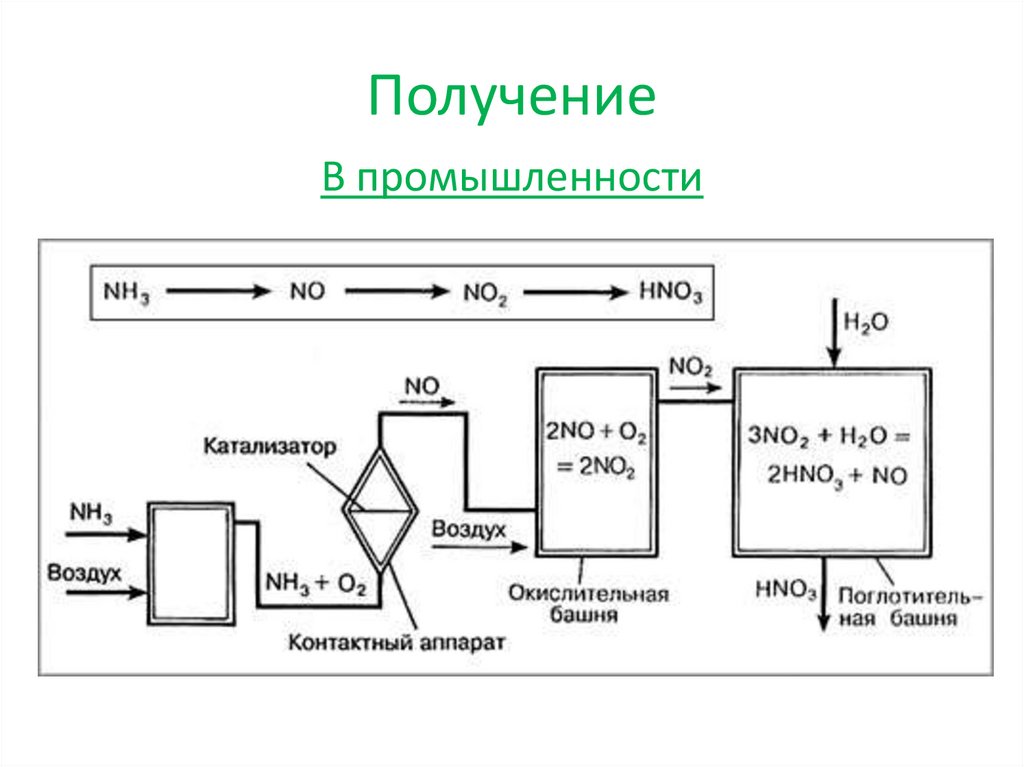
ПолучениеВ промышленности
4.
В лабораторииИз калийной или натриевой селитры
KNO3(тв.) + H2SO4(kонц.) → HNO3 + KHSO4
t
2KNO3(тв.) + H2SO4(kонц.) → HNO3 + K 2SO4
5.
Специфические химическиесвойства
1) Разложение (при комнатной температуре).
4HNO3 → 2H2O + 4NO2 + O2↑
2) Окисление неметаллов (S, C, P)
C + 4HNO3(конц. , гор. ) = CO2 + 4NO2 + 2H2O
3) Окисление сложных веществ
6HI + 2HNO3 = 3I2 + 2NO + 4H2O
FeS + 12HNO3 = Fe(NO3)3 + H2SO4 + 9NO2 + 5H2O
6.
4) С металлами7.
8.
Соли азотной кислоты в природе:
KNO3 – нитрат калия (индийская селитра)
NаNО3 – нитрат натрия (чилийская селитра)
Са(NО3)2 – нитрат кальция (норвежская
селитра)
Физические свойства:
Хорошо растворимые ионные соединения.
При обычных условиях – кристаллические
вещества.
Сильные электролиты.
9.
Специфическое химическоесвойство – термическое разложение
1)
Нитраты металлов левее Mg
(исключение - нитрат лития) до нитритов:
2NaNO3 = 2NaNO2 + O2
2КNO3 = 2KNO2 + O2
2) Нитраты металлов от Mg до Cu до оксида
азота (IV)
2Mg(NO3)2 = 2MgO + 4NO2 + O2
2Cu(NO3)2 =2CuO + 4NO2+ O2
10.
Специфические химическиесвойства
3)
Нитраты металлов правее меди :
Hg(NO3)2 = Hg + 2NO2 + O2
2AgNO3 = 2Ag + 2NO2 + O2
4) Нитрат и нитрит аммония в зависимости от
температуры так:
NH4NO3 = N2O ↑+ 2H2O (190-245°C)
2NH4NO3 = N2↑ + 2NO + 4H2O (250-300°C)
2NH4NO3 = 2N2 ↑+ O2 + 4H2O (выше 300°C)
Нитрит аммония:
NH4NO2 = N2 ↑+ 2H2O









 chemistry
chemistry








