Similar presentations:
Карбоновые кислоты
1. Урок 10ф класса
28.03.20162.
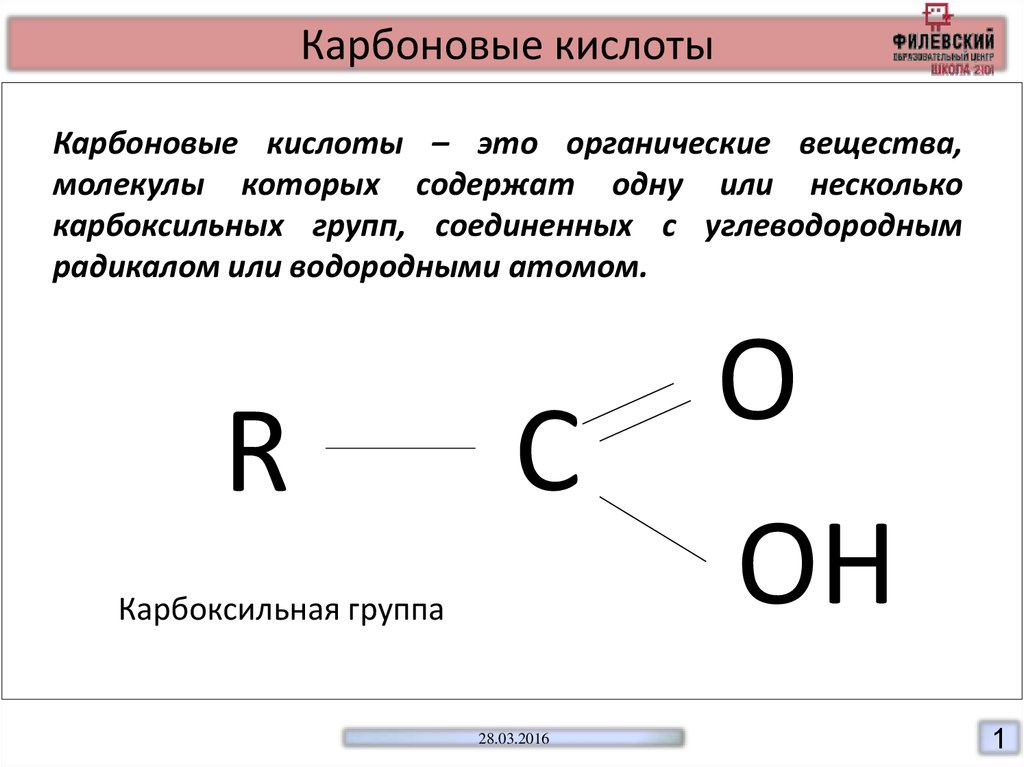
Карбоновые кислотыКарбоновые кислоты – это органические вещества,
молекулы которых содержат одну или несколько
карбоксильных групп, соединенных с углеводородным
радикалом или водородными атомом.
R
0
С
Карбоксильная группа
28.03.2016
О
ОН
1
3.
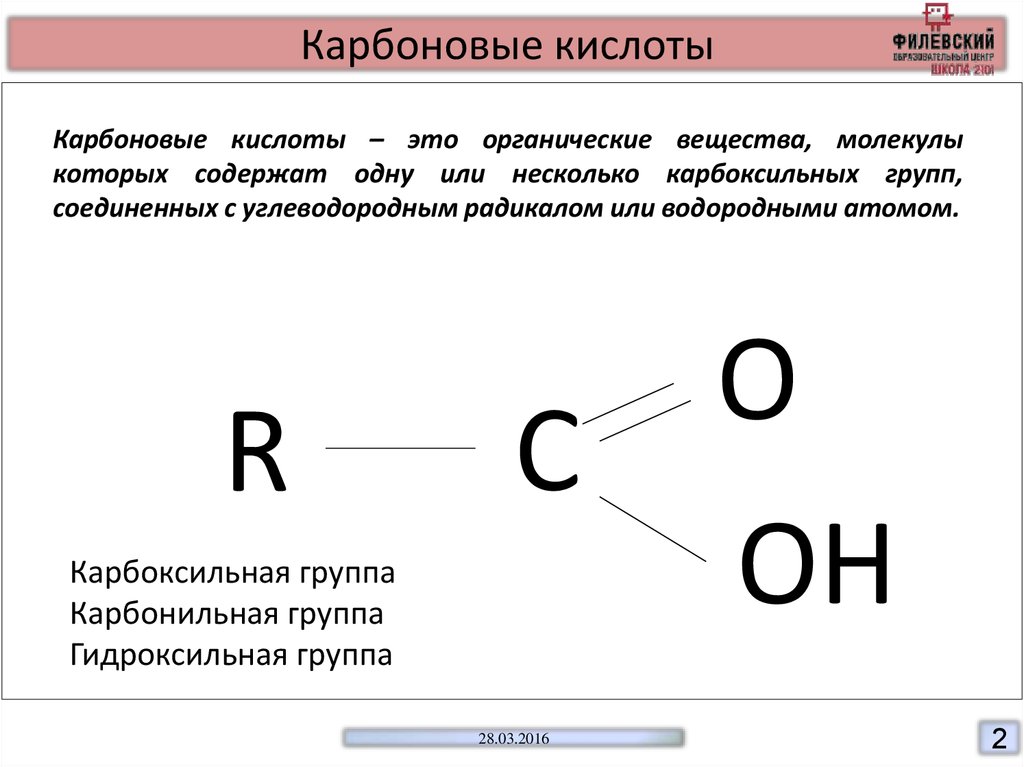
Карбоновые кислотыКарбоновые кислоты – это органические вещества, молекулы
которых содержат одну или несколько карбоксильных групп,
соединенных с углеводородным радикалом или водородными атомом.
R
0
С
Карбоксильная группа
Карбонильная группа
Гидроксильная группа
28.03.2016
О
ОН
2
4.
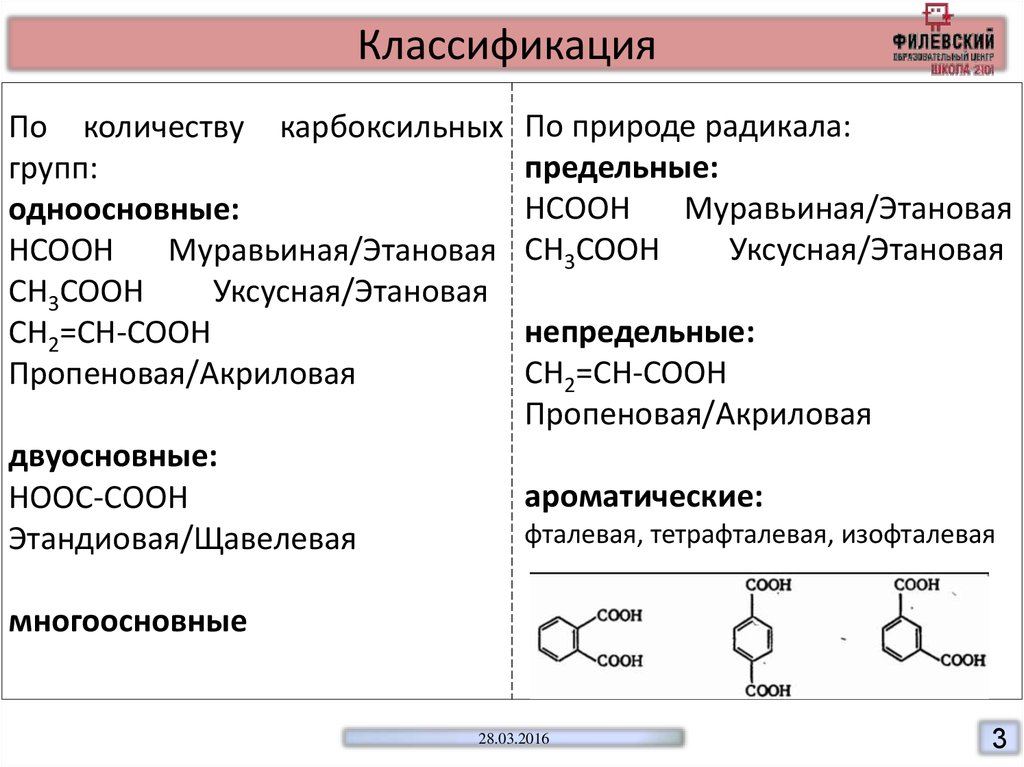
КлассификацияПо количеству карбоксильных
групп:
одноосновные:
HCOOH
Муравьиная/Этановая
CH3COOH
Уксусная/Этановая
CH2=CH-COOH
Пропеновая/Акриловая
двуосновные:
HOOC-COOH
Этандиовая/Щавелевая
По природе радикала:
предельные:
HCOOH
Муравьиная/Этановая
CH3COOH
Уксусная/Этановая
непредельные:
CH2=CH-COOH
Пропеновая/Акриловая
ароматические:
фталевая, тетрафталевая, изофталевая
многоосновные
28.03.2016
3
5.
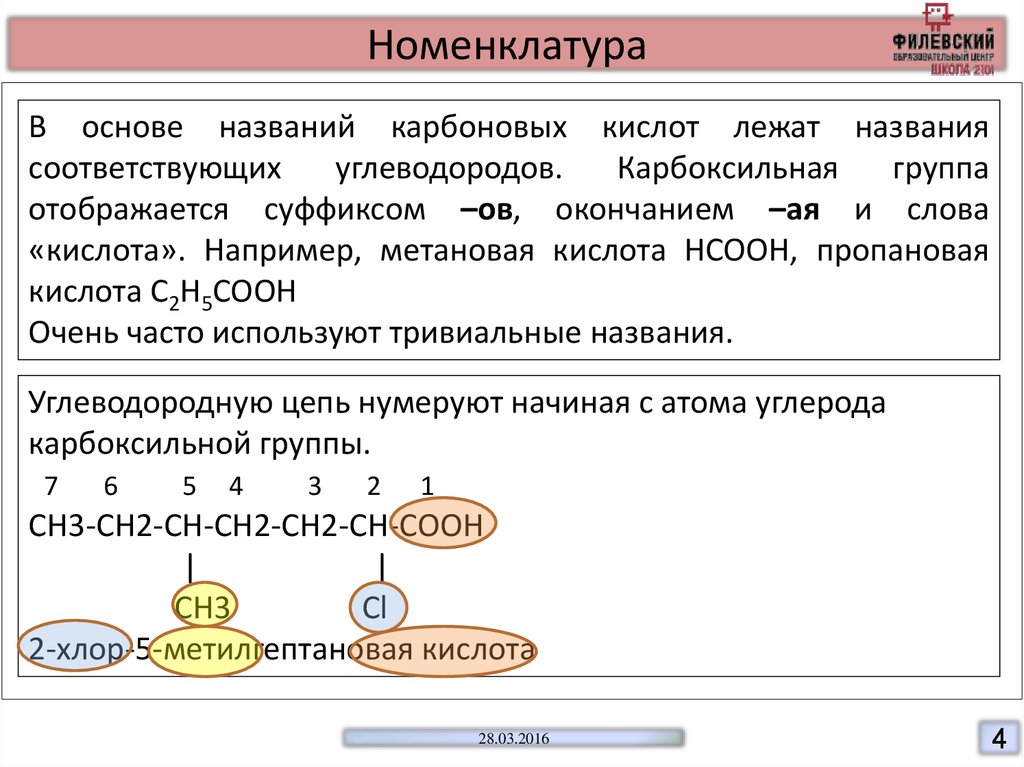
НоменклатураВ основе названий карбоновых кислот лежат названия
соответствующих
углеводородов.
Карбоксильная
группа
отображается суффиксом –ов, окончанием –ая и слова
«кислота». Например, метановая кислота HCOOH, пропановая
кислота C2H5COOH
Очень часто используют тривиальные названия.
Углеводородную цепь нумеруют начиная с атома углерода
карбоксильной группы.
7
6
5
4
3
2
1
СН3-СН2-СН-СН2-СН2-СН-СООН
|
|
CH3
Cl
2-хлор-5-метилгептановая кислота
28.03.2016
4
6.
Изомерия1. Изомерия углеродной цепи. Начинается с бутановой
(масляной) кислоты: масляная кислота, изомасляная кислота.
2. Изомерия положения кратной связи. Бутен-3-овая кислота и
бутен-2-овая кислота.
3. Цис-транс-изомерия
4. Межклассовая изомерия. Масляной кислоте изомерны
метиловый эфир пропановой кисолты и этиловый эфир
уксусной кислоты.
28.03.2016
5
7.
Способы полученияКарбоновые кислоты, можно получить из их солей действуя на них
серной кислотой при нагревании:
2СН3
С
O
O - Na
+ H2SO4
2СН3
С
O
O-H
+ Na2SO4
Окисление первичных спиртов – общий способ. В качестве
окислителей применяют KMnO4 и K2Cr2O7
Гидролиз галогензамещённых углеводородов, содержащих три
атома галогена у одного атома углерода.
R-CCl3 -> R-COOH + H2O
28.03.2016
6
8.
Химические свойства кислот1. Карбоновые кислоты более сильные кислоты, чем спирты.
RCOOH
RCOO- + H+
2. Из одноосновных карбоновых кислот муравьиная кислота
является самой сильной.
3. Муравьиная кислота легко окисляется (реакция «серебряного
зеркала»).
HCOOH + Ag2O 2Ag +
4. При нагревании с концентрированной серной кислотой
муравьиная кислота отщепляет воду и образуется оксид
углерода (II)
HCOOH -> H2O + CO
28.03.2016
7
9.
Химические свойства кислот5. Образование солей.
2RCOOH + Mg --> (RCOO)2Mg + H2
2RCOOH + CaO --> (RCOO)2Ca + H2O
RCOOH + NaOH --> RCOONa + H2O
RCOOH + NaHCO3 --> RCOONa + H2O + CO2
6. Минеральные кислоты вытесняют карбоновые из солей.
CH3COONa + HCl --> CH3COOH + NaCl
28.03.2016
8
10.
Муравьиная кислотаМуравьиная кислота HCOOH названа по кислоте содержащийся
в выделениях муравьев. Более того, впервые была выделена
Джоном Рэйем из рыжих лесных муравьев в 1671 году.
Она широко применяется в фармацевтической и пищевой
промышленности.
Её можно получить путём нагревания окисда углерода (II) с
порошкообразным гидроксидом натрия под давлением и
обработкой.
200C
H2SO4
NaOH + CO HCOONa HCOOH
28.03.2016
9






 chemistry
chemistry








