Similar presentations:
Основания как электролиты
1. Основания как электролиты.
Задачи:Рассмотреть классификацию
оснований, их физические и
химические свойства.
2. Выполните задания.
1.2.
3.
4.
5.
1.
2.
Напишите уравнения реакций:
Азотная кислота + оксид кальция;
Соляная кислота + силикат натрия;
Фосфорная кислота + гидроксид калия;
Бромоводородная кислота + нитрат серебра;
Железо + соляная кислота.
Почему следующие реакции не идут?
Сульфат меди + соляная кислота;
Хлорид цинка + азотная кислота.
3. Понятие оснований.
Основания с точки зрения ТЭД –это электролиты, которые в
водных растворах диссоциируют
на катионы металла и гидроксид анионы.
NaOH ↔ Na+ + OH2+
Ba(OH)2 ↔ Ba + 2OH
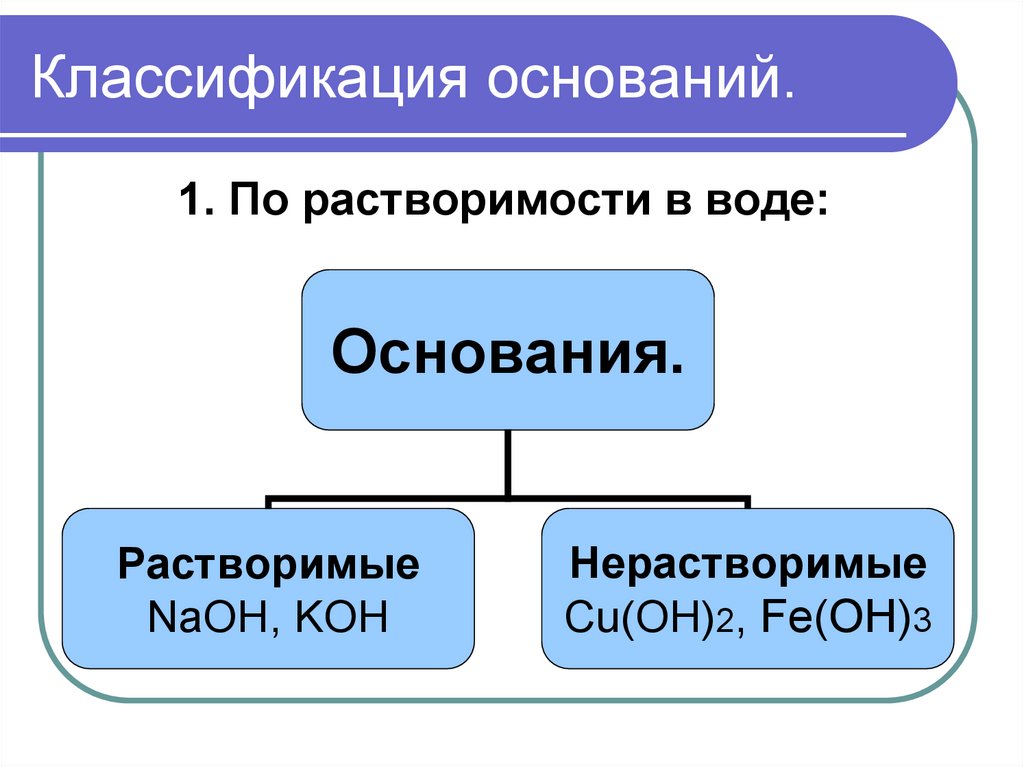
4. Классификация оснований.
1. По растворимости в воде:Основания.
Растворимые
NaOH, KOH
Нерастворимые
Сu(OH)2, Fe(OH)3
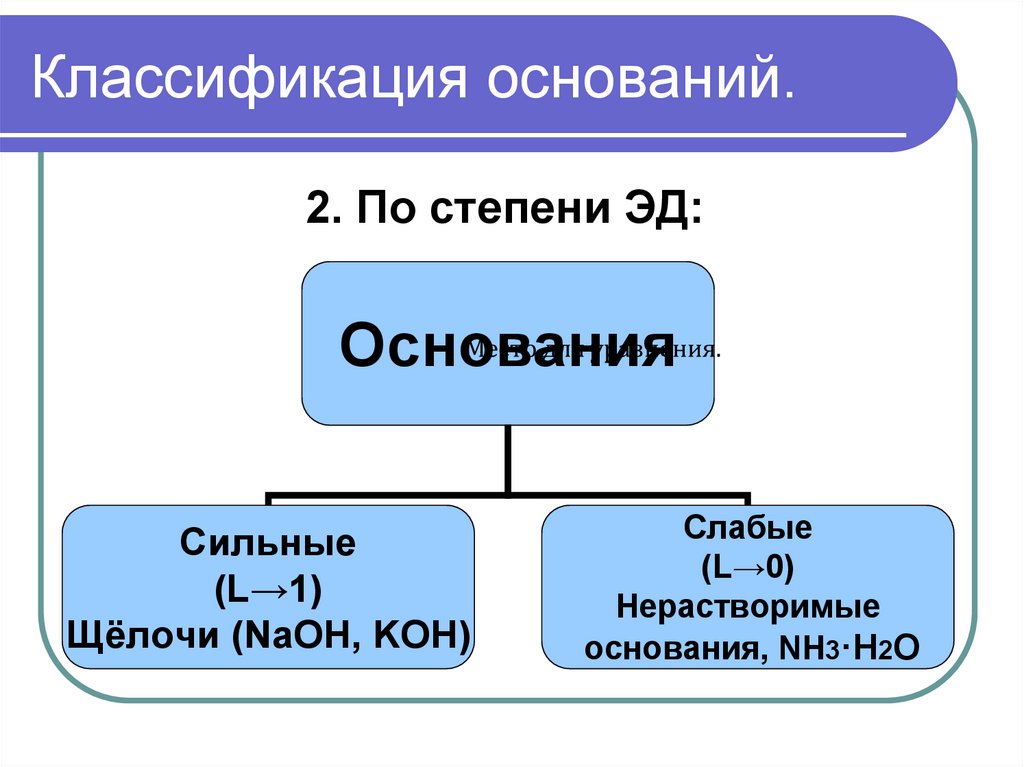
5. Классификация оснований.
2. По степени ЭД:Основания
Сильные
(L→1)
Щёлочи (NaOH, KOH)
Слабые
(L→0)
Нерастворимые
основания, NH3·H2O
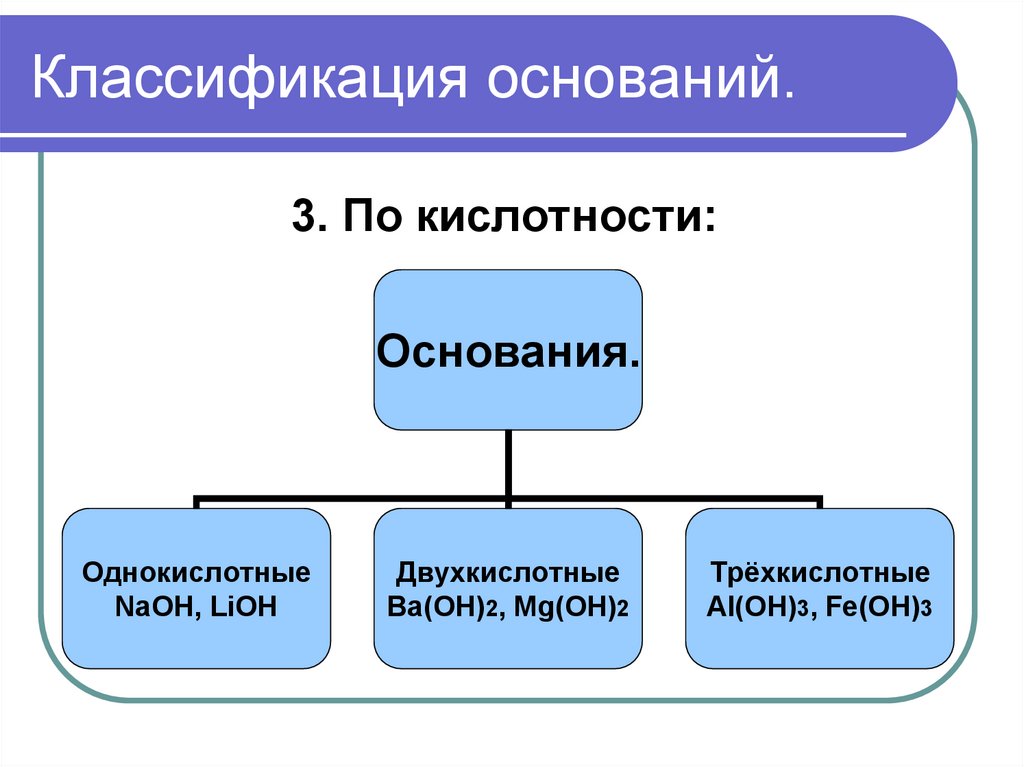
6. Классификация оснований.
3. По кислотности:Основания.
Однокислотные
NaOH, LiOH
Двухкислотные
Ba(OH)2, Mg(OH)2
Трёхкислотные
Al(OH)3, Fe(OH)3
7. Физические свойства.
Все основания, кроме NH3·H2O –твёрдые вещества, имеющие
различную окраску. Мягкие на ощупь,
изменяют окраску индикаторов.
Фенолфталеин (бесцв.) + OH- →
→ малиновый
Лакмус фиолетовый + OH- → синий
Метилоранж + OH- → желтый
8. Химические свойства.
2. Вступают в реакцию нейтрализацииОснование + кислота → соль + вода
а) Щёлочи
2NaOH + H2SO4 → Na2SO4 + 2H2O
OH- + H+ → H2O
Б) Нерастворимые основания
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
Cu(OH)2 + 2H+ → Cu2++ 2H2O
9. Химические свойства.
3. Щёлочь+ кислотный оксид →→ соль + вода
Ca(OH)2 + CO2 → CaCO3 + Н2О
Ca2++2OH- + CO2 → CaCO3 + Н2О
10.
Химические свойства.4. Щёлочь + соль →
нерастворимое основание ↓+ новая
соль
2КОН + СuSO4 → Cu(OH)2↓ + K2SO4
2OH- + Cu2+ → Cu(OH)2↓
11. Химические свойства.
5. Нерастворимое основание (при t°С)→ оксид металла + вода
2Fe(OH)3 t°С Fe2O3 + 3H2O
Cu(OH)2 t°С CuO + H2O
12. Химические свойства.
Закрепление.1. Напишите уравнения реакций,
характеризующие химические
свойства гидроксида калия
2. Составьте молекулярные уравнения
реакций: Аl3+ + 3OH- → Al(OH)3↓
Сu2+ + 2OH- → Cu(OH)2↓
3.Найдите в учебнике ответ на вопрос :
Чем объясняется явление амфотерности?
Как его доказать практически?
13. Особые свойства оснований.
Домашнее заданиеЗаписи в тетради
В задачнике № 2-24, 2-37, 2-53 (д)
14. Закрепление.
Домашнее задание.§ 10, упр. 1,3 на стр. 43,
в задачнике № 2.30, 2.37











 chemistry
chemistry








