Similar presentations:
Основания. Классификация оснований (8 класс)
1. Основания.
Электронное пособие дляучащихся 8-го класса.
Ознакомление с классом
«Основания»
2. Определение
Основания – это сложные вещества,состоящие из атомов металлов и
одной или нескольких гидроксильных
групп (ОН).
Общая формула: Ме (ОН)n, где
n – валентность металла.
3. Классификация оснований
РастворимыеНерастворимые
NaOH
Mg(OH)2
LiOH
Cu(OH)2
KOH
Fe(OH)3
Ba(OH)2
Al(OH)3
Ca(OH)2
Zn(OH)2
Образуют только
активные металлы
Образуют все
остальные металлы
4. Составление химических формул оснований
1. Записывается металл игидроксильная группа (ОН).
2. Над металлом записывается
валентность. Валентность
гидроксильной группы равна I.
3. Количество гидроксильных групп
зависит от валентности металла.
4. Рядом с гидроксильной группой
записывается индекс, равный
валентности металла.
5. Построение формулы и названия основания
IIII
Сr(OH)3
Название: гидроксид хрома (III).
Если металл имеет постоянную
валентность, то валентность в
названии не указывается.
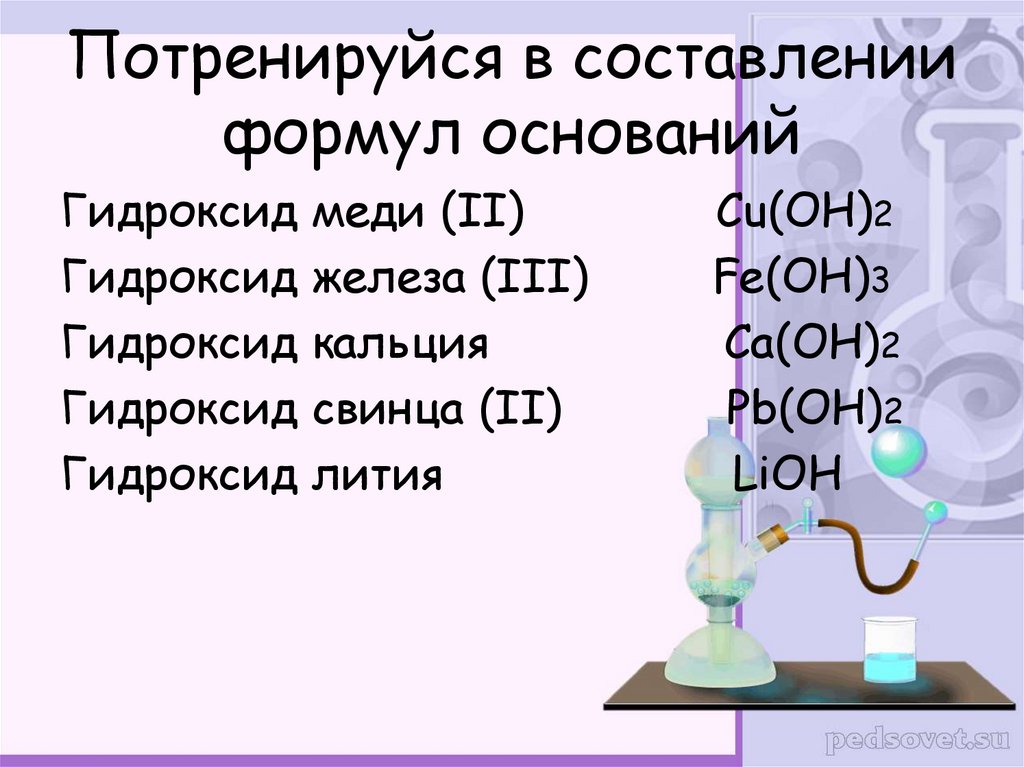
6. Потренируйся в составлении формул оснований
Гидроксид меди (II)Гидроксид железа (III)
Гидроксид кальция
Гидроксид свинца (II)
Гидроксид лития
Сu(OH)2
Fe(OH)3
Ca(OH)2
Pb(OH)2
LiOH
7. Физические свойства
8. Растворимые основания
9.
10. Химические свойства оснований
1. Взаимодействие с кислотными оксидами:Правило: При взаимодействии растворимых
оснований с кислотными оксидами
образуются соль и вода.
2KOH + SO2 = K2SO3 + H2O
(При составлении солей, напоминаю, что нужно
вспомнить, какая кислота соответствует
кислотному оксиду и записать ее кислотный
остаток. В нашем случае SO2 соответствует
Н2SO3, значит записываем кислотный остаток
SO3)
11. Химические свойства оснований
2. Взаимодействие с кислотами:Правило: При взаимодействии
растворимых оснований с кислотами
образуется соль и вода.
HCl + NaOH = NaCl + H2O
Реакция взаимодействия кислоты и
основания называется реакцией
нейтрализации.
12. Химические свойства оснований
3. Взаимодействие с растворимымисолями:
Правило: При взаимодействии
растворимых солей с растворимыми
основаниями образуются
нерастворимые основания.
CuCl2 + 2KOH = Cu(OH)2↓+ 2KCl
Заметьте, что если в качестве продуктов
реакции образуется растворимое
основание, то реакция теряет смысл!
13. Нерастворимые основания
14. Получение нерастворимых оснований
Правило: Чтобы получитьнерастворимое основание,
необходимо взять растворимую соль,
содержащую необходимый металл и
растворимое основание.
Итак, получим Fe(OH)3
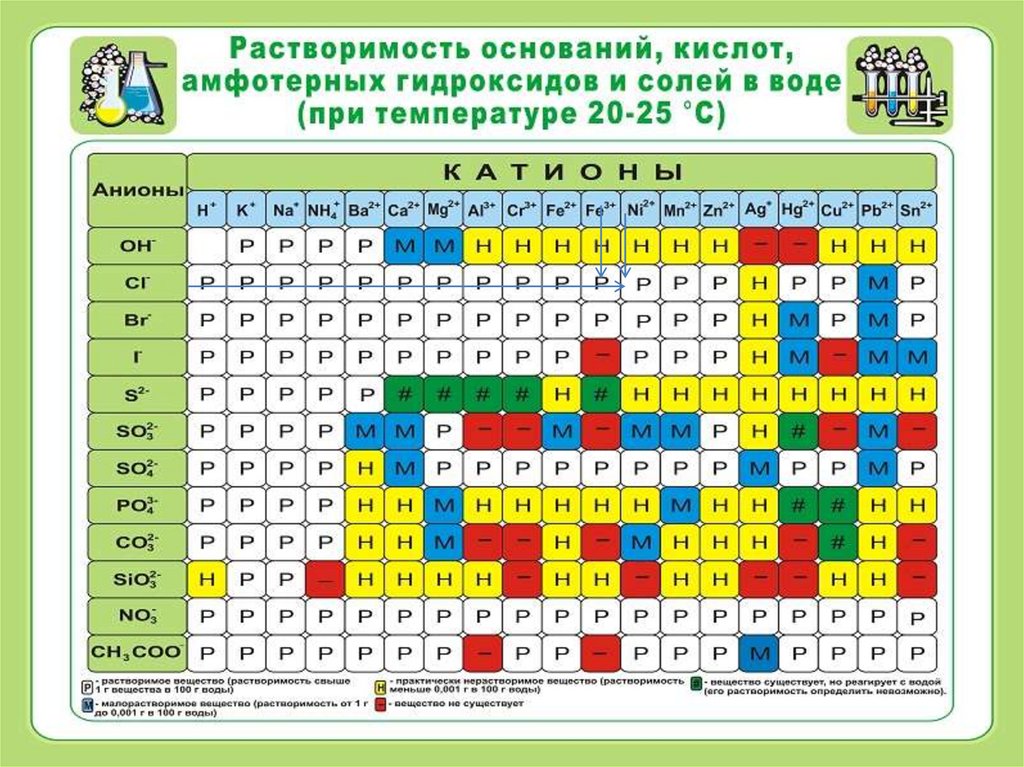
1. Находим по таблице растворимости
растворимую соль железа (III).
15.
16. Получение нерастворимых оснований
Это FeCl3, к нему добавляемрастворимое основание NaOH:
FeCl3 + 3NaOH = Fe(OH)3 ↓+ 3NaCl
Чтобы посмотреть видео перейдите по
ссылке: ..\..\Видео\Галиев Ильяс 10А
Опыты по химии\Неорганика\основ.
классы неорг. соедин\получ. нераств.
оснований.wmv
17. Химические свойства нерастворимых оснований
1. Взаимодействие с кислотами:Правило: При взаимодействии
нерастворимых оснований с
кислотами образуется соль и вода.
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
18. Химические свойства нерастворимых оснований
2. При нагревании разлагаютсяПравило: При нагревании
нерастворимые основания
разлагаются на основной оксид и
воду.
II
t
II
Сu(OH)2 = CuO + H2O
При составлении формулы основного оксида, не
забудьте учесть валентность металла. Какова она в
основании, такая же валентность металла будет и в
оксиде.
19. Химические свойства нерастворимых оснований
Чтобы посмотреть видео перейдите поссылке: ..\..\Видео\Галиев Ильяс 10А Опыты
по химии\Неорганика\основ. классы неорг.
соедин\свойства нераст. основан..wmv
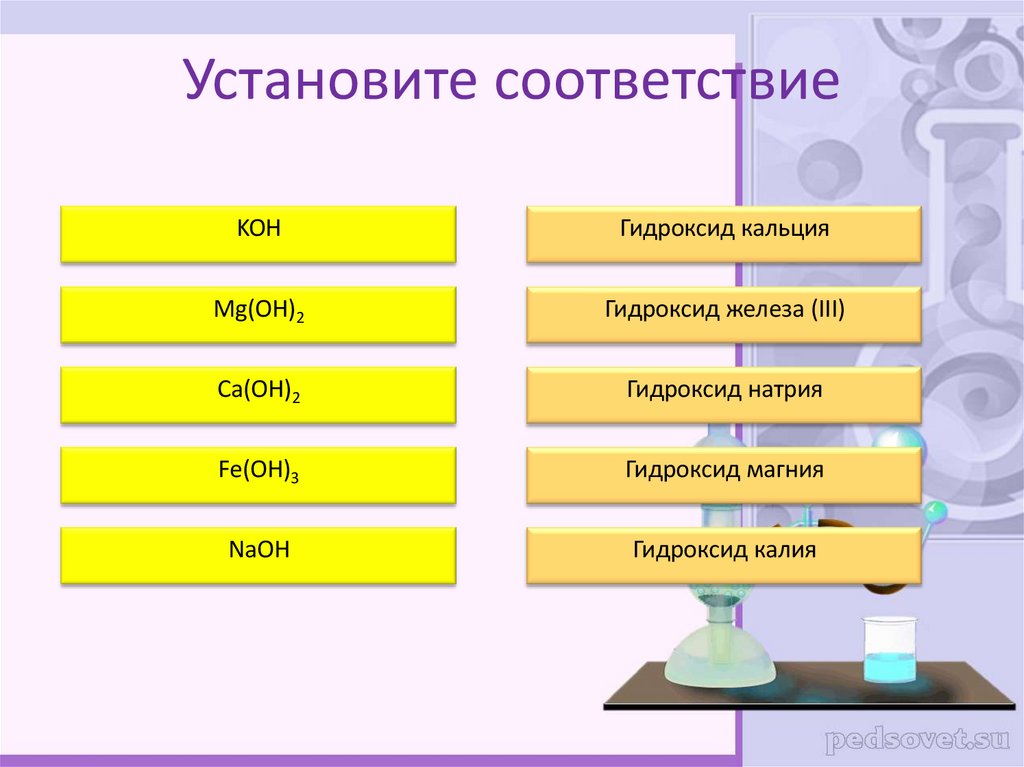
20. Установите соответствие
KOHГидроксид кальция
Mg(OH)2
Гидроксид железа (III)
Ca(OH)2
Гидроксид натрия
Fe(OH)3
Гидроксид магния
NaOH
Гидроксид калия
21.
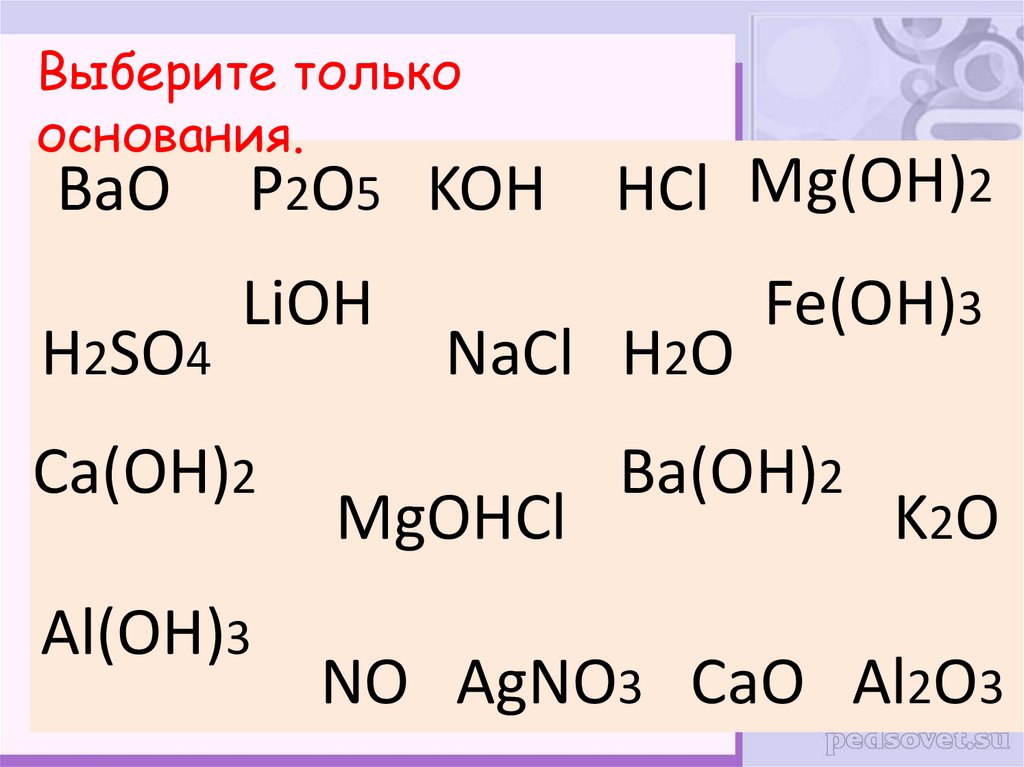
Выберите толькооснования.
BaO P2O5 KOH
H2SO4
LiOH
Ca(OH)2
Al(OH)3
HCl Mg(OH)2
NaCl H2O
MgOHCl
Fe(OH)3
Ba(OH)2
K2O
NO AgNO3 CaO Al2O3
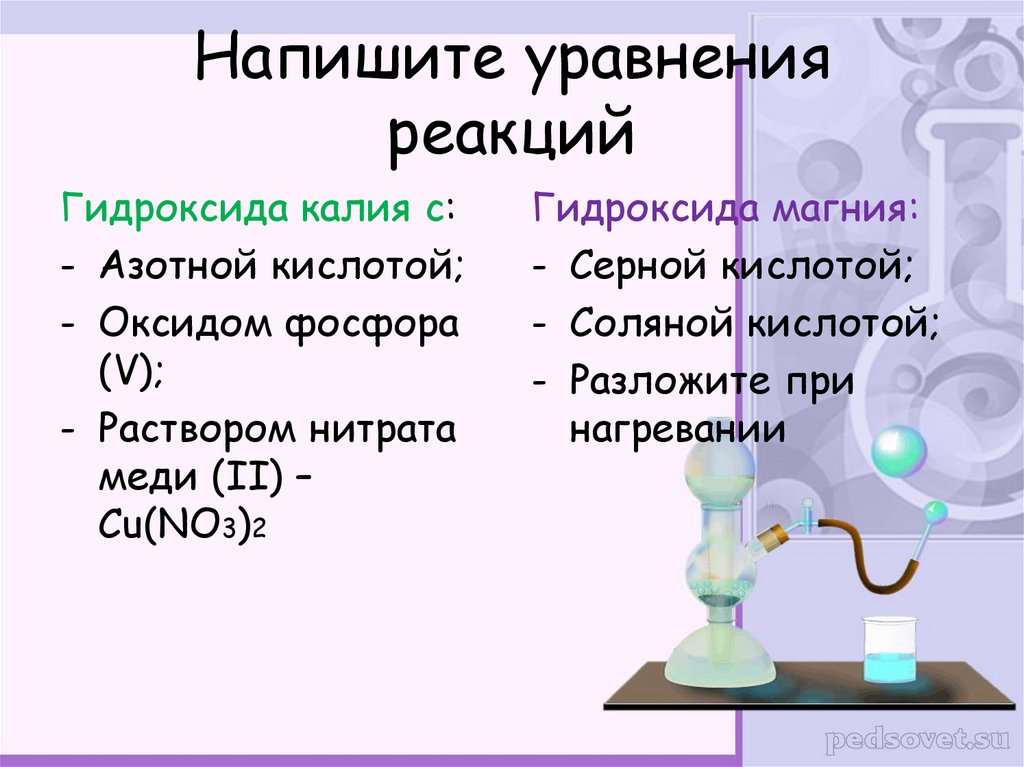
22. Напишите уравнения реакций
Гидроксида калия с:- Азотной кислотой;
- Оксидом фосфора
(V);
- Раствором нитрата
меди (II) –
Cu(NO3)2
Гидроксида магния:
- Серной кислотой;
- Соляной кислотой;
- Разложите при
нагревании
23. Напишите уравнения реакций, с помощью которых можно получить
- Гидроксид бария;- Гидроксид лития
- Гидроксид цинка;
- Гидроксид
алюминия
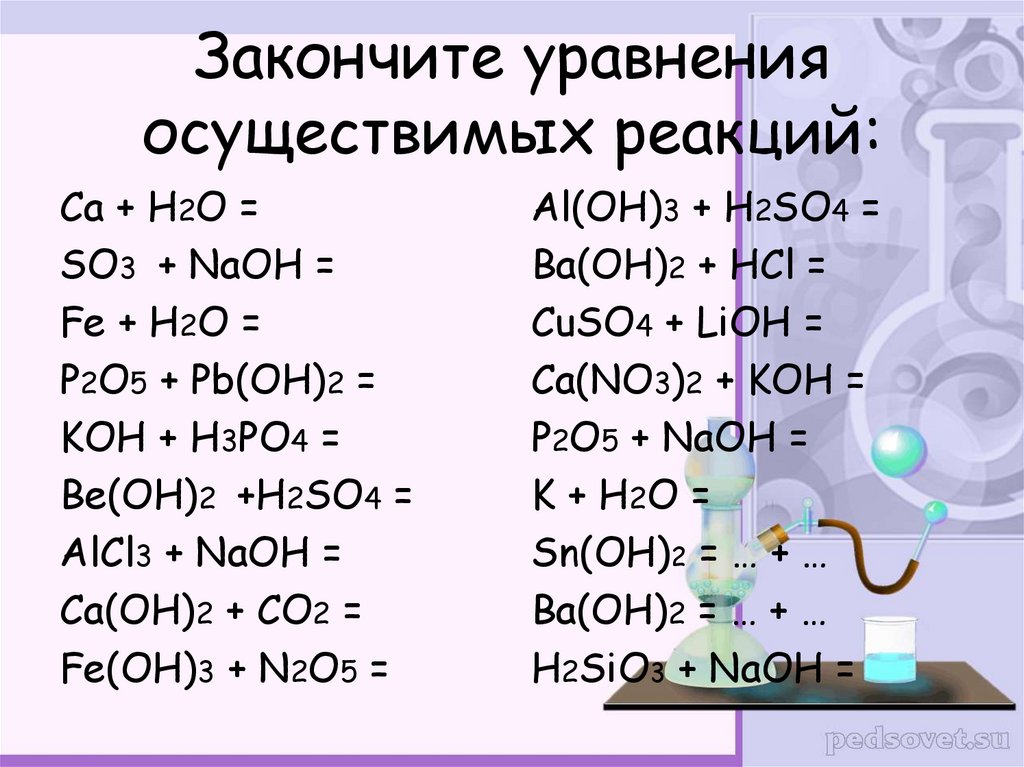
24. Закончите уравнения осуществимых реакций:
Са + H2O =SO3 + NaOH =
Fe + H2O =
P2O5 + Pb(OH)2 =
KOH + H3PO4 =
Be(OH)2 +H2SO4 =
AlCl3 + NaOH =
Ca(OH)2 + CO2 =
Fe(OH)3 + N2O5 =
Al(OH)3 + H2SO4 =
Ba(OH)2 + HCl =
CuSO4 + LiOH =
Ca(NO3)2 + KOH =
P2O5 + NaOH =
K + H 2O =
Sn(OH)2 = … + …
Ba(OH)2 = … + …
H2SiO3 + NaOH =
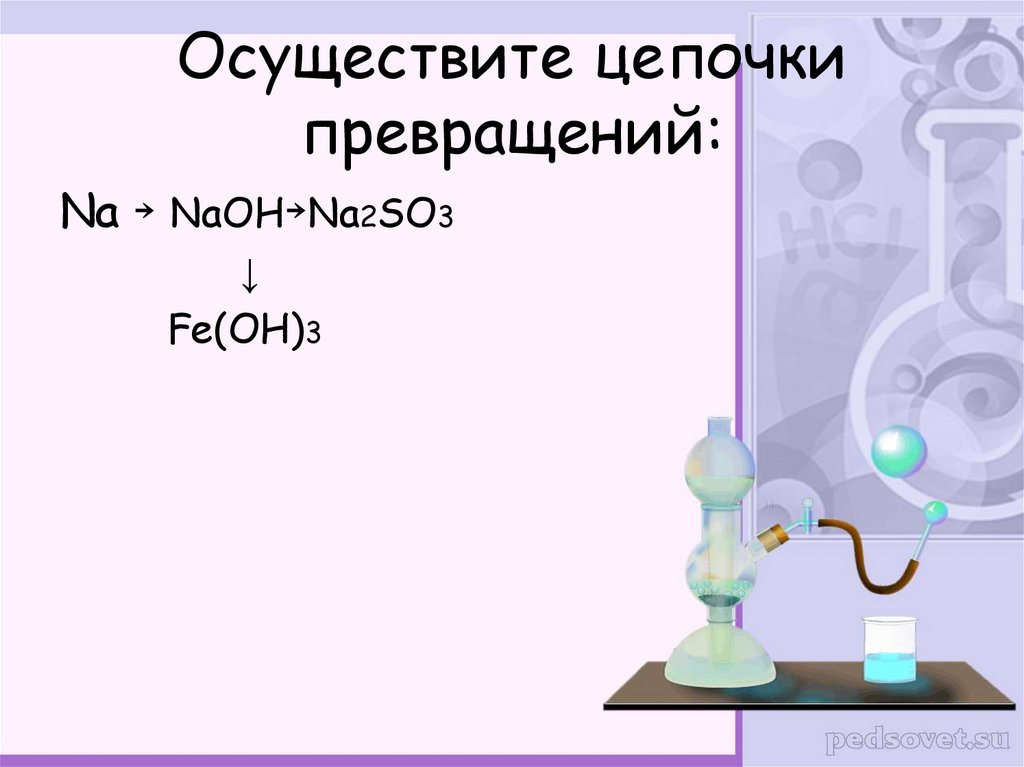
25. Осуществите цепочки превращений:
Na NaOH Na2SO3↓
Fe(OH)3


















 chemistry
chemistry








