Similar presentations:
Основания. 8 класс
1. Урок по теме: «Основания»
L/O/G/O2. План изучения темы:
1. Состав, названия иопределение оснований.
2. Классификация оснований.
3. Физические свойства
оснований.
4. Химические свойства
оснований.
3.
Основания– это сложные вещества,
состоящие из атома
металла и одной или
нескольких
гидроксогрупп.
4. Состав оснований: Назовите составные части оснований.
Валентность гидроксогруппы (ОН) – IКоличество гидроксогрупп определяется
валентностью металла, образующего основание.
Ме(ОН)х
5. Выберите формулы оснований. Назовите их.
НСl, NaOH, Na2O,Ca(OH)2, H2SO4,
P2O5, Fe(OH)3, MgO,
Cи(OH)2
6. Основания
NaOH – гидроксид натрияCa(OH)2 – гидроксид кальция
Fe(OH)3 – гидроксид железа (III)
Cи(OH)2 – гидроксид меди (III)
Найдите ошибку!
7.
Основанияраздел
Классификаций
8. Классификация оснований
РастворимыеНерастворимые
(щелочи)
NaOH
KOH
Ba(OH)2
LiOH
Cu(OH)2
Al(OH)3
Ni(OH)2
Fe(OH)2
Fe(OH)3
9. Таблица растворимости кислот, оснований, солей
10.
11. По какому признаку основания разделены на группы?
?NaOH
KOH
LiOH
СsOH
?
Cu(OH)2
Ba(OH)2
Pb(OH)2
Fe(OH)2
?
Al(OH)3
Fe(OH)3
12. Классификация оснований по числу гидроксогрупп.
ОснованияОднокислотные NaOH, KOH
Двухкислотные
Трехкислотные
Pb(OH)2, Fe(OH)2
Al(OH)3
13.
Основанияраздел Физический
(свойства)
14. Физические свойства оснований
КОНАгрегатное состояние:
Все твердые вещества
• Цвет кислот:
Белого – КОН,
Голубого - Cu(OH)2
Cu(OH)2
Красно-бурого - Fe(OH)3
• Запах – ?
• Вкус – ? (горький, солоноватый)
• Растворимость в воде - ?
15.
Основанияраздел
Химический (свойства)
16. Химические свойства нерастворимых оснований.
1). Разлагаются принагревании.
2). Взаимодействуют с
кислотами (реакция
нейтрализации).
17. Химические свойства щелочей.
1). Изменяют окраскуиндикаторов.
Взаимодействуют с:
2). кислотами (реакция
нейтрализации),
3). кислотными оксидами,
4). солями.
18.
ПРАВИЛА БЕЗОПАСНОСТИЕдкое вещество—щелочь!
Разрушает и раздражает
кожу, слизистые оболочки.
Попавшие на кожу капли раствора
щелочи немедленно смойте
сильной струей холодной воды, а
затем обработайте поврежденную
поверхность 1% раствором
уксусной кислоты.
19.
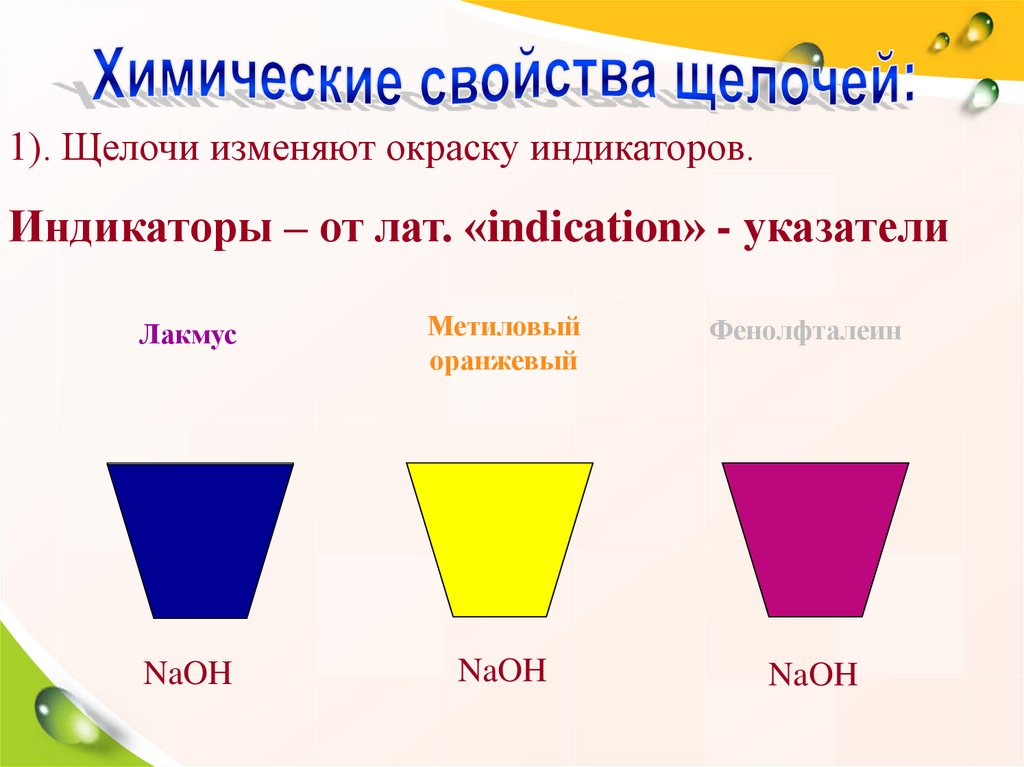
1). Щелочи изменяют окраску индикаторов.Индикаторы – от лат. «indication» - указатели
Лакмус
Метиловый
оранжевый
Фенолфталеин
NaOH
NaOH
NaOH
20.
2. Щелочь + кислота :Ва(ОН)2 + 2НСl = ВаСl2 + 2Н2О
хлорид бария
21.
3. Щелочь + кислотный оксид:В ходе реакции образуется соль и вода
Для написания реакции необходимо знать,
какая кислота соответствует кислотному оксиду.
22.
23. Условия протекания реакции: 1). исходные вещества должны быть растворимыми 2). образование осадка
4. Щелочь + соль =Условия протекания реакции:
1). исходные вещества должны быть
растворимыми
2). образование осадка






















 chemistry
chemistry








