Similar presentations:
Диссоциация кислот, оснований и солей
1. Урок химии, 9 класс
2. Диссоциация кислот, оснований и солей
Учитель химии Кукарева З.В.3. Цель урока
Объяснять понятия «кислоты», «основания», «соли»с точки зрения теории электролитической
диссоциации;
Уметь объяснять, чем обусловлены общие свойства
растворов кислот и растворов солей;
Уметь составлять уравнения электролитической
диссоциации кислот, оснований и солей;
Уметь решать задачи на вычисление количества
ионов.
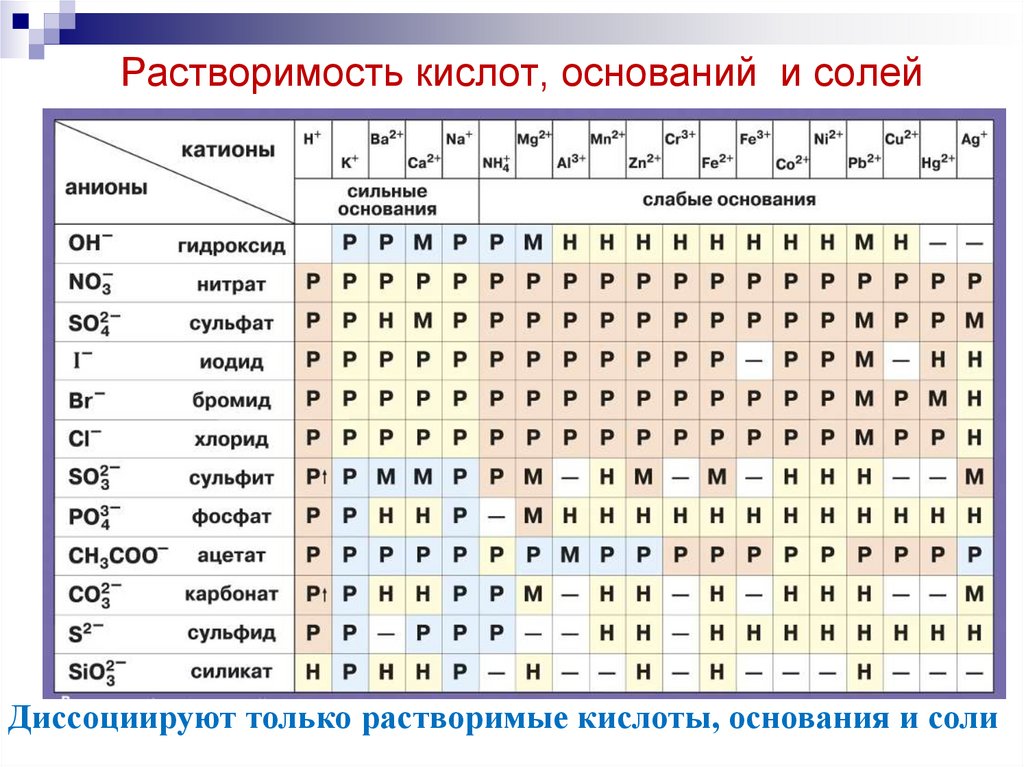
4. Растворимость кислот, оснований и солей
Диссоциируют только растворимые кислоты, основания и соли5. Диссоциация кислот
Все растворимые кислоты в водных растворах диссоциируют наионы водорода и кислотных остатков;
HCl = H+ + Clˉ
При диссоциации молекул кислот образуются не свободные
ионы водорода, а их гидраты – ионы гидроксония:
H+ + H2O H3O+
Ион гидроксония образуется по донорно-акцепторному
механизму; атом кислорода – донор, ион водорода - акцептор
HСl + H2O H3O+ + Clˉ
ион
гидроксония
6. Диссоциация кислот
Процесс диссоциации изображают упрощенно:HNO3 = H+ + NO3ˉ
Многоосновные кислоты диссоциируют ступенчато:
H2SO4
H+ + HSO4ˉ
HSO4ˉ
H+ + SO42ˉ
Кислоты – это сложные вещества, при диссоциации
которых в водных растворах в качестве катионов
отщепляются ионы водорода;
Именно ионы водорода H+ придают кислотам
характерные для них свойства.
7. Диссоциация оснований
Все растворимые основания в водных растворахдиссоциируют на отрицательно заряженные
гидроксид-ионы и положительно заряженные ионы
металлов.
NaOH = Na+ + OHˉ
Ca(OH)2 = Ca2+ + 2OHˉ
Основания - это сложные вещества , при диссоциации
которых в водных растворах в качестве анионов
отщепляются только гидроксид-ионы.
Присутствием в растворах гидроксид-иона OHˉ
объясняются характерные общие свойства
оснований.
8. Диссоциация солей
Все растворимые соли в водных растворахдиссоциируют на катионы металлов и анионы
кислотных остатков.
KNO3 = K+ + NO3ˉ
CaCl2 = Ca2+ + 2Clˉ
Al2(SO4)3 = 2Al3+ + 3SO42ˉ
Cоли - это сложные вещества, которые в водных
растворах диссоциируют на катионы металлов и
анионов кислотных остатков.
9. Свойства кислот, оснований и солей с точки зрения ТЭД
ЭлектролитыХарактерные
общие ионы
Характерные свойства
Кислоты
H+
Действуют на индикаторы и
реагируют с ионами ОНˉ
с образованием воды:
H+ + ОНˉ = H2O
Основания
ОНˉ
Действуют на индикаторы и
реагируют с ионами H+
с образованием воды:
ОНˉ + H+ = H2O
Соли
Общих ионов
нет
Отсутствуют общие свойства,
обусловленные наличием
общих ионов
10. Первичное закрепление знаний
Напишите схемы ступенчатой диссоциацииследующих веществ:
а) H3PO4
б) MgOHCl
в) Ca(OH)2
г) NaHCO3
11. Первичное закрепление знаний
Напишите схемы ступенчатой диссоциацииследующих веществ:
а) H3PO4
H2PO4ˉ
HPO42ˉ
H+ +H2PO4ˉ
H+ + HPO42ˉ
H+ + PO43ˉ
б) MgOHCl
MgOH+
MgOH+ + Clˉ
Mg2+ + OHˉ
в) Ca(OH)2
СaOH+
СaOH+ + OHˉ
Сa2+ + OHˉ
г) NaHCO3
HCO3ˉ
Na+ + HCO3ˉ
H+ + CO32ˉ
12. Закрепление знаний - зад. №7 ОГЭ
Напишите уравнения диссоциации солей. Наибольшее числоанионов образуется при полной диссоциации 1 моль:
1) нитрата кальция
2) сульфата алюминия
3) фосфата натрия
4) хлорида бария
Решение:
1) Ca(NO3)2 = Ca2+ + 2NO3ˉ
2) Al2(SO4)3 = 2Al3+ + 3SO42ˉ
3) Na3PO4 = 3Na+ + PO43ˉ
4) BaCl2 = Ba2+ + 2Clˉ
13. Закрепление знаний - №7 ОГЭ
При полной электролитической диссоциации какого из указанныхвеществ число образующихся катионов и анионов получается
поровну?
1) нитрата алюминия
2) фосфорная кислота
3) гидроксид бария
4) хлорид калия
Решение:
1) Al(NO3)3 = Al3+ + 3NO3ˉ
2) H3PO4 = 3H+ + PO43ˉ
3) Ba(OH)2 = Ba2+ + 2OHˉ
4) KCl = K+ + Clˉ
14. Задача Какое количество ионов образуется при растворении в воде 8,2 г нитрата кальция.
Дано:m (Ca(NO3)2) = 8,2г
n (Ca2+ ) -?
n (NO3ˉ) -?
Решение:
8,2 г
Ca(NO3)2
164 г
х моль
= Ca2+
1 моль
х моль
+ 2NO3ˉ
2 моль
1) M(Ca(NO3)2) = 40 +14·2 +16·6 = 164г/моль
2) 164 г – 1 моль
8,2 г · 1моль = 0,05 моль (Ca2+)
х= ________________
8,2 г – х моль
164 г
8,2 г · 2моль = 0,1 моль (NO ˉ)
3) 164 г – 2 моль х= ________________
3
164 г
8,2 г – х моль
Ответ: n(Ca2+) = 0,05 моль, n(NO3ˉ)= 0,1 моль
15. Рефлексия
Какая была тема урока?Какую цель мы преследовали?
Достигли ли мы поставленной цели?
Что вы узнали сегодня нового?
Что для вас было сложным и трудным для
понимания?
Какую оценку поставите вы себе за урок?
16.
Проработать§ 7, упр.2,3















 chemistry
chemistry








