Similar presentations:
Железо. Урок химии в 9 классе
1. ЖЕЛЕЗО
Урок химии в 9 классеПетухова Юлия Валентиновна,
МБОУ СОШ с. Георгиевка
район имени Лазо Хабаровского края
2. План работы по теме урока:
1. Качественные реакции Fe+2, Fe+32. Строение атома
3. Биологическое значение
4. Физические свойства
5. Местоположение Fe в
Периодической системе
6. Химические свойства
Что нужно исправить и добавить?
3. Положение железа в Периодической системе химических элементов Д. И. Менделеева
4. Строение атома железа
5. Физические свойства железа
Серебристо-серый металл,ковкий,
пластичный,
плотность 7,87г/см3;
tпл.=1539°С;
tкип.=2740°С;
хорошо проводит тепло и
электричество,
обладает магнитными свойствами
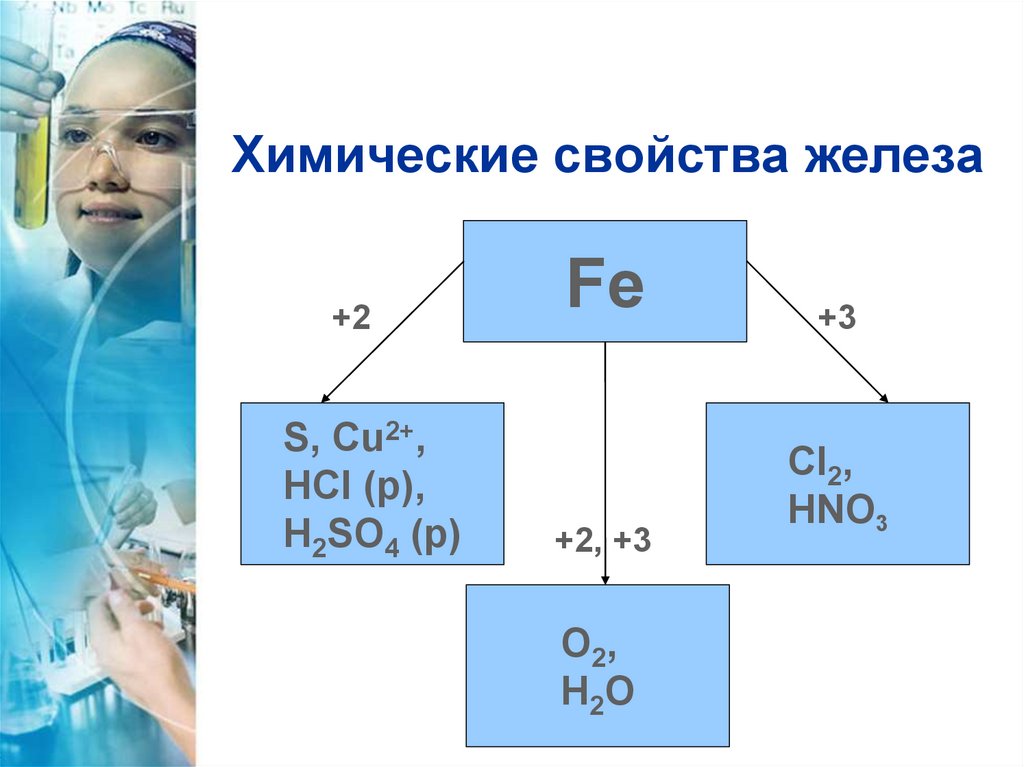
6. Химические свойства железа
+2S, Cu2+,
HCI (р),
H2SO4 (р)
Fe
+2, +3
O2,
H2O
+3
CI2,
HNO3
7.
Химические свойстважелеза
Fe+2
Fe+3
Fe + S →FeS
2Fe +3CL2 → 2FeCL3
3Fe + 2О2→ Fe3O4(FeO·Fe2O3)
Fe + 2HCl→FeCl2 + H2
Fе + 6HNOз (конц.) →
→ Fе(NOз)з + 3NО2 + 3Н2О
Fe + CuSO4 → FeSO4 + Cu
3Fe + 4H2O → Fe3O4(FeO·Fe2O3) + 4H2
8. Соединения железа
Fe3O4 – магнитный железнякFe2O3 – красный железняк (гематит)
2Fe2O3 * 3H2O – бурый железняк
FeS2 – железный (серный) колчедан,
пирит
FеСО3 – сидерит
Fе(НСОз)3 – гидрокарбонат железа (II)
9. Качественные реакции
Качественная реакция на ион Fe2+реактив – красная кровяная соль
K3[Fe(CN)6]
Качественная реакция на ион Fe3+
1) реактив – желтая кровяная соль
K4[Fe(CN)6];
2) реактив – роданид калия КNCS
10. Биологическое значение железа
Ионы железа входят в составгемоглобина, который содержится в
эритроцитах крови.
Источники железа:
Зеленные овощи, яичный желток,
Печень, горошек зеленый,
томаты сырые, капуста,
Чеснок, яблоки, груши,
земляника, сухофрукты.
11. Выполнение проверочного теста и работа на тренажёре
Самооценка: за каждый правильный ответпо одному баллу. Добавить по баллу,
работающим у доски ученикам.
1. Б. 2. А. 3. В. 4. Б. 5. Б.
Закончить предложения:
Сегодня я понял (а), что…
Главным на уроке для меня было…
Больше всего мне запомнилось…











 chemistry
chemistry








