Similar presentations:
Белки
1.
Жизнь –это способ
существования
белковых тел.
Ф.Энгельс
2. Белки
БЕЛКИЦель урока
Изучить:
функции
состав
строение белков
влияние окружающей среды
3. Основа жизни
ОСНОВА ЖИЗНИНаиболее важными
соединениями, которые
входят в состав живых
организмов, являются
белки (протеины).
Белки служат
основой всего
живого на нашей
планете.
4. Белки, протеины
БЕЛКИ, ПРОТЕИНЫ«Protos» первый
5. Функции белков
ФУНКЦИИ БЕЛКОВ
Строительная
Ферментативная (каталитическая)
Транспортная
Защитная
Двигательная
Регуляторная
Запасающая
Токсическая
Энергетическая
6.
Многообразие живыхорганизмов, населяющих
нашу планету, обусловливается многообразием белков,
из которых они построены.
Каждый организм имеет
собственный набор белков.
Вы слышали о проблеме
несовместимости тканей при
пересадке органов от одного организма к другому?
В чем по-вашему причина несовместимости?
7. Белки – природные полимеры
БЕЛКИ – ПРИРОДНЫЕПОЛИМЕРЫ
Белки образованы всего двадцатью разными
аминокислотами, общая формула которых:
R – CHNH2 – COOH
Внимание! Все аминокислоты белков – это
альфа-аминокислоты.
Полимерные цепи белков состоят из десятков
тысяч, миллионов и больше остатков
аминокислот.
8. Общая формула аминокислот
ОБЩАЯ ФОРМУЛААМИНОКИСЛОТ
R
|
O
||
Карбоксильная группа
NH2-CH-C –OH
аминогруппа
Какие группы
входят в состав аминокислот?
9. Образование пептидных связей
ОБРАЗОВАНИЕ ПЕПТИДНЫХ СВЯЗЕЙ10. H2N-CH2-COOH Глицин H2N-CH(CH3)-COOH Аланин
H2N-CH2-COOHГЛИЦИН
H2N-CH(CH3)-COOH АЛАНИН
Составьте
уравнение реакции образования
дипептида из приведенных выше
аминокислот.
Что из себя представляют реакции
поликонденсации?
Чем они отличаются от реакций
полимеризации?
Если в цепи число остатков аминокислот
большое, но не превышает 10000, то это
полипептиды
При большей длине цепи - Б е л к и
11. Проверяем:
ПРОВЕРЯЕМ:H2N - CH2 – CO – HN – CH - COOH +
Н2О
Пептидная связь
СН3
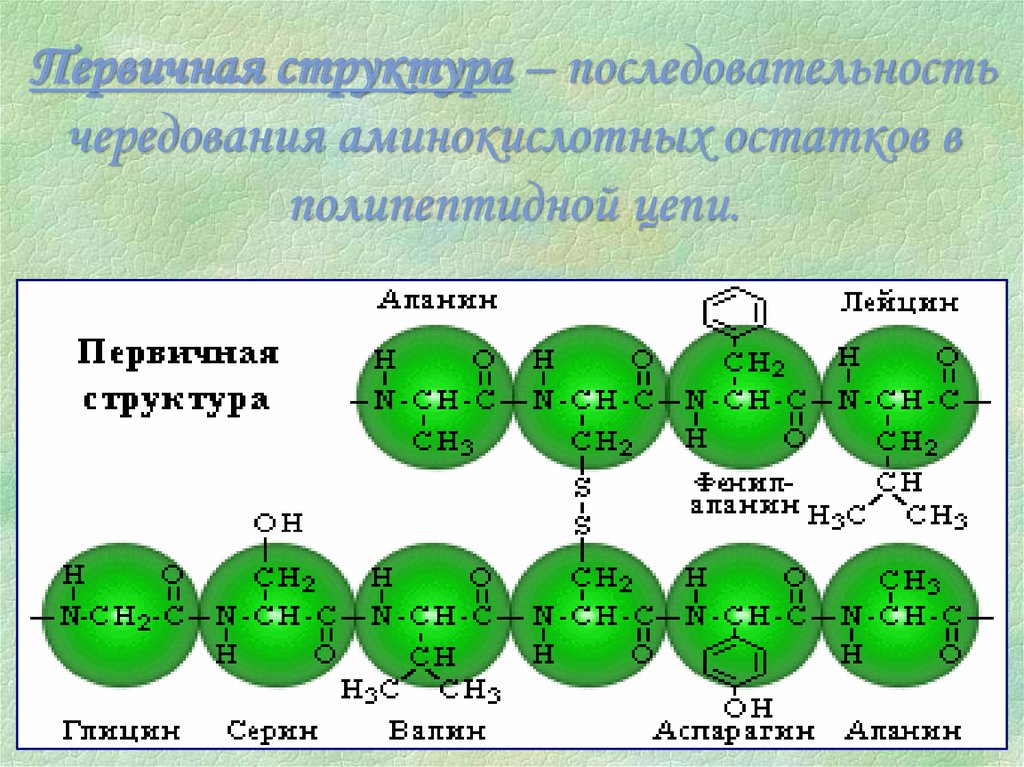
12.
Первичная структура – последовательностьчередования аминокислотных остатков в
полипептидной цепи.
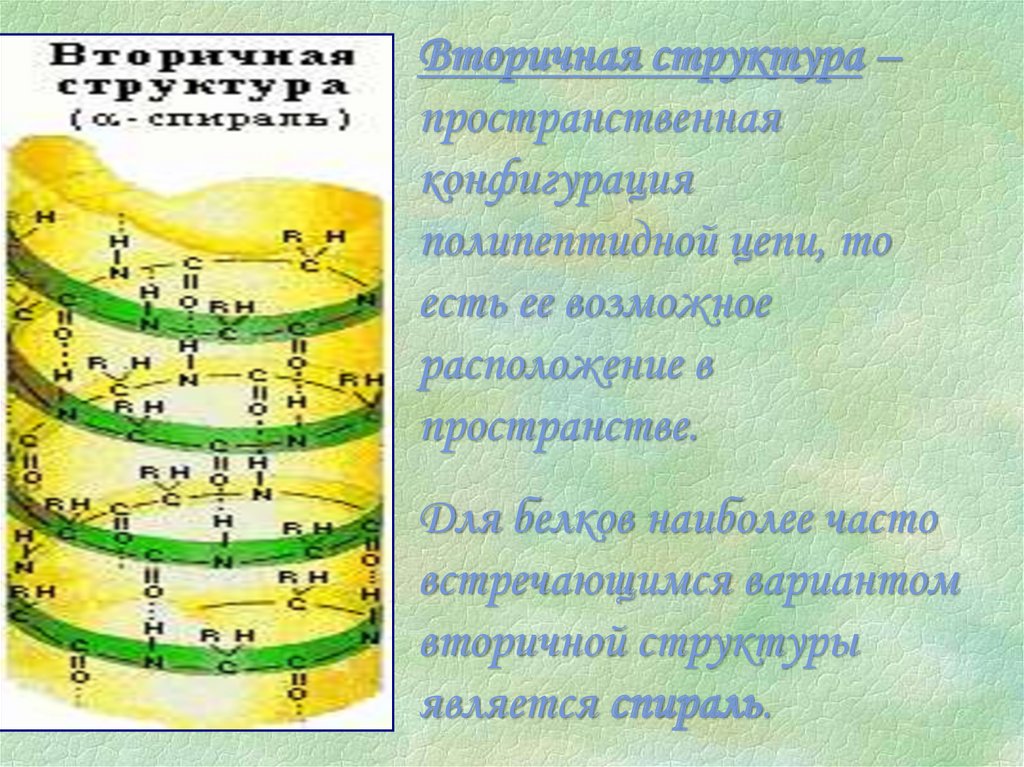
13.
Вторичная структура –пространственная
конфигурация
полипептидной цепи, то
есть ее возможное
расположение в
пространстве.
Для белков наиболее часто
встречающимся вариантом
вторичной структуры
является спираль.
14.
Третичная структура –трехмерная
конфигурация, которую
принимает в пространстве
закрученная спираль.
Третичной структурой
объясняется
специфичность белковой
молекулы и ее
биологическая активность.
15.
Четвертичная структура– расположение в
пространстве нескольких
полипептидных цепей,
каждая из которых имеет
свою первичную,
вторичную и третичную
структуру и называется
субъединицей.
16. Формы молекул белков и их относительные молекулярные массы
ФОРМЫ МОЛЕКУЛ БЕЛКОВ И ИХОТНОСИТЕЛЬНЫЕ МОЛЕКУЛЯРНЫЕ МАССЫ
рибонуклеаза
Мr = 13000
пепсин
Мr = 35000
бета-лактоглобулин
Мr = 40000
фибриноген
Мr = 450000
гемоглобин
Мr = 68000
бета-липопротеид
Мr = 1300000
гамма-глобулин
Мr = 300000
17. Форма молекул определяет их растворимость в воде
ФОРМА МОЛЕКУЛ ОПРЕДЕЛЯЕТ ИХРАСТВОРИМОСТЬ В ВОДЕ
Белки
Примеры
Фибриллярные Кератин – в коже,ногтях, волосах
(нераствориКоллаген – в сухожилиях
мые)
Миозин – в мускулах
Фиброин – в шелке
Глобулярные
Все ферменты
(растворимые) Многие гормоны в т.ч. инсулин
Гемоглобин
Антитела
18. Химические свойства белков
ХИМИЧЕСКИЕ СВОЙСТВА БЕЛКОВ1. Гидролиз белков
Гидролиз белков сводится к расщеплению полипептидных связей:
2. Денатурация
3. Качественные реакции
19.
Качественные реакции на белкиКсантопротеиновая
реакция
Биуретовая реакция
При действии азотной
кислоты – белки
окрашиваются в желтый
цвет.
С солями меди (II) в
присутствии щелочи
белки дают
фиолетовую окраску.
Это качественная
реакция на пептидную
группу.
20.
Разрушениеструктуры белка –
денатурация
Какими по вашему могут быть причины денатурации
белков?
21. Причины денатурации белков
ПРИЧИНЫ ДЕНАТУРАЦИИ БЕЛКОВПовышение
температуры
Влияние солей тяжелых металлов
Влияние алкоголя
22. Ответьте на вопросы:
ОТВЕТЬТЕ НА ВОПРОСЫ:В чем причина несовместимости
тканей
при
Для каждого
организма
характерен свой
индивидуальный
белков
пересадке органов от одного организма
к набор
другому?
протеины
Научное название белков.
Из чего построены молекулы белков?Из остатков аминокислот
4
Сколько структур белка существует?
вторичная
Структура белка, свернутая в спираль?
пептидная
Как называется связь - NH – CO - ?
Разрушение структуры белка.
денатурация
Реакции, определяющие наличие
белка?
Ксантопротеиновая,
биуретовая
Пищевые продукты с большим содержанием белка.
Самая неустойчивая структура белка?
четвертичная
23. Хорошо поработали!
ХОРОШО ПОРАБОТАЛИ!Молодцы!





















 chemistry
chemistry