Similar presentations:
Белки. Свойства и функции. Качественный состав белков
1.
Белки.Свойства и
функции.
2.
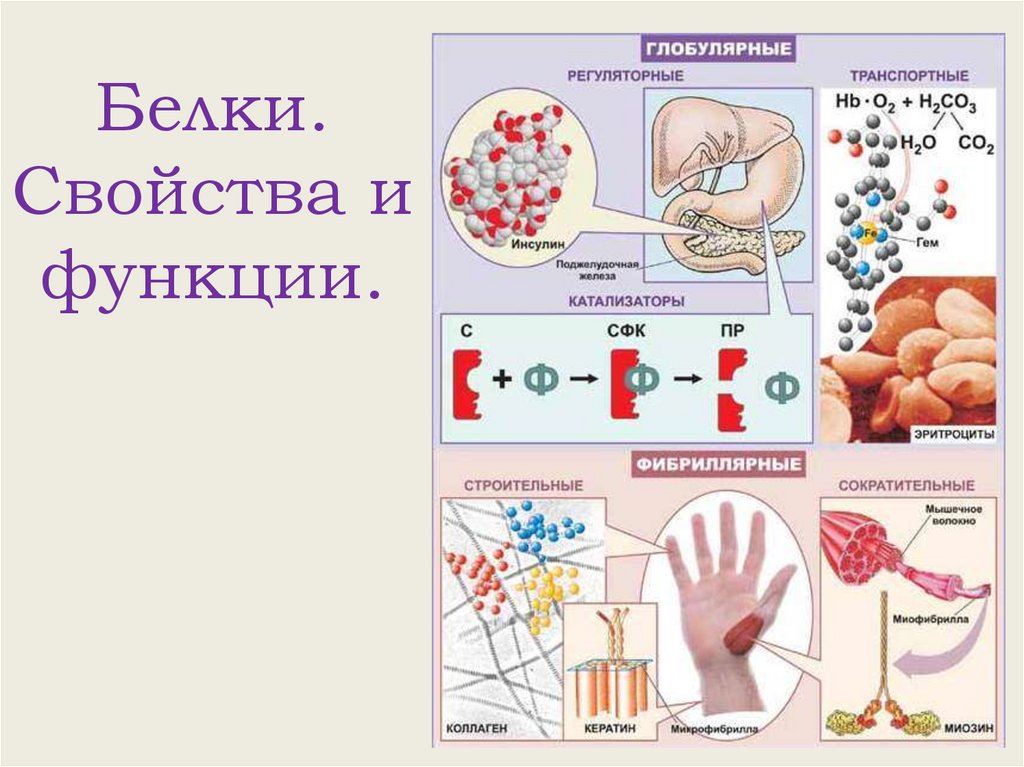
Функции белков• Строительная (пластическая) – белки участвуют в
образовании оболочки клетки, органоидов и мембран клетки.
• Каталитическая – все клеточные катализаторы – белки
(активные центры фермента).
• Двигательная – сократительные белки вызывают всякое
движение.
• Транспортная – белок крови гемоглобин присоединяет
кислород и разносит его по всем тканям.
• Защитная – выработка белковых тел и антител для
обезвреживания чужеродных веществ.
• Энергетическая – 1 г белка эквивалентен 17,6 кДж.
• Рецепторная – реакция на внешний раздражитель
3.
Жизнь –это способ
существования
белковых тел.
Ф.Энгельс
4.
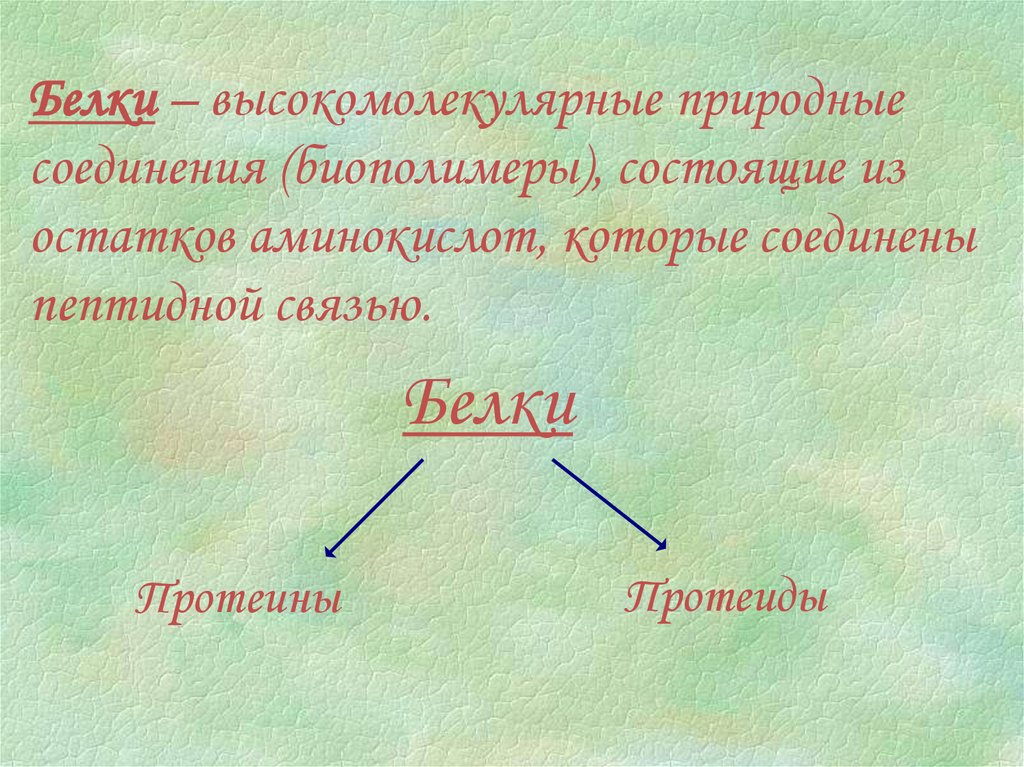
Белки – высокомолекулярные природныесоединения (биополимеры), состоящие из
остатков аминокислот, которые соединены
пептидной связью.
Белки
Протеины
Протеиды
5.
Качественный состав белков• В состав белковых веществ входят:
углерод, водород, кислород, азот, сера,
фосфор.
• Гемоглобин – C3032H4816O872N780S8Fe.
• Молекулярная масса белков колеблется от
нескольких тысяч до нескольких
миллионов.
• Mr белка яйца = 36 000,
• Mr белка мышц = 1 500 000
6.
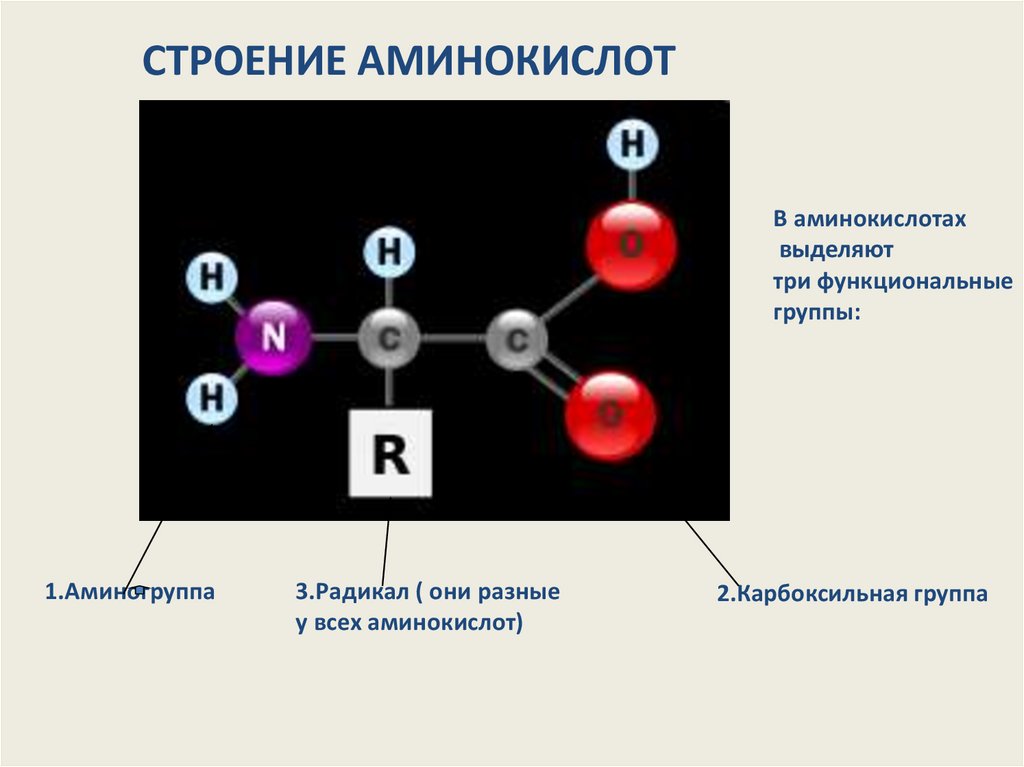
СТРОЕНИЕ АМИНОКИСЛОТВ аминокислотах
выделяют
три функциональные
группы:
1.Аминогруппа
3.Радикал ( они разные
у всех аминокислот)
2.Карбоксильная группа
7.
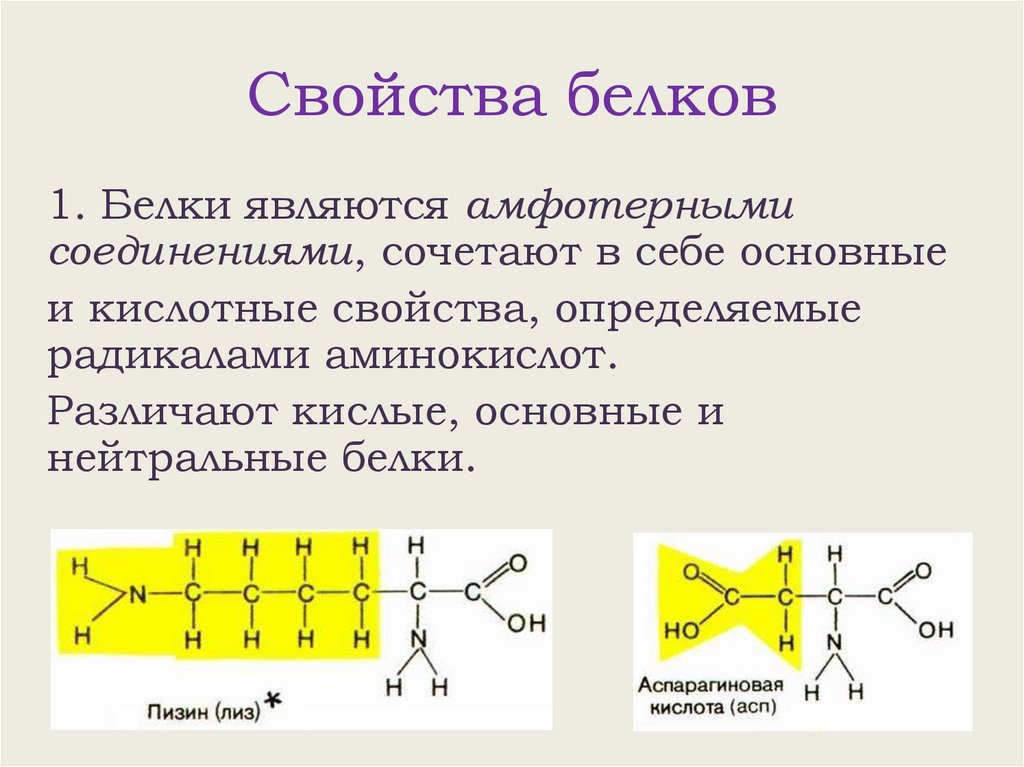
Свойства белков1. Белки являются амфотерными
соединениями, сочетают в себе основные
и кислотные свойства, определяемые
радикалами аминокислот.
Различают кислые, основные и
нейтральные белки.
8.
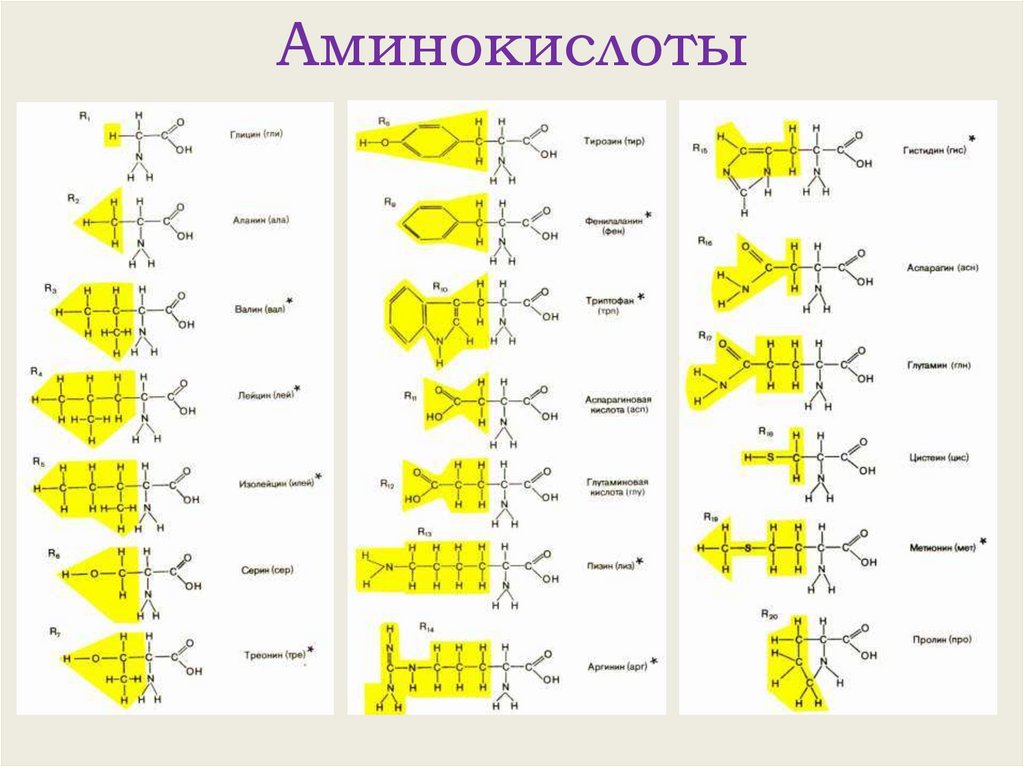
Аминокислоты9.
Строение белковВ начале 20 века Э.Фишер в результате гидролиза
белковых молекул получил смесь аминокислот и выдвинул
полипептидную теорию.
H2N – CH – COОН
│
CH3
аланин
+ Н – N – CH - COOH →
│
│
H CH3
аланин
H2N – CH – C – N – CH – COOH + Н2О
│
║
|
│
CH3 О Н
CH3
дипептид
10.
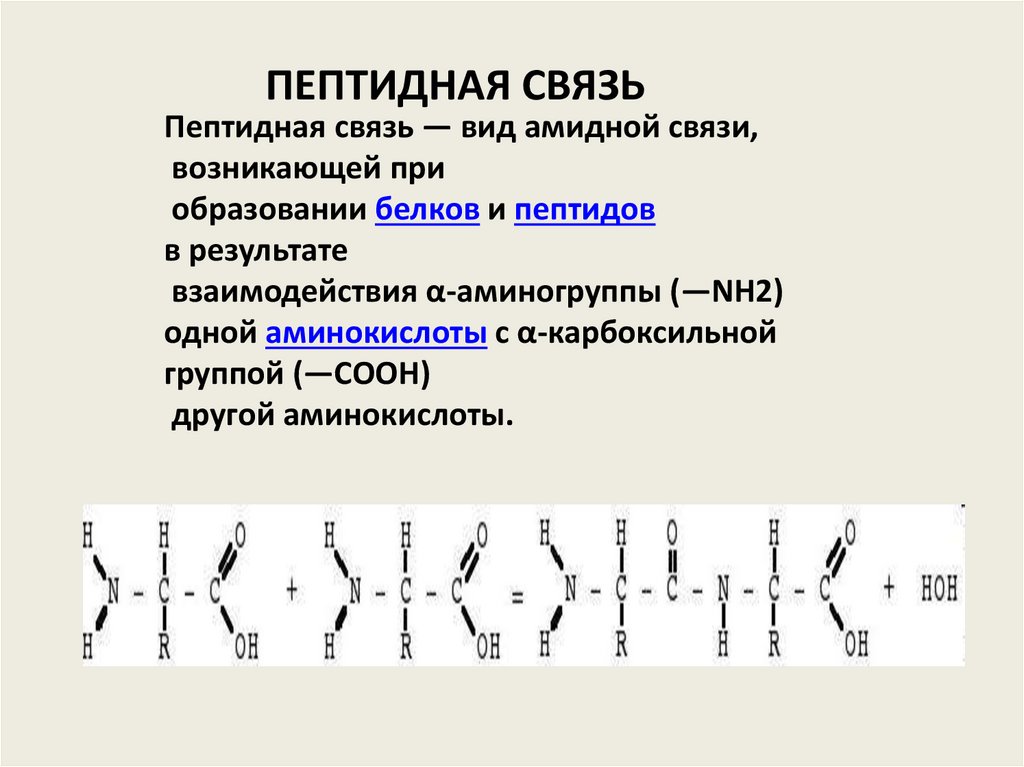
ПЕПТИДНАЯ СВЯЗЬПептидная связь — вид амидной связи,
возникающей при
образовании белков и пептидов
в результате
взаимодействия α-аминогруппы (—NH2)
одной аминокислоты с α-карбоксильной
группой (—СООН)
другой аминокислоты.
11.
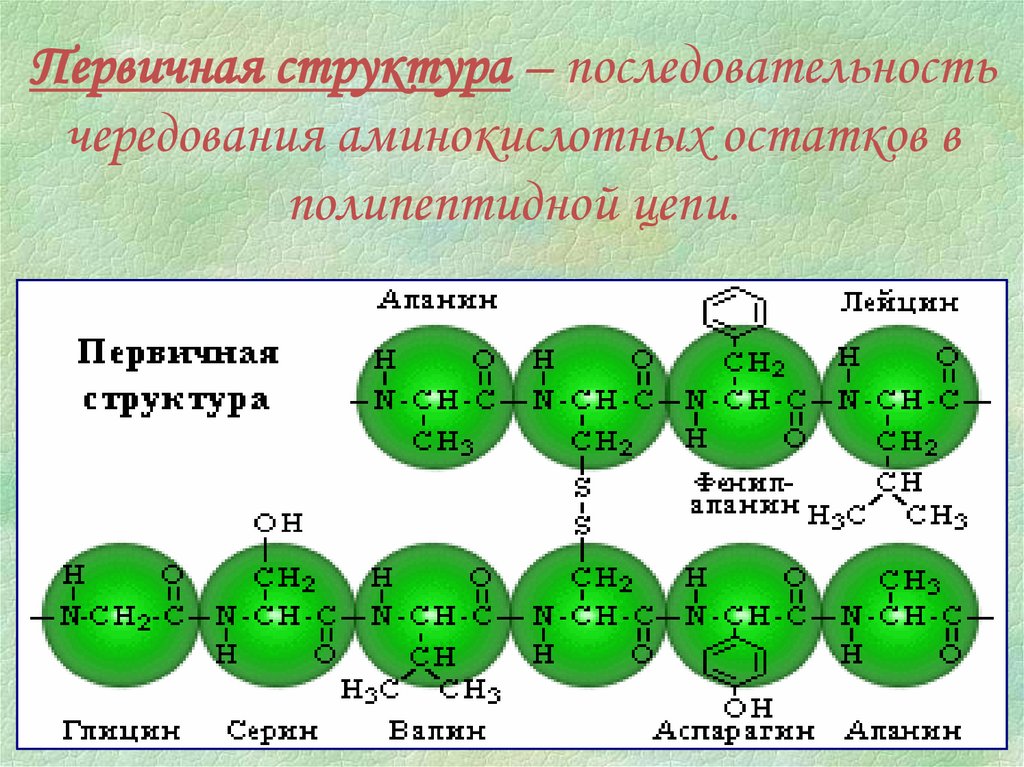
Первичная структура – последовательностьчередования аминокислотных остатков в
полипептидной цепи.
12.
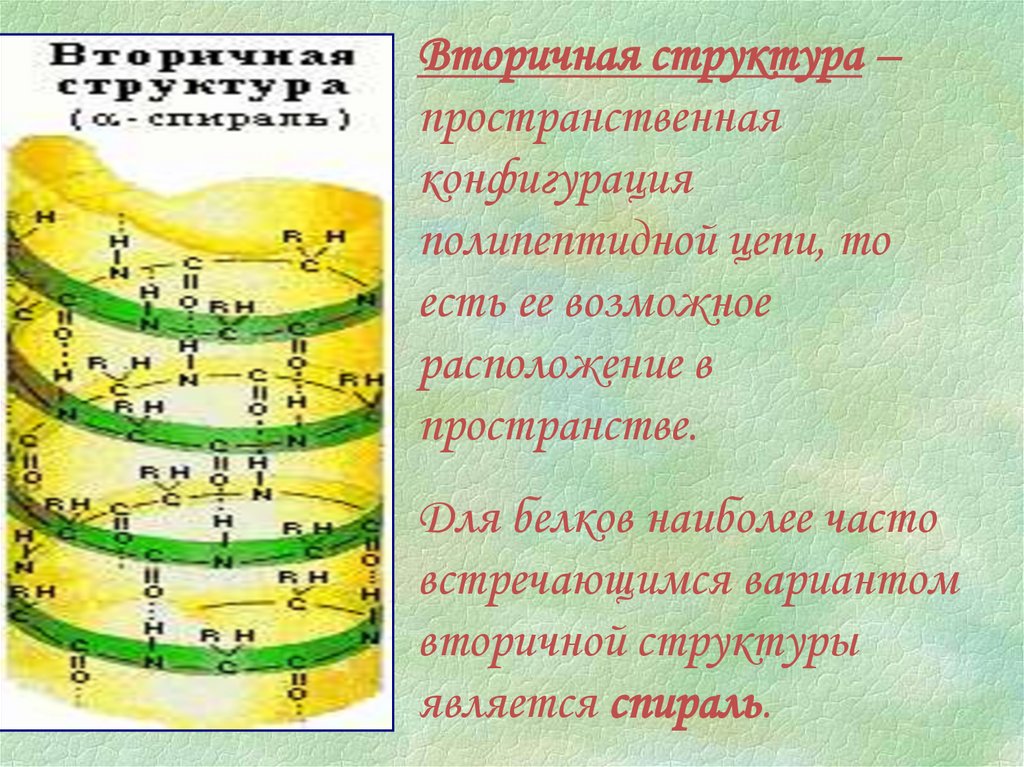
Вторичная структура –пространственная
конфигурация
полипептидной цепи, то
есть ее возможное
расположение в
пространстве.
Для белков наиболее часто
встречающимся вариантом
вторичной структуры
является спираль.
13.
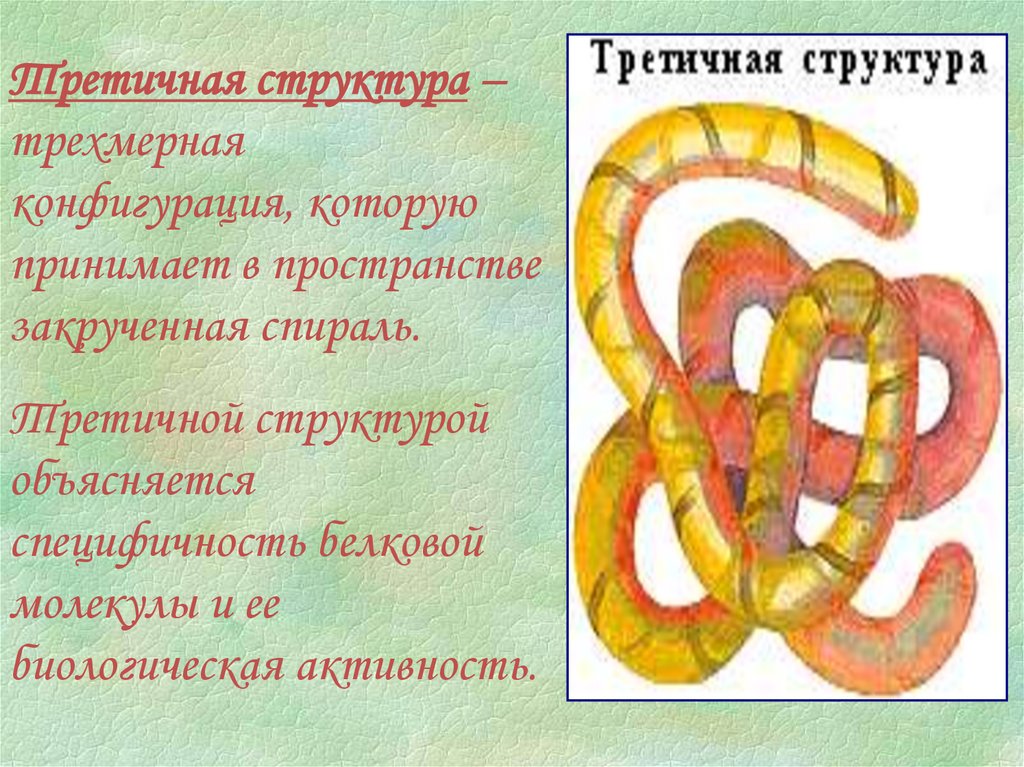
Третичная структура –трехмерная
конфигурация, которую
принимает в пространстве
закрученная спираль.
Третичной структурой
объясняется
специфичность белковой
молекулы и ее
биологическая активность.
14.
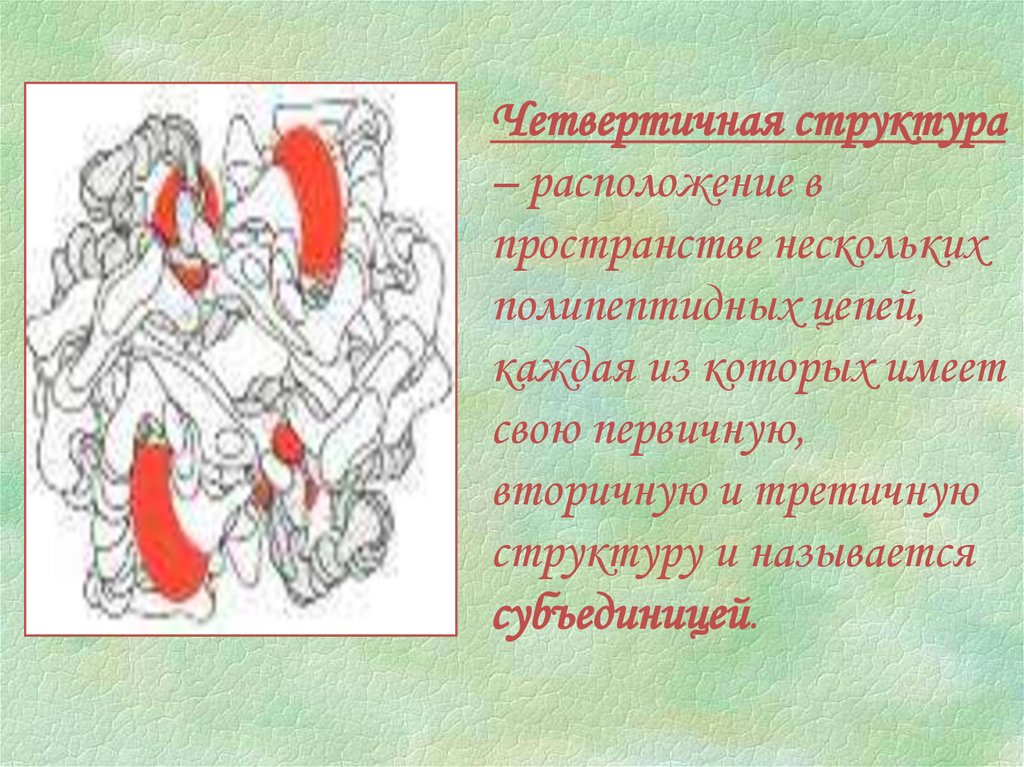
Четвертичная структура– расположение в
пространстве нескольких
полипептидных цепей,
каждая из которых имеет
свою первичную,
вторичную и третичную
структуру и называется
субъединицей.
15.
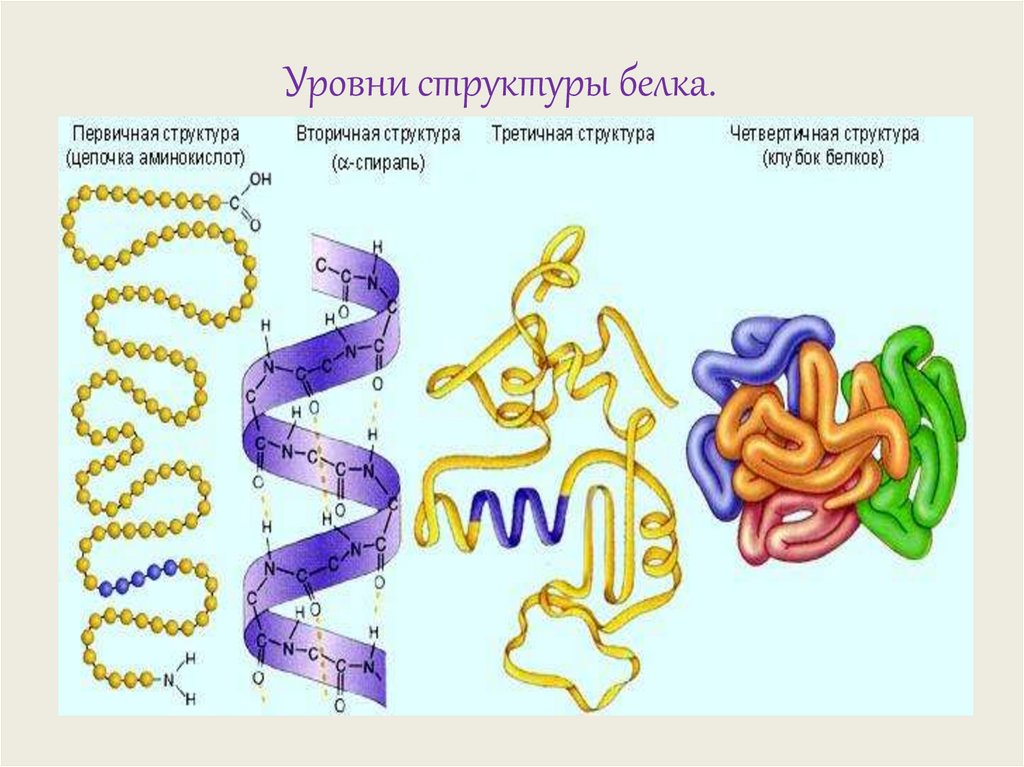
Уровни структуры белка.16.
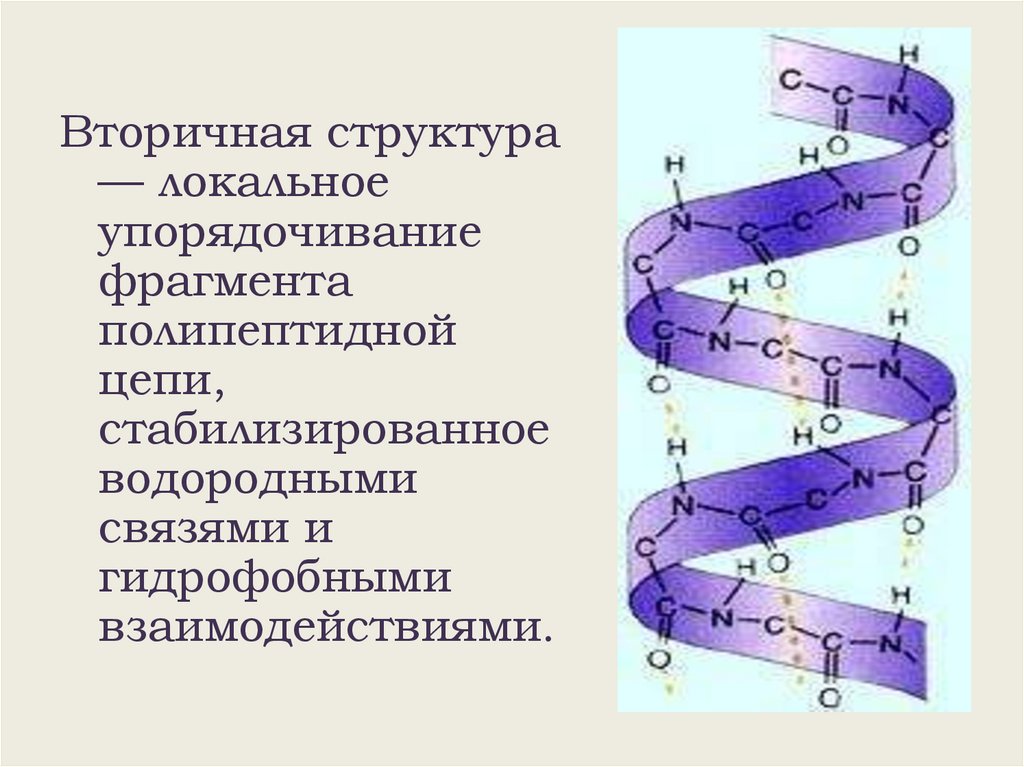
Вторичная структура— локальное
упорядочивание
фрагмента
полипептидной
цепи,
стабилизированное
водородными
связями и
гидрофобными
взаимодействиями.
17.
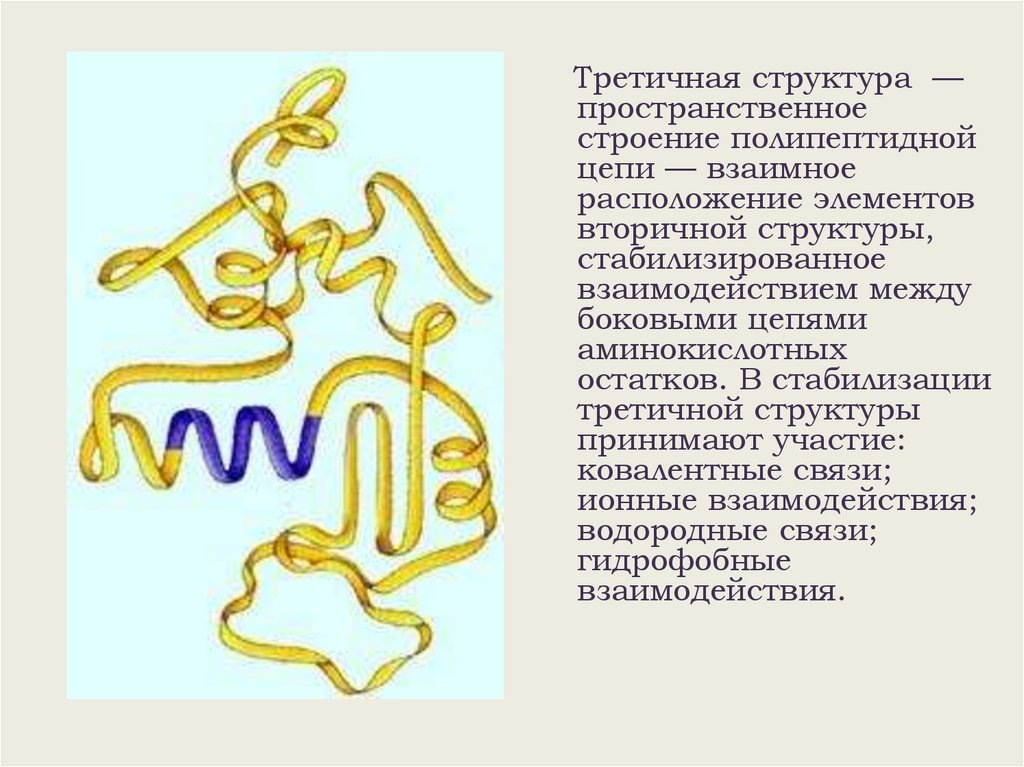
Третичная структура —пространственное
строение полипептидной
цепи — взаимное
расположение элементов
вторичной структуры,
стабилизированное
взаимодействием между
боковыми цепями
аминокислотных
остатков. В стабилизации
третичной структуры
принимают участие:
ковалентные связи;
ионные взаимодействия;
водородные связи;
гидрофобные
взаимодействия.
18.
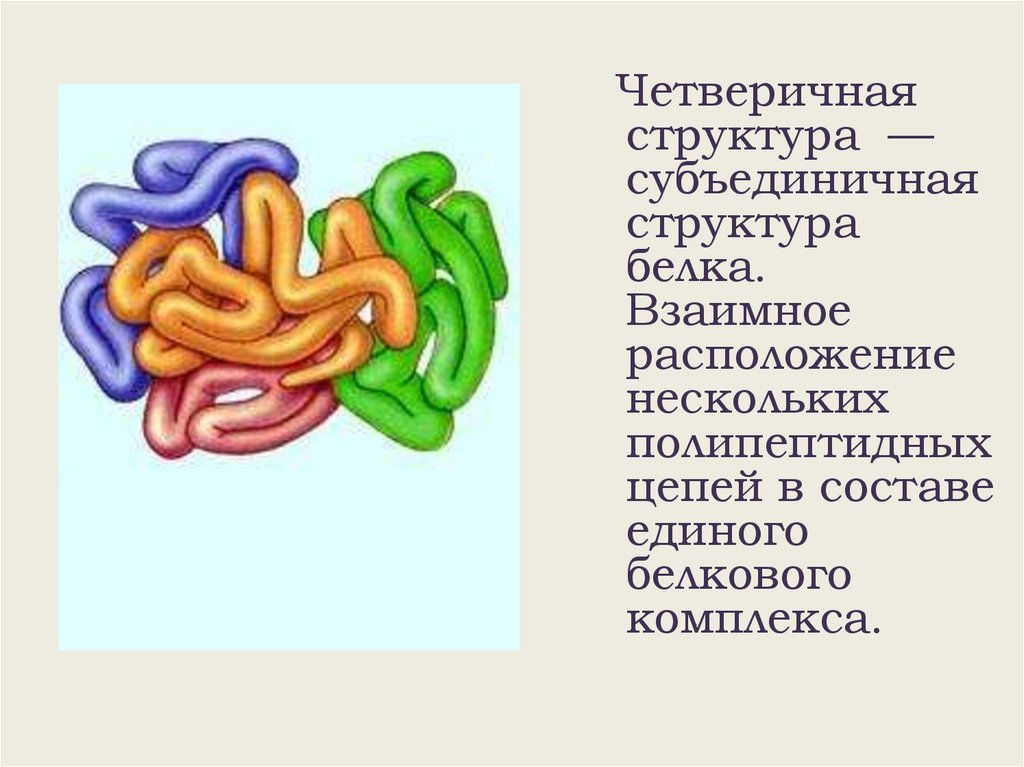
Четверичнаяструктура —
субъединичная
структура
белка.
Взаимное
расположение
нескольких
полипептидных
цепей в составе
единого
белкового
комплекса.
19.
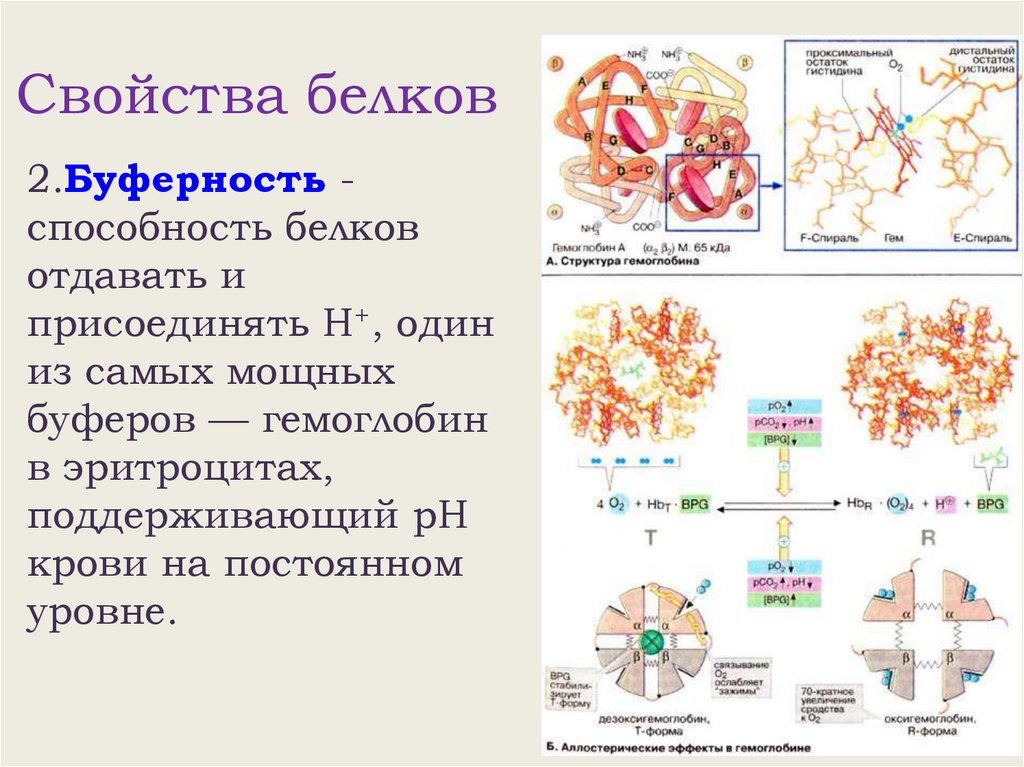
Свойства белков2.Буферность способность белков
отдавать и
присоединять Н+, один
из самых мощных
буферов — гемоглобин
в эритроцитах,
поддерживающий рН
крови на постоянном
уровне.
20.
Свойства белков3. Растворимость в воде.
Глобулярные белки Фибриллярные белки
нерастворимы
растворимы
21.
Свойства белков4. Активность.
Есть белки необычайно химически
активные (ферменты), есть химически
неактивные.
5. Устойчивость.
Есть устойчивые к воздействию
различных условий внешней среды и
крайне неустойчивые. Внешние
факторы (изменение температуры,
солевого состава среды, рН, радиация)
могут вызывать нарушение структурной
организации молекулы белка.
22.
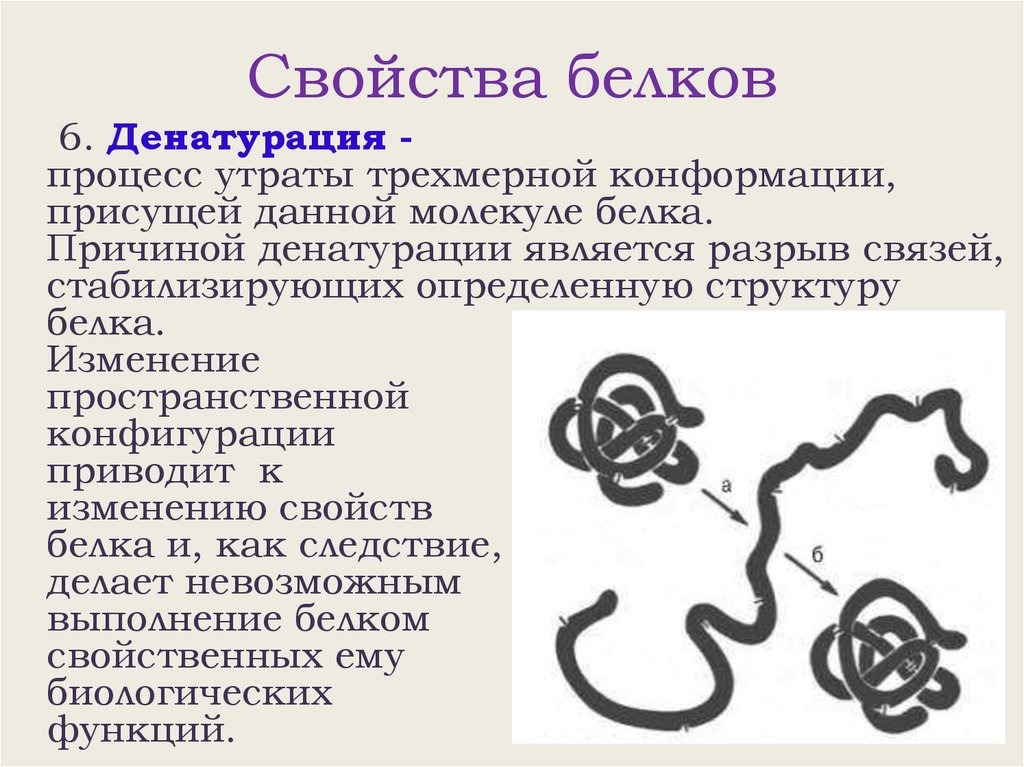
Свойства белков6. Денатурация процесс утраты трехмерной конформации,
присущей данной молекуле белка.
Причиной денатурации является разрыв связей,
стабилизирующих определенную структуру
белка.
Изменение
пространственной
конфигурации
приводит к
изменению свойств
белка и, как следствие,
делает невозможным
выполнение белком
свойственных ему
биологических
функций.
23.
Денатурация.Резкое изменение условий,
например, нагревание или
обработка белка кислотой или
щёлочью приводит к потере
четвертичной, третичной и
вторичной структур белка,
называемой денатурацией.
Самый известный случай
денатурации белка в быту —
это приготовление куриного
яйца
ОБРАТИМАЯ
Если сохранена
первичная структура
НЕОБРАТИМАЯ
Если первичная
Структура разрушена
24.
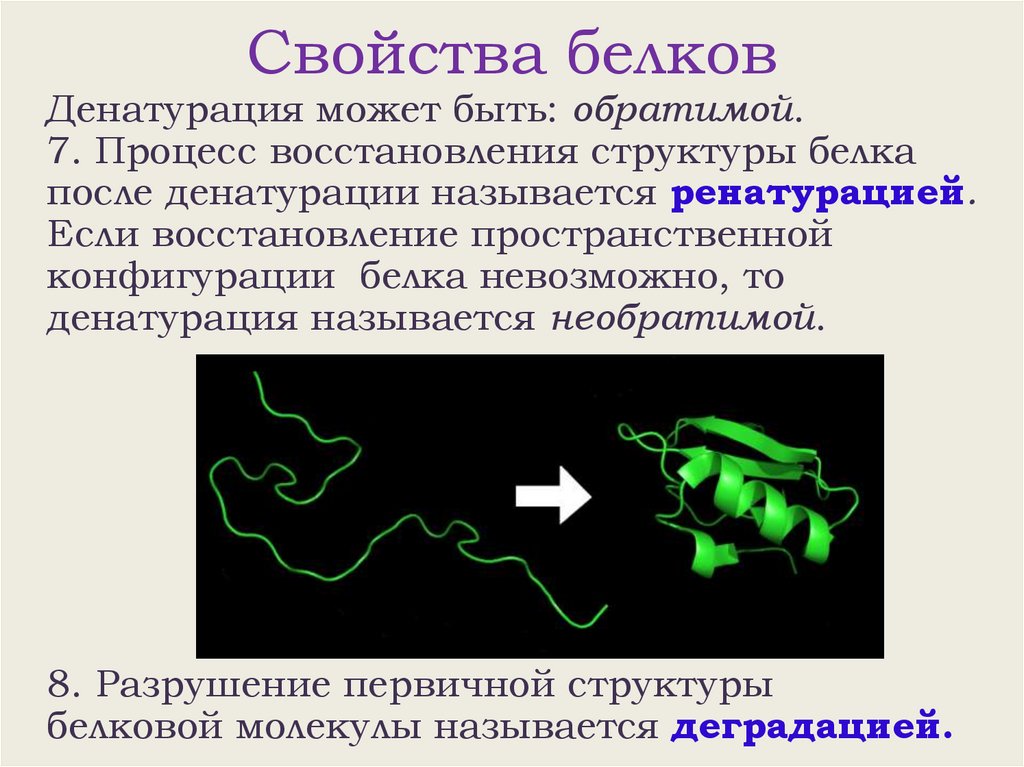
Свойства белковДенатурация может быть: обратимой.
7. Процесс восстановления структуры белка
после денатурации называется ренатурацией.
Если восстановление пространственной
конфигурации белка невозможно, то
денатурация называется необратимой.
8. Разрушение первичной структуры
белковой молекулы называется деградацией.
25.
Химические свойства белков1. Гидролиз белков
Гидролиз белков сводится к расщеплению полипептидных
связей:
26.
Превращения белков в организме27.
2. Денатурация белковДенатурация – нарушение природной
структуры белка под действием
нагревания и химических реагентов.
а) высокая или низкая температура
б) механическое воздействие;
в) облучение;
г) яды;
д) действие спирта;
б) действие солей тяжелых металлов
(Pb, Hg и др.)
28.
3. Цветные качественные реакциибелков
а) Биуретовая реакция (Cu(OH)2);
б) ксантопротеиновая реакция (HNO3
конц.);
в) взаимодействие белка с ацетатом
свинца
при нагревании.
г) горение белка
29.
Цветные реакции на белки1. Ксантопротеиновая – взаимодействие с
концентрированной азотной кислотой,
которое сопровождается появлением
желтой окраски.
2. Биуретовая – взаимодействие
слабощелочных растворов белков с раствором
сульфата меди (II), в результате которой
появляется фиолетово-синяя окраска.
30.
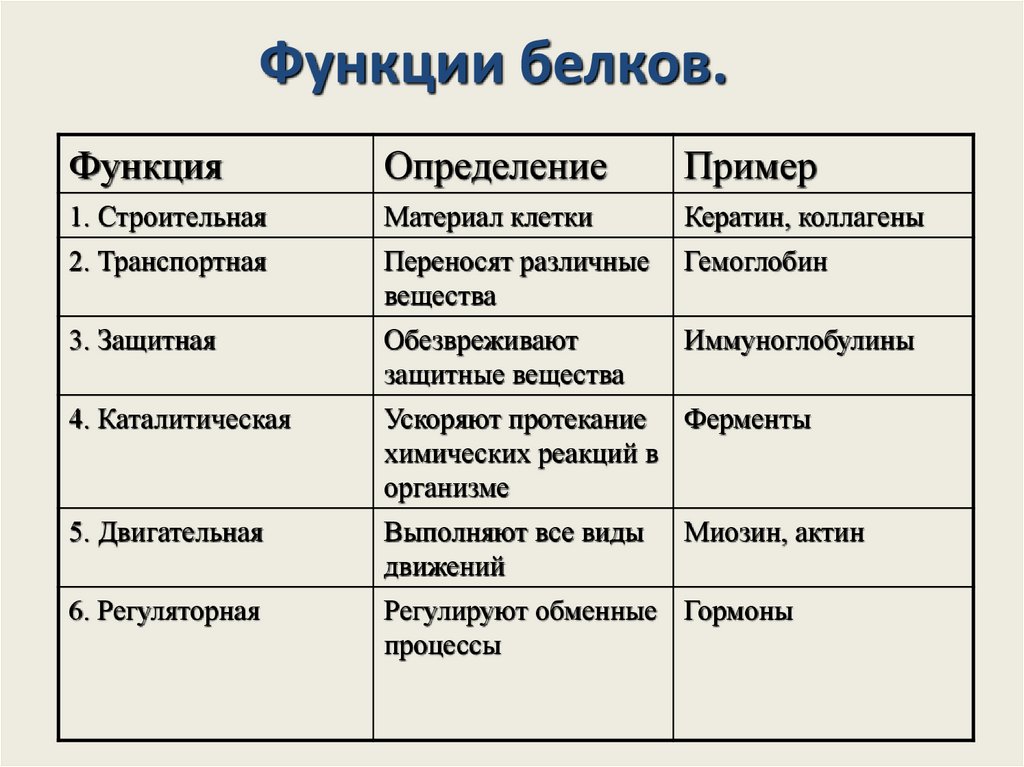
Функции белков.Функция
Определение
Пример
1. Строительная
Материал клетки
Кератин, коллагены
2. Транспортная
Переносят различные
вещества
Гемоглобин
3. Защитная
Обезвреживают
защитные вещества
Иммуноглобулины
4. Каталитическая
Ускоряют протекание Ферменты
химических реакций в
организме
5. Двигательная
Выполняют все виды
движений
6. Регуляторная
Регулируют обменные Гормоны
процессы
Миозин, актин
31.
Функции белков1. Структурная функция.
Структурные белки в комплексе с
липидами являются структурной основой
клеточных и внутриклеточных мембран.
32.
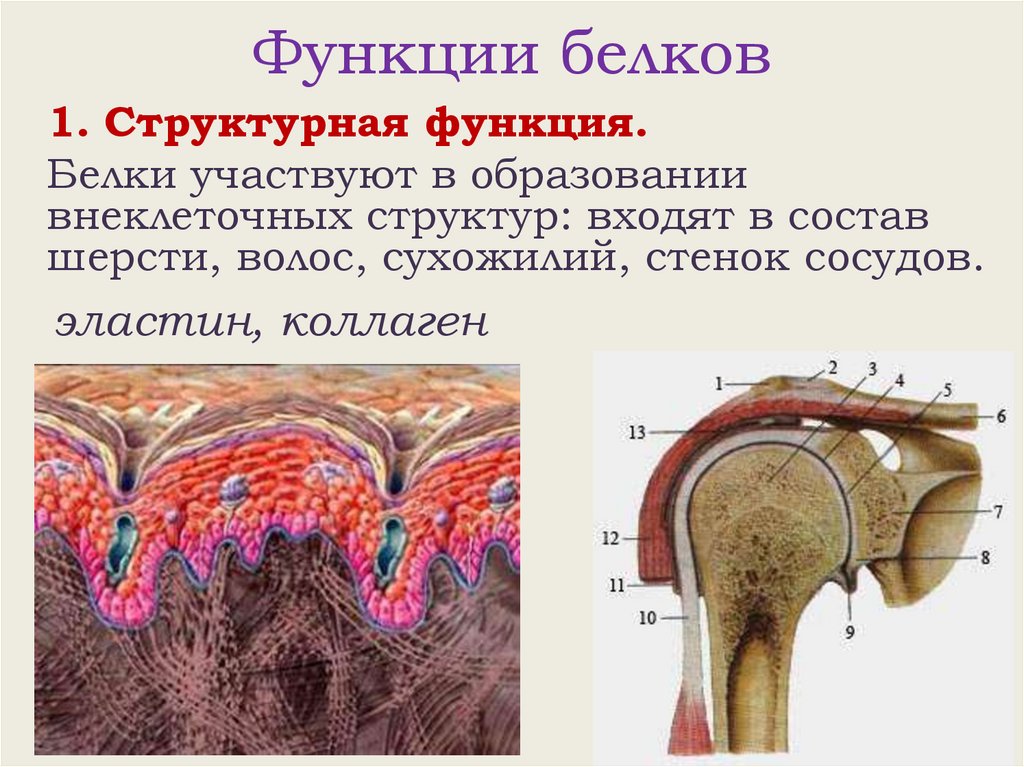
Функции белков1. Структурная функция.
Белки участвуют в образовании
внеклеточных структур: входят в состав
шерсти, волос, сухожилий, стенок сосудов.
кератин
33.
Функции белков1. Структурная функция.
Белки участвуют в образовании
внеклеточных структур: входят в состав
шерсти, волос, сухожилий, стенок сосудов.
эластин, коллаген
34.
Функции белков2. Транспортная
функция.
Некоторые белки
способны присоединять
различные вещества и
переносить их к
различным тканям и
органам тела, из одного
места клетки в другое.
Например, белок крови
гемоглобин
транспортирует
О2 и СО2
35.
Функции белков2. Транспортная
функция.
В состав клеточных
мембран входят
особые белки,
обеспечивают
активный и строго
избирательный
перенос некоторых
веществ и ионов из
клетки во внешнюю
среду и обратно.
36.
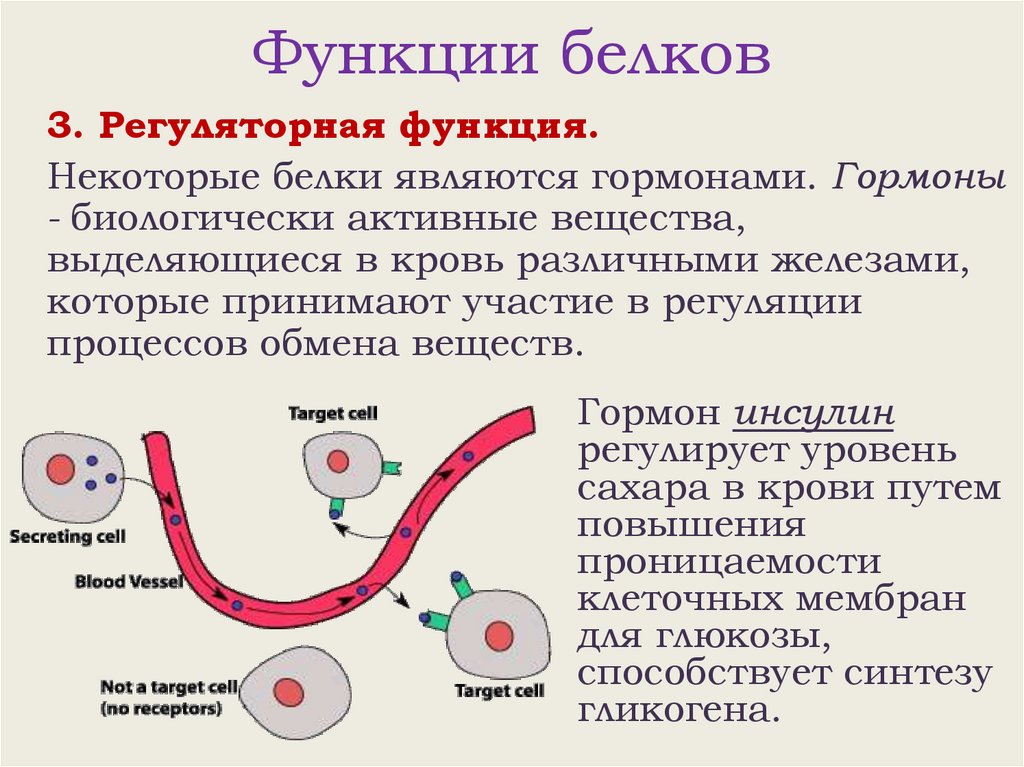
Функции белков3. Регуляторная функция.
Некоторые белки являются гормонами. Гормоны
- биологически активные вещества,
выделяющиеся в кровь различными железами,
которые принимают участие в регуляции
процессов обмена веществ.
Гормон инсулин
регулирует уровень
сахара в крови путем
повышения
проницаемости
клеточных мембран
для глюкозы,
способствует синтезу
гликогена.
37.
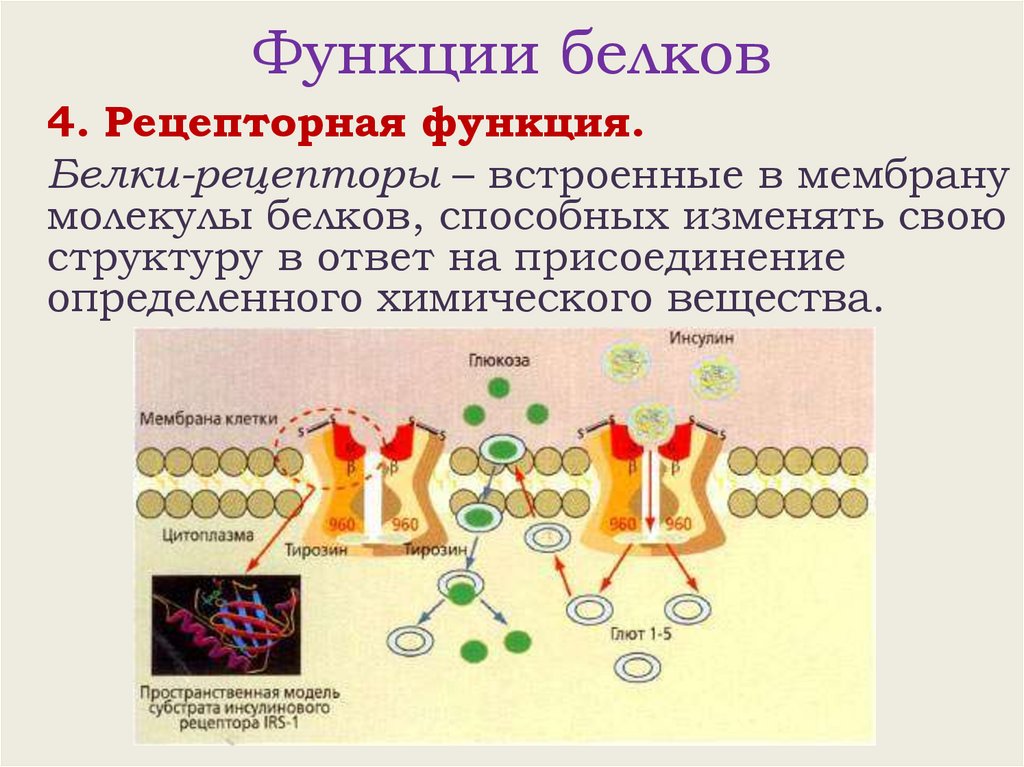
Функции белков4. Рецепторная функция.
Белки-рецепторы – встроенные в мембрану
молекулы белков, способных изменять свою
структуру в ответ на присоединение
определенного химического вещества.
38.
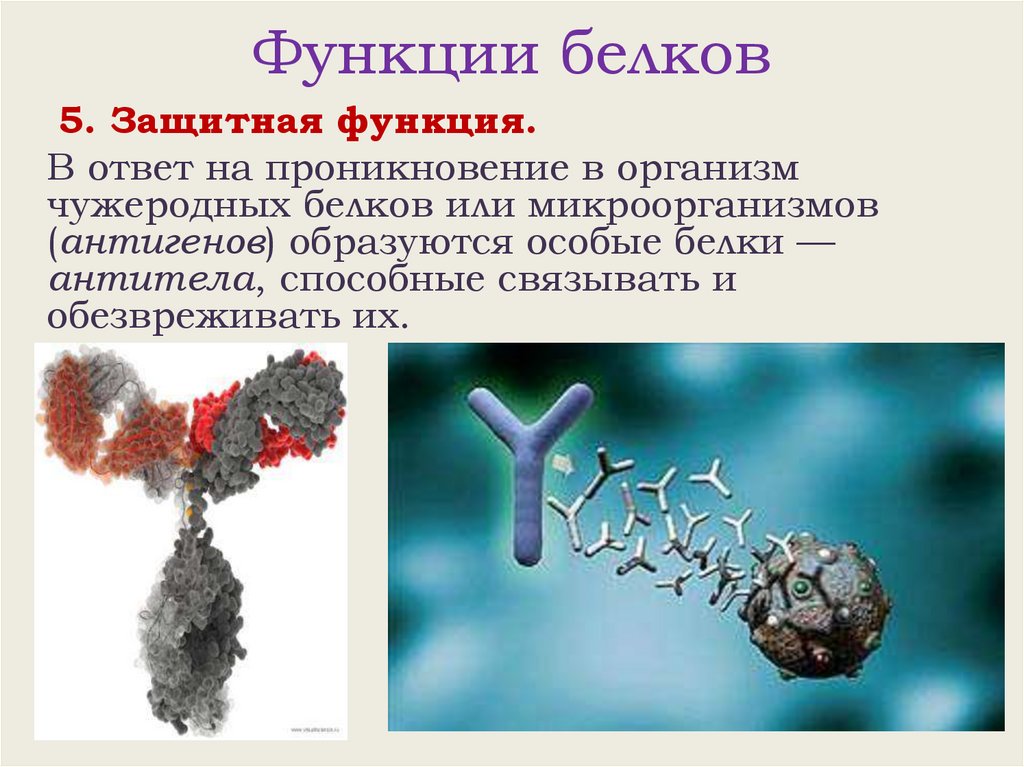
Функции белков5. Защитная функция.
В ответ на проникновение в организм
чужеродных белков или микроорганизмов
(антигенов) образуются особые белки —
антитела, способные связывать и
обезвреживать их.
39.
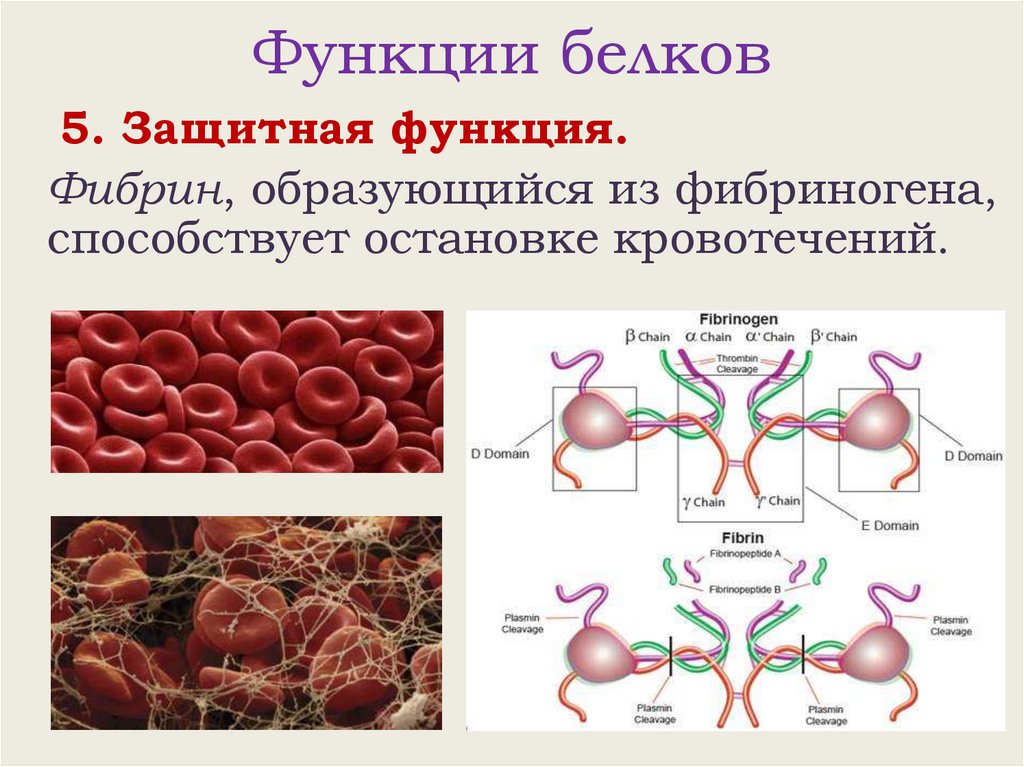
Функции белков5. Защитная функция.
Фибрин, образующийся из фибриногена,
способствует остановке кровотечений.
40.
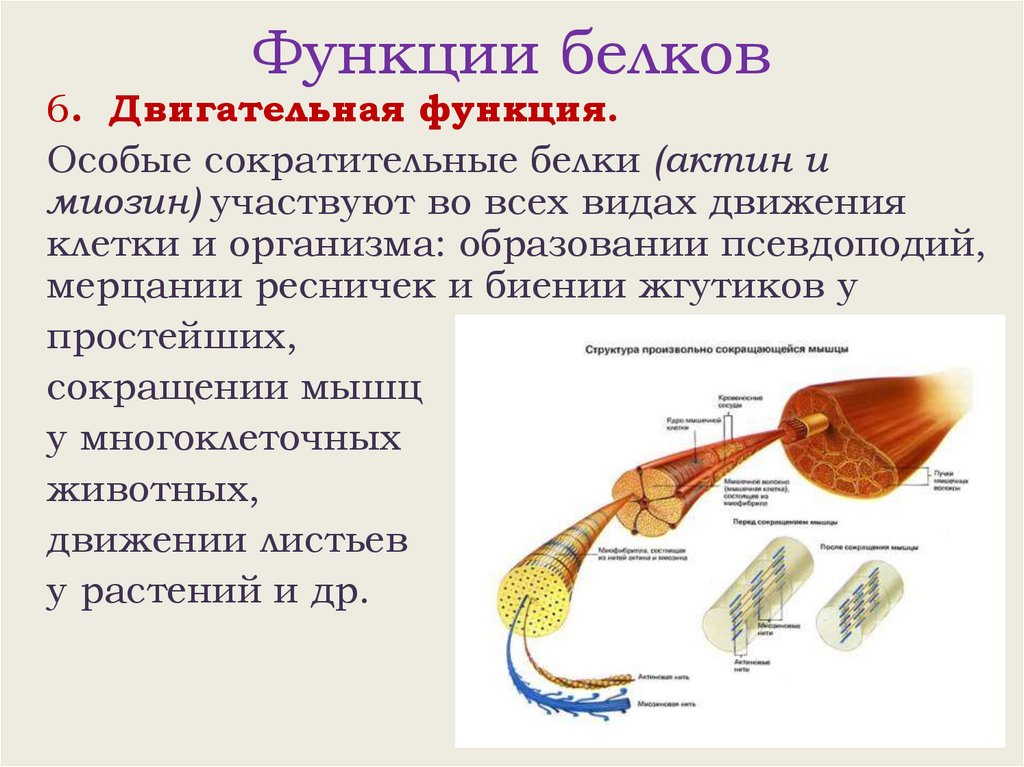
Функции белков6. Двигательная функция.
Особые сократительные белки (актин и
миозин) участвуют во всех видах движения
клетки и организма: образовании псевдоподий,
мерцании ресничек и биении жгутиков у
простейших,
сокращении мышц
у многоклеточных
животных,
движении листьев
у растений и др.
41.
Функции белков7. Запасающая функция.
Эту функцию выполняют резервные белки, которые
запасаются в качестве источника энергии.
казеин молока
альбумин яиц
Например, при распаде гемоглобина железо не
выводится из организма, а сохраняется в организме,
образуя комплекс с белком ферритином.
42.
Функции белков8. Энергетическая
функция.
При распаде 1 г белка
до конечных
продуктов выделяется
17,6 кДж энергии.
Сначала белки
распадаются до
аминокислот, а затем
до конечных
продуктов:
• воды,
• углекислого газа,
• аммиака.
43.
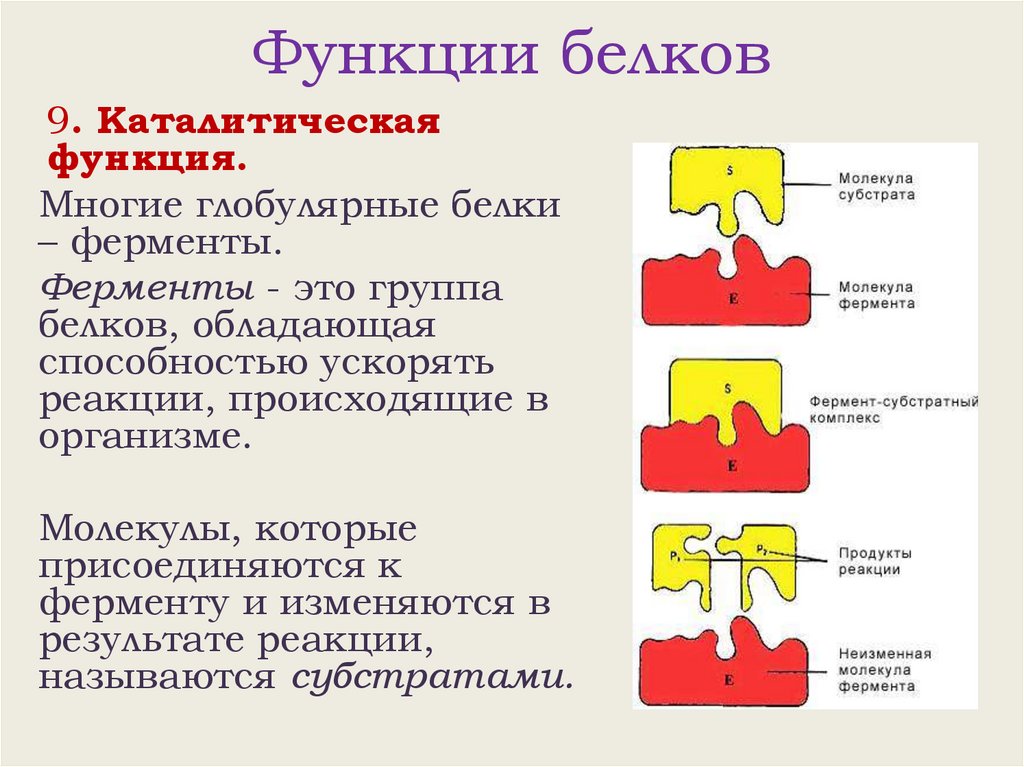
Функции белков9. Каталитическая
функция.
Многие глобулярные белки
– ферменты.
Ферменты - это группа
белков, обладающая
способностью ускорять
реакции, происходящие в
организме.
Молекулы, которые
присоединяются к
ферменту и изменяются в
результате реакции,
называются субстратами.
44.
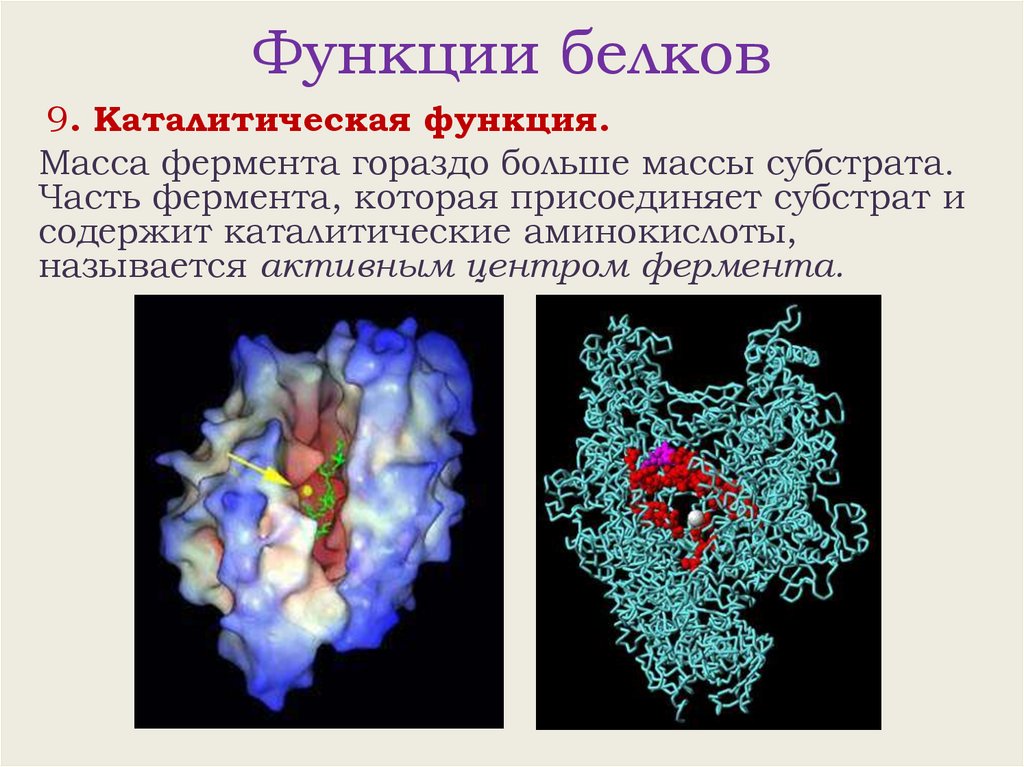
Функции белков9. Каталитическая функция.
Масса фермента гораздо больше массы субстрата.
Часть фермента, которая присоединяет субстрат и
содержит каталитические аминокислоты,
называется активным центром фермента.
45.
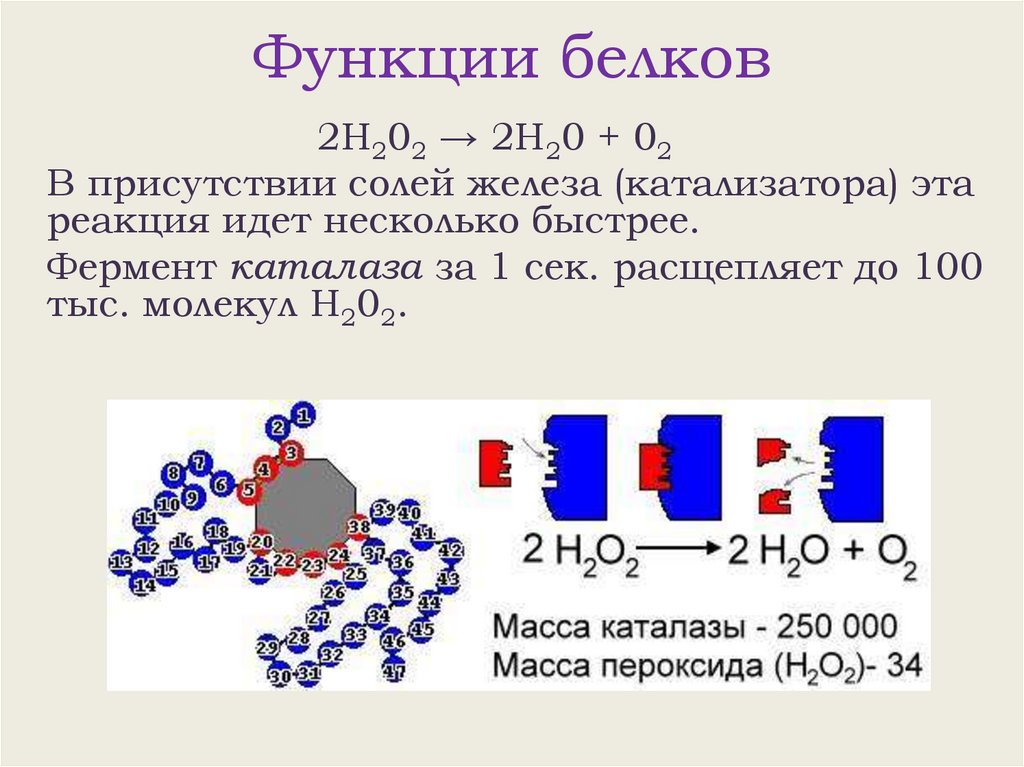
Функции белков2Н202 → 2Н20 + 02
В присутствии солей железа (катализатора) эта
реакция идет несколько быстрее.
Фермент каталаза за 1 сек. расщепляет до 100
тыс. молекул Н202.
46.
Значение белков• Отдельные белки находят применение в
народном хозяйстве, например белки шерсти,
шелка, кожи и рогов животных.
• Выяснение структуры белков, их многообразных
функций в организме позволяет понять
механизм наследственности, что в свою очередь,
имеет большое значение для выведения
высокопродуктивных пород животных и сортов
растений.
• Изучение белков важно и для выяснения
природы заболеваний, наблюдаемых у человека
и животных



















 chemistry
chemistry








