Similar presentations:
Строение, свойства и многообразие функций белков
1. Лекция № 3. Строение, свойства и многообразие функций белков
2. План лекции
1) Аминокислоты – мономеры белков
2) Классификация аминокислот
3) Пептидная связь
4) Уровни организации белковой молекулы
5) Химические и физические свойства
белков
• 6) Методы анализа белков
• 7) Функции белков
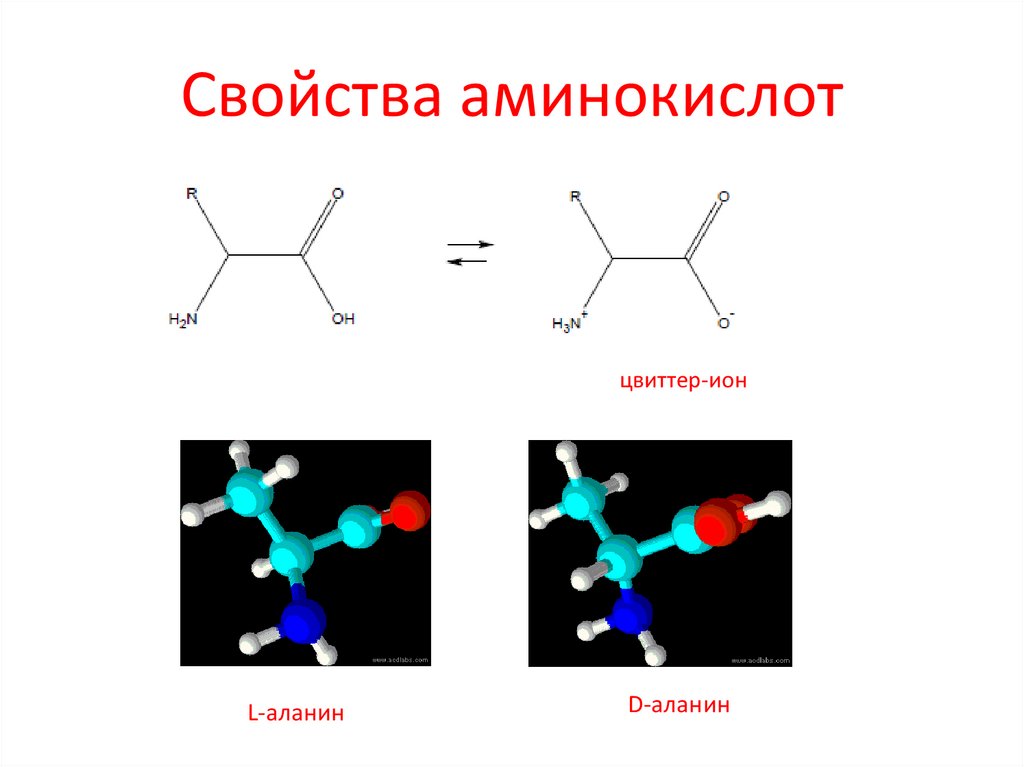
3. Свойства аминокислот
цвиттер-ионL-аланин
D-аланин
4. Биологические функции
• 1) Входят в состав пептидов и белков;• 2) Метаболиты и коферменты (орнитин);
• 3) Нейромедиаторы и гормоны (ГАМК);
5. БЕЛКИ – нерегулярные биополимеры
• Мономеры полипептидов протеиногенные 19 α-L-аминокислот ииминокислота (пролин).
6. Классификация аминокислот
• Неполярные, или алифатическиеглицин
лейцин
аланин
изолейцин
валин
метионин
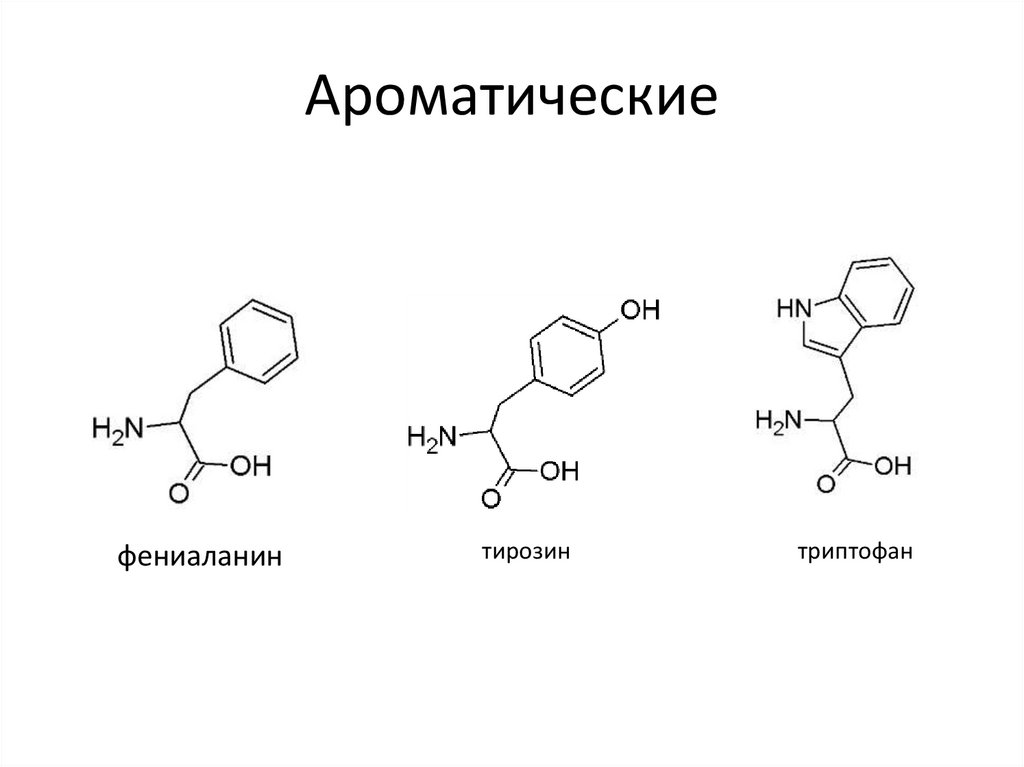
7. Ароматические
фениаланинтирозин
триптофан
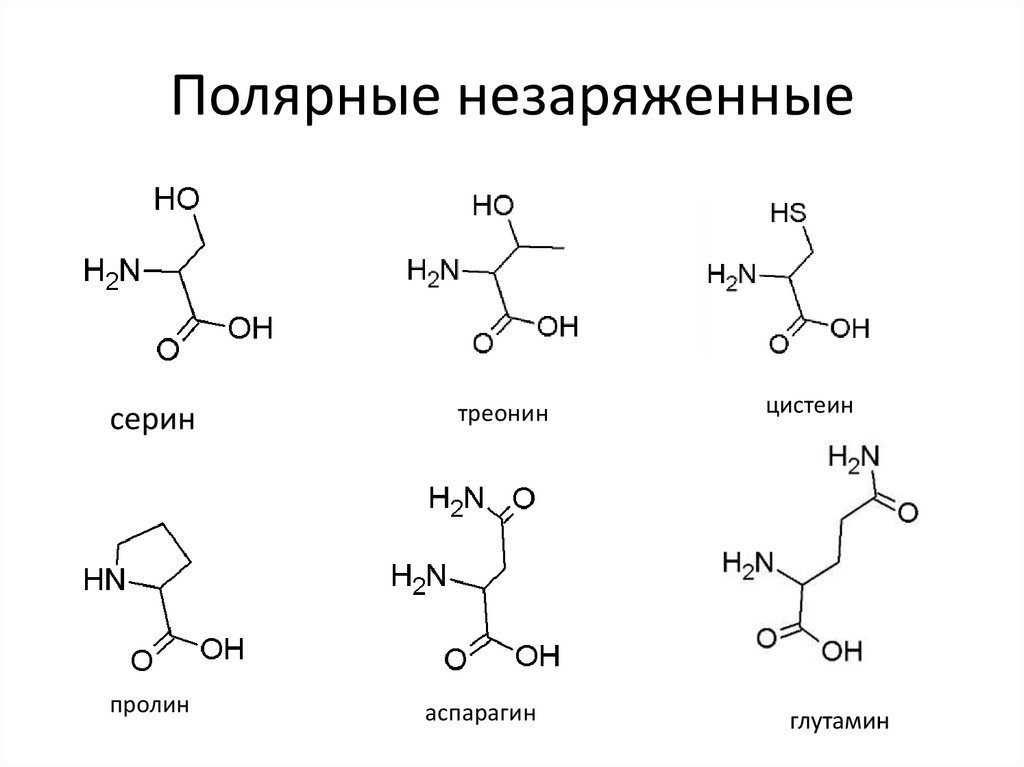
8. Полярные незаряженные
серинпролин
треонин
аспарагин
цистеин
глутамин
9. Положительно заряженные
лизинаргинин
гистидин
10. Отрицательно заряженные
аспарагиноваякислота
глутаминовая кислота
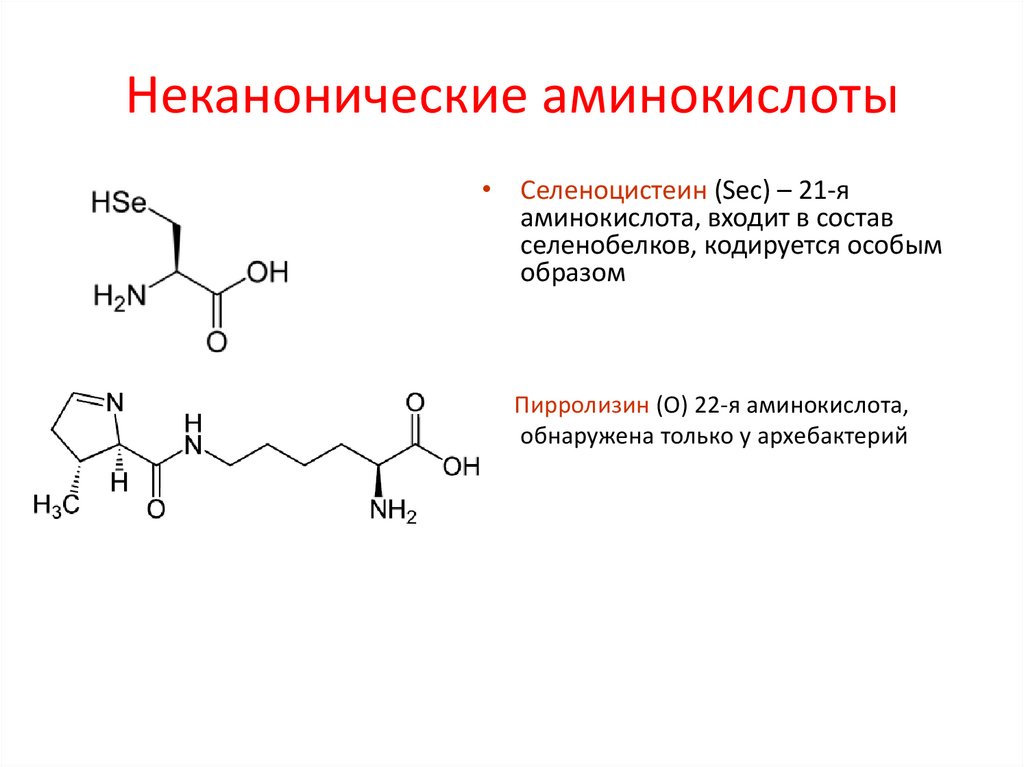
11. Неканонические аминокислоты
• Селеноцистеин (Sec) – 21-яаминокислота, входит в состав
селенобелков, кодируется особым
образом
Пирролизин (О) 22-я аминокислота,
обнаружена только у архебактерий
12. НЕЗАМЕНИМЫЕ АМИНОКИСЛОТЫ
• не могут быть синтезированы в организме• необходимо поступление в организм с пищей.
Для человека: аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин,
триптофан и фенилаланин.
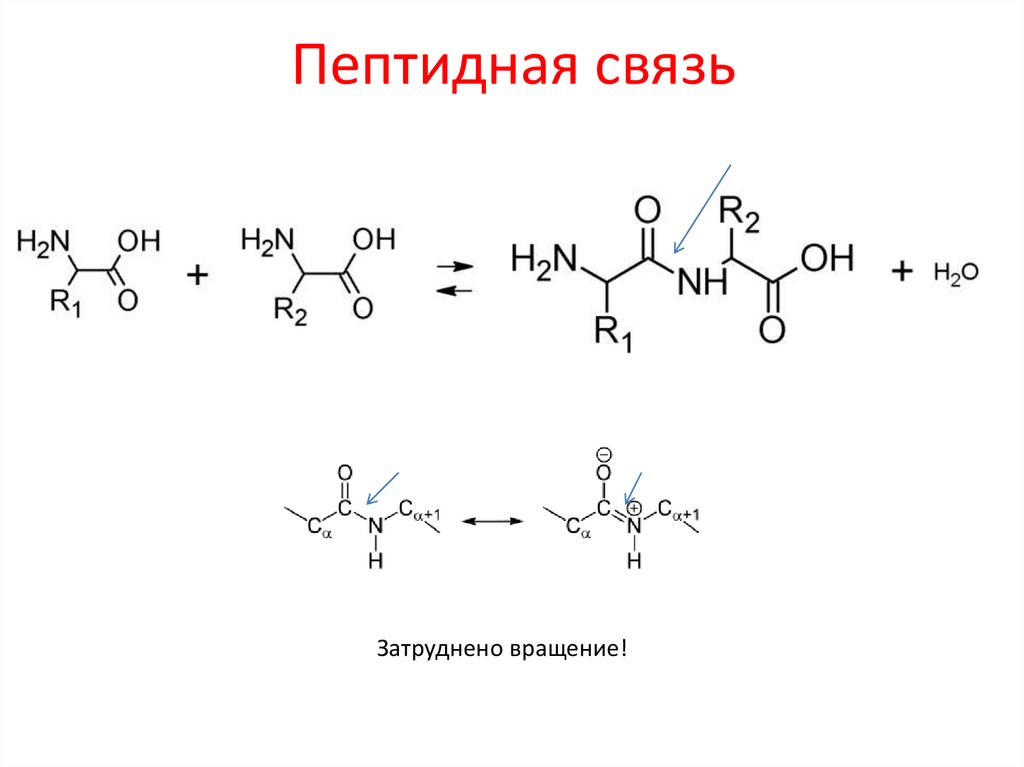
13. Пептидная связь
Затруднено вращение!14. ПОЛИПЕПТИДЫ
• Белки – от 100 до 2000аминокислотных
остатков
• Многообразие – число и
порядок аминокислот
• Упорядоченность
структуры
Белковые и вирусные кристаллы,
выращенные на косм. кораблях
(NASA Marshall Space Flight Center)
15. Уровни организации белковой молекулы
• Первичная структурапоследовательность аминокислотных
остатков
Первичная структура
инсулина человека
(http://www.interactive-biology.com)
Разрушение первичной структуры – гидролиз!
16. Вторичная структура белка
• упорядочивание за счет водородных связейАльфа спирали
Лайнус Карл Полинг
(1901-1994)
Нобелевская премия по химии 1954 г.
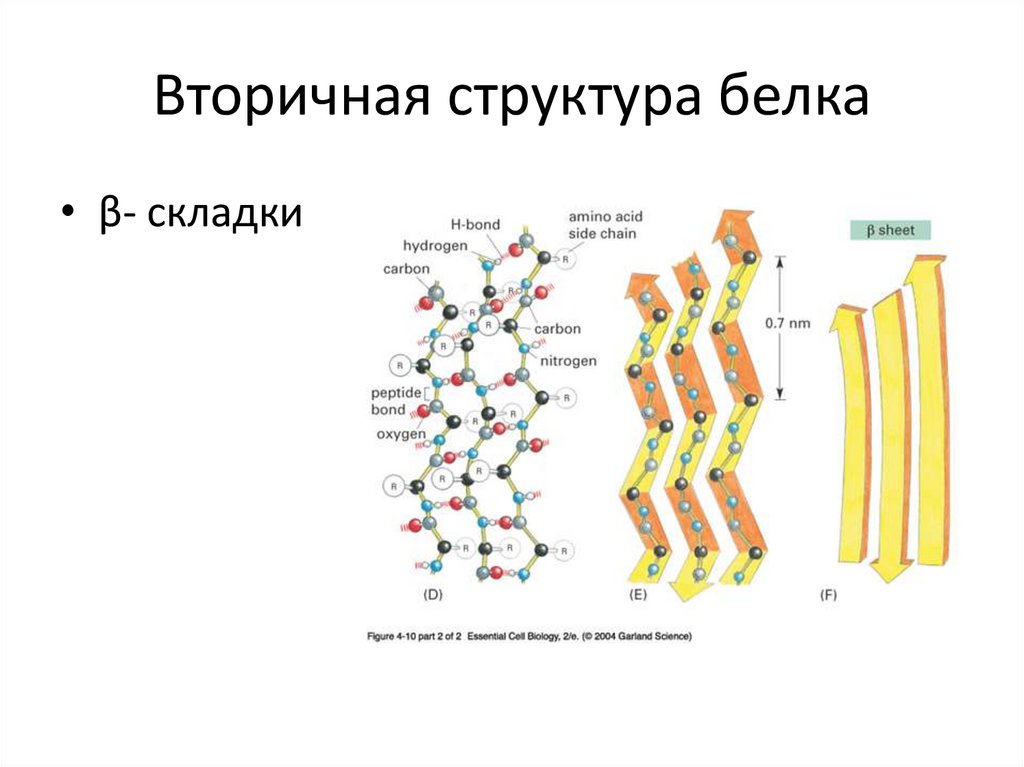
17. Вторичная структура белка
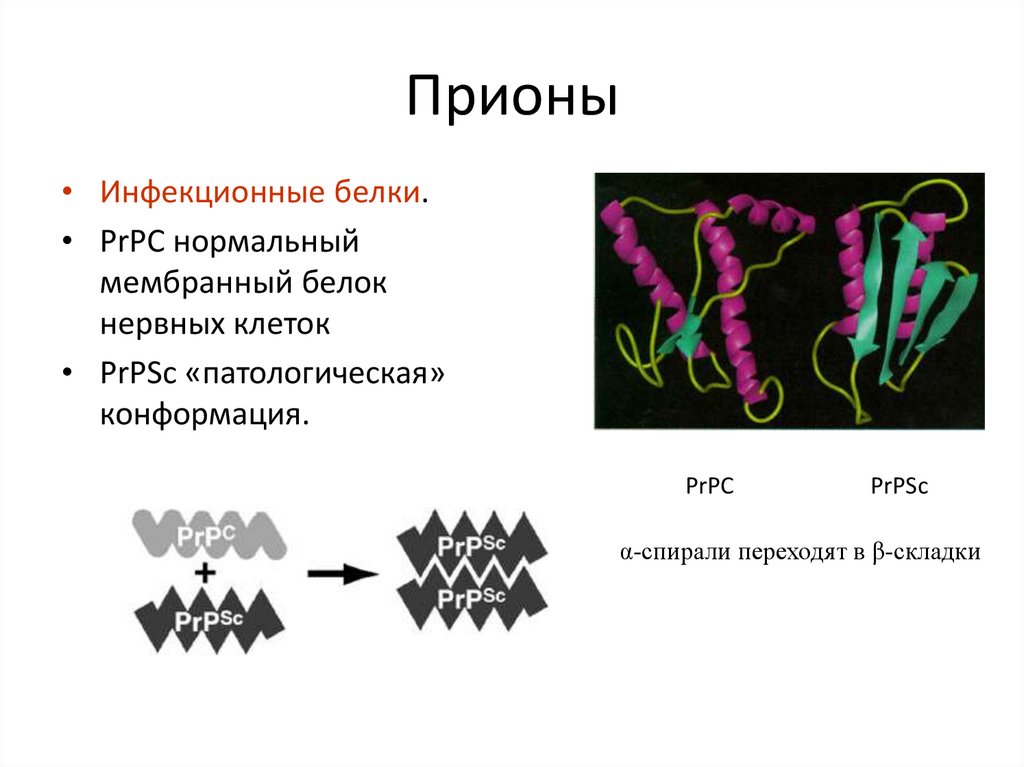
• β- складки18. Прионы
• Инфекционные белки.• PrPC нормальный
мембранный белок
нервных клеток
• PrPSc «патологическая»
конформация.
PrPC
PrPSc
α-спирали переходят в β-складки
19. ТРЕТИЧНАЯ СТРУКТУРА БЕЛКА
• Пространственное расположениеполипептидной цепи, обусловленное
взаимодействием между боковыми
группами аминокислотных остатков
гидрофобные
водородные
ковалентные
ионные
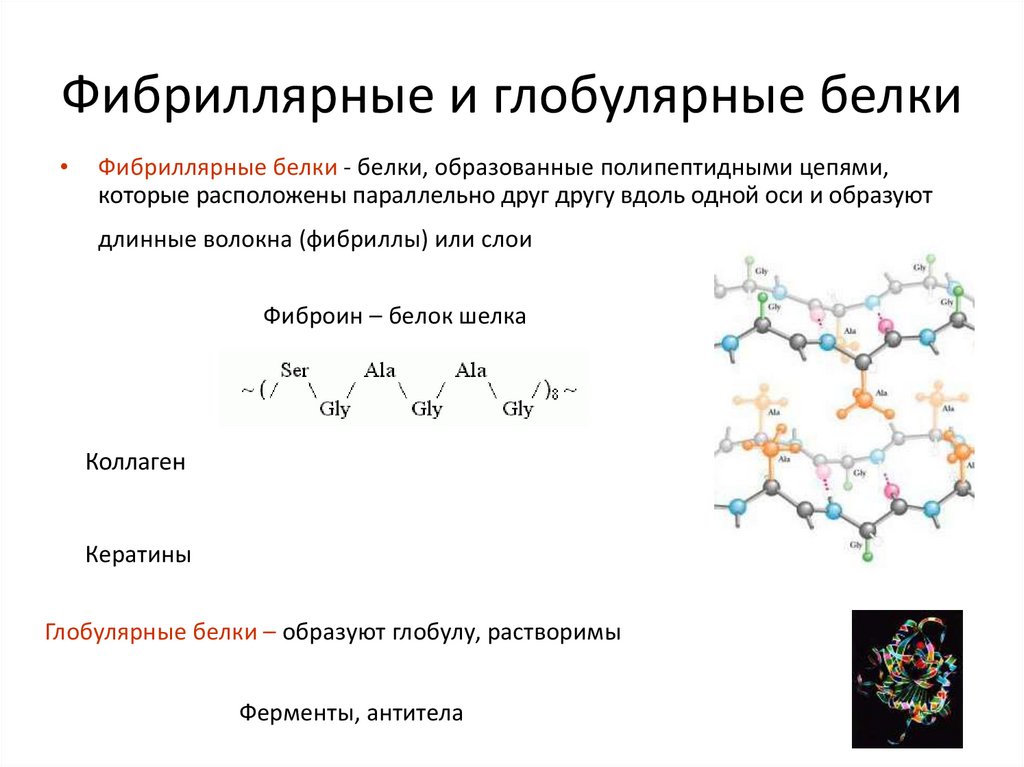
20. Фибриллярные и глобулярные белки
Фибриллярные белки - белки, образованные полипептидными цепями,
которые расположены параллельно друг другу вдоль одной оси и образуют
длинные волокна (фибриллы) или слои
Фиброин – белок шелка
Коллаген
Кератины
Глобулярные белки – образуют глобулу, растворимы
Ферменты, антитела
21. ЧЕТВЕРТИЧНАЯ СТРУКТУРА БЕЛКА
Взаимное расположение нескольких
полипептидных цепей в составе
единого белкового комплекса
Гемоглобин – тетрамер, содержащий
4 полипептидные цепи
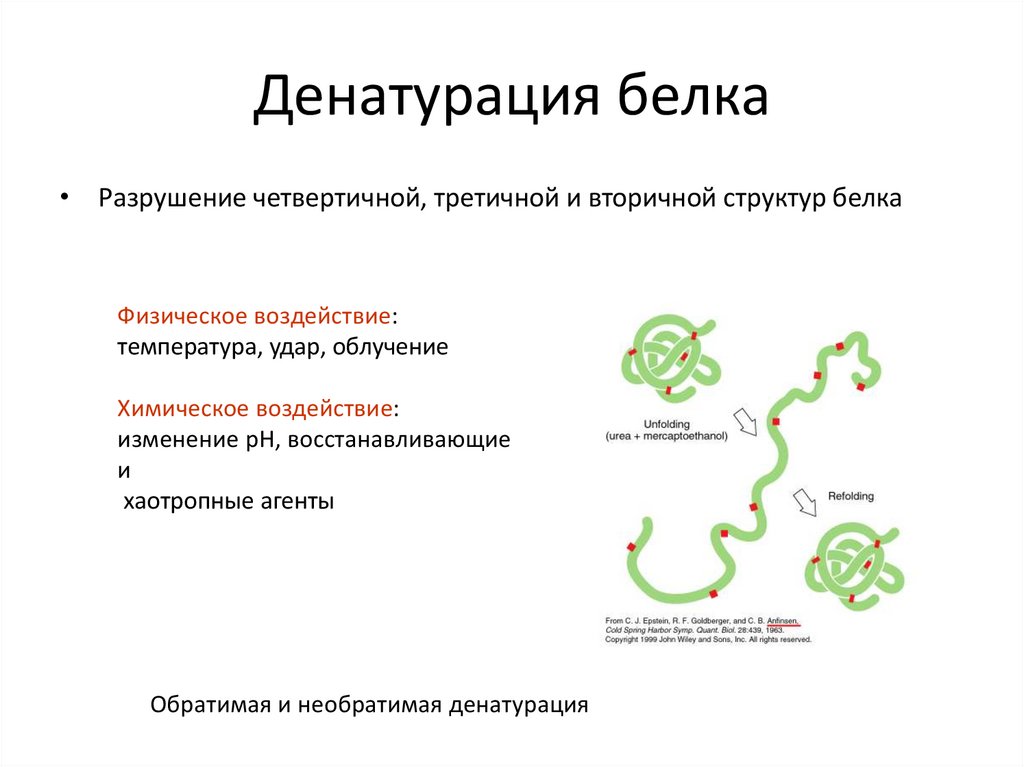
22. Денатурация белка
• Разрушение четвертичной, третичной и вторичной структур белкаФизическое воздействие:
температура, удар, облучение
Химическое воздействие:
изменение pH, восстанавливающие
и
хаотропные агенты
Обратимая и необратимая денатурация
23. Шапероны
Белки,
восстанавливающие
правильную третичную
структуру повреждённых
белков (синтез
увеличивается в ответ на
тепловой шок)
Обнаружены во всех про- и эукариотах!
24. Физические свойства белков
Размер – в среднем 300-500 а/к, самый крупный – коннектин
38138 а/к
Заряд (изоэлектрическая точка)
Основные белки (гистоны, протамины, pI=11)
Кислые белки (пепсин, pI=1)
25. Гидролиз белка
• Разрушение первичной структурыферментативный
химический
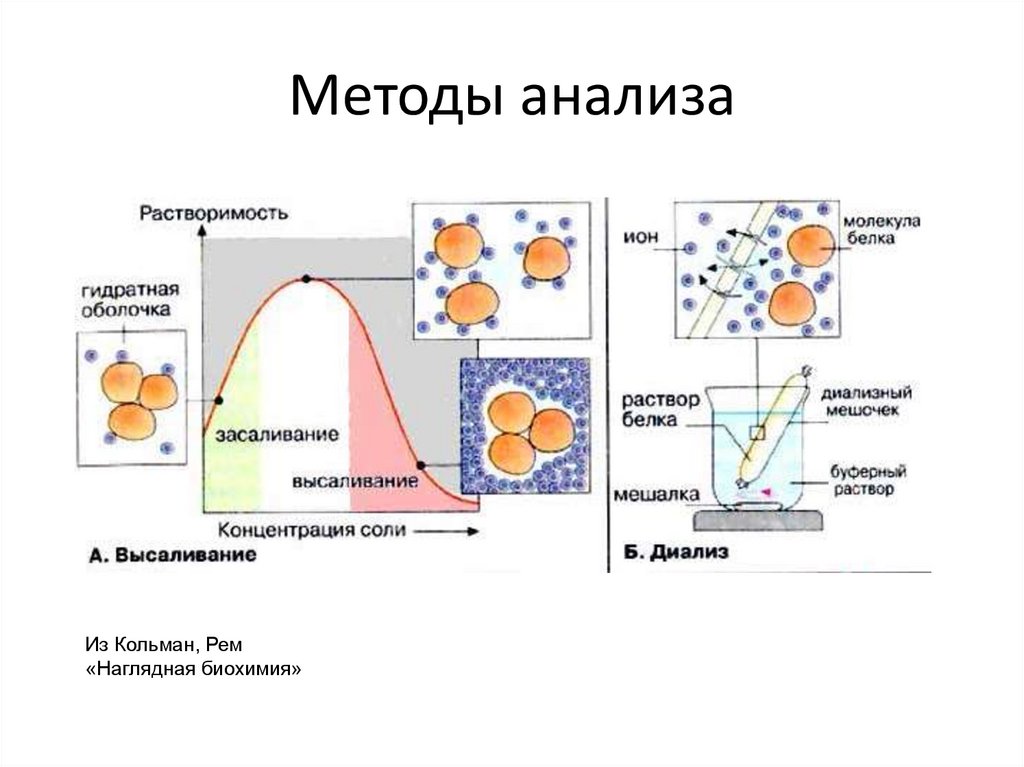
26. Методы анализа
Из Кольман, Рем«Наглядная биохимия»
27. Методы анализа белков
Из Кольман, Рем«Наглядная биохимия»
28. Методы анализа белков
• Рентгеноструктурный анализЭлектронная микроскопия
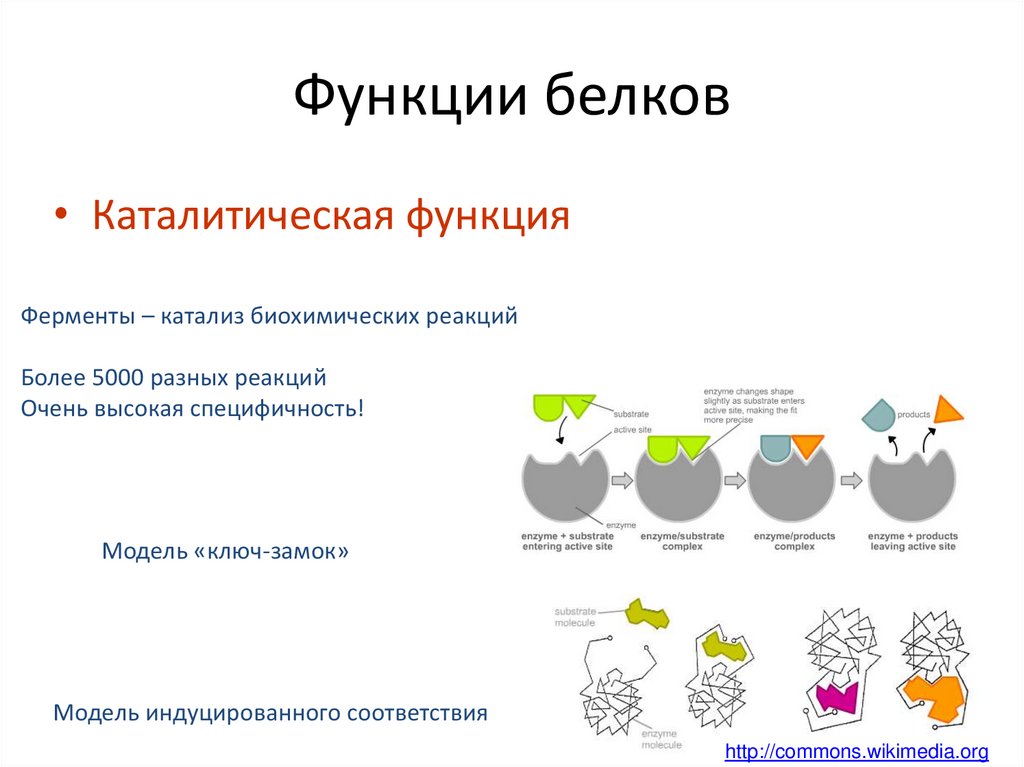
29. Функции белков
• Каталитическая функцияФерменты – катализ биохимических реакций
Более 5000 разных реакций
Очень высокая специфичность!
Модель «ключ-замок»
Модель индуцированного соответствия
http://commons.wikimedia.org
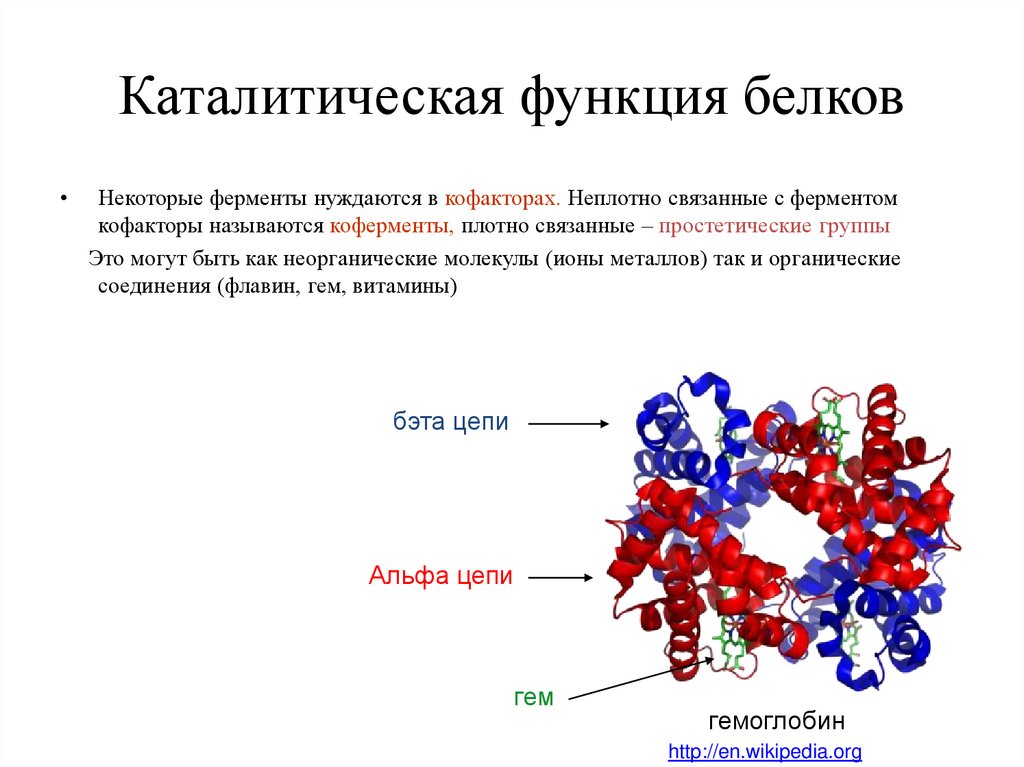
30. Каталитическая функция белков
Некоторые ферменты нуждаются в кофакторах. Неплотно связанные с ферментом
кофакторы называются коферменты, плотно связанные – простетические группы
Это могут быть как неорганические молекулы (ионы металлов) так и органические
соединения (флавин, гем, витамины)
бэта цепи
Альфа цепи
гем
гемоглобин
http://en.wikipedia.org
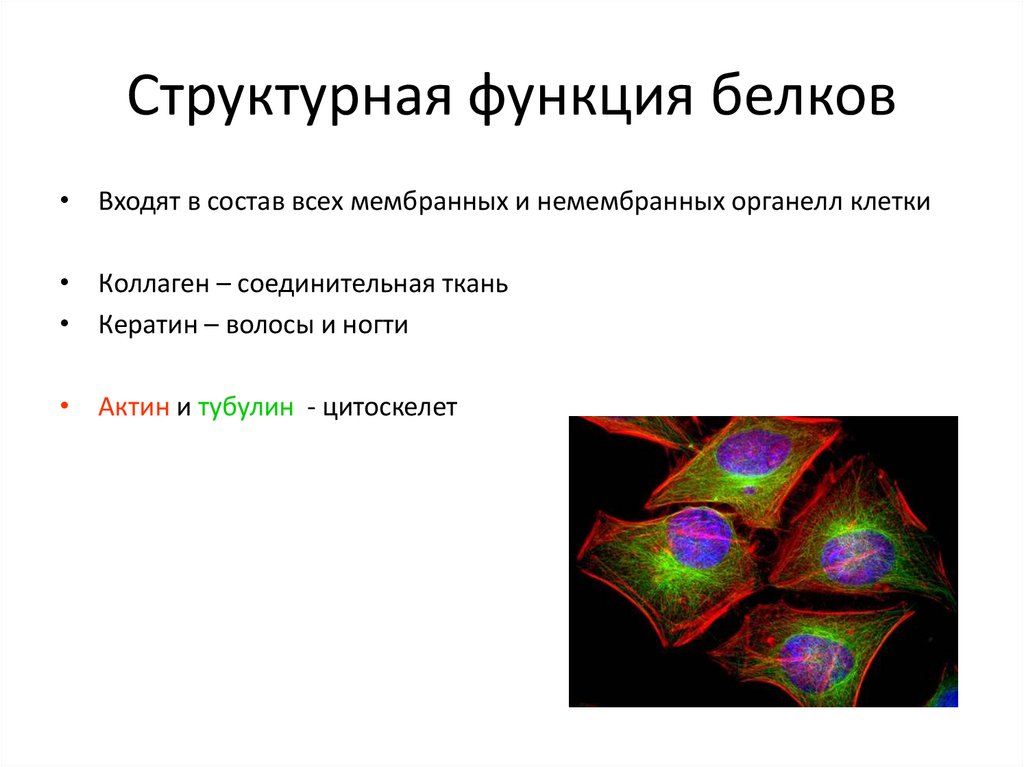
31. Структурная функция белков
• Входят в состав всех мембранных и немембранных органелл клетки• Коллаген – соединительная ткань
• Кератин – волосы и ногти
• Актин и тубулин - цитоскелет
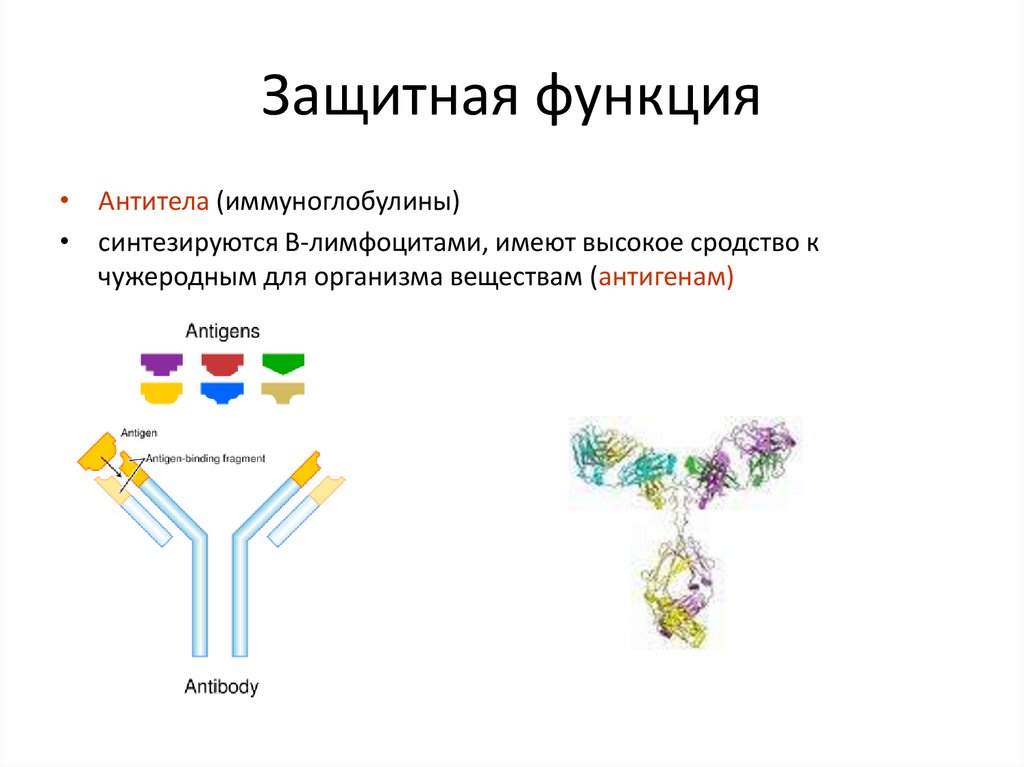
32. Защитная функция
• Антитела (иммуноглобулины)• синтезируются В-лимфоцитами, имеют высокое сродство к
чужеродным для организма веществам (антигенам)
33. Регуляторная функция
• Белки – гормоны (инсулин)• Факторы роста
• Белки - регуляторы активности генов
(активаторы и репрессоры)
34. Транспортная функция
• Гемоглобин, аполипопротеины• Ионные каналы мембран
35. Запасная и питательная функции
• Овальбумин яйцаКазеин молока
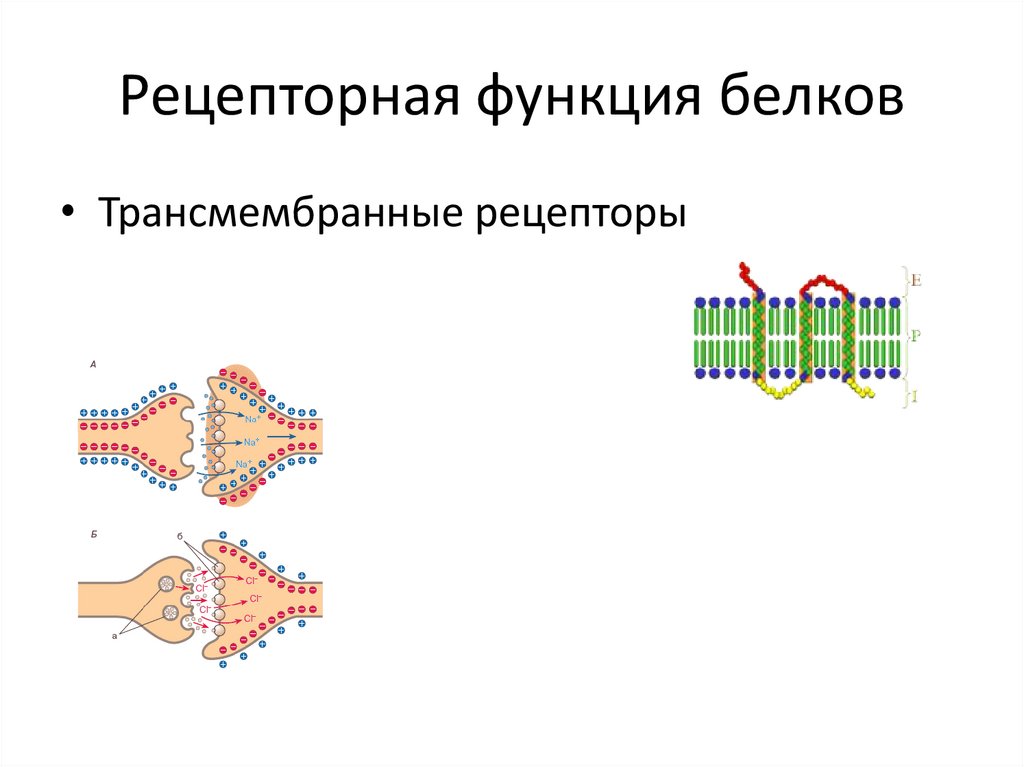
36. Рецепторная функция белков
• Трансмембранные рецепторы37. Трансформация энергии
• Химическая →механическая• Световая →химическая
• Химическая →тепловая
(множество экзотермических реакций)
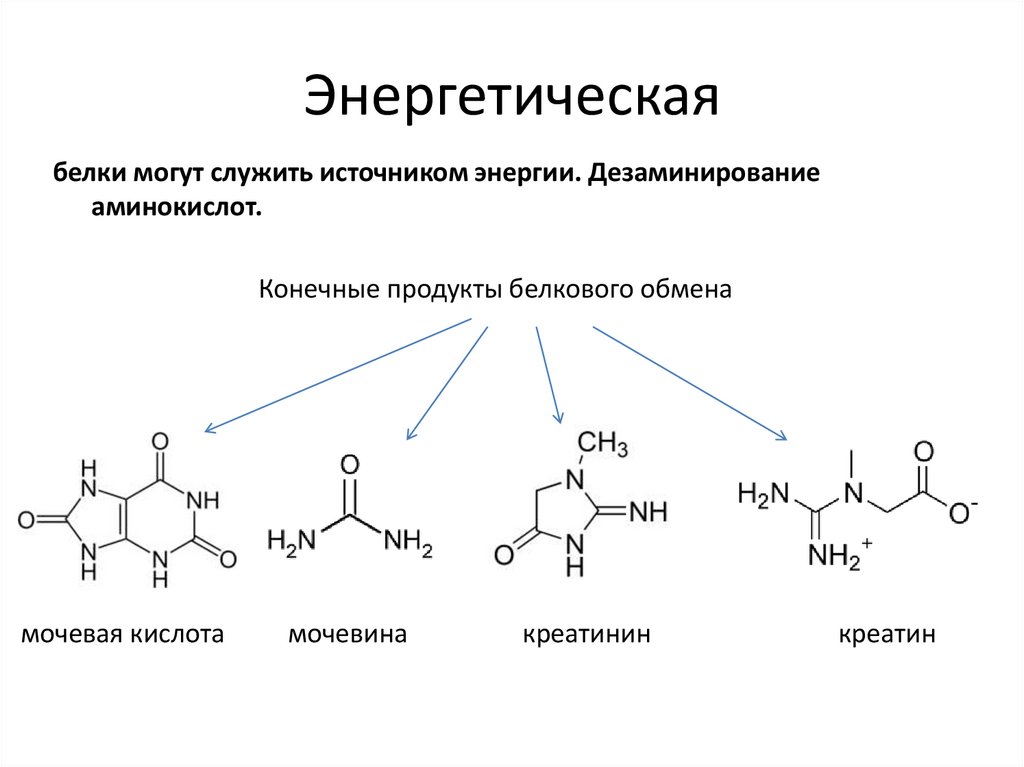
38. Энергетическая
белки могут служить источником энергии. Дезаминированиеаминокислот.
Конечные продукты белкового обмена
мочевая кислота
мочевина
креатинин
креатин






















 chemistry
chemistry








