Similar presentations:
Химические свойства карбоновых кислот
1. Химические свойства карбоновых кислот
Все познается в сравнении…Химические свойства
карбоновых кислот
2.
ЦЕЛЬ УРОКА:Изучить химические свойства
карбоновых кислот.
3.
Сегодня вы :Познакомитесь с химическими свойствами
карбоновых кислот;
Узнаете, чем органические кислоты
похожи на неорганические, и чем они
отличаются;
Научитесь составлять уравнения
химических реакций, отражающих свойства
предельных одноосновных карбоновых
кислот;
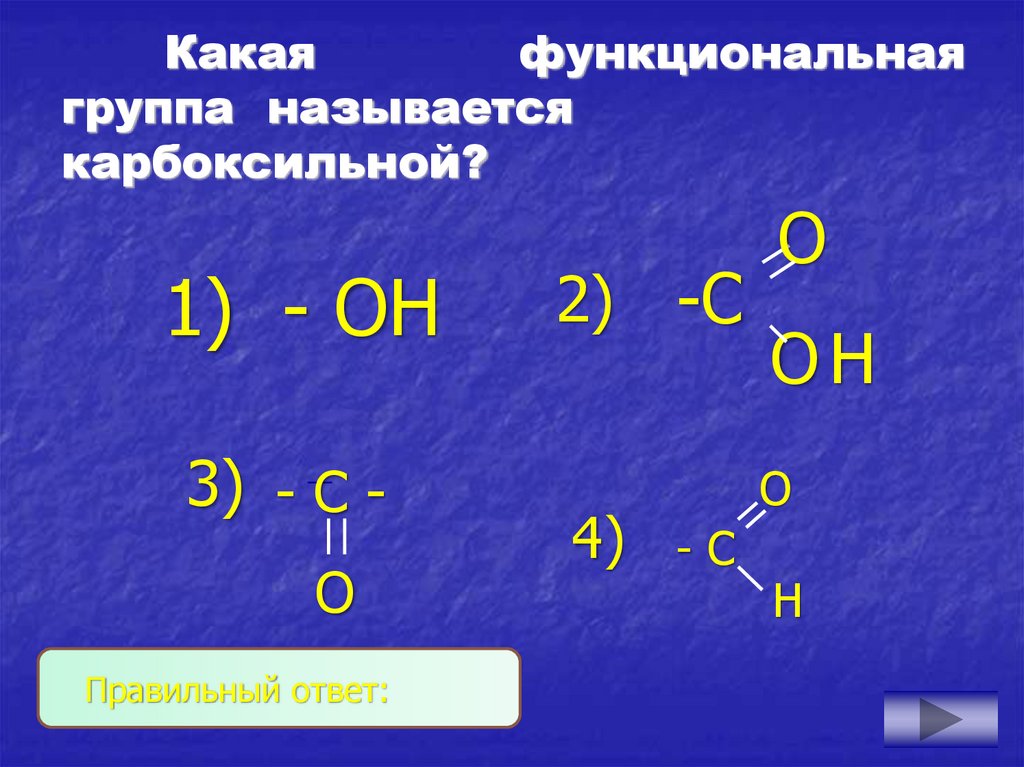
4. Какая функциональная группа называется карбоксильной?
1) - ОН3) - С О
Правильный ответ:
2) -C
4) - C
O
OH
O
H
5.
СН31) СН3- С - СООН
Этановая (уксусная) кислота
O
4) HО– C
СН3
СН3
2,2 – диметилпропановая кислота
2) С2Н5– C
O
Н
5) СН3- СН2- СН2- СН2- СООН
СН3кислота
Пентановая (валериановая)
6)
СН3- С – СН3
СН3
3) СН3- СН2- СН2- СН2- СН2 – ОН
6.
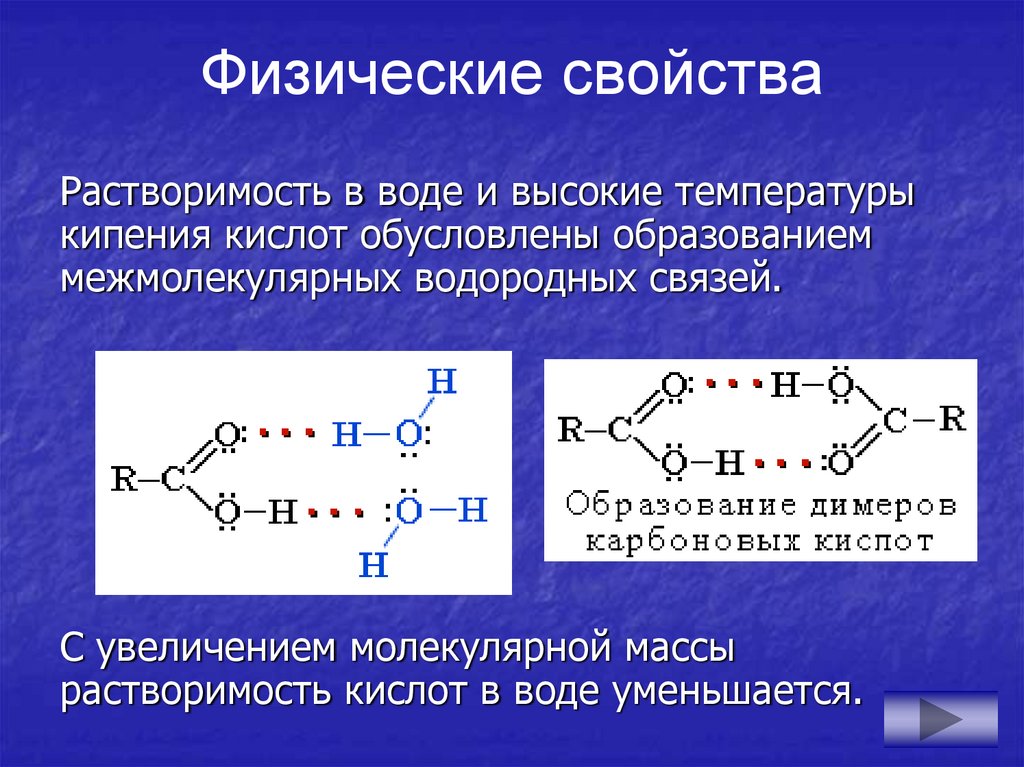
Физические свойстваРастворимость в воде и высокие температуры
кипения кислот обусловлены образованием
межмолекулярных водородных связей.
С увеличением молекулярной массы
растворимость кислот в воде уменьшается.
7.
Йорданс Якоб«Пир Клеопатры» 1653
“Она
… опустила
жемчужину в
уксус… Когда от
нее не осталось и
следа, Клеопатра
подняла кубок, и
выпила весь до
последней капли”
8.
Химические свойстванеорганических кислот.
+
1.Диссоциация: HCl = H
+ Cl
2.Взаимодействие с металлами:
2 HCl + Mg = MgCl2 + H2
3.Взаимодействие с оксидами:
2 HCl + CaO = CaCl2 + H2O
4.Взаимодействие с основаниямиреакция
нейтрализации: HCl + NaOH = NaCl + H2O
5.Взаимодействие с солями:
2 HCl + Na2CO3 = 2 NaCl + H2O + CO2
9.
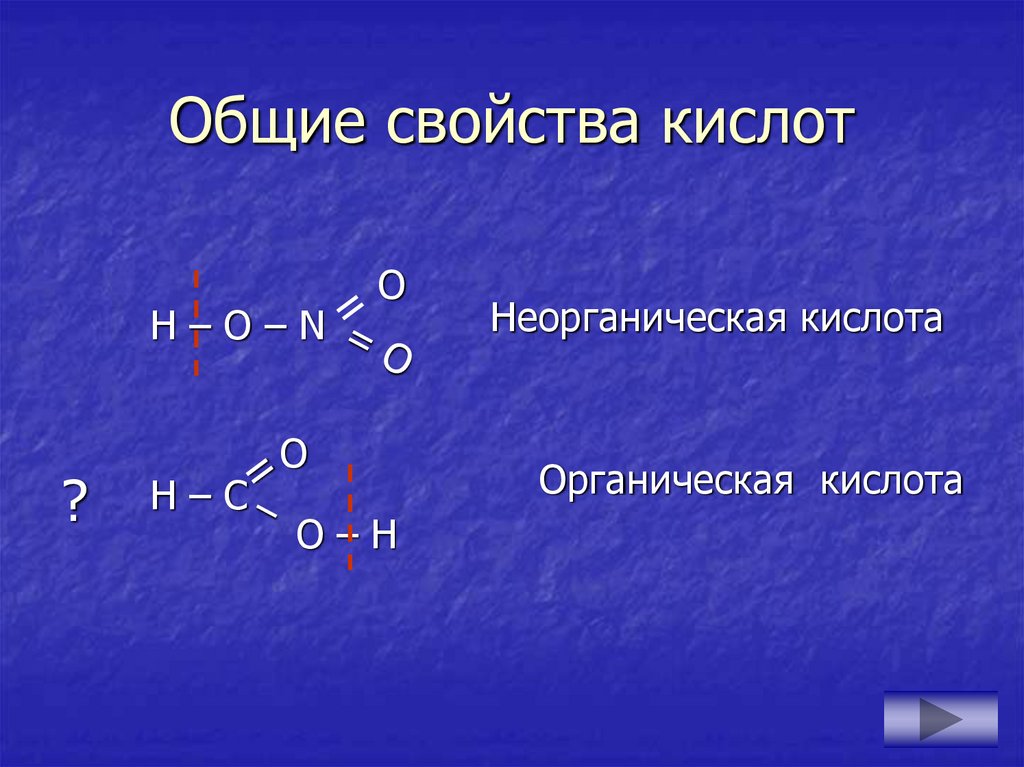
10. Общие свойства кислот
H–O–N?
H–C
O
O
O–H
Неорганическая кислота
Органическая кислота
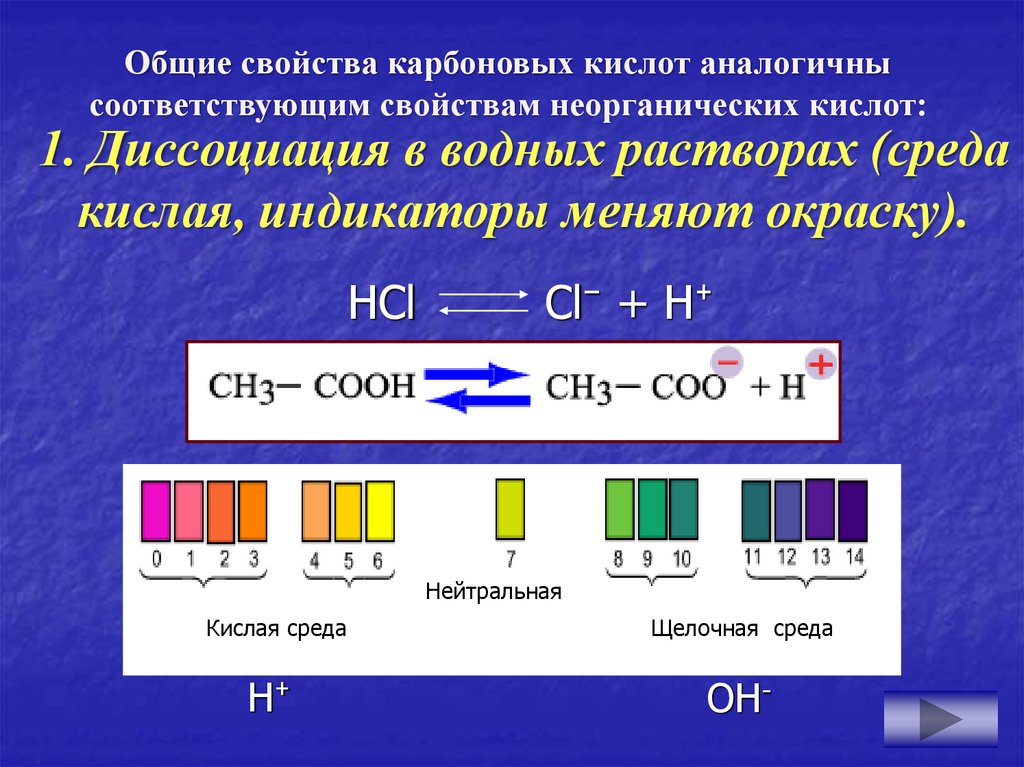
11. 1. Диссоциация в водных растворах (среда кислая, индикаторы меняют окраску).
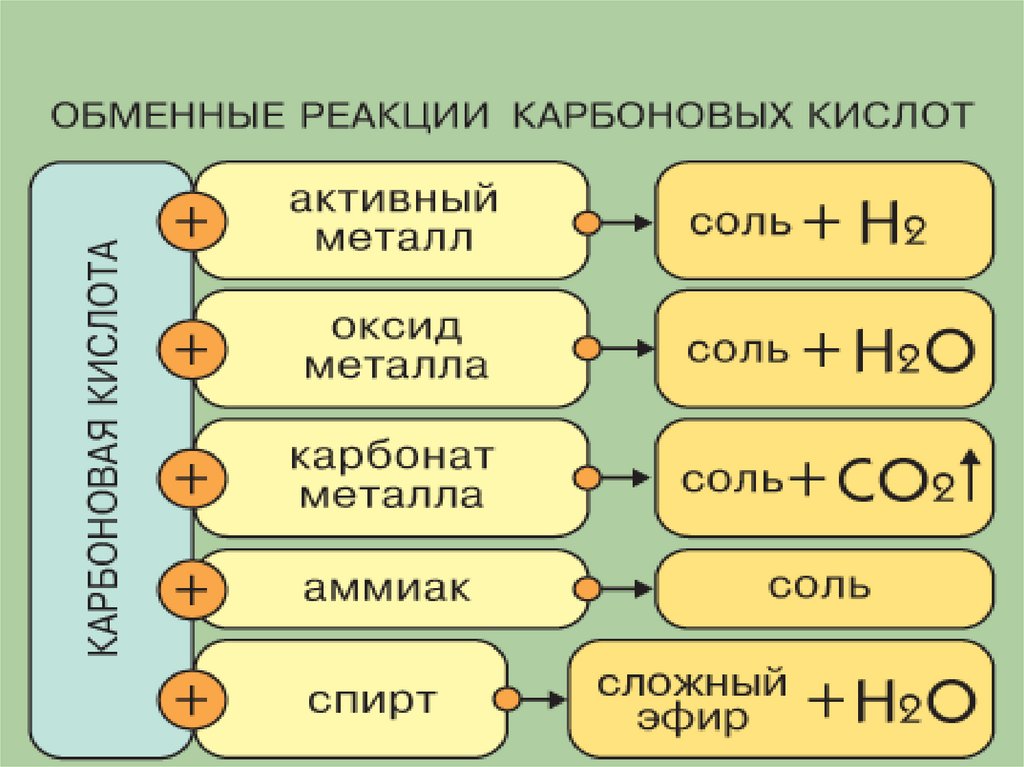
Общие свойства карбоновых кислот аналогичнысоответствующим свойствам неорганических кислот:
1. Диссоциация в водных растворах (среда
кислая, индикаторы меняют окраску).
НСl
Сl⁻ + Н⁺
Нейтральная
Кислая среда
Н⁺
Щелочная среда
ОН-
12.
2. Взаимодействиес металлами (до Н):
2НСl + Zn = ZnCl2 + H2
Карбоновые кислоты вступают в реакцию замещения с
металлами, стоящими в ряду напряжений до водорода.
2НСООН + Zn = (НСОО)2Zn + H2
формиат цинка
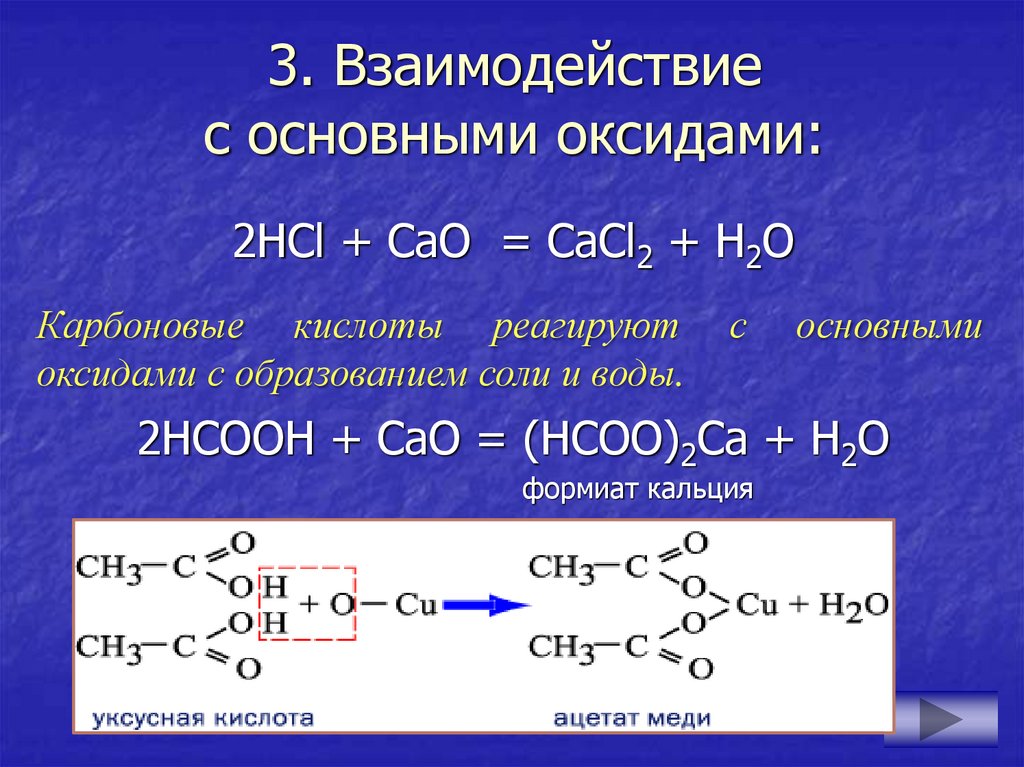
13. 3. Взаимодействие с основными оксидами:
2НСl + СаО = СаCl2 + H2ОКарбоновые кислоты реагируют
оксидами с образованием соли и воды.
с
основными
2НСООН + СаО = (НСОО)2Са + H2O
формиат кальция
14. 4. Взаимодействие с основаниями
Реакция нейтрализации!НСl + КОH = NаCl + H2О
НСООН + КОН = НСООК + H2O
формиат калия
15. 5. Взаимодействие с солями менее сильных кислот
2НСl + Na2СО3 = 2NаCl + H2CО3СО2
Н2О
2 НСООН + Na2СО3 = 2 НСООNa + H2O + CO2
формиат натрия
16. 6. Реакция этерификации:
R-CO
OH
Карбоновая
кислота
Сложный
эфир
+ H–O–R
Спирт
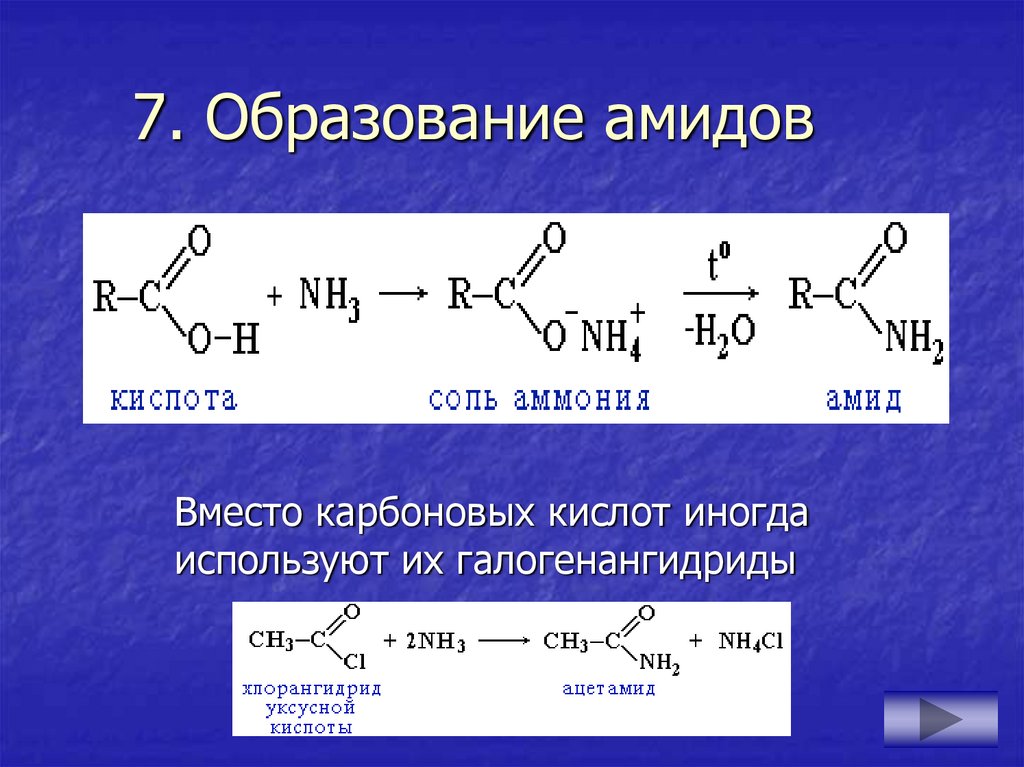
17. 7. Образование амидов
Вместо карбоновых кислот иногдаиспользуют их галогенангидриды
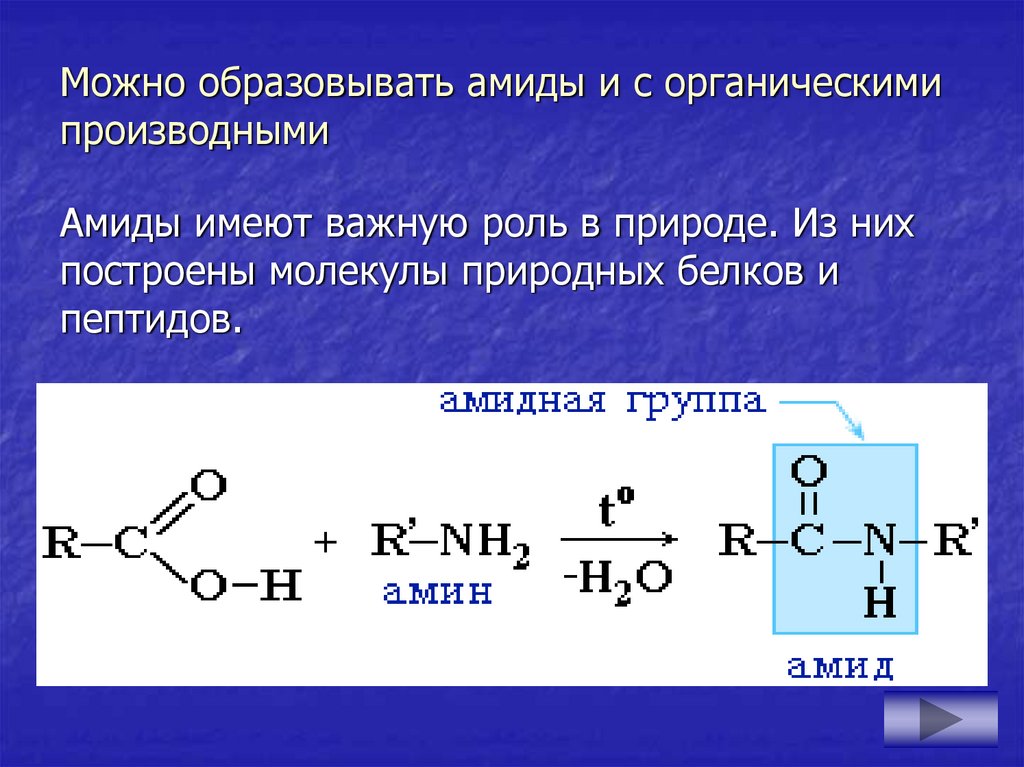
18. Можно образовывать амиды и с органическими производными
Амиды имеют важную роль в природе. Из нихпостроены молекулы природных белков и
пептидов.
19.
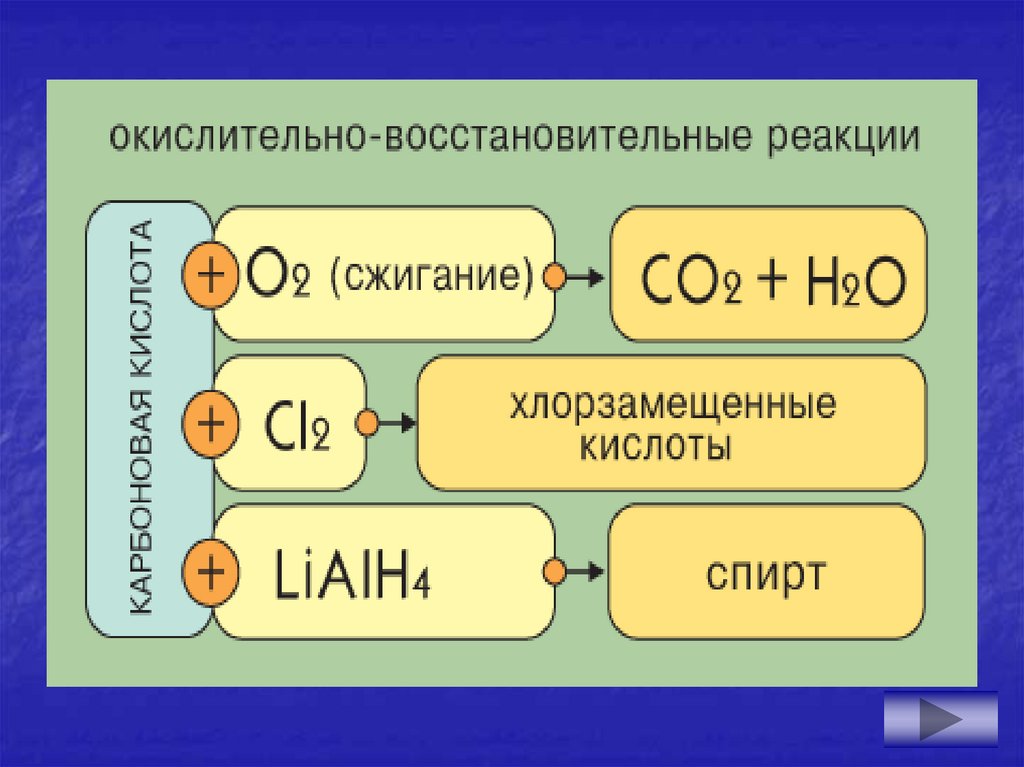
20. 8. Галогенирование
Cl – Cl + CH3COOH → Cl CH2COOH +хлор
монохлоруксусная
кислота
HCl
21. Выполнить задания:
Учебник:1) Упр. 17 (а,б) – стр. 118.
2) Задача 1 (с. 118).
22. Домашнее задание
28 (прочитать), табл. 11 (с.111-112)-заучить, упр. 18,
задача 2 (с.118).
§














 chemistry
chemistry








