Similar presentations:
Основные положения молекулярно-кинетической теории идеальных газов. Тема 7
1.
Тема 7ОСНОВНЫЕ ПОЛОЖЕНИЯ
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ
ТЕОРИИ ИДЕАЛЬНЫХ ГАЗОВ
2.
План лекции1. ОСНОВНЫЕ ПОЛОЖЕНИЯ МОЛЕКУЛЯРНО-КИНЕТИЧЕСКОЙ
ТЕОРИИ ИДЕАЛЬНЫХ ГАЗОВ (МКТ). Статистический и
термодинамический методы исследований.
2. Силы и потенциальная энергия межмолекулярных
взаимодействий.
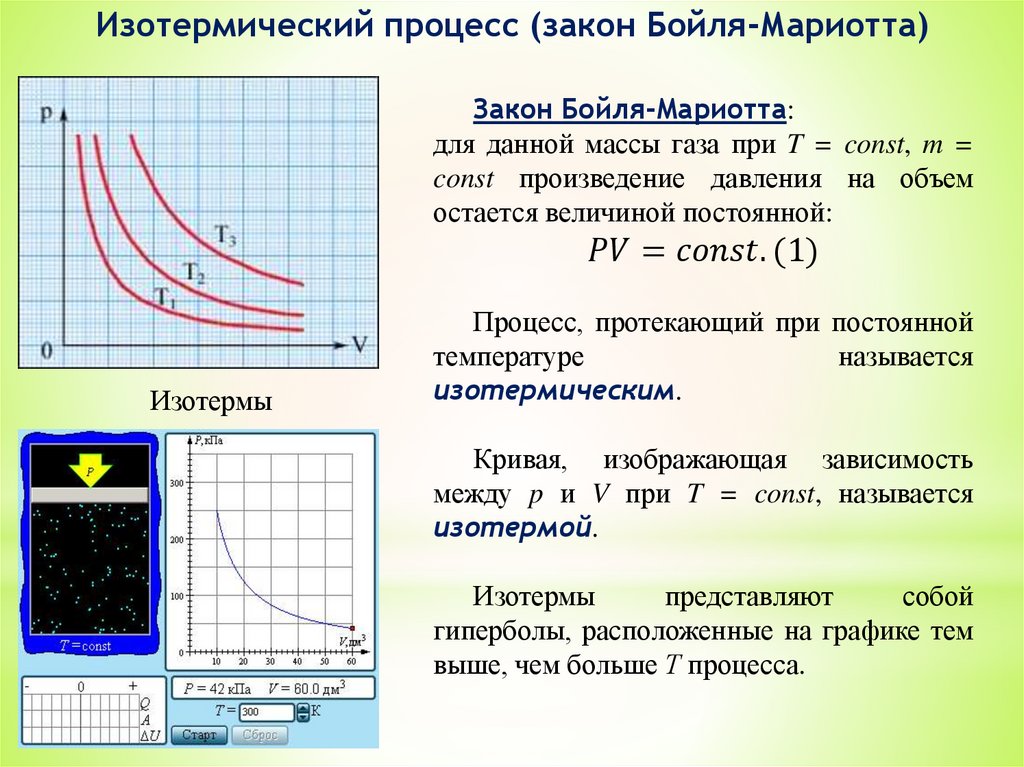
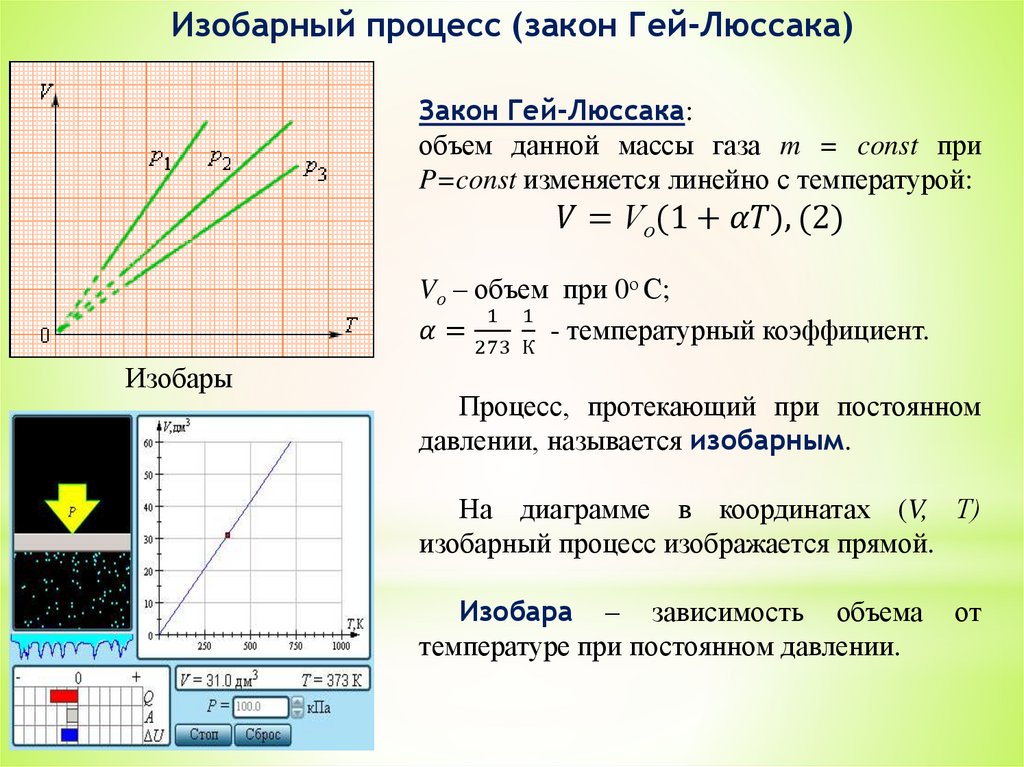
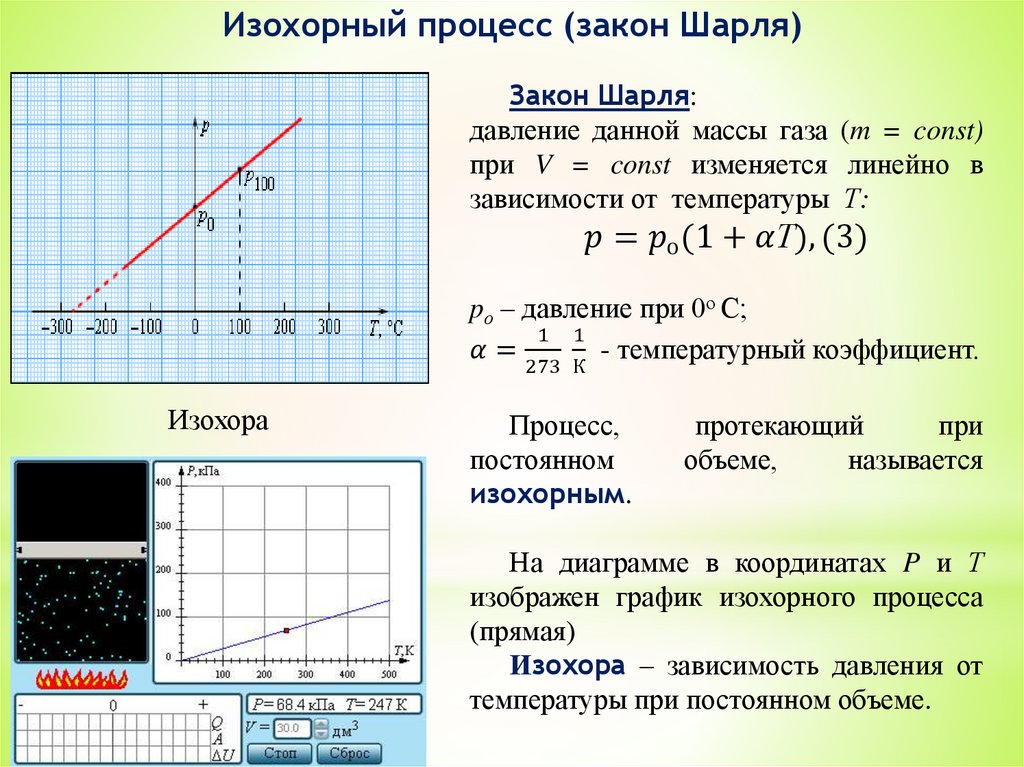
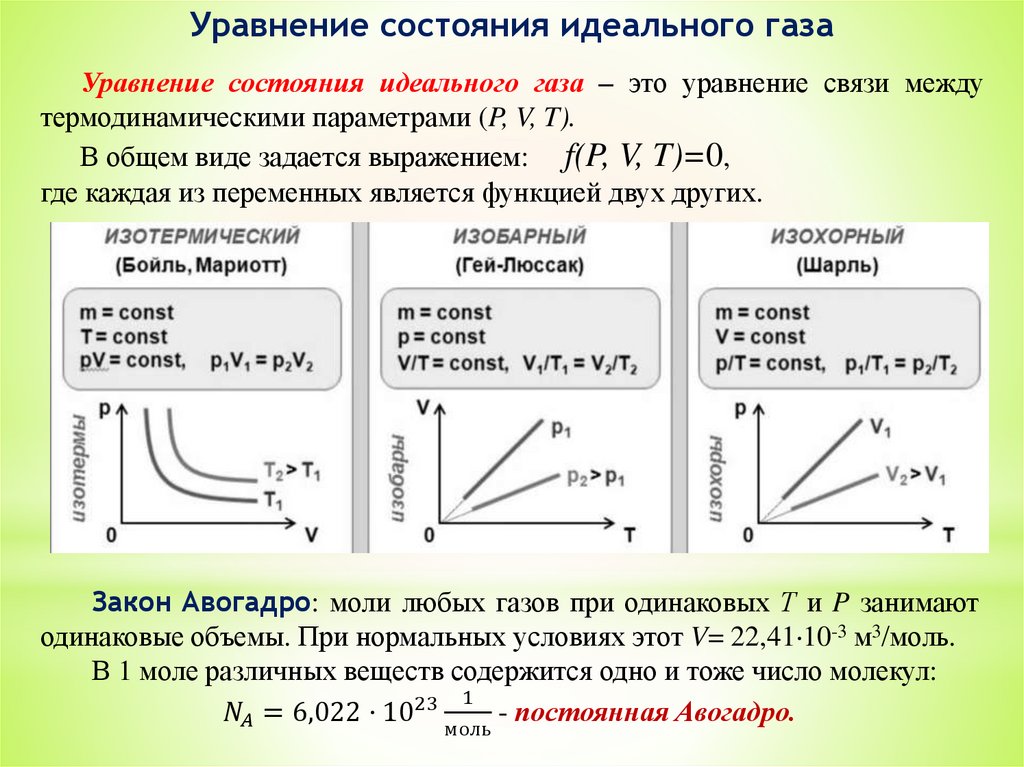
3. Уравнение состояния идеальных газов.
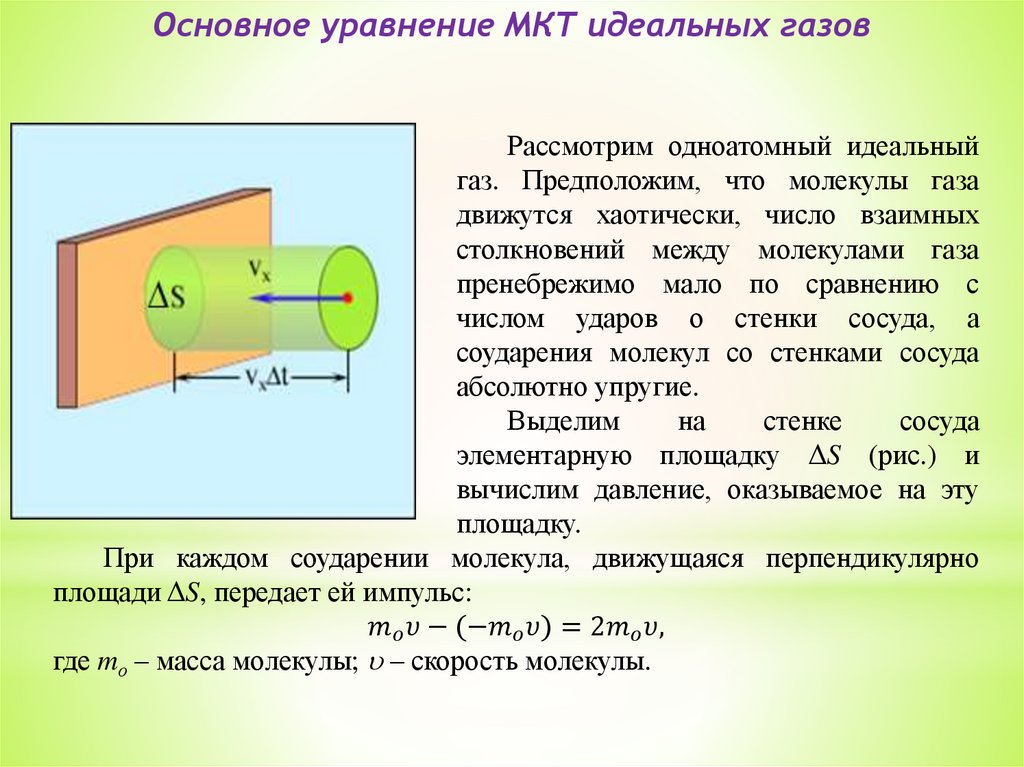
4. Основное уравнение МКТ идеального газа.
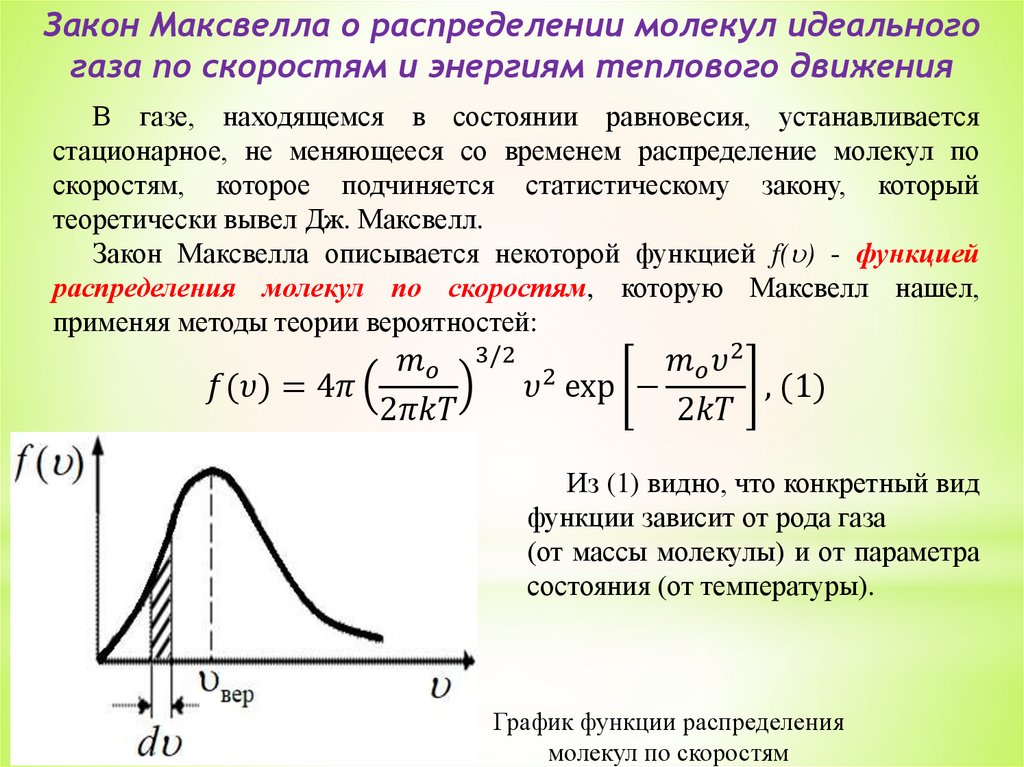
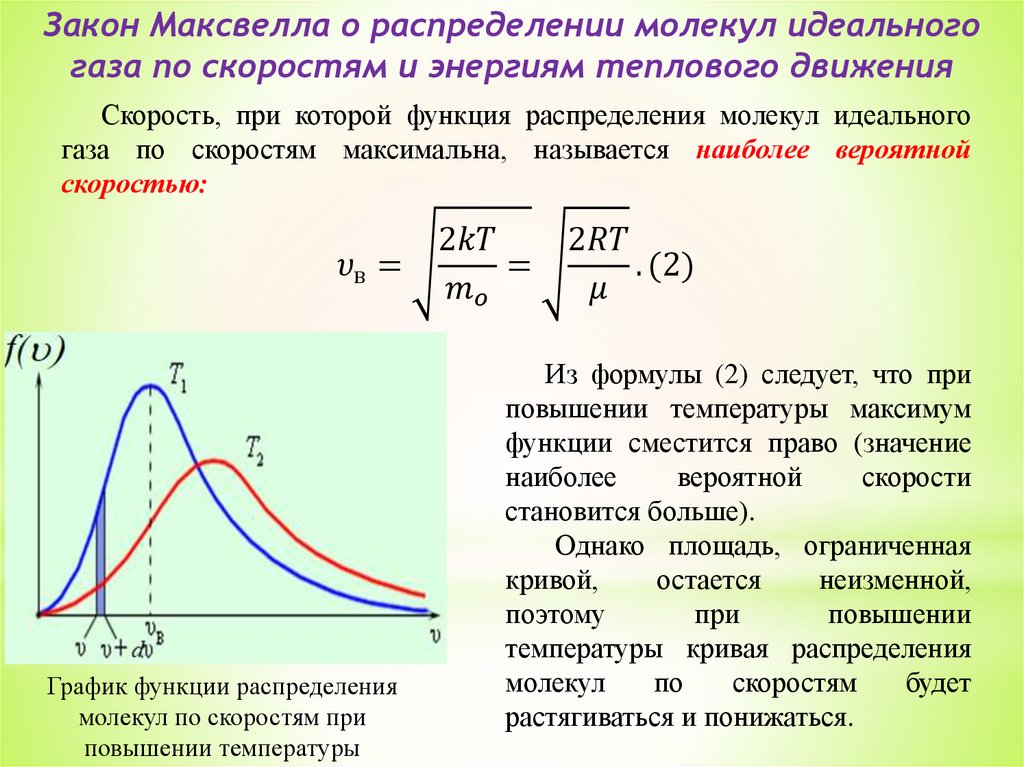
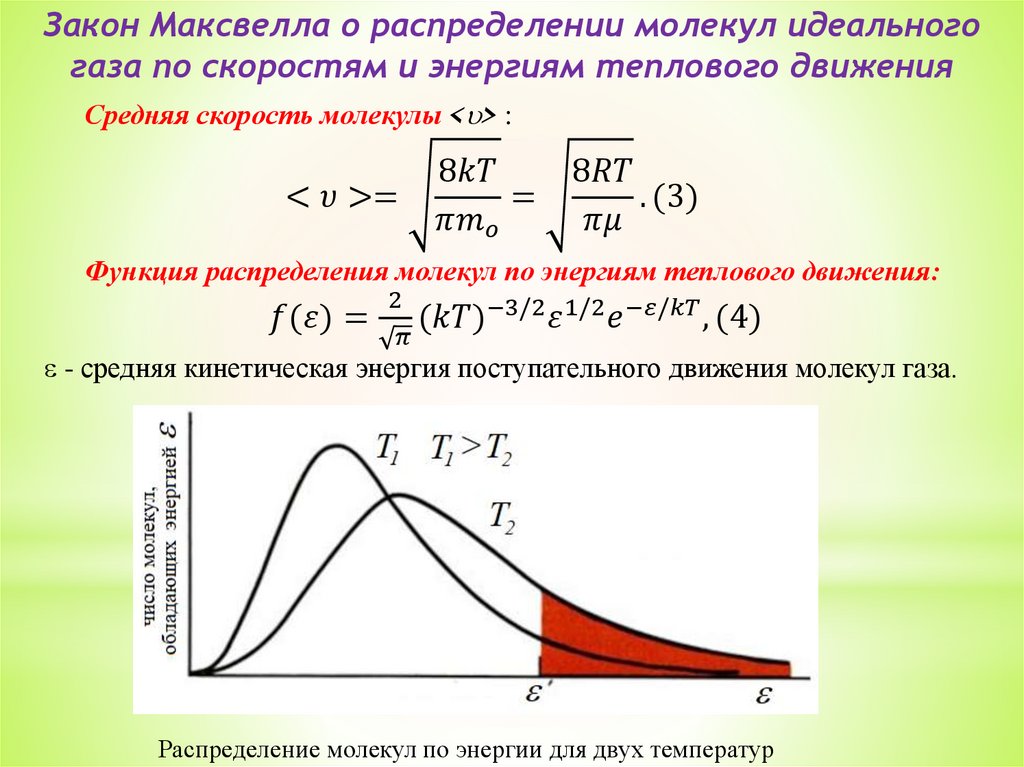
5. Закон Максвелла о распределении молекул идеального газа
по скоростям и энергиям теплового движения. Распределение
Больцмана.
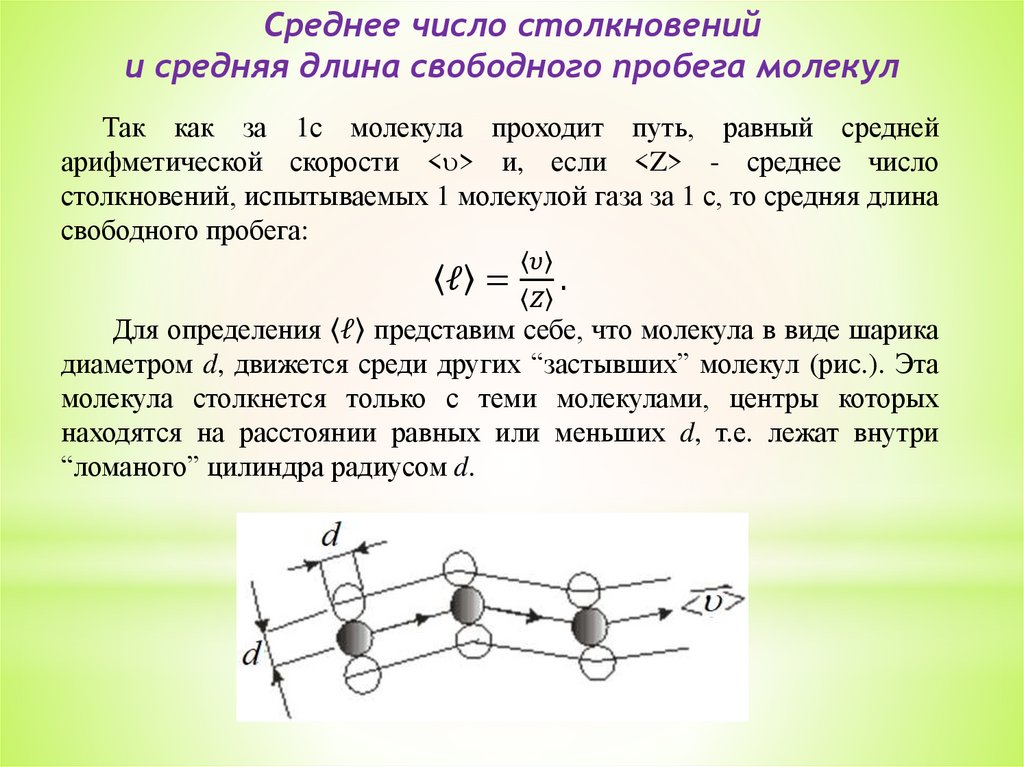
6. Среднее число столкновений и средняя длина свободного
пробега молекул.
3.
ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ.Статистический и термодинамический методы
Молекулярная физика и термодинамика – разделы физики, в которых
изучаются макроскопические процессы, связанные с огромным числом
атомов и молекул, содержащихся в телах.
Молекулярная физика – раздел физики, изучающий
строение и свойства вещества исходя из молекулярнокинетических представлений (все тела состоят из
молекул, находящихся в непрерывном хаотическом
движении).
Статистический метод изучает процессы,
которые являются результатом совокупного действия,
огромного числа молекул.
Он основан на том, что свойства макро системы определяются свойствами
частиц системы, особенностями их движения и усредненными значениями
динамических характеристик (например, <V>, <E>).
4.
ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ.Статистический и термодинамический методы
Термодинамика – раздел физики, изучающий общие свойства
макросистем, находящихся в состоянии термодинамического равновесия
и процессы перехода между этими состояниями.
Термодинамика не рассматривает микропроцессы, которые лежат в
основе этих превращений. Она базируется на двух началах, которые
являются результатом обобщения опытных данных.
Термодинамический
метод
определяет
состояние термодинамической системы.
Состояние
термодинамической
системы
обычно задается параметрами P, T, V.
Процесс - любые изменения хотя бы одного из
термодинамических параметров.
Термодинамическое равновесие – состояние,
когда параметры макросистемы с течением
времени не меняются.
5.
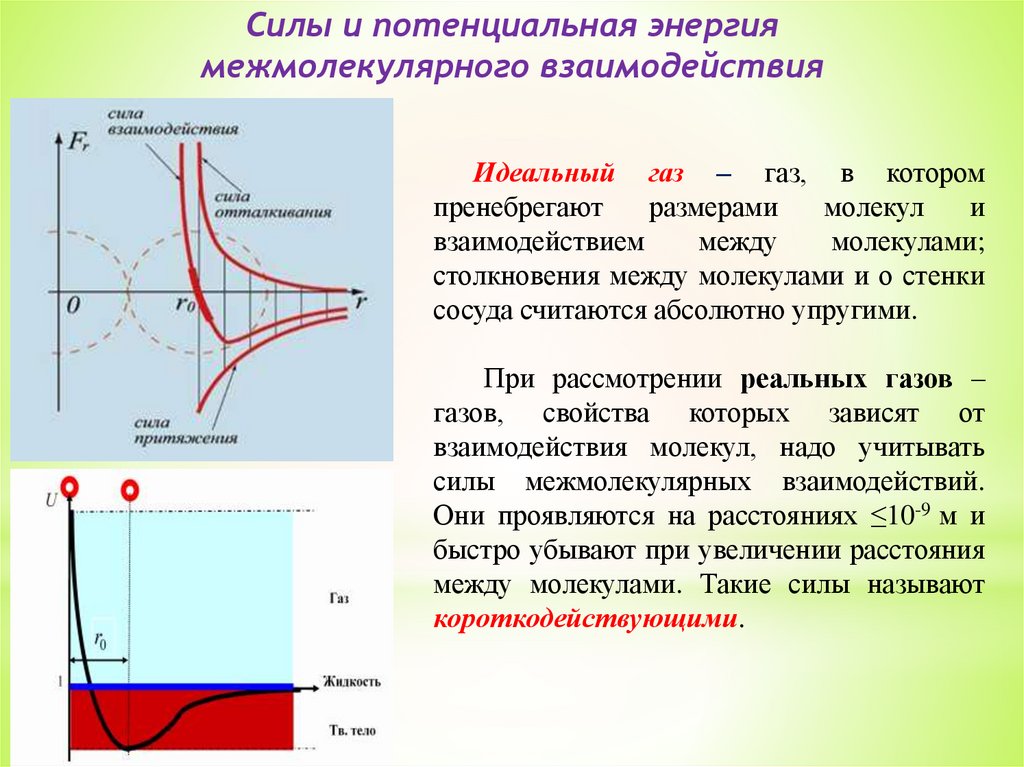
Силы и потенциальная энергиямежмолекулярного взаимодействия
Идеальный газ – газ, в котором
пренебрегают
размерами
молекул
и
взаимодействием
между
молекулами;
столкновения между молекулами и о стенки
сосуда считаются абсолютно упругими.
При рассмотрении реальных газов –
газов, свойства которых зависят от
взаимодействия молекул, надо учитывать
силы межмолекулярных взаимодействий.
Они проявляются на расстояниях ≤10-9 м и
быстро убывают при увеличении расстояния
между молекулами. Такие силы называют
короткодействующими.
6.
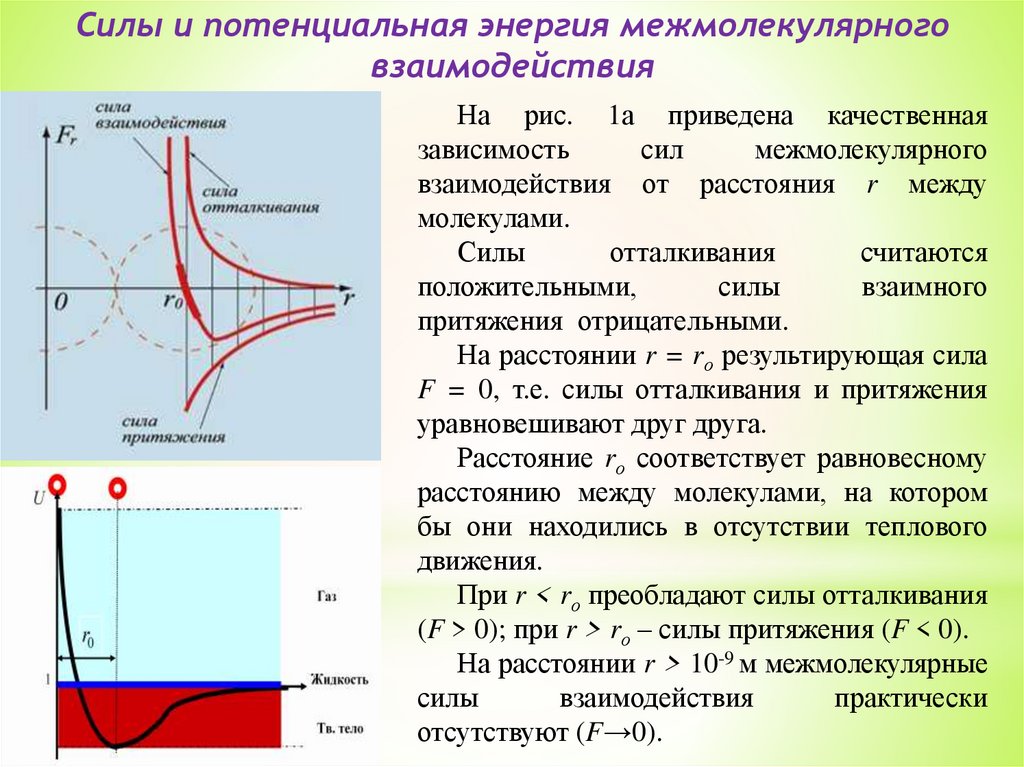
Силы и потенциальная энергия межмолекулярноговзаимодействия
На рис. 1а приведена качественная
зависимость
сил
межмолекулярного
взаимодействия от расстояния r между
молекулами.
Силы
отталкивания
считаются
положительными,
силы
взаимного
притяжения отрицательными.
На расстоянии r = rо результирующая сила
F = 0, т.е. силы отталкивания и притяжения
уравновешивают друг друга.
Расстояние rо соответствует равновесному
расстоянию между молекулами, на котором
бы они находились в отсутствии теплового
движения.
При r < rо преобладают силы отталкивания
(F > 0); при r > rо – силы притяжения (F < 0).
На расстоянии r > 10-9 м межмолекулярные
силы
взаимодействия
практически
отсутствуют (F→0).
7.
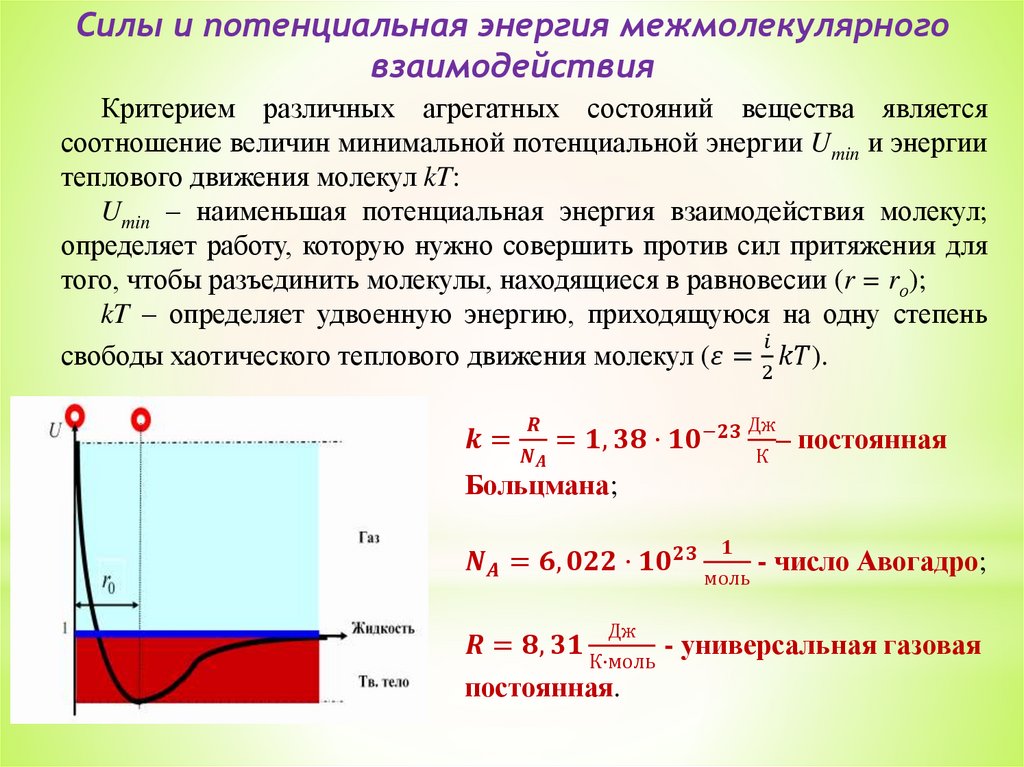
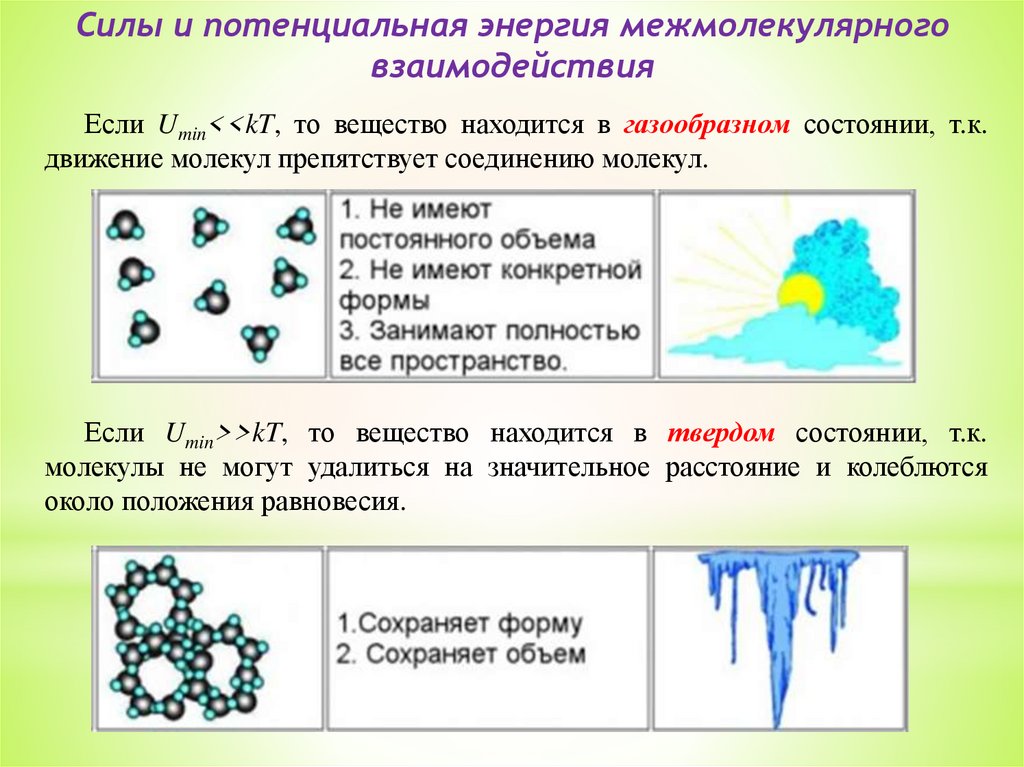
Силы и потенциальная энергия межмолекулярноговзаимодействия
Критерием различных агрегатных состояний вещества является
соотношение величин минимальной потенциальной энергии Umin и энергии
теплового движения молекул kT:
Umin – наименьшая потенциальная энергия взаимодействия молекул;
определяет работу, которую нужно совершить против сил притяжения для
того, чтобы разъединить молекулы, находящиеся в равновесии (r = rо);
kT – определяет удвоенную энергию, приходящуюся на одну степень














 physics
physics








