Similar presentations:
Основные классы неорганических соединений
1. Основные классы неорганических соединений
2.
Солеобразующиеосновные (FeO),
кислотные (СО2),
амфотерные (BeO)
Несолеобразующие
(CO, NO, N2O, SiO)
оксид калия
оксид алюминия
оксид серы (+4)
z – наименьшее общее кратное
3.
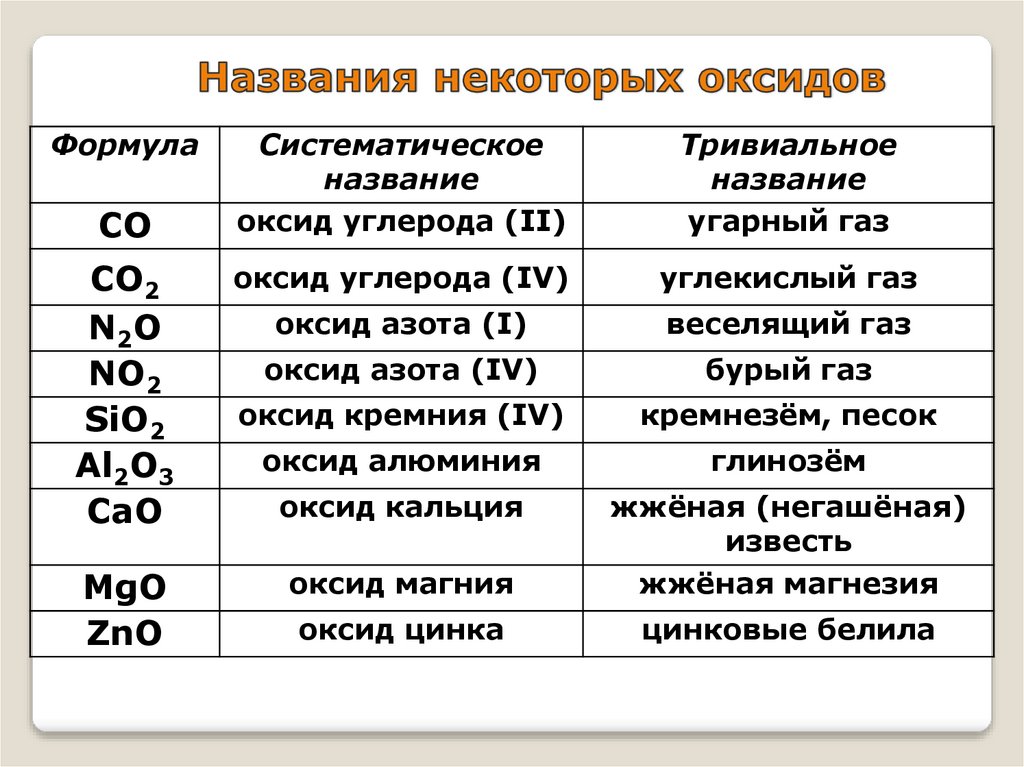
ФормулаСистематическое
название
оксид углерода (II)
Тривиальное
название
угарный газ
СО2
N2O
NO2
SiO2
Al2O3
CaO
оксид углерода (IV)
углекислый газ
оксид азота (I)
веселящий газ
оксид азота (IV)
бурый газ
оксид кремния (IV)
кремнезём, песок
оксид алюминия
глинозём
оксид кальция
MgO
ZnO
оксид магния
жжёная (негашёная)
известь
жжёная магнезия
оксид цинка
цинковые белила
СО
4.
1. Окисление простых веществ.2. Окисление сложных веществ.
3. Термическое разложение гидроксидов и
солей.
1. Взаимодействие с водой (при образовании
растворимых гидроксидов):
K2O + H2O = 2KOH
SiO2 + H2O ≠
2. Взаимодействие с оксидами.
3. Взаимодействие с гидроксидами.
5.
По кислотности:По растворимости:
.
гидроксид натрия
гидроксид магния
6.
ФормулаСистематическое
название
гидроксид натрия
Тривиальное
название
едкий натр, каустик
гидроксид калия
гидроксид кальция
едкое кали, калиевый
щёлок
гашеная известь,
известковое молоко
Mg(OH)2
гидроксид магния
магниевое молочко
(исп. в медицине)
Ва(ОН)2
гидроксид бария
баритовая вода
NH4OH
гидроксид аммония
нашатырный спирт
(водн. раствор)
NaOH
KOH
Ca(OH)2
7.
1. Взаимодействие основных оксидов с водой.2. Взаимодействие щелочных металлов с
водой: 2Na + 2H2O = 2NaOH + H2↑.
3. Взаимодействие солей со щелочами:
MgCl2 + 2NaOH = Mg(OH)2↓ + 2NaCl.
4. Электролиз водных растворов солей.
1. Взаимодействие щелочей с неметаллами и
металлами.
2. Взаимодействие с кислотными оксидами.
3. Взаимодействие с кислотами (реакция
нейтрализации): HCl + KOH = KCl + H2O.
4. Взаимодействие с солями.
5. Термическое разложение
труднорастворимых оснований.
8.
По оснόвности:По растворимости:
По летучести:
По составу кислотного остатка:
ортофосфорная кислота
сероводородная кислота
9.
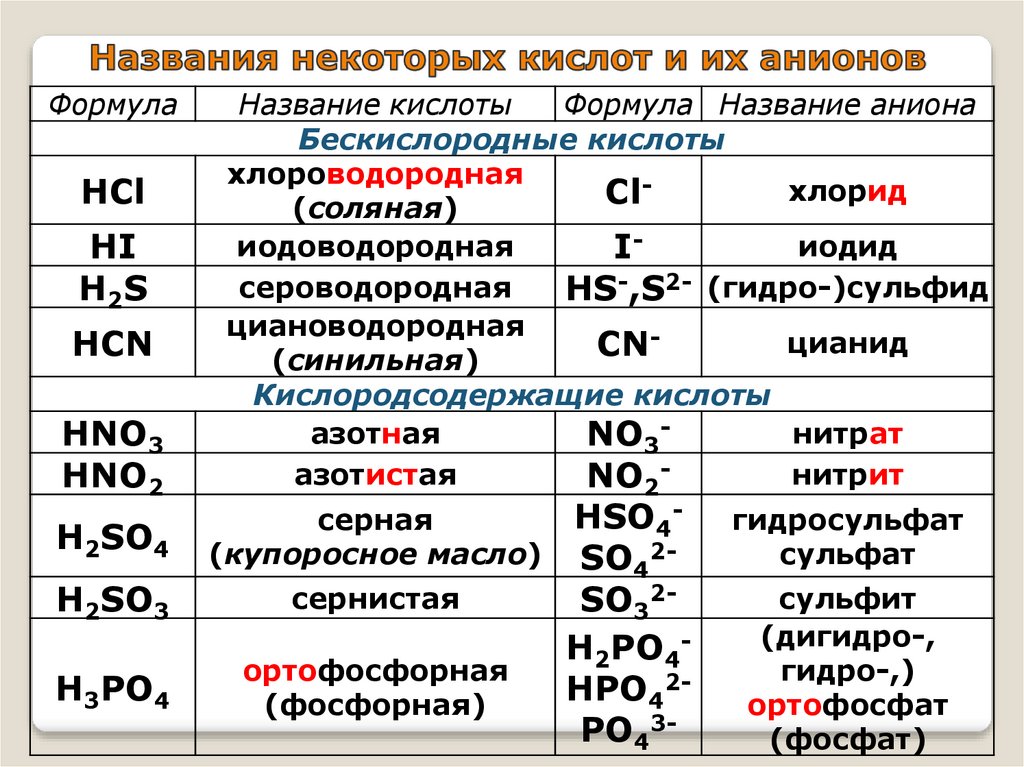
ФормулаHNO3
HNO2
Название кислоты
Формула Название аниона
Бескислородные кислоты
хлороводородная
хлорид
Cl
(соляная)
иодоводородная
иодид
Iсероводородная
HS-,S2- (гидро-)сульфид
циановодородная
цианид
CN
(синильная)
Кислородсодержащие кислоты
азотная
нитрат
NO3азотистая
нитрит
NO2-
H2SO4
серная
(купоросное масло)
H2SO3
сернистая
H3PO4
ортофосфорная
(фосфорная)
HCl
HI
H2S
HCN
НSO4SO42SO32Н2PO4НPO42PO43-
гидросульфат
сульфат
сульфит
(дигидро-,
гидро-,)
ортофосфат
(фосфат)
10.
1. Взаимодействие неметаллов с водородом.2. Взаимодействие кислотных оксидов с
водой.
3. Взаимодействие солей с кислотами.
1. Взаимодействие с металлами.
2. Взаимодействие с основными оксидами.
3. Взаимодействие с основаниями.
4. Взаимодействие с солями.
5. Термическое разложение кислот.
11.
Диссоциациякак кислота
как основание
гидроксид алюминия
гидроксид хрома (III)
12.
1. Взаимодействие солей со щелочами.1. Взаимодействие с кислотными оксидами.
Ве(ОН)2 + СО2 = ВеСО3 + Н2О
2. Взаимодействие с основными оксидами.
Ве(ОН)2 + К2О = К2ВеО2 + Н2О
3. Взаимодействие с кислотами.
Ве(ОН)2 + 2HNO3 = Ве(NО3)2 + 2Н2О
4. Взаимодействие с основаниями.
в расплаве: Ве(ОН)2 + 2КОН = К2ВеО2 + 2Н2О
в растворе: Ве(ОН)2 + 2КОН = К2[Ве(ОH)4]
5. Термическое разложение амфотерных
гидроксидов.
13.
По растворимости: растворимые,нерастворимые.
По составу: средние (CaCl2, Na2CO3),
кислые (NaHCO3),
оснóвные (CaOHCl),
двойные, смешанные, комплексные.
хлорид кальция
гидрокарбонат меди (II)
сульфат гидроксокальция
z – наименьшее общее кратное
14.
ФормулаПолусистематическое
Na2CO3
карбонат натрия
гидрокарбонат
натрия
карбонат кальция
СаСО3
хлорид натрия
NaCl
хлорид аммония
NH4Cl
сульфат кальция
CaSO4
сульфат меди (II)
CuSO4
хлорат калия
KClO3
кристаллогидрат
.
Na2SO4 10H2O сульфата натрия
NaNO3, KNO3, нитраты: натрия,
калия, аммония
NH4NO3
NaHCO3
AgNO3
нитрат серебра
Тривиальное
сода
кальцинированная
сода питьевая
мел, известняк
поваренная соль
нашатырь
гипс
медный купорос
бертолетова соль
глауберова соль
селитры
ляпис
15.
МЕТАЛЛНЕМЕТАЛЛ
1
2
3
ОСНОВНЫЙ
ОКСИД
4
КИСЛОТНЫЙ
ОКСИД
5
6
ОСНОВАНИЕ
9
СОЛЬ
7
КИСЛОТА
11
СОЛЬ
8
10
16.
1. Взаимодействие с металлами.2. Взаимодействие с основаниями.
3. Взаимодействие с кислотами.
4. Взаимодействие с солями.
5. Термическое разложение солей.
Привести примеры реакций получения и
химических свойств для каждого класса
неорганических соединений.














 chemistry
chemistry








