Similar presentations:
Основные классы неорганических соединений
1.
Основные классынеорганических соединений
Преподаватель Юридического колледжа
Валентина Владимировна Киреева
2.
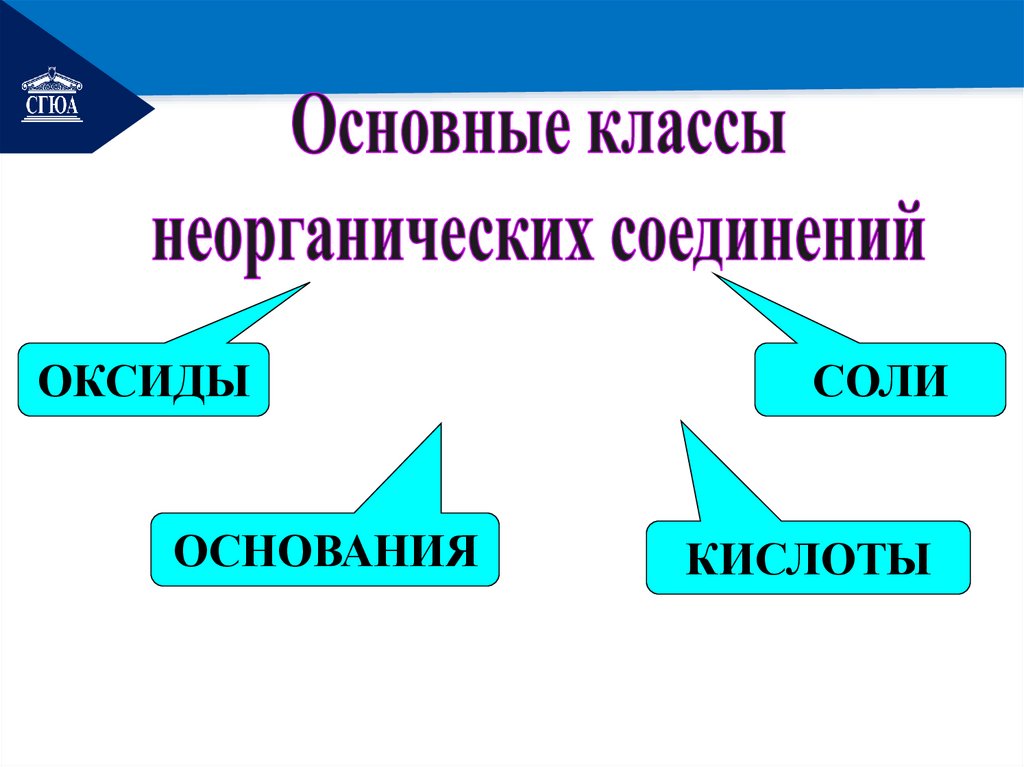
РЕМОНТОКСИДЫ
ОСНОВАНИЯ
СОЛИ
КИСЛОТЫ
3.
РЕМОНТОКСИДЫ - это сложные вещества, состоящие
из двух элементов, один из которых кислород со
степенью окисления -2.
Состав оксидов выражается общей формулой ЭхОу.
Числовые значения х и у определяются степенью
окисления элементов.
В названиях оксидов вначале указывают слово оксид, а
затем - название элемента в родительном падеже:
MgO - оксид магния, Al2O3 - оксид алюминия.
Если элемент образует несколько оксидов, то после
названия элемента в скобках указывается его степень
окисления: FeO – оксид железа (II), Fe2O3 - оксид железа
(III).
4.
Названия отдельных представителейкласса оксидов
Химическая
формула
Традиционное
название
Международное название
H2 O
Вода
Оксид водорода
CO2
Углекислый газ
Оксид углерода (IV), или
диоксид углерода
CO
Угарный газ
Оксид углерода (II), или
монооксид углерода
CaO
Негашеная известь
Оксид кальция
Al2O3
Глинозем
Оксид алюминия
Fe2O3
Гематит
Оксид железа (III), или
триоксид дижелеза
SO2
Сернистый газ
Оксид серы (IV), или
диоксид серы
SO3
Серный газ
Оксид серы (VI), или
триоксид серы
5.
РЕМОНТОксид цинка ZnO – вещество белого цвета, используется для
приготовления белой масляной краски (цинковые белила), которыми
можно
красить
любые поверхности.
Нерастворимость
и
неядовитость позволяют использовать его при изготовлении
косметических кремов, пудры.
Оксид титана (IV) – TiO2 красивого белого цвета применяется для
изготовления титановых белил, пластмасс, прочных эмалей для
посуды.
Оксид хрома (III) – Cr2O3 – прочные кристаллы темно-зеленого цвета, не
растворимые в воде, используют как пигмент при изготовлении
зеленого стекла и керамики, в полиграфических красках (для
окраски денежных купюр).
Оксид кремния SiO2 — самое распространённое твёрдое вещество на
Земле: входит в состав почвы (песок), горных пород и минералов,
атомы кремния и кислорода образуют атомную кристаллическую
решетку, образуя тугоплавкие, твёрдые, но хрупкие кристаллы
правильной формы.
6.
РЕМОНТКлассификация оксидов
солеобразующие - взаимодействуют с
кислотами или щелочами с образованием
солей и воды: СаО, СО2, SO3 Na2O.
несолеобразующие - не взаимодействуют
ни с кислотами, ни с щелочами и не
образуют солей: CO, NO, N2O и SiO.
7.
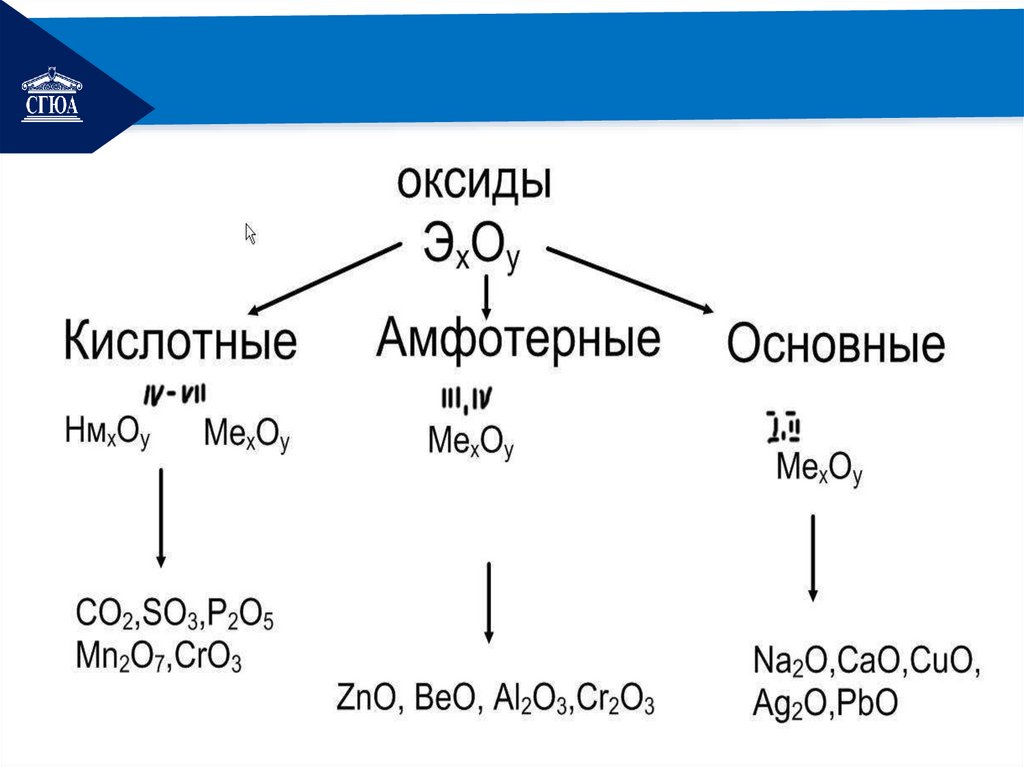
РЕМОНТСолеобразующие оксиды делятся
основные, кислотные, амфотерные.
на
Основные оксиды - оксиды, которые
взаимодействуют
с
кислотами
(или
кислотными оксидами) с образованием солей.
Основные оксиды образуют только
металлы со степенью окисления, как
правило, +1, +2: СаО, К2О, FeO и др..
Основным
оксидам
соответствуют
основания.
8.
РЕМОНТКислотные оксиды - оксиды, которые
взаимодействуют
с
основаниями
(или
основными оксидами) с образованием солей.
Кислотные
оксиды
могут
быть
образованы как неметаллами, так и
металлами c высокой
степенью окисления:
СО2, Сl2O7 CrO3 Mn2O7 .
Кислотным оксидам
соответствуют кислоты.
9.
РЕМОНТАмфотерные оксиды – оксиды металлов со
степенями окисления +3, +4, иногда +2,
образующие соли при взаимодействии как
с кислотами, так и с щелочами:
Cr2O3, MnO2, Al2O3, ZnO, PbO2.
Если металл образует несколько оксидов, в которых
он проявляет разные степени окисления, то с ростом
степени окисления металла уменьшаются основные
и усиливаются кислотные свойства оксидов:
оксид хрома (II) CrO - основный, оксид хрома (III)
Cr2O3 - амфотерный, а оксид хрома (VI) CrO3 кислотный.
10.
РЕМОНТ11.
РЕМОНТФизические свойства оксидов
Основные и амфотерные оксиды при комнатной температуре
— твёрдые вещества (СаО, FeO); кислотные оксиды —
твёрдые вещества (SiO2), жидкости (SO3) или газы (CO2). Все
несолеообразующие оксиды являются газами, кроме SiO,
который является твёрдым
веществом.
Оксиды щелочных и щёлочноземельных металлов обычно
белого цвета, Сr2O3 — зеленый;
HgO — красно-оранжевый; CuO —
чёрный, а Сu2O — красный.
12.
РЕМОНТПолучение оксидов
1.Взаимодействие простых веществ с кислородом
a) С + O2 = СO2
b) 2Са + О2 = 2СаО
Не взаимодействуют с кислородом золото, платина, палладий.
2. Горение сложных веществ
СН4 + О2 = СО2 + Н2О
3. Окисление оксидов
2СО + О2 = 2СО2
4. Разложение солей при нагревании
СаСО3 = СаО + СО2
5. Разложение кислот при нагревании
Н2СО3 = СО2 + Н2О
6. Разложение нерастворимых оснований при нагревании
Сu(ОН)2 = СuО + Н2О
13.
РЕМОНТХимические свойства оксидов
1. Взаимодействие с водой.
С водой реагируют основные оксиды, которым
соответствуют щелочи: оксиды лития, натрия,
калия, рубидия, цезия, кальция, стронция, бария.
CaO + H2O → Ca(OH)2
С водой реагируют кислотные оксиды
Р2O5 + 3H2O → 2H3РO4
Амфотерные оксиды не взаимодействуют с водой —
даже при нагревании!
14.
РЕМОНТ2. Взаимодействие основных
оксидов с кислотными оксидами и
кислотами
Na2O + SO2 → Na2SO3
СаO + 2НСl → CaCl2 + H2O
Взаимодействие кислотных оксидов с
основными оксидами и щелочами
SO3 + CuO = CuSO4
N2O5 + 2NaOH = 2NaNO3 + H2O
15.
РЕМОНТ3. Взаимодействие с амфотерными
оксидами и гидроксидами.
При этом образуется соль. Металл в соли берется из
более основного оксида, кислотный остаток — из
более кислотного.
K2O + Al2O3 → 2KAlO2
SO3 + Al(OH)3 = Al2(SO4)3 + H2O
16.
РЕМОНТКислоты - сложные вещества, молекулы
которых состоят из атомов водорода и
кислотного остатка.
Кислота (Н n А)
H 2SO4 серная
Многие кислоты – это
HNO3 азотная
бесцветные жидкости.
HMnO4 марганцевая
Твёрдые кислоты:
H 2SO3 сернистая
H 3PO4 ортофосфорная
ортофосфорная,
HCl соляная
борная H3BO3.
H2CO3 угольная
Почти все кислоты
H2SiO 3 кремниевая
НСlO хлорноватистая
растворимы в воде.
НСlO 2 хлористая
Нерастворимая кислота –H S сероводородная
2
кремниевая
17.
РЕМОНТВстречаемость в природе: сероводородная и угольная
кислоты содержатся в минеральных водах. Соляная кислота
входит в состав желудочного сока человека. Азотная и серная
кислоты встречаются в дождевой воде. Борная кислота
встречается в виде минерала сассолина в горячих
источниках и минеральных водах.
Применение: азотная - производство удобрений, красителей,
лаков; синильная - производство ароматических веществ,
химических волокон, органического стекла, фосфорная - как
регулятор кислотности напитков, производство удобрений, в
составах для обезжиривания металлических поверхностей
18.
РЕМОНТКлассификация:
По числу атомов водорода, которые
можно заместить на металлы:
одноосновные (HNO3), двухосновные (H2SO4),
трехосновные (H3PO4) и т.д.
По содержанию атомов кислорода
кислоты бывают бескислородные (соляная
кислота HCl) и кислородсодержащие (серная
кислота H2SO4).
19.
РЕМОНТСильные кислоты:
• бескислородные кислоты: HCl, HBr, HI;
• некоторые кислородсодержащие кислоты: H2SO4, HNO3,
HClO4 и др.
Слабые кислоты:
• растворимые кислоты: H3PO4, HF и др.,
• летучие или неустойчивые кислоты: H2S - газ; H2CO3 распадается на воду и оксид;
• нерастворимые в воде кислоты: H2SiO3.
Определить, сильная кислота перед вами, или слабая,
можно, вычитая из числа атомов O в кислоте число
атомов H. Если получаем число 2 или 3, то
кислота сильная. Если 1 или 0 - то кислота слабая.
Например: HClO: 1-1 = 0, кислота слабая.
20.
РЕМОНТПолучение кислот
1. Взаимодействие кислотных оксидов с водой:
SO3 + H2O → H2SO4
2. Взаимодействие неметаллов с водородом:
H2 + Cl2→ 2HCl
3. Электролиз растворов солей:
2CuSO4 + 2H2O → 2Cu + 2H2SO4 + O2
4. При взаимодействии других кислот с
солями. При этом более сильная кислота
вытесняет менее сильную:
CaCO3 + H2SO4 → CaSO4 + H2O + CO2
21.
РЕМОНТХимические свойства кислот
1. Диссоциация кислот в водных растворах на катионы водорода Н+ и
анионы кислотных остатков: HCl → H+ + Cl–
Кислоты изменяют окраску индикатора: лакмус окрашивается
в красный цвет, метилоранж - в красный цвет.
2. Реагируют с основаниями и основными оксидами:
3NaOH + H3PO4 → Na3PO4 + 3H2O
3. Растворимые кислоты взаимодействуют с амфотерными оксидами и
гидроксидами: 3НСl+ Al(OH)3 → AlCl3 + 3H2O
4. Взаимодействуют с солями: СaCO3 + 2HCl → CaCl2 + H2O + CO2
5. Взаимодействуют с металлами. При взаимодействии минеральных
кислот с металлами образуются соль и водород: Fe +2HCl → FeCl2 + H2
Кислоты-окислители (HNO3 любой концентрации и концентрированная
H2SO4) при взаимодействии с металлами водород не образуют.
6. Некоторые кислоты разлагаются при нагревании.
Слабые кислоты H2CO3, H2SO3 и HNO2 разлагаются без нагревания:
H2CO3 → H2O + CO2
22.
РЕМОНТОснования – сложные вещества,
которые состоят из катиона металла
Ме+ (или металлоподобного катиона,
например, иона аммония NH4+) и гидроксиданиона ОН-.
По растворимости в воде основания делят
на растворимые (щелочи) и нерастворимые
основания.
Есть неустойчивые основания, которые
самопроизвольно разлагаются - NH4ОН,
АgOH.
23.
РЕМОНТТривиальные названия некоторых оснований
Формула
Название
KOH
Едкое кали
NaOH
Едкий натр, каустическая сода
Ca(OH)2
Гашеная известь
Ca(OH)2 (прозрачный раствор) Известковая вода
Ca(OH) 2 (мутный раствор)
Известковое молоко
Ba(OH) 2
Едкий барит
24.
РЕМОНТПрименение
NаОН и КОН - очистка нефтепродуктов, производство
мыла, искусственного шелка, бумаги, используются в текстильной
и кожевенной промышленности.
Гашеная известь Са(ОН)2 применяется в качестве
ингибитора коррозии металлов под действием морской воды, а
также в качестве реагента для устранения жесткости воды и
очистки мазута, в производстве строительных материалов,
известковых удобрений, защитных средств для растений,
смягчения воды, нейтрализации сточных вод.
Гидроксид алюминия - компонент зубных паст,
обволакивающее и адсорбирующее средство в медицине.
Гидроксид лития применяется для наполнения щелочных
аккумуляторов, изготовления эмалей и стекол
Гидроксид цинка - наполнитель резин, компонент красок, в
ветеринарии как компонент мазей.
25.
РЕМОНТПолучение оснований
1. Взаимодействие основных оксидов с водой
(получение щелочей): Na2O + H2O → 2NaOH
2. Взаимодействие щелочных металлов, кальция,
стронция и бария с водой при обычных условиях:
2K + 2H2O → 2KOH + H2
3. Электролиз растворов некоторых солей
щелочных металлов:
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. При взаимодействии других щелочей с солями:
K2CO3 + Ca(OH)2 → CaCO3↓ + 2KOH
26.
РЕМОНТХимические свойства оснований
1.
Реакции
нейтрализации
взаимодействие
с
любыми кислотами:
3NaOH + H3PO4 → Na3PO4 + 3H2O
2. Взаимодействие щелочей с амфотерными оксидами и
гидроксидами. При этом в расплаве образуются обычные
соли, а в растворе – комплексные соли:
NaOH + Al(OH)3 = NaAlO2 + 2H2O
3. Взаимодействие с кислотными оксидами:
2NaOH + CO2 = Na2CO3 + H2O
4. Взаимодействие щелочей с растворимыми солями в
растворе:
CuSO4 + 2NaOH = Cu(OH)2↓ + Na2SO4
5. Разложение нерастворимых оснований при нагревании на
оксид и воду: 2Fe(OH)3 = Fe2O3 + 3H2O
27.
РЕМОНТСоли – сложные вещества, состоящие из катиона
металла (или металлоподобных катионов, например, иона
аммония NH4+) и аниона кислотного остатка.
Соли в природе и в повседневной жизни человека
Соли очень широко распространены в природе Общая масса солей,
растворенных в воде всех морей и океанов нашей планеты, равна 5·1019 кг. Около
3/4 этой массы приходится на хлорид натрия NaCl, а оставшуюся четверть
составляют соли калия, кальция, магния, железа и других металлов. В 1 л воды
Мертвого моря содержатся от 350 до 420 г солей! Хлорид натрия и хлорид калия в
виде минерала сильвинита содержатся в земной коре.
К важнейшим природным солям относятся также карбонат кальция
CaCO3, фосфат кальция Сa3(PO4)2 и сульфат кальция СaSO4. Большие залежи
карбоната кальция в виде известняка и минерала кальцита встречаются на
поверхности земли, а в виде мела — на дне океанов и морей.
Многие соли образуют ценные руды, из которых добывают чистые
металлы - цинк сульфид ZnS, сульфид свинца PbS, сульфид мышьяка.
Соли меди - медный купорос CuS04 • 5H20, а также малахит (CuOH) CО3.
28.
РЕМОНТНазвания
солей
составляются
из
названия кислотного остатка и названия
металла. Главным в названии является
кислотный
остаток.
Названия
кислородсодержащих солей имеют окончания
«ат» или «ит» , а названия бескислородных
солей – окончания «ид»
29.
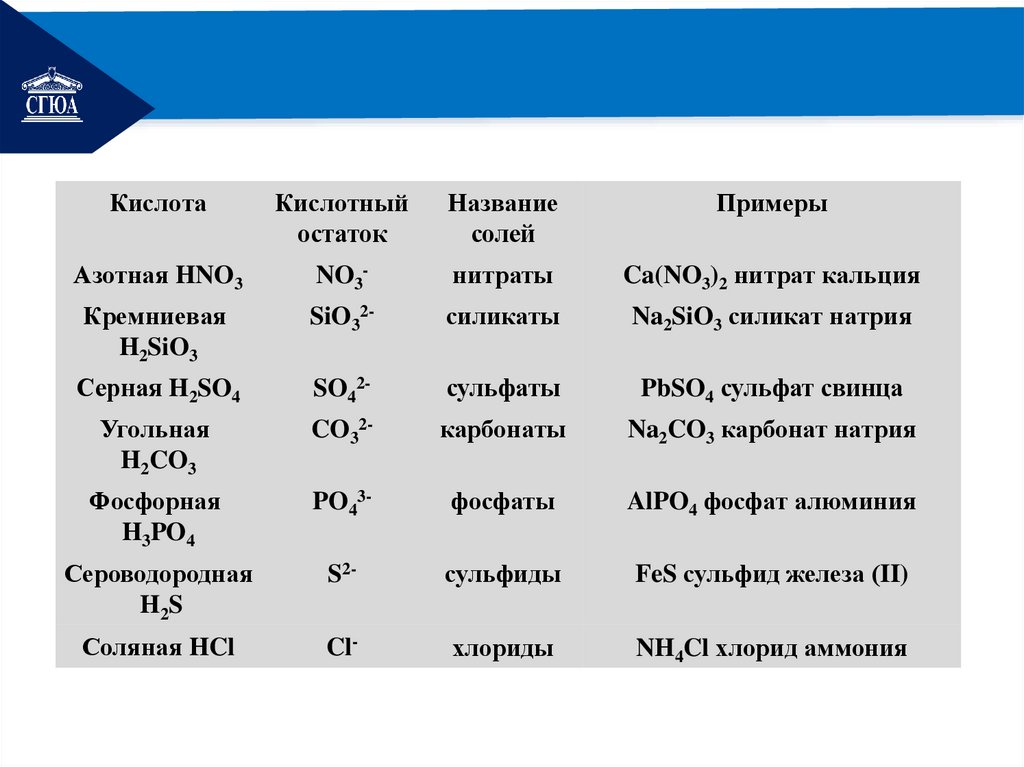
РЕМОНТКислота
Кислотный
остаток
Название
солей
Примеры
Азотная HNO3
NO3-
нитраты
Ca(NO3)2 нитрат кальция
Кремниевая
H2SiO3
SiO32-
силикаты
Na2SiO3 силикат натрия
Серная H2SO4
SO42-
сульфаты
PbSO4 сульфат свинца
Угольная
H2CO3
CO32-
карбонаты
Na2CO3 карбонат натрия
Фосфорная
H3PO4
PO43-
фосфаты
AlPO4 фосфат алюминия
Сероводородная
H2S
S2-
сульфиды
FeS сульфид железа (II)
Соляная HCl
Cl-
хлориды
NH4Cl хлорид аммония
30.
РЕМОНТКлассификация солей
Средние соли – продукты полного замещения катионов водорода в
кислоте на катионы металла (Na2CO3, K3PO4).
Кислые соли – продукты неполного замещения катионов водорода
в кислоте на катионы металлов (NaHCO3, K2HPO4).
Основные соли – продукты неполного замещения гидроксогрупп
основания
на
анионы
кислотных
остатков
кислоты
(малахит (CuOH)2CO3).
По числу катионов и анионов соли разделяют на:
Простые соли – состоящие из катиона одного типа и аниона одного
типа (CaCl2).
Двойные соли – соли, состоящие из двух или более разных
катионов и аниона одного типа (алюмокалиевые квасцы –
KAl(SO4)2).
Смешанные соли – соли, состоящие из катиона одного типа и
двух или более анионов разного типа (хлорид-гипохлорит
кальция Ca(OCl)Cl)
31.
РЕМОНТПолучение солей
1. Взаимодействие кислотных оксидов с основными:
SO3 + Na2O → Na2SO4
2. Взаимодействие кислот с основаниями и амфотерными гидроксидами:
HCl + NaOH → NaCl + H2O
3. Взаимодействие кислот с основными оксидами и амфотерными
оксидами:
2HCl + CuO → CuCl2 + H2O
4. Взаимодействие оснований с кислотными оксидами:
2NaOH + CO2 → Na2CO3 + H2O
5. Взаимодействие кислот с солями. Нерастворимые соли взаимодействуют
только с более сильными кислотами. Растворимые соли взаимодействуют
с растворимыми кислотами, если в продуктах реакции есть осадок, газ или
вода или слабый электролит: CaCO3 + H2SO4 → CaSO4 + 2H2O + CO2
6. Взаимодействие металлов с неметаллами: Ca + S → CaS
7. Растворение металлов в кислотах: Fe + 2HCl → FeCl2 + H2
8. Взаимодействие солей с неметалами: 2KBr + Cl2 = 2KCl + Br2
32.
РЕМОНТХимические свойства солей
1. В водных растворах соли диссоциируют на катионы
металлов Ме+ и анионы кислотных остатков:
CaCl2 → Ca2+ + 2Cl–
2. Взаимодействие с кислотными и амфотерными оксидами
K2CO3 + SiO2 → K2SiO3 + CO2↑
3. Взаимодействие с кислотами: K2CO3 + 2НCl → 2КCl +CO2 +Н2О
4. Растворимые соли взаимодействуют с щелочами:
CuSO4 + 2KOH → Cu(OH)2 + K2SO4
5. Растворимые соли взаимодействуют друг с другом. Реакция
возможна, если в результате образуется осадок:
CuSO4 + BaCl2 → BaSO4↓+ CuCl2
6.Более активные металлы вытесняют из солей менее активные:
CuSO4 + Fe = FeSO4 + Cu
7. Некоторые соли при нагревании разлагаются:
MgСO3 → MgO + СО2
33.
РЕМОНТГенетическая связь - связь между веществами
различных классов, основанная на их
взаимопревращениях и отражающая единство их
происхождения.
Простые вещества – металлы и неметаллы –
образуют цепочки превращений, отражающие
генетическую связь неорганических веществ.
Посредством химических реакций присоединения,
замещения и разложения образуются новые более
простые или сложные соединения.
Каждое звено цепочки связано с предыдущим
наличием простого вещества.
34.
РЕМОНТПримеры цепочек превращения
Активный металл → основный оксид → щёлочь →
соль
2Са + О2 → 2CaO;
CaO + Н2О → Ca(ОН)2;
Ca(ОН)2 + 2HCl → CaCl2 + 2H2O
Неметалл→ кислотный оксид → растворимая
(сильная) кислота → соль
4P + 5O2 → 2P2O5;
P2O5 + 3H2O → 2H3PO4;
H3PO4 + 3NaOH → Na3PO4 + 3H2O
35.
РЕМОНТЗадание
Написать уравнения реакций для цепочки
превращения:
Натрий → гидроксид натрия → карбонат натрия→
оксид натрия → хлорид натрия
36.
СПАСИБО ЗАВНИМАНИЕ!

































 chemistry
chemistry








