Similar presentations:
Білки як високомолекулярні сполуки
1. Білки як високомолекулярні сполуки
2. Фронтальна робота
• 1) Я кі функціональні групи входять до складуамінокислот?
• 2) Самостійно виберіть із таблиці три амінокислоти та
складіть формули утворених ними трипептидів.
3. Білки
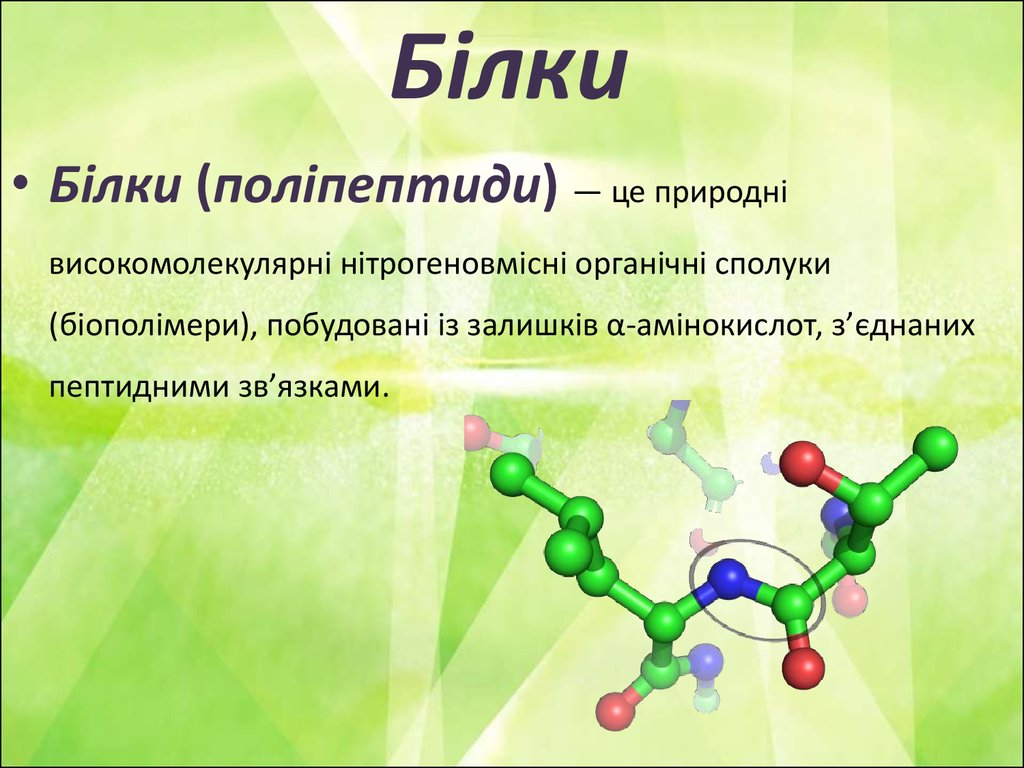
• Білки (поліпептиди) — це природнівисокомолекулярні нітрогеновмісні органічні сполуки
(біополімери), побудовані із залишків α-амінокислот, з’єднаних
пептидними зв’язками.
4.
У живих організмах амінокислотний склад білківвизначається генетичним кодом, у синтезі в більшості
випадків використовуються двадцять стандартних
амінокислот. Безліч їхніх комбінацій дають велику
розмаїтість властивостей молекул білків.
5. Фізичні властивості білків
• Білки відрізняються за ступенем розчинності у воді, алебільшість із них у ній розчиняються. До нерозчинних
належать, наприклад, кератин і фіброїн, який входить до
складу шовку й павутиння. Білки також поділяються на
гідрофільні й гідрофобні.
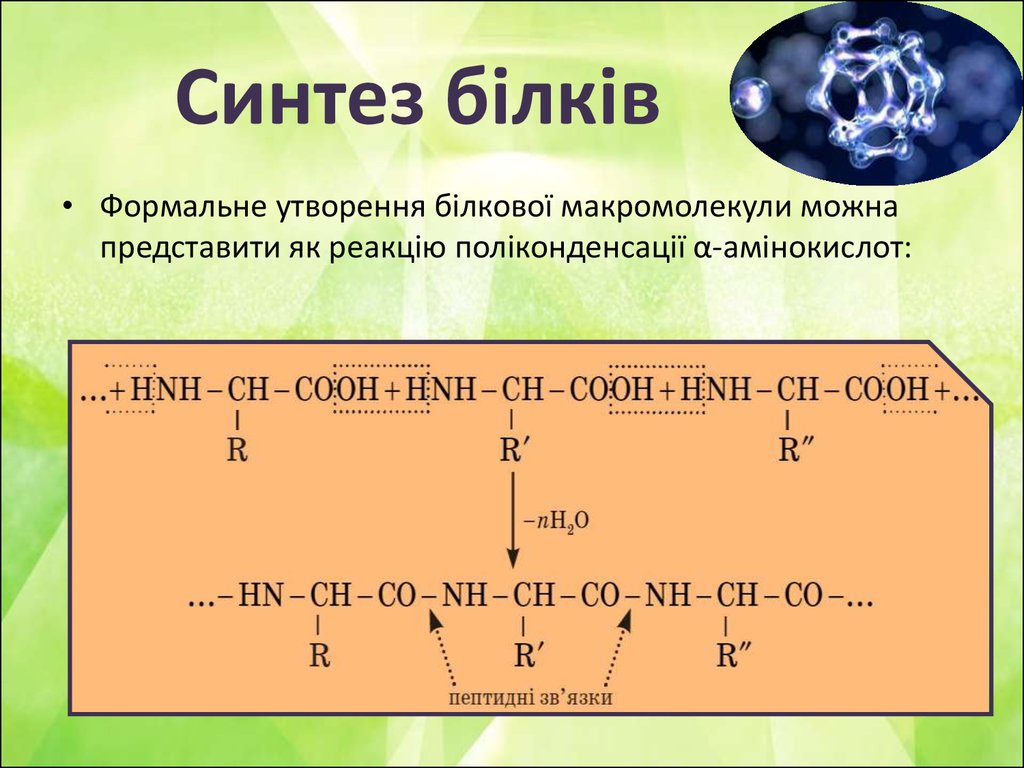
6. Синтез білків
• Формальне утворення білкової макромолекули можнапредставити як реакцію поліконденсації α-амінокислот:
7.
Виділяють чотири рівні структурної організаціїбілків.
Первинна структура — певна послідовність α-
амінокислотних залишків у поліпептидному ланцюзі.
Вторинна структура (α-спіраль) — це конформація
поліпептидного ланцюга, закріплена безліччю водневих
зв’язків між групами N−H і C = O. Одна з моделей
вторинної структури — α-спіраль.
8.
Третинна структура — форма закрученої в просторіспіралі, утворена головним чином за рахунок
дисульфідних містків −S − S−, водневих зв’язків,
гідрофобних та йонних узаємодій.
Четвертинна структура — агрегати кількох білкових
макромолекул (білкові комплекси), утворені за рахунок
узаємодії різних поліпептидних ланцюгів.
9. Хімічні властивості білків
• 1) Гідроліз білків є гідролізом поліпептидного ланцюга зутворенням набору амінокислот, що утворили цей
поліпептидний ланцюг.
• 2) Денатурація — руйнування третинної та вторинної
структур білкової молекули під дією нагрівання, сильних
кислот, лугів, солей важких металів, спиртів, радіації.
10. Застосування одержаних знань
• 1) Яєчний білок поміщаємо в хімічну склянку, додаємоводи (1:1), розмішуємо. Що спостерігаємо? Зробіть
висновок про розчинність білка.
• 2) Наливаємо 1–2 мл одержаного розчину в пробірку.
Дотримуючись правил техніки безпеки, нагріваємо до
згортання білка.
• 3) Наливаємо 1–2 мл розчину білка в пробірку, доливаємо
1–2 мл спирту (98 %). Що спостерігаємо?







 chemistry
chemistry








