Similar presentations:
Фазовые равновесия в двухкомпонентных конденсированных системах
1.
2.
Система-любой изучаемый объект. Совокупностьфаз в равновесном состоянии. Система является
гомогенной, если состоит из одной фазы. Системы
многофазные-гетерогенные. Системы бывают
однокомпонентные и многокомпонентные.
Компоненты ‒ вещества, образующие систему; ими
бывают простые вещества (химические элементы) и
образуемые при их взаимодействии сложные
вещества (химические соединения, промежуточные
фазы и пр.). Сплав, как система, может состоять из
множества компонентов (веществ).
2
3.
Фаза ‒ однородная (гомогенная) часть системы,характеризующаяся одинаковым химическим
составом, строением, агрегатным состоянием,
свойствами и отделенная от других частей
системы поверхностью раздела, при переходе
через которую химический состав и структура
резко меняются.
3
4.
Диаграмма состояния ‒ графическое описание фазовогосостава любого сплава изучаемой системы в зависимости
от концентрации компонентов и температуры.
Диаграмма состояния строиться в координатных осях,
по которым откладывают температуру и массовую
(мольную) долю компонентов.
Геометрические образы диаграммы ‒ точки, линии (если
система одно ‒ или двухкомпонентная), а также
поверхности и объемы (для многокомпонентных систем)
являются геометрическим местом критических температур
и позволяет определять химическую природу, состав и
границы существования равновесных фаз.
4
5.
Диаграмма плавкости − диаграмма состояния вкоординатах «Т − состав» для равновесия «ж − тв».
Внутри диаграммы плавкости в каждой точке (за
исключением некоторых) находятся два компонента
Основные элементы строения бинарных диаграмм
плавкости:
координатные оси, вертикали составов, изотермы,
кривые ликвидуса и солидуса, особые точки (точки
составов химических соединений, точки эвтектики и
перитектики), изотермы полиморфных превращений
5
6.
Концентрационная шкала может быть различной:мольные или массовые доли, мольное или массовое
содержание (в %)
Цифры на оси абсцисс указывают содержание какоголибо одного компонента
6
7.
Левая ось концентраций соответствует чистомукомпоненту А (или 1-й компонент системы), а правая −
чистому компоненту В (или 2-й компонент системы)
Все поле диаграммы разделяется на ряд областей,
соответствующих равновесному существованию
определенных фаз
7
8.
На диаграмме плавкости есть равновесные линии солидусаи ликвидуса, которые разделяют ее на несколько областей
существования фаз. Между линиями ликвидуса и солидуса
находится область равновесного существования жидких и
твердых растворов
8
9.
Линия ликвидуса − графическая зависимость температуры,находящихся в равновесии фаз от состава жидкой фазы
T=f(NBж). Выше этой линии существует только жидкая фаза.
Точки кривых ликвидуса показывают температуру начала
кристаллизации расплава при его охлаждении
Линия солидуса − графическая зависимость температуры
находящихся в равновесии фаз от состава твердой фазы
T=f(NBтв). Ниже этой линии жидкая фаза существовать не
может. Точки на кривых солидуса показывают температуру
конца кристаллизации при охлаждении расплава
9
10.
11.
При кристаллизации двухкомпонентных раствороввозможно образование механической смеси кристаллов
чистых компонентов, когда твердые вещества не
растворимы друг в друге, а также возможно образование
смешанных кристаллов или твердых растворов
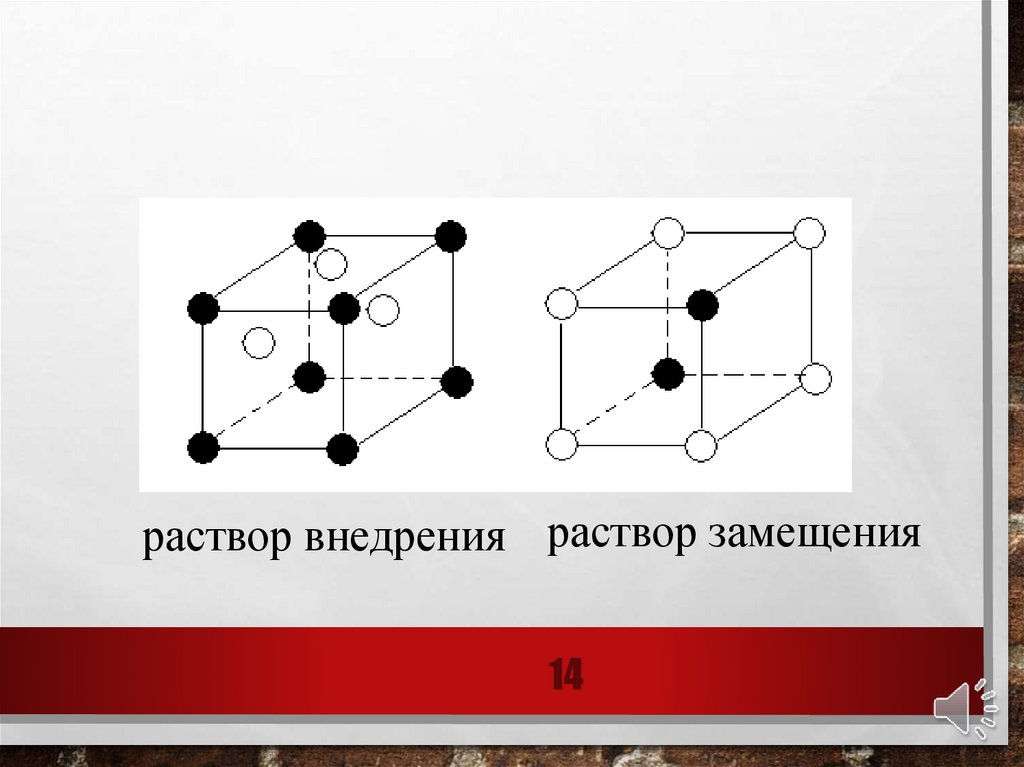
Твердые растворы - однофазные системы переменного
состава, состоящие из двух или более компонентов.
Различают твердые растворы внедрения и замещения
11
12.
В твердых растворах внедрения частицы (атомы,молекулы и ионы) одного компонента размещаются
между узлами кристаллической решетки другого
компонента. Они получаются при растворении в
металлах неметаллов – бора, углерода, водорода, азота
12
13.
В твердых растворах замещения частицы (атомы илиионы) одного компонента замещают в узлах
кристаллической решетки частицы другого компонента
(изоморфизм). Число атомов в решетке сохраняется, но
изменяется ее объем и плотность
13
14.
раствор внедрения раствор замещения14
15.
Смешанные твердые растворы (смешанныекристаллы) – это фазы переменного состава,
отличающиеся от чистых веществ тем, что ячейки
кристаллических решеток в твердых растворах
неодинаковы.
15














 chemistry
chemistry








