Similar presentations:
Аортокоронарное шунтирование как метод хирургического лечения ИБС
1.
Федеральное государственное автономное образовательное учреждениевысшего образования «Российский национальный исследовательский медицинский университет
имени Н.И. Пирогова» Министерства здравоохранения Российской Федерации
(ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России)
Кафедра факультетской хирургии № 1 ЛФ
Реферат на тему:
«Аортокоронарное шунтирование как метод
хирургического лечения ИБС»
Заведующий кафедрой: д.м.н. профессор,
член-корреспондент РАН
Сажин Александр Вячеславович
Преподаватель: д.м.н. профессор
Вирганский Анатолий Олегович
Докладчик: студент 1.4.01б группы
Зузенков Макар Вадимович
2.
Содержание1) Введение.
2) Определение.
2) История операции.
3) Показания и противопоказания к операции.
4) Ход операции.
5)Проведение АКШ без искусственного кровообращения.
6) Осложнения.
7) Заключение.
8) Список литературы.
3.
ВведениеПо данным ВОЗ, во всем мире на
протяжении многих десятилетий
бессменным лидером среди причин
смертности
и
инвалидности
являются заболевания сердечнососудистой системы. Каждый год
они уносят жизни около 17 млн
человек.
Наибольшая
доля
смертности
среди
заболеваний
сердечнососудистой системы приходится на
ишемическую болезнь сердца и
составляет ежегодно около 7 млн
человек.
4.
ВведениеПроблема лечения ИБС остается актуальной во всем мире. Несмотря на широкое
внедрение в клиническую практику новых эффективных медикаментозных методов
и рентгенэндоваскулярного лечения, аортокоронарное шунтирование остается
одним из наиболее эффективных методов лечения ИБС.
5.
Методы реваскуляризации миокарда6.
ОпределениеКоронарное шунтирование – восстановление кровотока в коронарных
артериях в обход стенозированного или окклюзированного участка путем
создания обходных анастомозов между аортой (аортокоронарне
шунтирование) или внутренней грудной артерией (маммарокоронарное
шунтирование) и пораженной коронарной артерией дистальнее места ее
сужения.
7.
История операцииВпервые попытался создать шунт
Алексис Каррель. В 1910 году в
эксперименте на собаках он соединял
нисходящую
грудную
аорту
с
коронарной
артерией
сердца
с
помощью сонной артерии. Однако
выполнить успешно эту операцию ему
мешала фибрилляция желудочков,
начинающаяся
после
пережатия
коронарной артерии более чем на 3
минуты. Каррель не имел возможности
сшить артерии за 3 минуты, поэтому
эксперимент провалился.
8.
История операцииВ 1920-30 годах врачи пытались восстановить
кровоснабжение ишемизированной области
миокарда методом непрямой реваскуляризации.
Клод Бек предложил способ так называемого
"слипчивого
перикардита",
когда
между
перикардом и миокардом образовывались
соединительнотканные спайки, по которым
кровь шла к миокарду и таким образом
кровоснабжала его.
О'Шонесси
пробовал
разные
методы
кровоснабжения миокарда, подшивая к эпикарду
хорошо васкуляризованные органы, например,
легкие, грудные мышцы, большой сальник и др.
9.
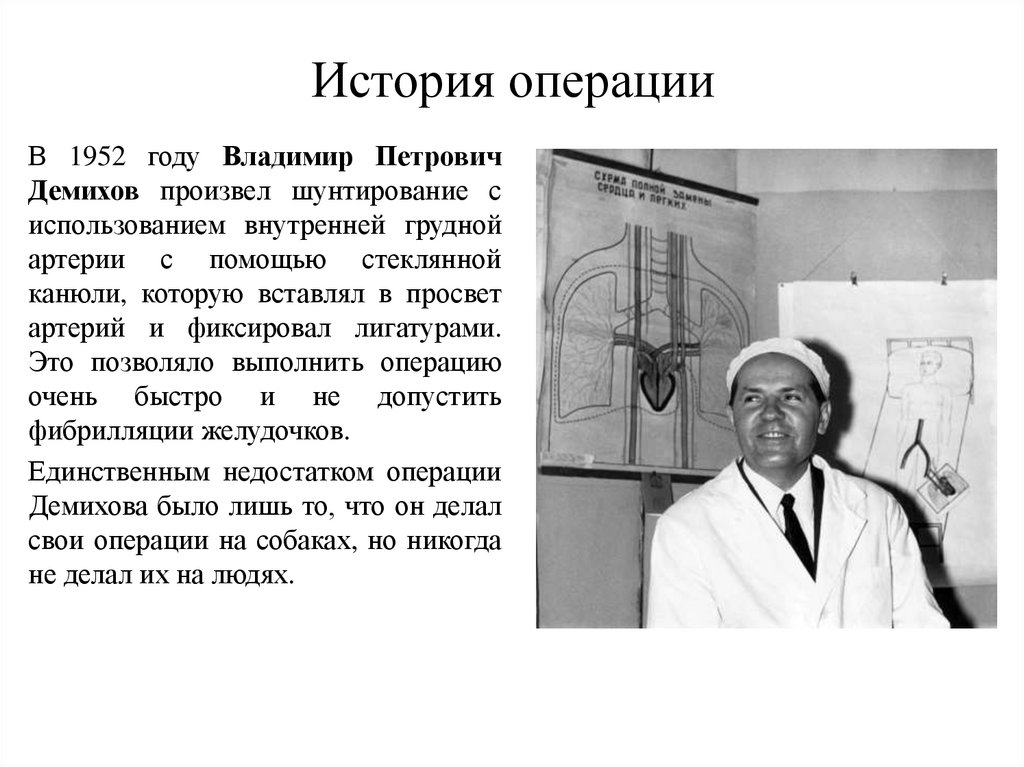
История операцииВ 1952 году Владимир Петрович
Демихов произвел шунтирование с
использованием внутренней грудной
артерии с помощью стеклянной
канюли, которую вставлял в просвет
артерий и фиксировал лигатурами.
Это позволяло выполнить операцию
очень быстро и не допустить
фибрилляции желудочков.
Единственным недостатком операции
Демихова было лишь то, что он делал
свои операции на собаках, но никогда
не делал их на людях.
10.
История операции2 мая 1960 доктор Роберт Гетц вошел в
историю, выполнив первое успешное
шунтирование коронарной артерии у
человека. Пациентом был 38-летнем
водитель, у которого была такая тяжелая
стенокардия, что он принимал от 70 до
90 таблеток нитроглицерина в день.
Гетц сделал анастомоз по типу "конецв-конец" с использованием танталовых
колец. Применяемая им при этом
модифицированная
техника
Пайра
позволяла вывернуть края сшиваемых
сосудов таким образом, что они
соприкасались между собой только
интимой.
Выполнение
анастомоза
заняло всего 17 секунд.
11.
История операцииПосле операции, выполненной Гетцем,
пациент чувствовал себя хорошо, и
прожил год без приступов стенокардии.
Он умер 23.06.1961 от острого инфаркта
миокарда
задней
стенки
левого
желудочка,
однако
аутопсия
не
проводилась. Это был первый и
последний
коронарный
шунт,
выполненный Гетцем. Это может звучать
удивительно, но это соответствовало
особенностям того времени: несмотря на
то, что операция была выполнена
успешно, и у пациента не было
осложнений, руководство клиники сочло
данную операцию недопустимой, факт
её выполнения долгое время скрывали.
12.
История операцииПозже, в 1964 году, Василий
Иванович Колесов провел маммарокоронарный анастомоз на работающем
сердце уже с применением шовной
техники, а не канюли. Эта операция
уже была приближена к современному
варианту операции.
В 1967 году Рене Фавалоро выполнил
первое успешное аутовенозное коронарное
шунтирование.
Через две недели после успешной
операции
Фавалоро
Джонсон
модифицировал операцию, вшив вену
конец-в-бок. Эта методика стала в
дальнейшем
стандартной
техникой
выполнения анастомоза.
13.
Показания к операции1) Значимый стеноз ствола левой коронарной артерии (> 50%);
2) Стеноз проксимальной части передней нисходящей артерии и
проксимальной части огибающей артерии > 70% (эквивалент поражения
ствола ЛКА);
3) Трехсосудистое поражение включая проксимальный стеноз передней
нисходящей артерии и ФВЛЖ<50%;
4) Стеноз >70% в двух основных коронарных артериях с обширной
ишемией миокарда по результатам стресс-тестирования;
5) Опасная желудочковая аритмия, вызванная стенозом ствола ЛКА или
трехсосудистым поражением коронарных артерий;
6) Невозможность ЧТКА из-за анатомических особенностей коронарного
русла;
7) Стенокардия III-IV ФК, рефрактерная к медикаментозной терапии;
8) Механические осложнения инфаркта миокарда, такие как повреждение
межжелудочковой перегородки, разрыв сосочковой мышцы или разрыв
миокарда.
14.
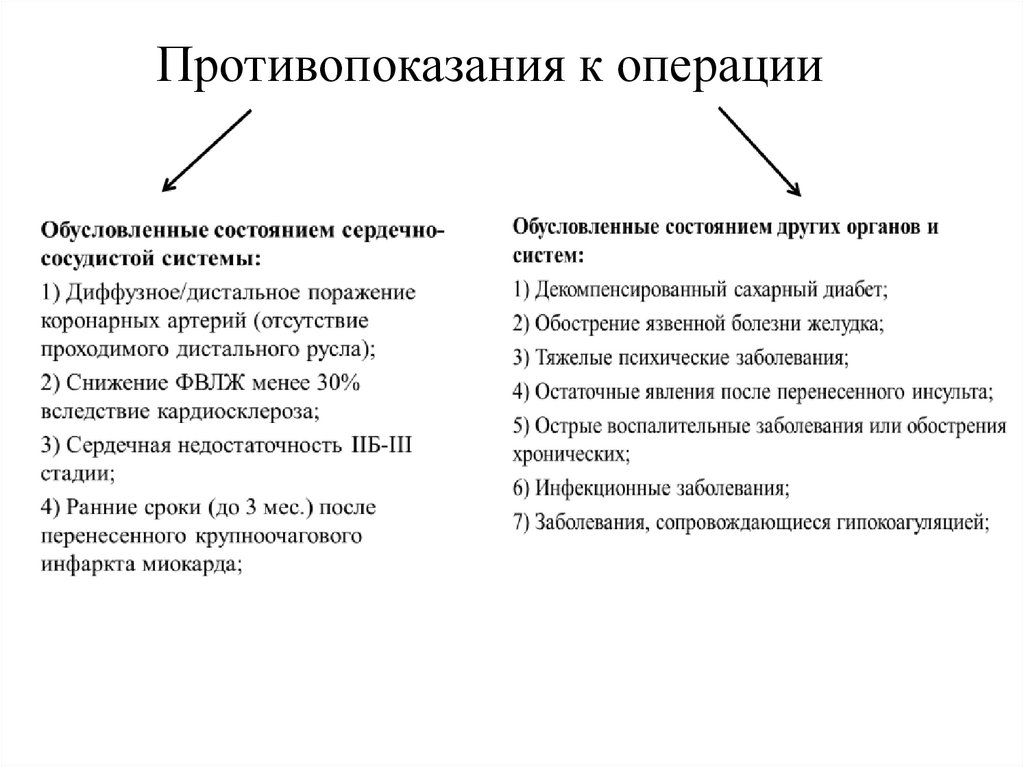
Противопоказания к операции15.
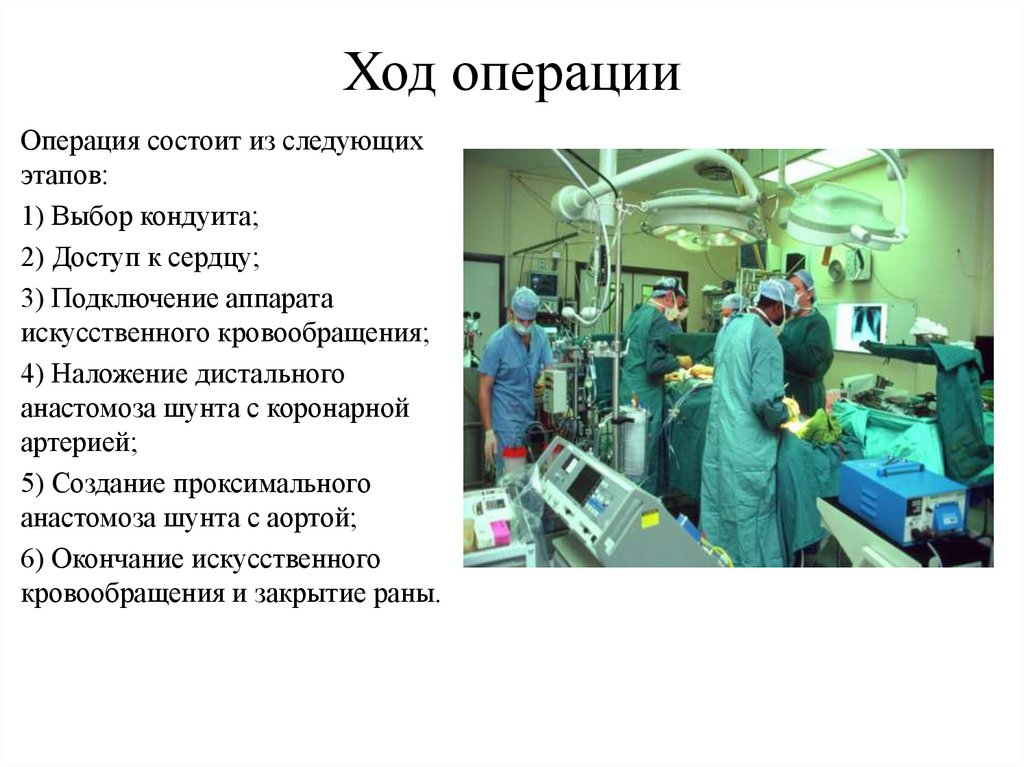
Ход операцииОперация состоит из следующих
этапов:
1) Выбор кондуита;
2) Доступ к сердцу;
3) Подключение аппарата
искусственного кровообращения;
4) Наложение дистального
анастомоза шунта с коронарной
артерией;
5) Создание проксимального
анастомоза шунта с аортой;
6) Окончание искусственного
кровообращения и закрытие раны.
16.
Виды кондуитов17.
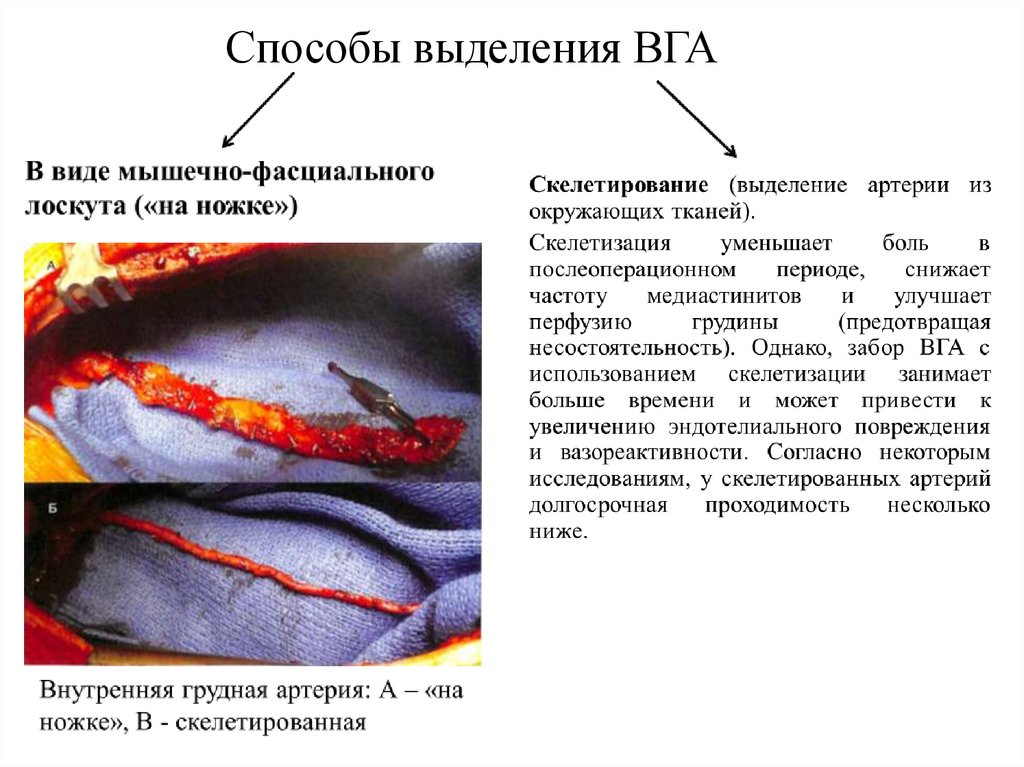
Внутренняя грудная артерияВнутренняя грудная артерия обладает молекулярными
и клеточными особенностями, которые определяют ее
уникальное
сопротивление
атеросклерозу
и
чрезвычайно высокую долговечность в качестве
шунта:
1) Плотная, без фенестраций интима предотвращает
миграцию клеток в субинтимальное пространство;
2) Гладкие мышцы внутренней грудной артерии мало
способны к пролиферативной реакции в ответ на
воздействие факторов роста;
3) Эндотелий внутренней грудной артерии производит
значительно больше простациклина (вазодилататора и
ингибитора тромбоцитов) и NO;
4)
Нитроглицерин
вызывает
вазодилатацию
внутренней грудной артерии, в отличие от v. saphena
magna;
5) Внутренняя грудная артерия может адаптироваться к
меняющемуся кровотоку и, как часто наблюдается,
увеличивается
в
диаметре
в
отдаленном
послеоперационном периоде.
18.
Способы выделения ВГА19.
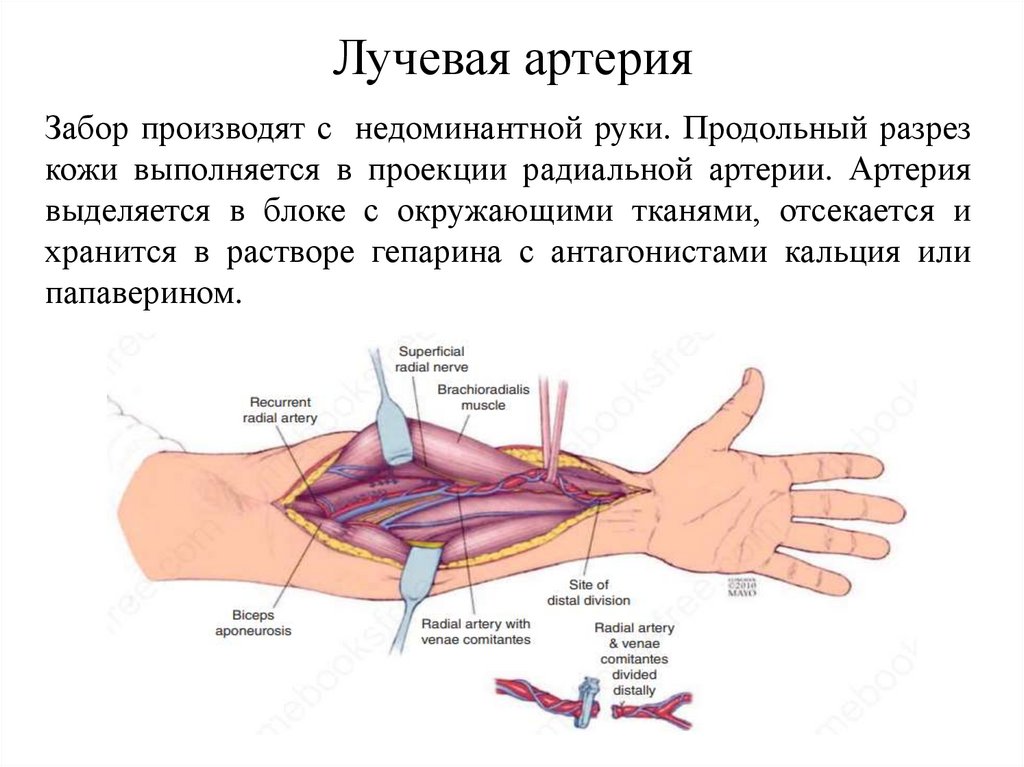
Лучевая артерияЗабор производят с недоминантной руки. Продольный разрез
кожи выполняется в проекции радиальной артерии. Артерия
выделяется в блоке с окружающими тканями, отсекается и
хранится в растворе гепарина с антагонистами кальция или
папаверином.
20.
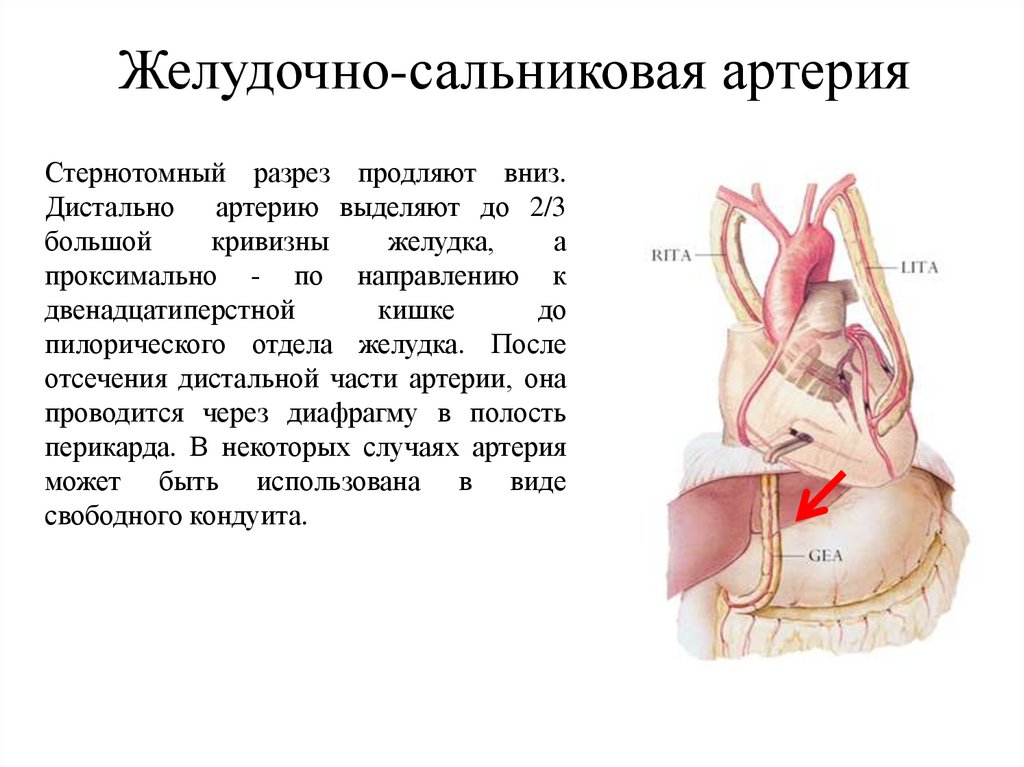
Желудочно-сальниковая артерияСтернотомный разрез продляют вниз.
Дистально артерию выделяют до 2/3
большой
кривизны
желудка,
а
проксимально - по направлению к
двенадцатиперстной
кишке
до
пилорического отдела желудка. После
отсечения дистальной части артерии, она
проводится через диафрагму в полость
перикарда. В некоторых случаях артерия
может быть использована в виде
свободного кондуита.
21.
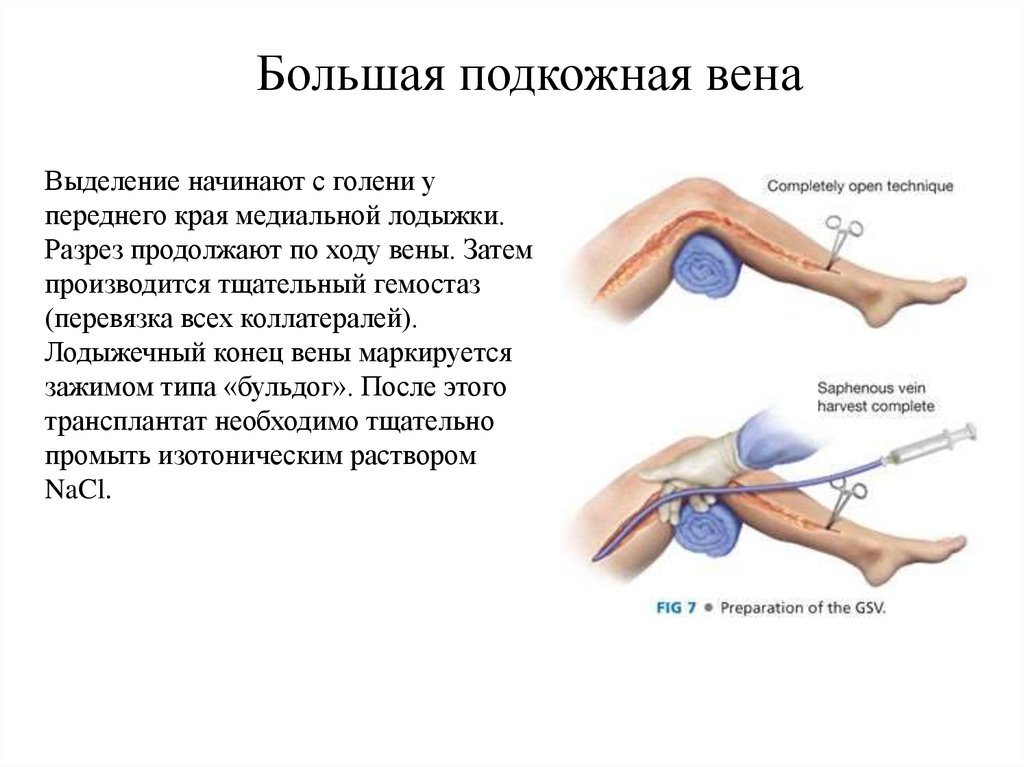
Большая подкожная венаВыделение начинают с голени у
переднего края медиальной лодыжки.
Разрез продолжают по ходу вены. Затем
производится тщательный гемостаз
(перевязка всех коллатералей).
Лодыжечный конец вены маркируется
зажимом типа «бульдог». После этого
трансплантат необходимо тщательно
промыть изотоническим раствором
NaCl.
22.
Длительность функции шунтовКомбинация уникальной биологии внутренней грудной артерии и хорошего
оттока по передней межжелудочковой ветви левой коронарной артерии
обеспечивает чрезвычайно длительную нормальную функцию этого шунта.
10-летняя компетентность кондуита отмечена более чем у 90% пациентов, и
есть сообщения о более длительной нормальной функции спустя 15, 20, 25, и
30 лет после операции.
Лучевая артерия в качестве свободного кондуита от аорты нормально
функционирует у 85% пациентов в течение в 5 лет
Хорошая функция желудочно-сальниковой артерии в 5-летнем периоде
наблюдения отмечена у 85-90% пациентов, однако опыт ее использования
ограничен и крупномасштабные данные недоступны.
Большая подкожная вена.
Раннее (в течение первого года) нарушение ее функции происходит в 20-25%
случаев. В течение 5 и 10-летнего периода наблюдения остаются нормально
функционирующими соответственно 60% и 40% венозных шунтов.
23.
Выбор кондуита: клиническиерекомендации
В качестве шунтов у всех пациентов рекомендуется
использование левой внутренней грудной артерии для
увеличения времени «выживаемости» шунта. При отсутствии
высокого риска стернальных осложнений (ожирения,
декомпенсированного сахарного диабета) рекомендуется
использование правой внутренней грудной артерии. В
дополнение к внутренним грудным артериям при стенозах
коронарных сосудов более 80% и/или их окклюзиях
рекомендовано применение лучевой артерии в качестве
аортокоронарных шунтов, реваскуляризация остальных ветвей
проводится аутовенозными трансплантатами.
24.
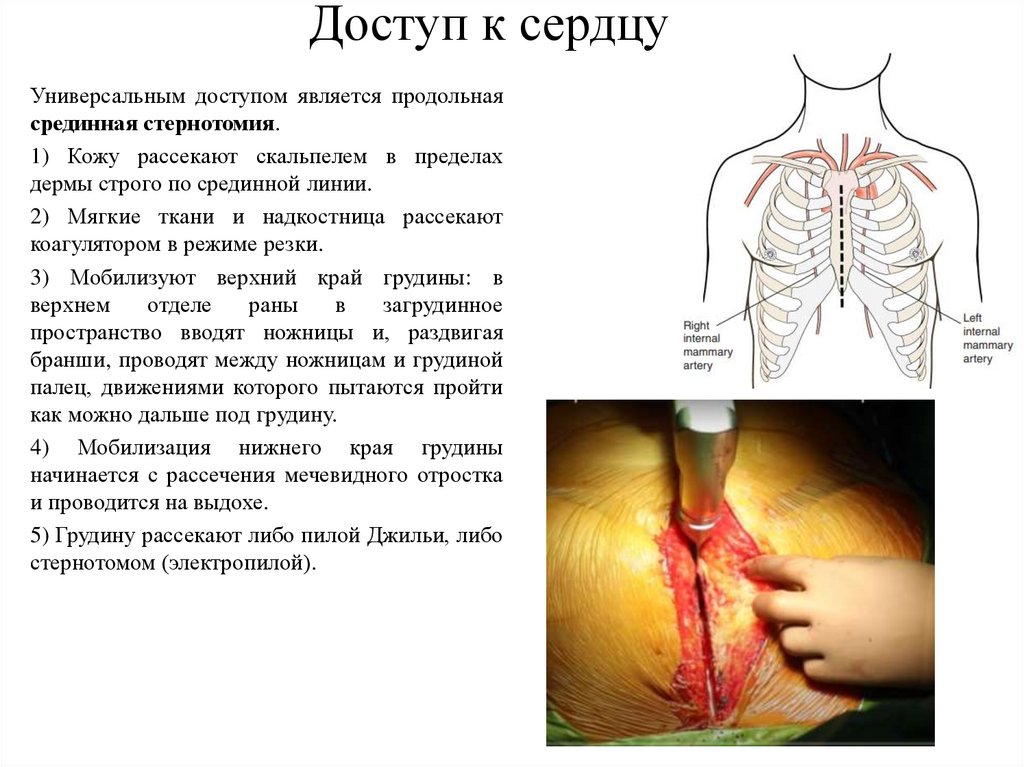
Доступ к сердцуУниверсальным доступом является продольная
срединная стернотомия.
1) Кожу рассекают скальпелем в пределах
дермы строго по срединной линии.
2) Мягкие ткани и надкостница рассекают
коагулятором в режиме резки.
3) Мобилизуют верхний край грудины: в
верхнем
отделе
раны
в
загрудинное
пространство вводят ножницы и, раздвигая
бранши, проводят между ножницам и грудиной
палец, движениями которого пытаются пройти
как можно дальше под грудину.
4) Мобилизация нижнего края грудины
начинается с рассечения мечевидного отростка
и проводится на выдохе.
5) Грудину рассекают либо пилой Джильи, либо
стернотомом (электропилой).
25.
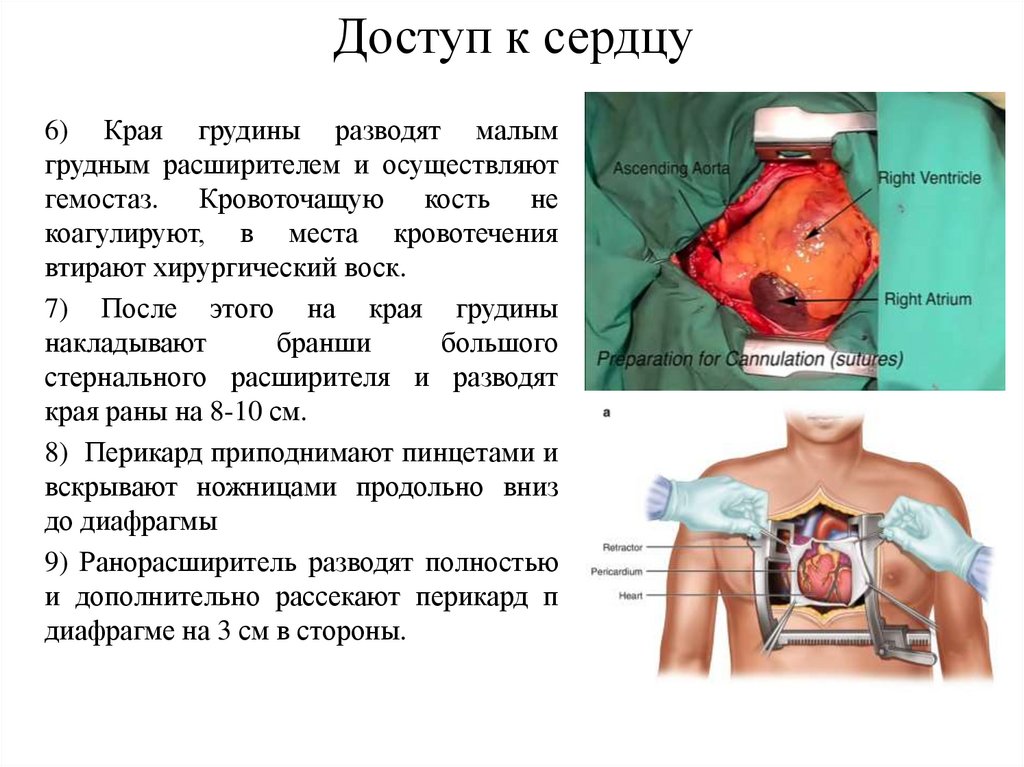
Доступ к сердцу6) Края грудины разводят малым
грудным расширителем и осуществляют
гемостаз. Кровоточащую кость не
коагулируют, в места кровотечения
втирают хирургический воск.
7) После этого на края грудины
накладывают
бранши
большого
стернального расширителя и разводят
края раны на 8-10 см.
8) Перикард приподнимают пинцетами и
вскрывают ножницами продольно вниз
до диафрагмы
9) Ранорасширитель разводят полностью
и дополнительно рассекают перикард п
диафрагме на 3 см в стороны.
26.
Подключение аппарата искусственногокровообращения
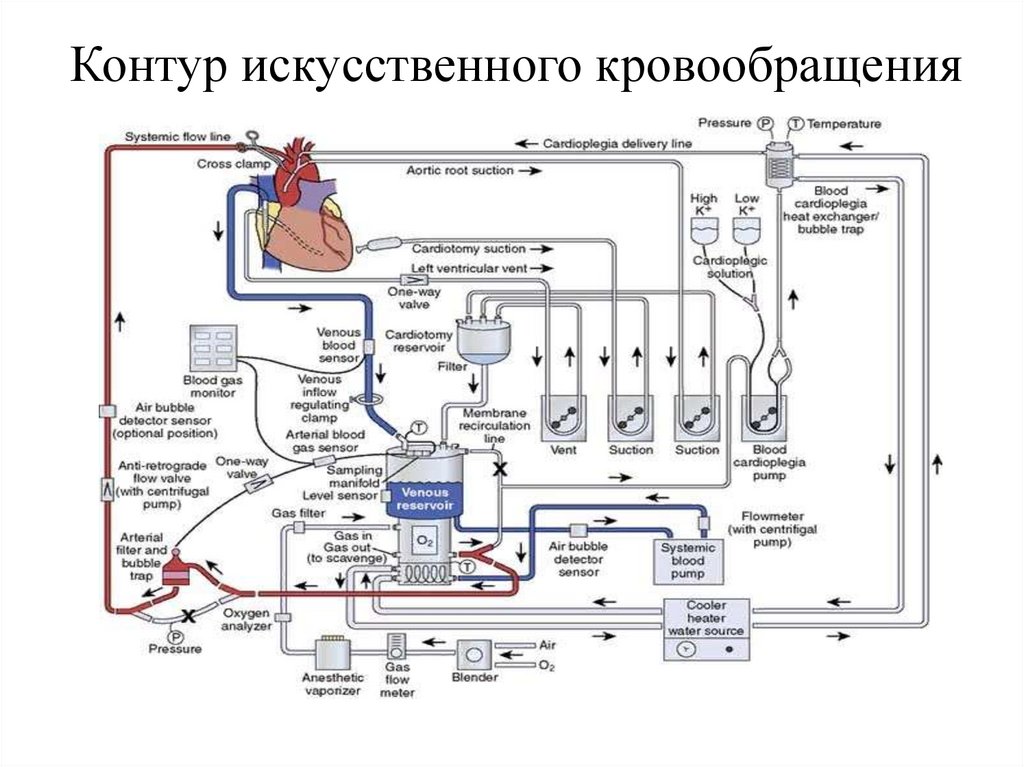
Стандартные компоненты контура искусственного кровообращения:
1) Венозные канюли;
2) Венозная магистраль;
3) Венозный резервуар;
4) Магистраль от выхода венозного резервуара до основного насоса;
5) Магистраль роликового насоса;
6) Магистраль от выхода насоса до входа в оксигенатор;
7) Оксигенатор;
8) Магистраль от выхода оксигенатора до входа в артериальный фильтр;
9) Артериальный фильтр;
10) Артериальная магистраль;
11) Артериальная канюля (варианты: для канюляции аорты, магистральных
артериальных сосудов - бедренной артерии, подключичной артерии и т.д.);
27.
Контур искусственного кровообращения28.
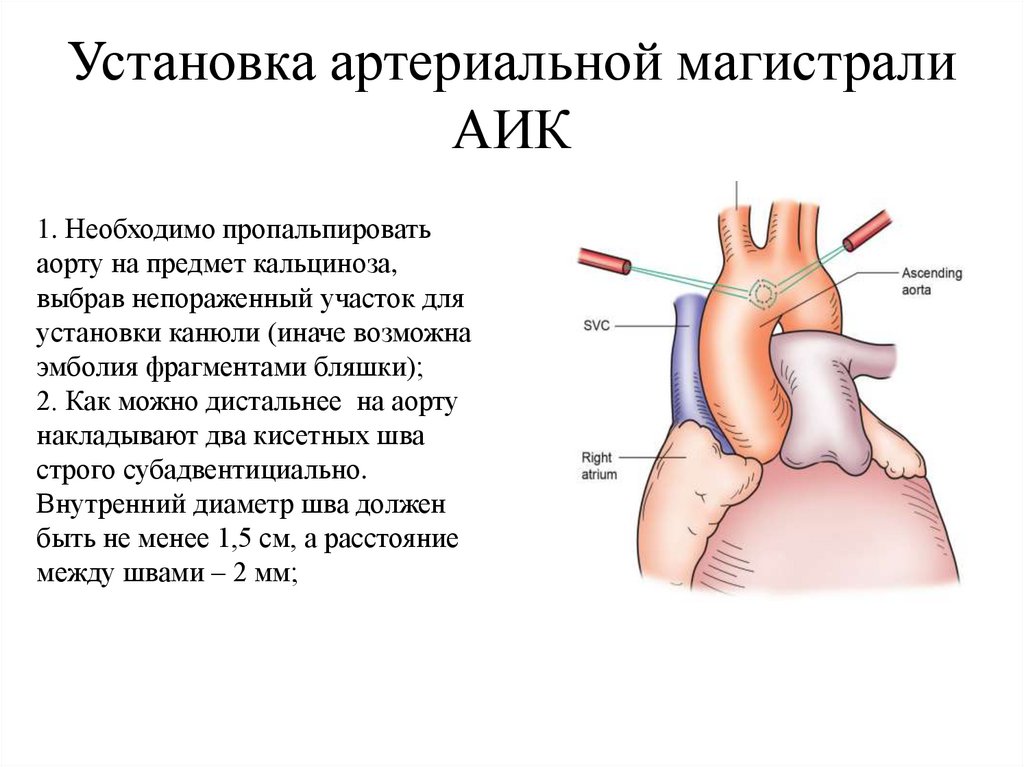
Установка артериальной магистралиАИК
1. Необходимо пропальпировать
аорту на предмет кальциноза,
выбрав непораженный участок для
установки канюли (иначе возможна
эмболия фрагментами бляшки);
2. Как можно дистальнее на аорту
накладывают два кисетных шва
строго субадвентициально.
Внутренний диаметр шва должен
быть не менее 1,5 см, а расстояние
между швами – 2 мм;
29.
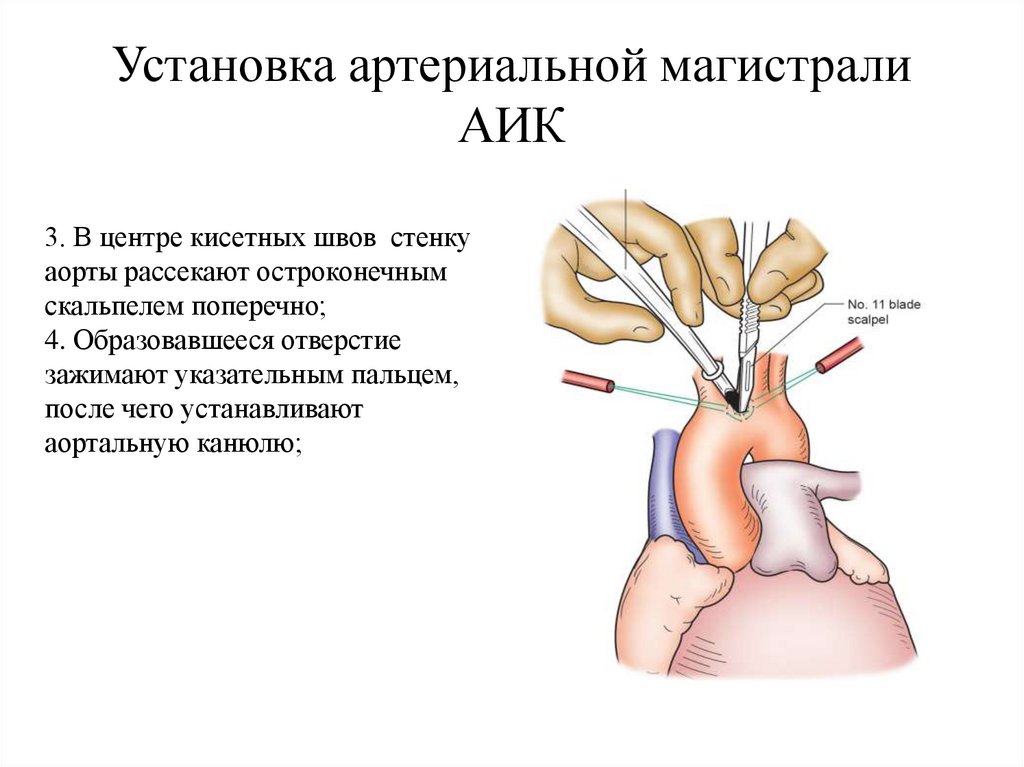
Установка артериальной магистралиАИК
3. В центре кисетных швов стенку
аорты рассекают остроконечным
скальпелем поперечно;
4. Образовавшееся отверстие
зажимают указательным пальцем,
после чего устанавливают
аортальную канюлю;
30.
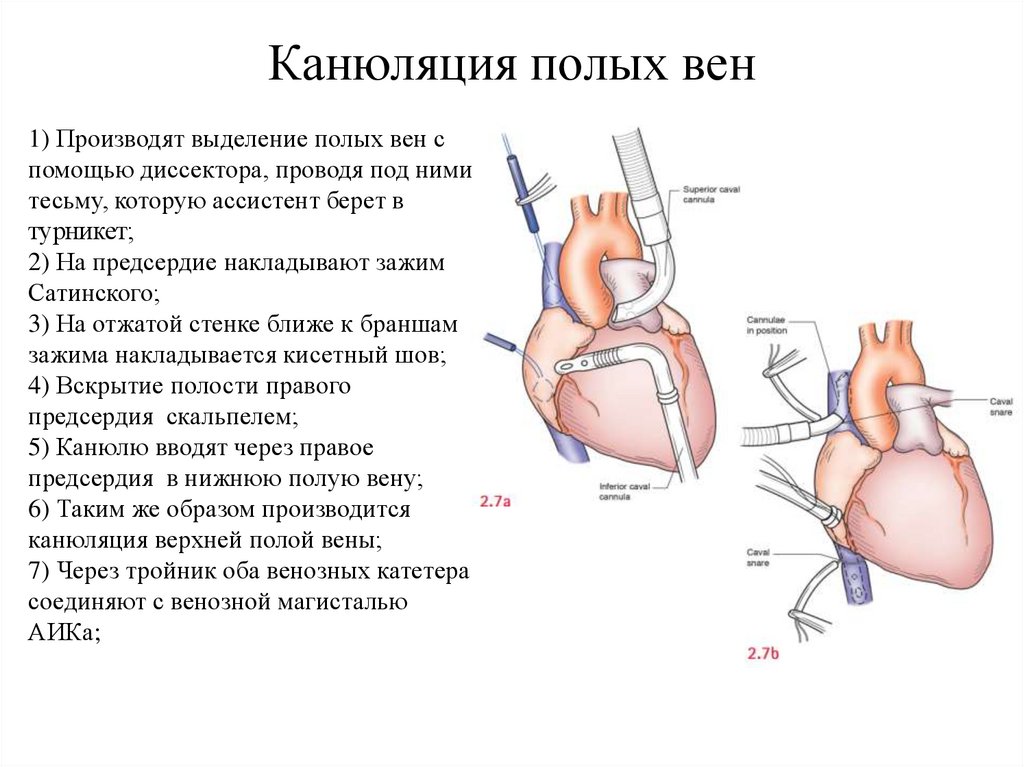
Канюляция полых вен1) Производят выделение полых вен с
помощью диссектора, проводя под ними
тесьму, которую ассистент берет в
турникет;
2) На предсердие накладывают зажим
Сатинского;
3) На отжатой стенке ближе к браншам
зажима накладывается кисетный шов;
4) Вскрытие полости правого
предсердия скальпелем;
5) Канюлю вводят через правое
предсердия в нижнюю полую вену;
6) Таким же образом производится
канюляция верхней полой вены;
7) Через тройник оба венозных катетера
соединяют с венозной магисталью
АИКа;
31.
КардиоплегияКомплекс мер, направленных на защиту миокарда во время основного этапа
кардиохирургического вмешательства, включающих в себя остановку сердца и
протекцию миокарда.
32.
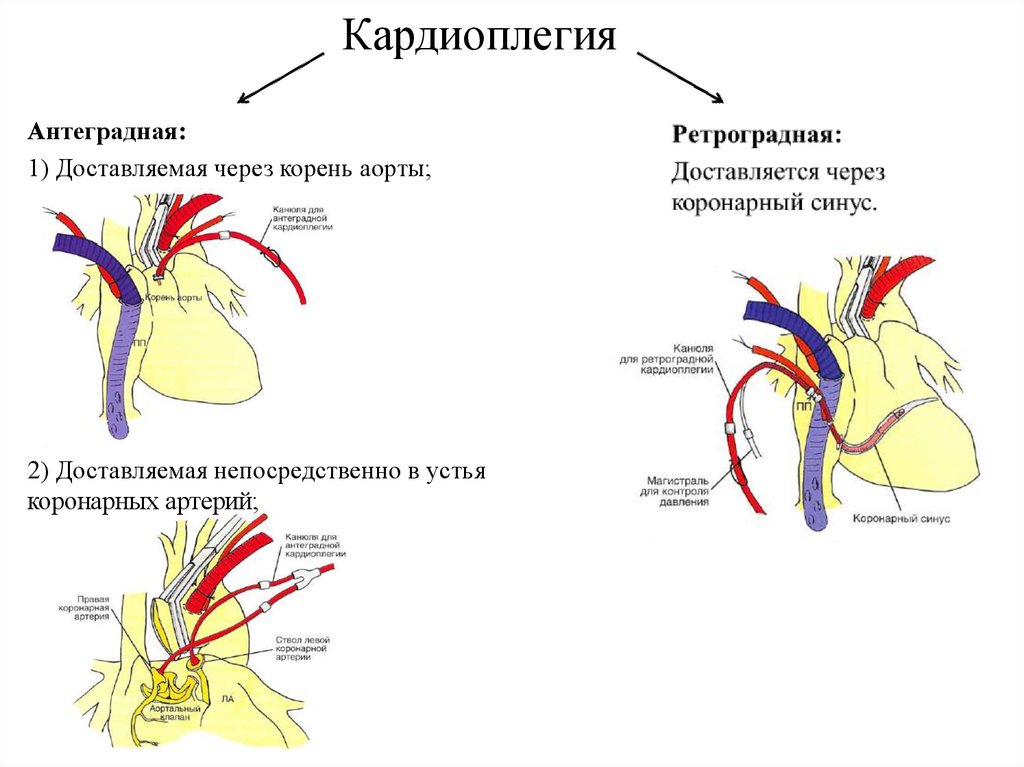
КардиоплегияАнтеградная:
1) Доставляемая через корень аорты;
2) Доставляемая непосредственно в устья
коронарных артерий;
33.
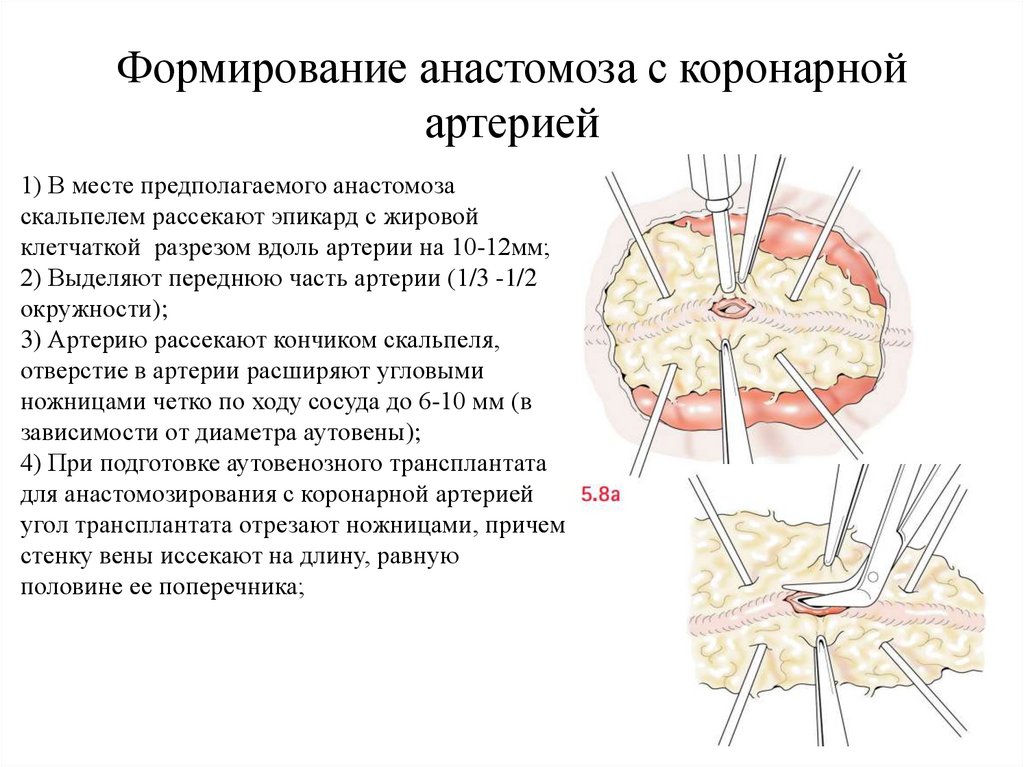
Формирование анастомоза с коронарнойартерией
1) В месте предполагаемого анастомоза
скальпелем рассекают эпикард с жировой
клетчаткой разрезом вдоль артерии на 10-12мм;
2) Выделяют переднюю часть артерии (1/3 -1/2
окружности);
3) Артерию рассекают кончиком скальпеля,
отверстие в артерии расширяют угловыми
ножницами четко по ходу сосуда до 6-10 мм (в
зависимости от диаметра аутовены);
4) При подготовке аутовенозного трансплантата
для анастомозирования с коронарной артерией
угол трансплантата отрезают ножницами, причем
стенку вены иссекают на длину, равную
половине ее поперечника;
34.
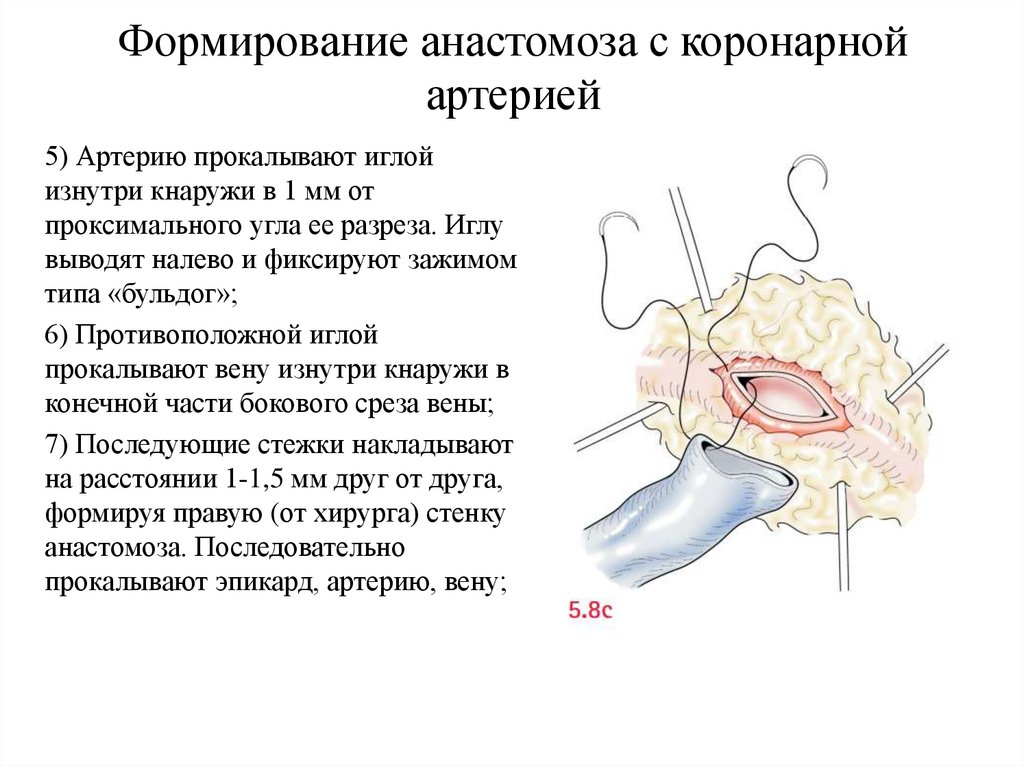
Формирование анастомоза с коронарнойартерией
5) Артерию прокалывают иглой
изнутри кнаружи в 1 мм от
проксимального угла ее разреза. Иглу
выводят налево и фиксируют зажимом
типа «бульдог»;
6) Противоположной иглой
прокалывают вену изнутри кнаружи в
конечной части бокового среза вены;
7) Последующие стежки накладывают
на расстоянии 1-1,5 мм друг от друга,
формируя правую (от хирурга) стенку
анастомоза. Последовательно
прокалывают эпикард, артерию, вену;
35.
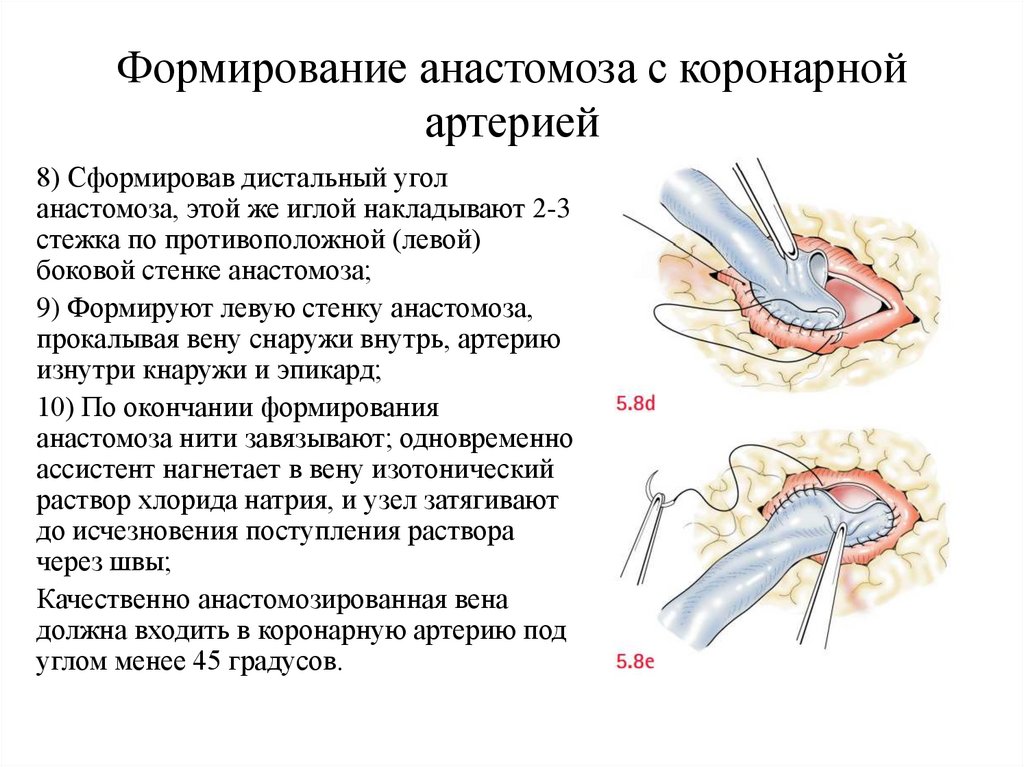
Формирование анастомоза с коронарнойартерией
8) Сформировав дистальный угол
анастомоза, этой же иглой накладывают 2-3
стежка по противоположной (левой)
боковой стенке анастомоза;
9) Формируют левую стенку анастомоза,
прокалывая вену снаружи внутрь, артерию
изнутри кнаружи и эпикард;
10) По окончании формирования
анастомоза нити завязывают; одновременно
ассистент нагнетает в вену изотонический
раствор хлорида натрия, и узел затягивают
до исчезновения поступления раствора
через швы;
Качественно анастомозированная вена
должна входить в коронарную артерию под
углом менее 45 градусов.
36.
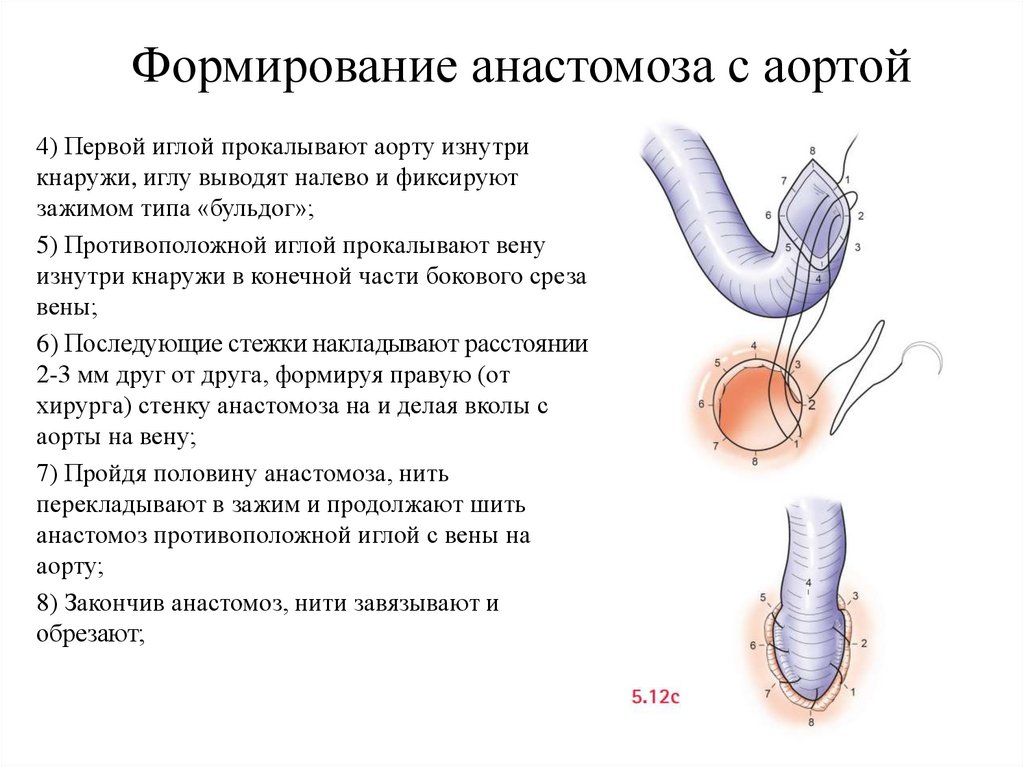
Формирование анастомоза с аортой1) Аорту отжимают зажимом вблизи
луковицы на половину ее диаметра;
2) На отжатом участке скальпелем
делают разрезы длиной 5 мм на всю
толщину стенки в количестве,
соответствующем числу аортальных
анастомозов;
3) В разрез аорты вводят кончик
аортального выкусывателя, которым
формируют округлые отверстия с
ровными стенками;
37.
Формирование анастомоза с аортой4) Первой иглой прокалывают аорту изнутри
кнаружи, иглу выводят налево и фиксируют
зажимом типа «бульдог»;
5) Противоположной иглой прокалывают вену
изнутри кнаружи в конечной части бокового среза
вены;
6) Последующие стежки накладывают расстоянии
2-3 мм друг от друга, формируя правую (от
хирурга) стенку анастомоза на и делая вколы с
аорты на вену;
7) Пройдя половину анастомоза, нить
перекладывают в зажим и продолжают шить
анастомоз противоположной иглой с вены на
аорту;
8) Закончив анастомоз, нити завязывают и
обрезают;
38.
Использование ВГА для реваскуляризациимиокарда
Золотым стандартом в
коронарной хирургии является
шунтирование ПМЖА левой
внутренней грудной артерией.
Чаще всего ВГА применяют
совместно с аутовенозным
шунтированием артерий
системы ОА и ПКА. В этих
случаях ВГА анастомозируют
в ПМЖА в последнюю очередь.
39.
Использование ВГА для реваскуляризациимиокарда
ВГА отделяют от
окружающих тканей на
протяжении 1,5 см и
вскрывают продольным
разрезом на 5 мм длиннее
разреза коронарной
артерии, после чего
накладывается анастомоз.
40.
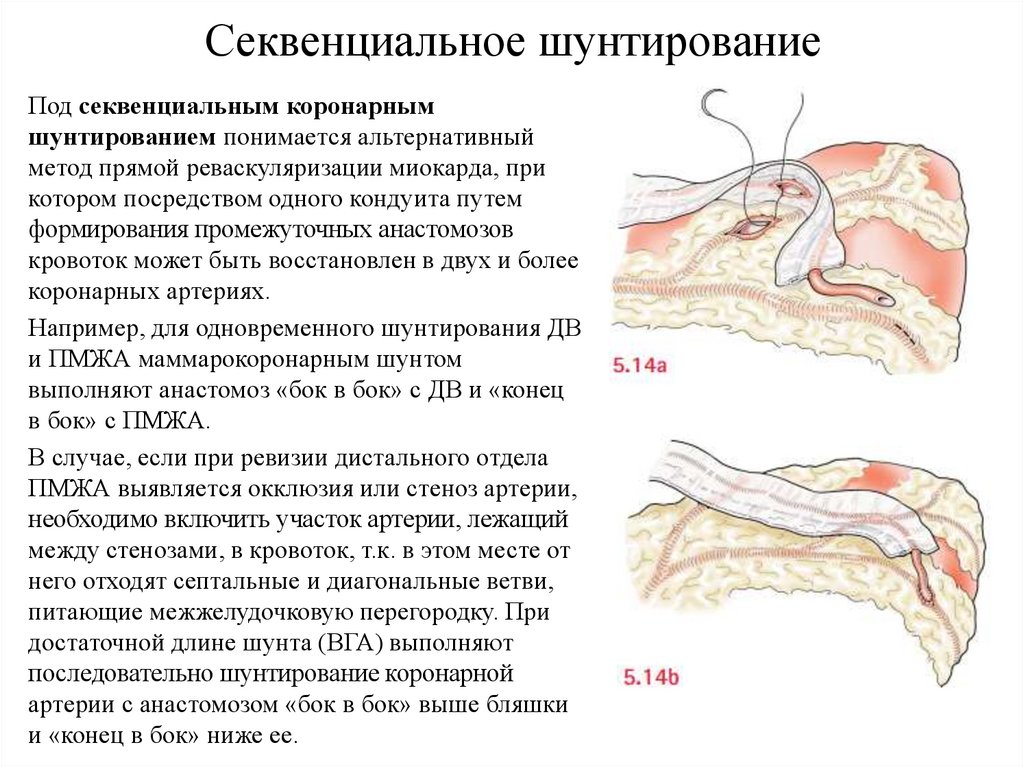
Секвенциальное шунтированиеПод секвенциальным коронарным
шунтированием понимается альтернативный
метод прямой реваскуляризации миокарда, при
котором посредством одного кондуита путем
формирования промежуточных анастомозов
кровоток может быть восстановлен в двух и более
коронарных артериях.
Например, для одновременного шунтирования ДВ
и ПМЖА маммарокоронарным шунтом
выполняют анастомоз «бок в бок» с ДВ и «конец
в бок» с ПМЖА.
В случае, если при ревизии дистального отдела
ПМЖА выявляется окклюзия или стеноз артерии,
необходимо включить участок артерии, лежащий
между стенозами, в кровоток, т.к. в этом месте от
него отходят септальные и диагональные ветви,
питающие межжелудочковую перегородку. При
достаточной длине шунта (ВГА) выполняют
последовательно шунтирование коронарной
артерии с анастомозом «бок в бок» выше бляшки
и «конец в бок» ниже ее.
41.
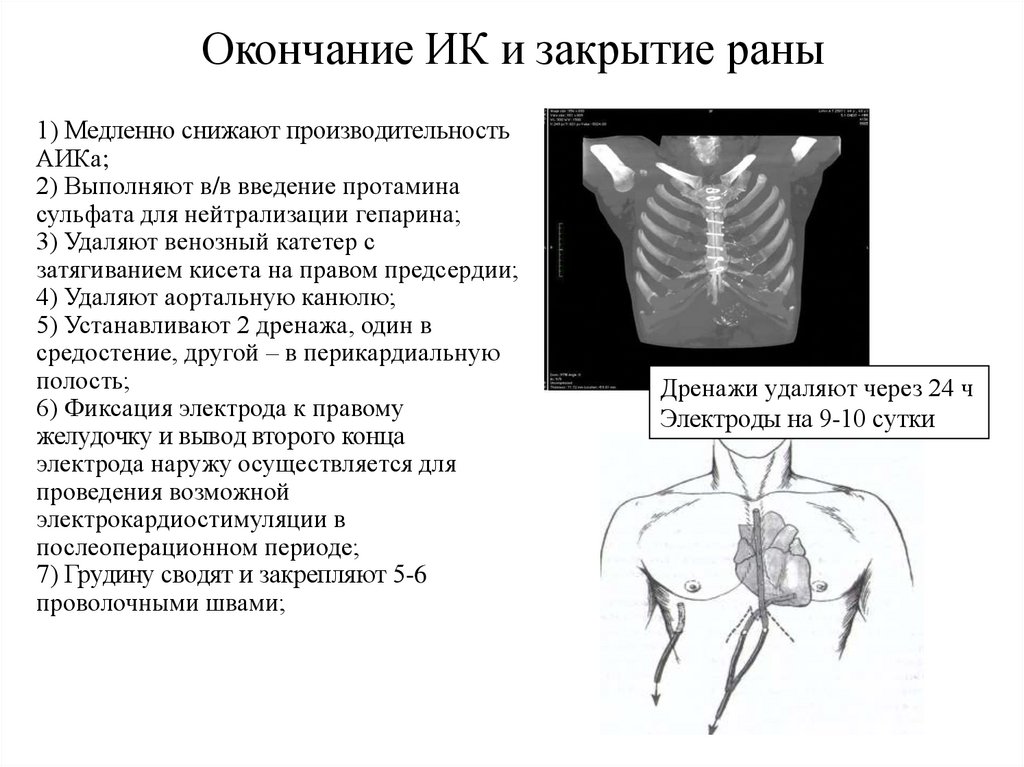
Окончание ИК и закрытие раны1) Медленно снижают производительность
АИКа;
2) Выполняют в/в введение протамина
сульфата для нейтрализации гепарина;
3) Удаляют венозный катетер с
затягиванием кисета на правом предсердии;
4) Удаляют аортальную канюлю;
5) Устанавливают 2 дренажа, один в
средостение, другой – в перикардиальную
полость;
6) Фиксация электрода к правому
желудочку и вывод второго конца
электрода наружу осуществляется для
проведения возможной
электрокардиостимуляции в
послеоперационном периоде;
7) Грудину сводят и закрепляют 5-6
проволочными швами;
Дренажи удаляют через 24 ч
Электроды на 9-10 сутки
42.
Проведение АКШ без искусственногокровообращения
Несмотря на то, что ретроспективные нерандомизированные исследования
показали уменьшение частоты осложнений и смертности при проведении
АКШ без ИК по сравнению с АКШ со стандартным ИК, эти изменения не
были воспроизведены в проспективных рандомизированных исследованиях.
Однако
большинство
этих
исследований
показало
сокращение
продолжительности пребывания в отделении интенсивной терапии и
длительности госпитализации, снижение потребности в переливании крови и
уменьшение высвобождения сердечных ферментов.
Тем не менее, метаанализы показали уменьшение долгосрочной
проходимости и количества ревасуляризированных сосудов при АКШ без
ИК. Кроме того, некоторые коронарные артерии (маленькие,
внутримышечные, кальцинированные сосуды) могут быть недоступны во
время АКШ без ИК, а перевод таких пациентов на ИК сопровождается
высокой смертностью.
43.
Осложнения1) Послеоперационное кровотечение возникает в 2-5% случаев и может
потребовать возвращения пациента в операционную. Кровотечение может
исходить из аорты, анастомоза, недостаточно герметичной ветви кондуита
или из грудины.
2) Инфаркт миокарда может развиться после операции либо из-за
технических факторов, либо из-за специфики пациента. В большинстве
исследований его частота составляет от 2% до 10%. Продолжающаяся
ишемия может потребовать экстренной ангиографии или повторной
операции.
3) Могут возникать аритмии — чаще всего фибрилляция предсердий
(частота 20-40%), которая лечится коррекцией электролитного баланса и
контролем частоты сердечных сокращений и ритма.
44.
Осложнения4) Неблагоприятные неврологические эффекты могут возникнуть после
АКШ примерно у 1,5% пациентов. Они могут проявляться в виде
инсульта, комы или делирия. Возможные причины: использование
искусственного кровообращения, гипоперфузия или эмболия головного
мозга.
5) Раневые инфекциив грудине (поверхностные или глубокие), которые
чаще всего вызываются золотистым стафилококком. Забор двух
внутренних грудных артерий для шунтирования является фактором риска,
поскольку это значительно ухудшает перфузию грудины.
6) Были описаны осложнения со стороны желудочно-кишечного тракта,
которые чаще всего возникают из-за лекарств, вводимых во время
операции.
45.
ЗаключениеВ настоящее время нет сомнений в высокой эффективности
хирургического метода в лечении больных ИБС, при этом
наиболее результативной операцией признано коронарное
шунтирование. Однако нельзя также отрицать наличие
нежелательных осложнений и последствий хирургической
агрессии, которые сопровождают любую операцию на
открытом сердце.
46.
Список литературы1) Искусство коронарной хирургии: «Для целеустремленных»/ Ю. В. Белов.
— М. : ООО «Медицинское информационное агенство», 2009.
2) Основные вопросы кардиохирургии/ Н. Мурджани, Н. Виола, С. К.
Охри; пер. с англ. под ред. Ю. В. Белова. — М. : ГЭОТАР-Медиа, 2021.
3) Cardiac Surgery in the Adult/ Lawrence H. Cohn. — NY: McGraw-Hill, 2018
4) Operative Cardiac Surgery/ Thomas L. Spray, Michael A. Acker. — Boca
Raton : CRC Press, 2019

























 medicine
medicine