Similar presentations:
Химические свойства оксидов
1.
ОКСИДЫ-2
ЭхОу
2.
Кто это?3.
Сейчас ясно?4.
Перед вами два оксида:Р2О5 и СаО. Где какой?
5.
Как определить характер оксида?+
6.
Как определить характер оксидапросто добавь воды!!!Основные
1
10
Основания
НемеО
НемеО
Кислотные
НО
H2O
1
Кроме SiO2
Кислоты
индикатор к раствору щелочи или кислоты
7.
Оксиды (по св-вам)Солеобразующие
основные
несолеобразующие
амфотерные кислотные
4 оксида
8.
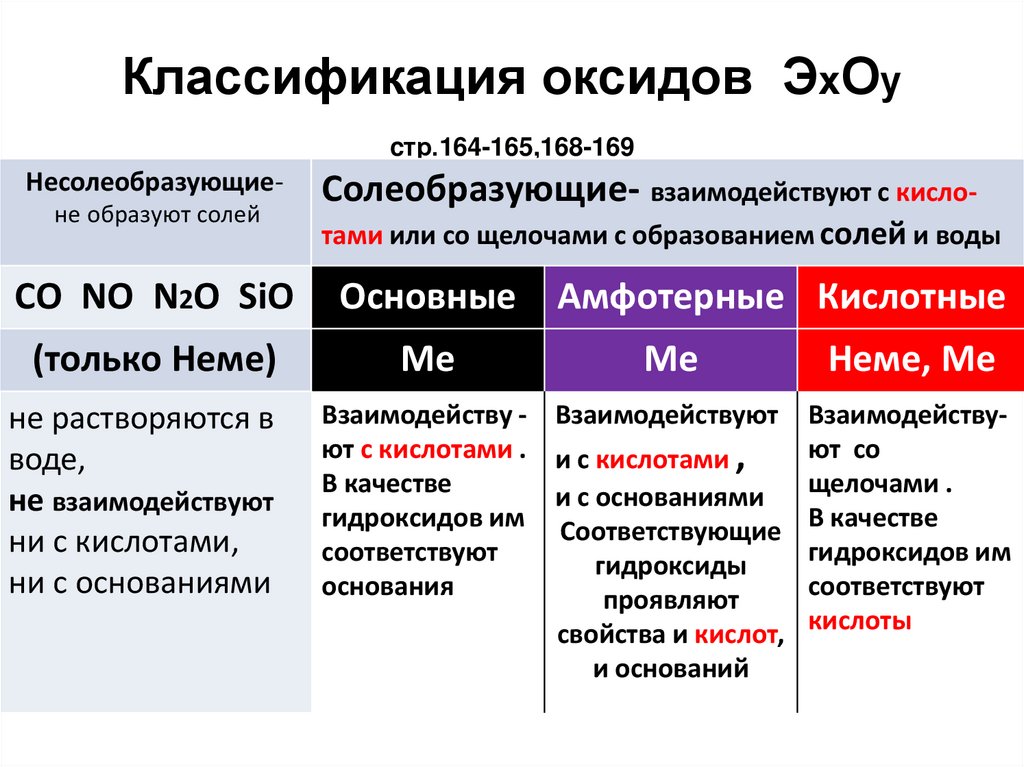
Классификация оксидов ЭхОуcтр.164-165,168-169
Несолеобразующиене образуют солей
Солеобразующие- взаимодействуют с кислотами или со щелочами с образованием солей и воды
СО NO N2O SiO
Основные
(только Неме)
Ме
не растворяются в
воде,
не взаимодействуют
ни с кислотами,
ни с основаниями
Амфотерные Кислотные
Ме
Взаимодейству - Взаимодействуют
ют с кислотами . и с кислотами ,
В качестве
и с основаниями
гидроксидов им Соответствующие
соответствуют
гидроксиды
основания
проявляют
свойства и кислот,
и оснований
Неме, Ме
Взаимодействуют со
щелочами .
В качестве
гидроксидов им
соответствуют
кислоты
9.
НемеОВсе кислотные,
кроме
Несолеобразующие
СО NO
N2O SiO
10.
МеООсновные
n: +1, +2
(за
исключением
ВеО ZnO )
Амфотерные
ВеО ZnO
Al2O3 Fe2O3
(и все с n= +3,+4)
Кислотные
n≥+5
V2O5
CrO3
11.
Определите характер свойств оксидов,составьте соответствующий гидроксид
NO несолеобразующий
FeO основный
SO2 кислотный
ZnO амфотерный
12.
NO → ничего!!!FeO → Fe(OH)2
SO2 → Н2SO3
ZnO → и основание, и кислота
Zn(OH)2
H2ZnO2
13.
Д\з упр 1,2 стр 172Проведите классификацию оксидов,
составьте формулы соответствующих
гидроксидов (посмотреть на стр.170-71)
Стр. 164,165,168,169 – определения оксидов
На следующем слайде – решение
домашнего задания Проверьте упр 1, если
неверно, постарайтесь ПОНЯТЬ,ПЕРЕЧИТАТЬ
стр. 170-171, посмотреть видео
https://youtu.be/YAa9vbb_OHc
14.
Упр.1.Кисл → кислота
С+4O2-2 →Н2С+4О3(или просто добавь воды :
СO2
+ Н2 О
Н2СО3
Кисл → кислота (или просто добавь воды :
N2+3O3→ НNО2
N 2O 3
+ Н2 О
Н2N2О4(:2)НNО2
Основн → Основание
Na2+1O → Na+1OH 1
15.
Упр.2.несолеобразующий
N2О→ нет ничего
Кислотный → кислота
+3
-2
+1 +3 -2
Cl2O3→
НClО2
1
Основный → Основание
+2
+2
1
MgO → Mg(OH)2
Амфотерный → амфотерный гидроксид
ZnO → Zn(OH)2 ↔H2ZnO2
16.
Химическиесвойства
оксидов
17.
18.
Химические свойства оксидов3
Основные
1
2
2
10
Основания
НемеО
НемеО
Кислотные
НО
H2O
Соили
1
Кроме SiO2
Кислоты
19.
20.
Правило кота МатроскинаВсё основное- на первое место.
Всё кислое – на второе
21.
Химические свойства оксидовПравило кота Матроскина!(всё чёрное пишем на первом месте,
всё красное – на втором)
Генетическая связь
1 оксид+Н2О= гидроксид
а)основный оксид + Н2О = основание
( только 10! оксидов)
б)Н2О + кислотный оксид = кислота
(кроме SiO2)
2
Солеобразование
а)основный оксид + кислота = соль + Н2О
б)основание + кислотный оксид = соль + Н2О
3 основный оксид + кислотный оксид = соль
22.
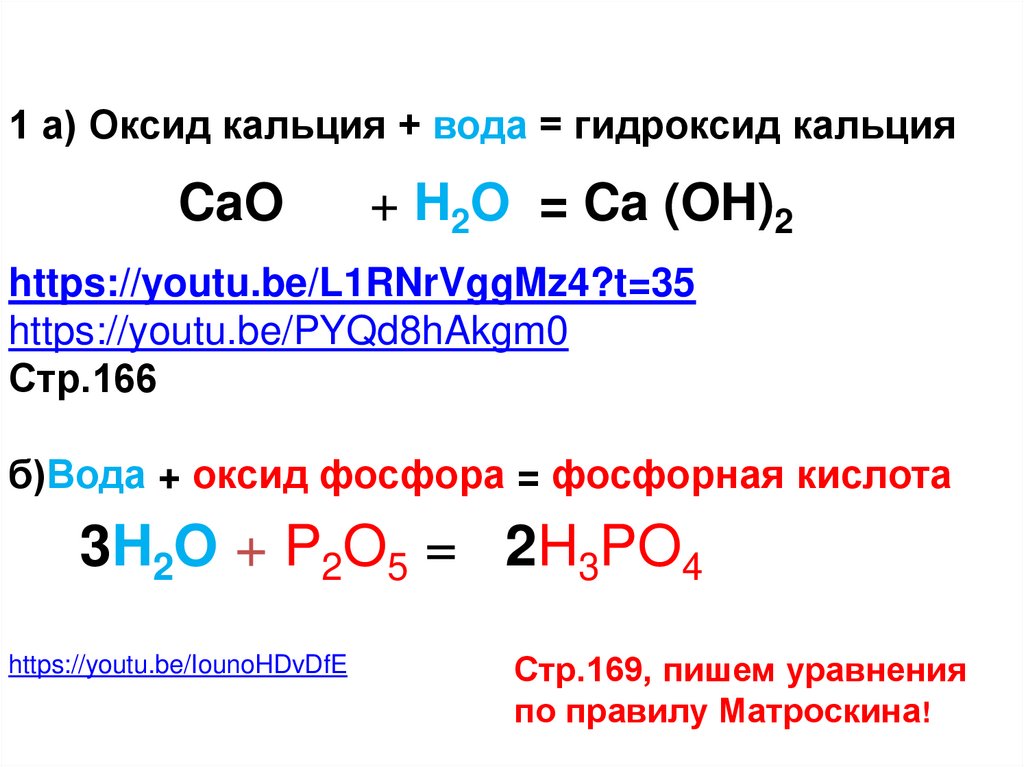
1 а) Оксид кальция + вода = гидроксид кальцияCaO
+ H2O = Ca (OH)2
https://youtu.be/L1RNrVggMz4?t=35
https://youtu.be/PYQd8hAkgm0
Стр.166
б)Вода + оксид фосфора = фосфорная кислота
3H2O + P2O5 = 2H3PO4
https://youtu.be/IounoHDvDfE
Стр.169, пишем уравнения
по правилу Матроскина!
23.
2 Солеобразованиеа)оксид магния + соляная кислота = хлорид магния + вода
н
р
р
н
!Все оксидынеэлектролиты, ставим н!
MgO + 2HCl = MgCl2 + H2O
MgO + 2H+
= Mg2+
+ H2O
Стр.165
https://youtu.be/jMAml7K0fKo https://youtu.be/DMBExFKOTwM
б) гидроксид кальция + оксид углерода (IV) =
карбонат кальция + вода
Ca(OH)2 + СO2 = CaСO3 + H2O
Чтобы составить это уравнение, надо «видеть» сразу результат реакции –соль
Сперва кислотный оксид реагирует с водой, которая есть в растворе, образуется
кислота Н2СО3, а уже она даёт соль с основанием(как в реакции нейтрализации)
Ca(OH)2 + СO2
= CaСO3 + H2O
Ca(OH)2 + Н2СО3 = CaСO3 + 2H2O стр. 168
https://youtu.be/qaNJxwTPlEY
https://youtu.be/FvsdXkhd2BA
2
24.
3 основный оксид + кислотный оксид = сольОксид кальция + оксид азота (V) =
(cм. Стр. 166)
нитрат кальция
Оксид кальция + оксид углерода (IV) = карбонат кальция
CaO
+ СO2
=
CaСO3 стр.169
25.
Д./з 1)Л.о. №10(составить уравнение взаимодействияоксида магния с серной кислотой, молекулярное и
сокращённо-ионное).Реакция идёт, как с оксидом кальция
на видео
2)Сделать тестовые задания на следующих двух слайдах,
есть ответы(самопроверка)
3)Упр 2 Выбрать, какие оксиды реагируют с гидроксидом
калия, а какие с азотной кислотой. Фото работ можете
прислать мне
*Написать уравнения реакций- кто хочет учиться на «4» и
«5» (для амфотерных оксидов со щелочью- сложно!стр172) Фото уравнений присылать на адрес
chemist4dist@mail.ru
3)*Докажите характер оксидов
Na2O и SO3 (посмотреть на стр170-171)
- кто хочет учиться на «5» и «4»
По учебнику: стр.164-166, 168-169(без св-в амфотерных
оксидов, их можно разобрать тем, кто хочет учиться на 6!)
26.
Тестовые задания27.
Блок А. (7 вопросов) Выберите цифру верного ответа:А3 К основным оксидам относится:
1)ВеО
2)РbO2
3)NO
4) СuO
В3 Выберите, с какими из перечисленных
веществ будет реагировать SO2:
1) ВaO
2)Вa(OH)2
3) H2O 4) H3PO4
5) СO2
6) BeO
1,2, 3,6 SO2 –кислотный,
А3 4
будет реагир с основным(1),
Основанием(2),водой(3),
В3
амфотерным (6) оксидом
Не реагир с кислотой(4)и
кислотным оксидом (5)
28.
В1 Установите соответствие междуБлок В
формулой оксида и его химическими
свойствами (характером)
А) SO3
1) несолеобразующий
Б) СО
2) основный
В) MnO
3) амфотерный
Г) Mn2O7
4) кислотный
Д) ZnO
А
Б
В
Г
Д
4
1
2
4
3
29.
Домашнее задание : Решения30.
Л.о. №10н
н
MgO + H2SO4 = MgSO4 + H2O
MgO + 2H+
= Mg2+
+ H2O
н
н
MgO + 2HCl = MgCl2 + H2O
MgO + 2H+
= Mg2+
+ H2O
31.
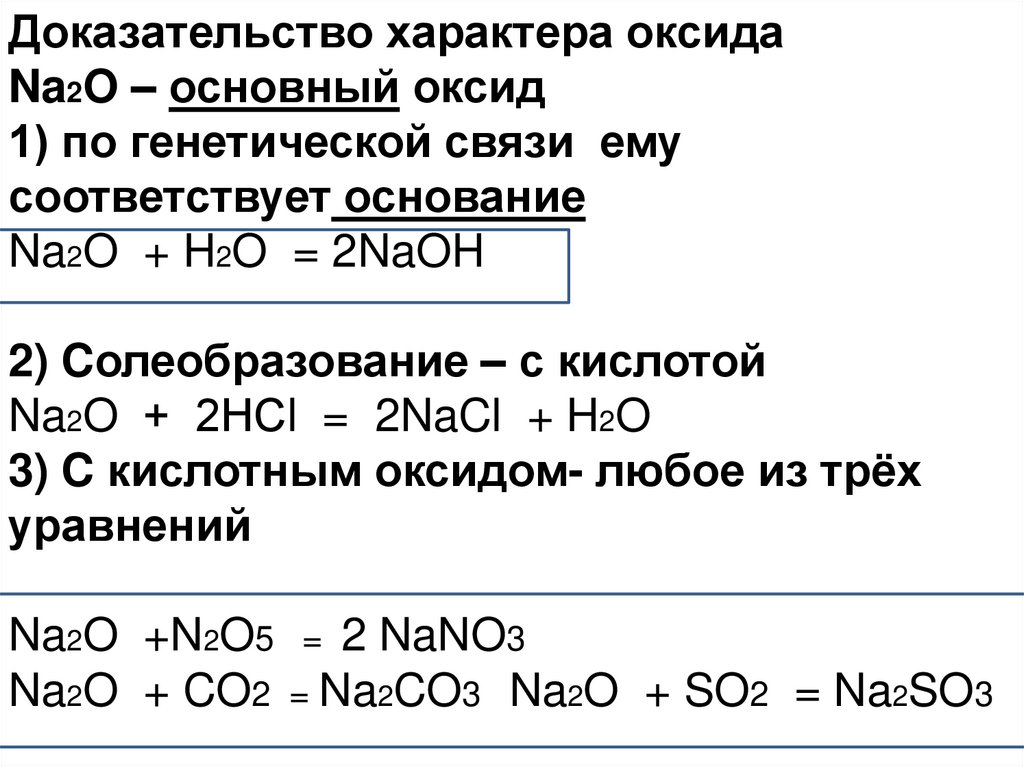
Доказательство характера оксидаNa2O – основный оксид
1) по генетической связи ему
соответствует основание
Na2O + H2O = 2NaOH
2) Cолеобразование – с кислотой
Na2O + 2НСl = 2NaCl + H2O
3) C кислотным оксидом- любое из трёх
уравнений
Na2O +N2O5 = 2 NaNO3
Na2O + CO2 = Na2CO3 Na2O + SO2 = Na2SO3
32.
Так нельзя писать!Правило Матроскина! Красное на второе место!
SO2 + 2H2O ≠S(OH)4
SO2 + 4NaOH ≠ S(OH)4 + 2Na2O
Стр. 171





























 chemistry
chemistry








