Similar presentations:
Скорость химических реакций. Тема 9
1.
Министерство образования и науки Республики КазахстанКарагандинский университет
им. Е.А. Букетова
Тема 9. Скорость химических реакций
Автор: Кокибасова Г.Т. к.х.н., профессор кафедры неорганической и
технической химии
Вид занятия: лекция
Караганда 2022
2.
План лекции:• Химическая кинетика. Основные понятия.
• Скорость реакции.
• Гомогенные и гетерогенные реакции.
• Факторы влияющие на скорость химической реакции.
Литература
• Угай Я.А. Общая и неорганическая химия. – М.: Высшая школа, 2004. – 527 с.
• Неорганическая химия: В 3 Т. /Под ред. Ю.Д. Третьякова. Т.1.: Физико-химические основы
неорганической химии. – М.: Изд. «Академия», 2004. – 240 с. Центр «Академия», 2004. –
240 с.
• Ахметов Н.С. Общая и неорганическая химия. М.:ВШ.1988.640с.
• Некрасов Б.В. Основы общей химии. В 2-х томах.М.:Химия.1972-1973.Т.1-2.
3.
Понятие о скорости химических реакций.Раздел химии изучающий, скорость химической реакции,
называется химической кинетикой.
Химические реакции протекают с различными
скоростями. Одни реакции протекают быстро. Так,
практически мгновенно происходят реакции ионного
обмена. Другие протекают медленно, часами, как,
например, разложение пищевых продуктов , месяцами —
коррозия (ржавление) железа и т.д.
4.
Химическая кинетика• Все реакции, с точки зрения химической
кинетики, делятся на простые и сложные.
• Простые реакции проходят в одну стадию,
то
есть
исходные
вещества
сразу
превращаются в продукты реакции.
• В элементарном акте простой химической
реакции, различают: мономолекулярные,
бимолекулярные, тримолекулярные.
5.
Простые реакции:Одна молекула распадается
на продукты реакции.
Примером
простой
мономолекулярной
реакции
может
быть
реакция
диссоциации
молекулы
брома
на
отдельные атомы:
Br2 → 2Br
Две молекулы исходных
веществ сталкиваются, в
результате чего происходит
образование продуктов
реакции.
В элементарном акте
участвуют три молекулы.
6.
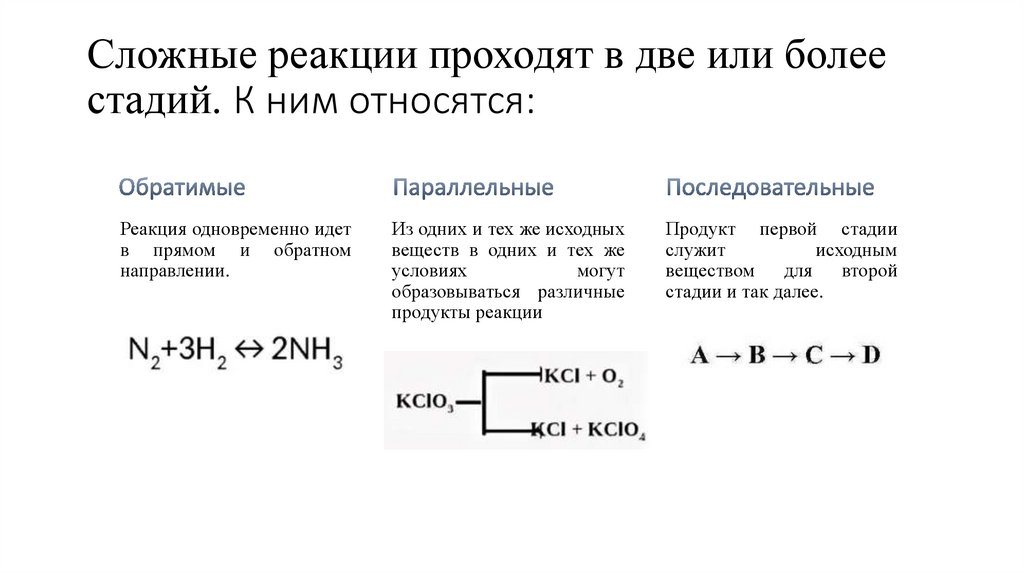
Сложные реакции проходят в две или болеестадий. К ним относятся:
Реакция одновременно идет
в прямом и обратном
направлении.
Из одних и тех же исходных
веществ в одних и тех же
условиях
могут
образовываться различные
продукты реакции
Продукт первой стадии
служит
исходным
веществом
для
второй
стадии и так далее.
7.
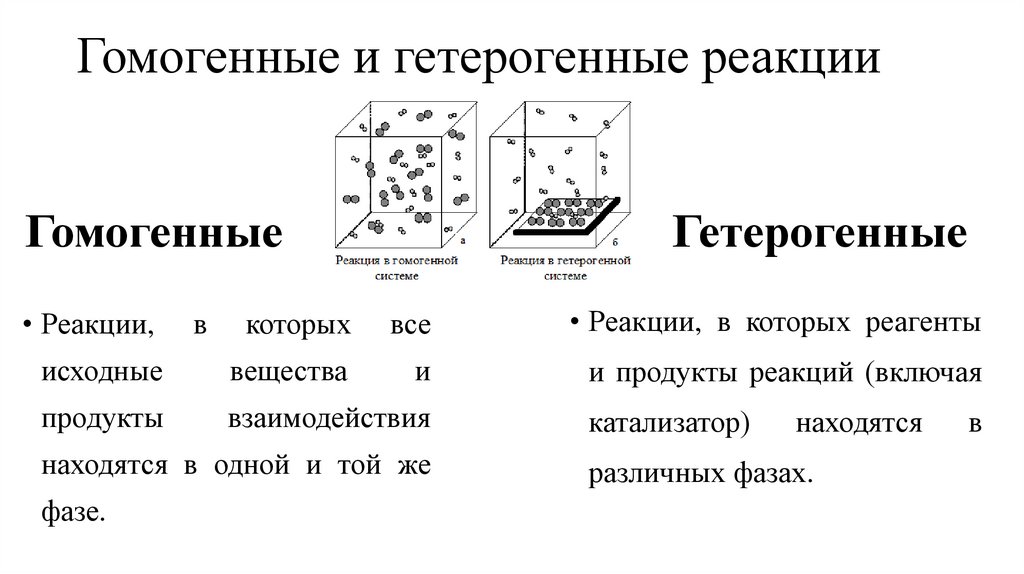
Гомогенные и гетерогенные реакцииГомогенные
Гетерогенные
которых
все
• Реакции, в которых реагенты
исходные
вещества
и
и продукты реакций (включая
продукты
взаимодействия
• Реакции,
в
находятся в одной и той же
фазе.
катализатор)
находятся
различных фазах.
в
8.
Скорость реакцийСкорость химической реакции – это изменение
количества реагирующего вещества в единицу
времени в единице объема.
9.
Факторы влияющие на скорость реакцииЗависимость
скорости
химической
реакции
от
концентрации.
При
повышении концентрации хотя бы одного из реагирующих веществ,
скорость реакции возрастает в соответствии с законом действующих масс.
10.
Зависимость скорости реакции от концентрации.• Зависимость
скорости
реакции от концентрации
реагирующих
веществ
изучали в конце 19 века
норвежские ученые К.
Гульдберг и П. Вааге. В
1867
году
они
сформулировали
кинетический
закон
действующих масс для
простых реакций:
11.
Зависимость скорости реакции от температуры.• Влияние температуры на скорость
химической
реакции
описывает
правило
Вант-Гоффа:
при
повышении температуры на каждые
10 градусов скорость реакции
возрастает в 2 – 4 раза.
12.
Вычислить, во сколько раз увеличится скорость реакции приповышении температуры от 40 до 200 ºС, принимая
температурный коэффициент γ равным 2
т.е. скорость реакции увеличится в 65536 раз.
13.
Зависимость скорости реакции от температуры.Более строго зависимость
скорости химической реакции
от температуры описывает
уравнение Аррениуса
14.
РезюмеЗадание на составление кинетического уравнения реакции.
15.
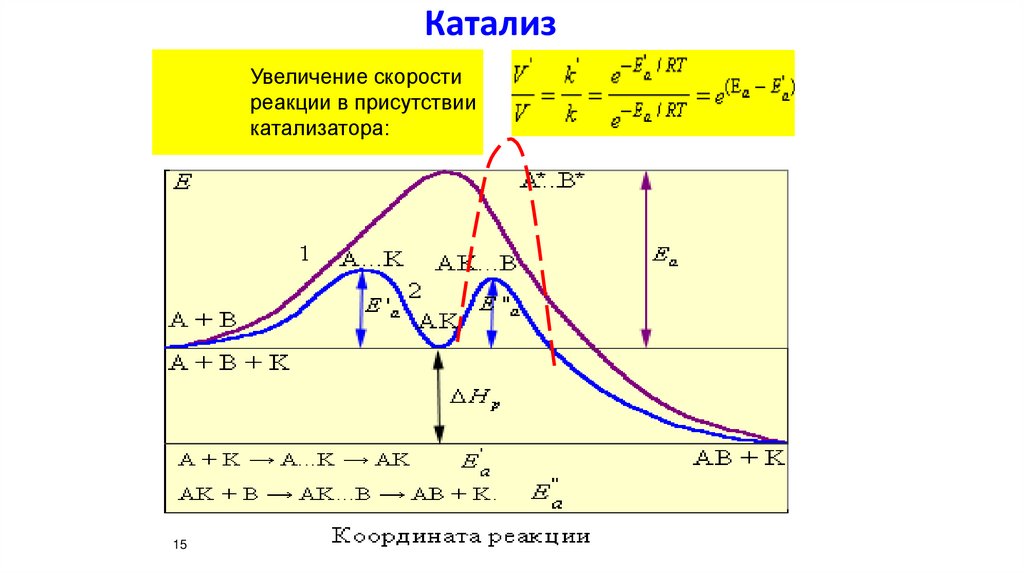
КатализУвеличение скорости
реакции в присутствии
катализатора:
15
16.
17.
✔•«Кинетика» и «термодинамика» химических реакций – два
взаимосвязанных подхода
изучения
и
контроля химических превращений.
•Основное отличие теории кинетики химических реакций –
исследование превращений во времени с целью
установления его механизма и элементарных стадий
процесса.
• Термодинамика
предсказывает
возможность
или
также самопроизвольность или
невозможность,
а
несамопроизвольность процесса, определяет условия и
положение равновесия. При этом теория кинетики
химических реакций позволяет найти оптимальные
практические решения для эффективного осуществления
требуемых химических реакций, возможность которых
была предсказана на основе термодинамических
соображений.
43














 chemistry
chemistry








