Similar presentations:
Скорость химических реакций
1.
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ2.
Раздел химии, изучающий скорости имеханизмы химических процессов, называется
химической кинетикой.
Скорость химической реакции определяется изменением
количества реагирующего вещества в единицу времени:
Δn(x)
v
.
Δt
Истинная скорость гомогенной реакции, т.е., скорость реакции в
данный момент времени, рассчитывается по уравнению:
ΔC(x)
dC
v lim
.
Δt 0
Δt
dt
3.
Для гомогенной (однородной) системы средняя скоростьхимической реакции измеряется количеством веществ, вступивших
в реакцию или образующихся в результате реакции за единицу
времени в единице объема
системы или изменением
концентраций реагирующих
веществ в единицу времени:
Размерность скорости гомогенной реакции: [моль∙л 1∙с 1].
Для гетерогенной (неоднородной) системы скорость химической
реакции измеряется количеством веществ, вступивших в реакцию
или образующихся в результате
реакции за единицу времени
на единице поверхности раздела фаз:
Размерность скорости гетерогенной реакции: [моль∙м–2∙с–1].
ΔC(x)
v
Δt
Δn(x)
v
S Δt
4.
Скорость химической реакции зависит от природы реагирующихвеществ, их концентрации, температуры и наличия катализатора.
1. Влияние концентраций реагирующих веществ на скорость
реакции выражается основным законом химической кинетики
или законом действующих масс:
Скорость химической реакции, протекающей при постоянной
температуре в гомогенной среде, пропорциональна
произведению концентраций реагирующих веществ в степенях,
равных коэффициентам, стоящим перед формулами этих
веществ в уравнении реакции.
aA bB cC dD
v k С a (A) С b (B)
пр.
1
vобр. k2 С с (C) С d (D)
5.
Уравнения, выражающие зависимость скорости химических реакций отконцентраций реагентов, называют кинетическими.
Коэффициент пропорциональности k называют константой скорости
химической реакции.
Величина k зависит от природы реагирующих веществ, температуры, наличия
катализатора и не зависит от концентрации реагирующих веществ.
Физический смысл константы скорости реакции заключается в следующем:
она численно равна скорости реакции в случае, если концентрации всех
реагирующих веществ равны и составляют 1 моль/л.
H2(газ) I2(газ) ⇄ 2HI(газ)
vпр. k1 С(H 2 ) С(I 2 )
vобр. k2 С (HI)
2
Если система гетерогенна, то концентрация твердой фазы в кинетическом
уравнении учитывается в значении константы скорости (т.е., в явном виде в
уравнении не присутствует):
S(тв) + O2(газ) ⇄ SO2(газ)
vпр. k1 С(O2 )
vобр. k2 С(SO2 )
6.
2. Зависимость скорости реакции от температуры.При повышении температуры скорость
0 t 0
t
2 1
реакции, как правило, увеличивается.
Эта закономерность может быть
v2 v1 γ 10
выражена уравнением:
v 2 , v1 скорости реакций при температурах t , t10
0
2
температурный коэффициент скорости реакции (температурный коэффициент
Вант-Гоффа), который показывает во сколько раз возрастает скорость данной
реакции при повышении температуры на 100.
Для большинства реакций = 2-4. В таких случаях выполняется правило
Вант-Гоффа:
При повышении температуры на каждые 100 скорость химической
реакции возрастает в 2-4 раза.
Для ферментативных процессов, протекающих в биосистемах, больше
4 (обычно около 7).
7.
Основное влияние температура оказывает на константу скорости реакции.Эта зависимость выражается
Ea
RT
уравнением Аррениуса:
k
A
e
где: k – константа скорости реакции;
А – частотный фактор, отражающий число столкновений между
реагирующими молекулами в единице объема в единицу времени;
R – универсальная газовая постоянная (8,31 Дж моль 1 К 1);
T – температура по Кельвину (273 + t0С);
Ea – энергия активации, кДж/моль.
Энергия активации представляет тот избыток энергии,
которым должны обладать молекулы взаимодействующих
веществ по отношению к средней энергии молекул.
kT Ea 1 1
Соотношение констант скоростей при разных
2,303 lg 2
kT R T1 T2
температурах определяется уравнением:
1
kT1 и kT2 - константы скорости реакции при температурах Т1 и Т2
Ea – энергия активации данной реакции в кДж/моль.
8.
Реакции, подчиняющиеся уравнениям типа: v k C a ( A ) C b ( B ) C c ( C )...принято классифицировать по признаку кинетического порядка.
Общим или суммарным порядком реакции называют сумму всех
показателей степеней при концентрациях в выражении закона
действующих масс, установленным опытным путем:
n = a + b + c …,
где a, b, с частные порядки реакции, соответственно по веществам A, B и C.
1) реакции нулевого порядка: v k0 , n = 0;
2) реакции первого порядка: v k I C( A ) , n = 1;
3) реакции второго порядка:
v kII C 2( A )
n = 2;
v kII C( A ) C( B )
4) реакции третьего порядка: v kIII C 3( A )
v kIII C 2(A) C(B)
v k III C(A) C(B) C(C)
n = 3.
9.
Молекулярностью реакции называется число молекул,участвующих в одном элементарном акте реакции.
Если в элементарном акте участвует одна молекула, то реакция является
мономолекулярной:
CH3N = NCH3
C2H6 + N2.
Если в одном акте в реакцию вступают две молекулы, то реакция является
бимолекулярной:
H2 + I2
2HI.
Соответственно при тримолекулярной реакции в одном элементарном акте
участвуют три частицы (молекулы):
2NO + O2
2NO2.
10.
Реакции I порядкаДля реакций I порядка убыль концентрации реагента определяется
уравнением:
С C0 e k I τ
где С – концентрация вещества в данный момент времени;
С0 – начальная концентрация вещества;
kI – константа скорости реакции первого порядка;
– время.
В логарифмической форме это выражение выглядит так:
kI
2,303
C0
lg
C
Периодом полупревращения ( 1/2) называют время, необходимое для
превращения половины первоначального количества вещества.
11.
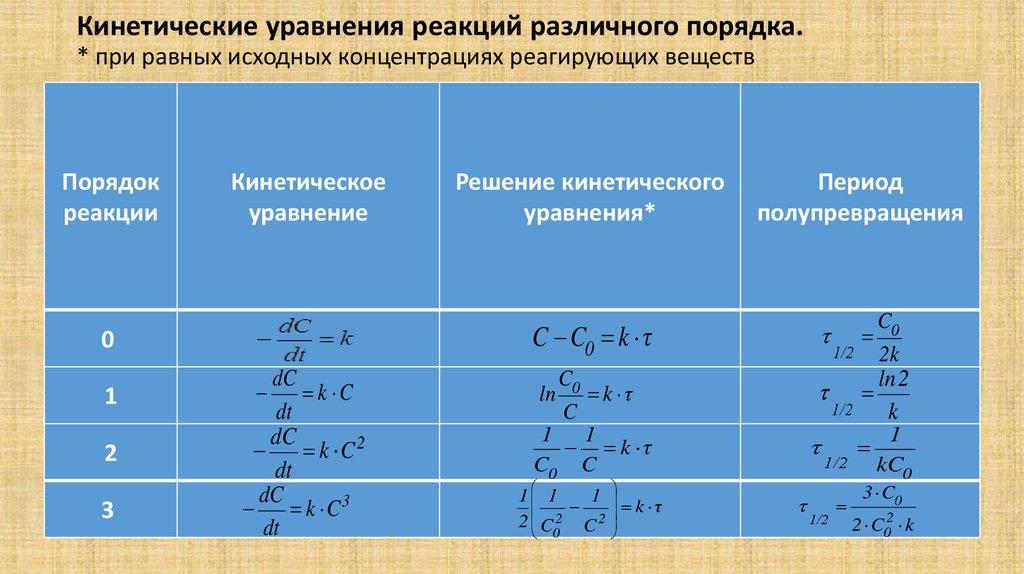
Кинетические уравнения реакций различного порядка.* при равных исходных концентрациях реагирующих веществ
Порядок
реакции
Кинетическое
уравнение
2
3
Период
полупревращения
C C0 k τ
0
1
Решение кинетического
уравнения*
dC
k C
dt
dC
k C2
dt
dC
k C3
dt
ln
C0
C
k τ
1 1
k τ
C0 C
1 1
1
k τ
2 C 2 C 2
0
1/2
1/2
1/2
1/2
C0
ln 2
k
1
kC0
2k
3 C0
2 C02 k
12.
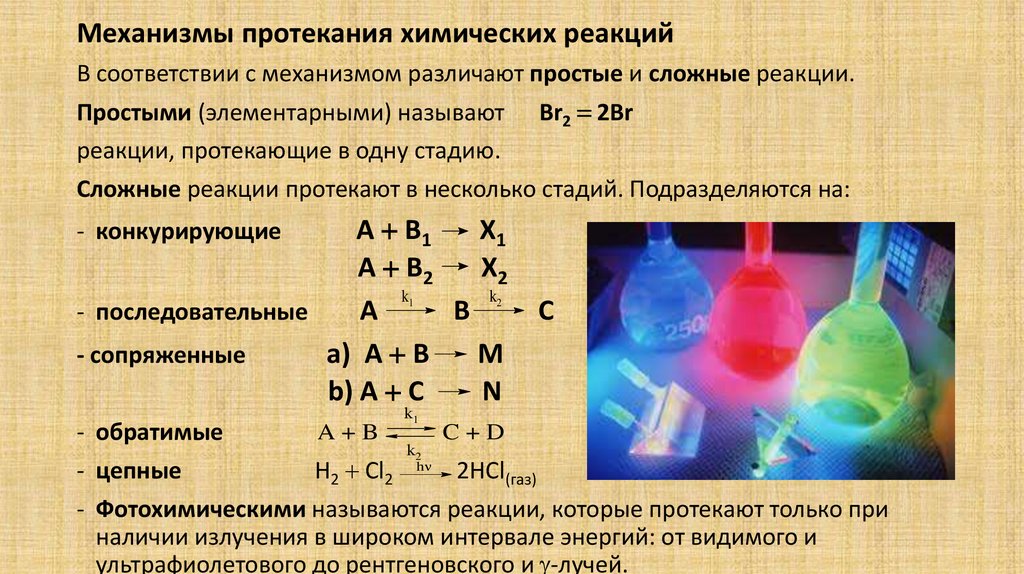
Механизмы протекания химических реакцийВ соответствии с механизмом различают простые и сложные реакции.
Простыми (элементарными) называют Br2 2Br
реакции, протекающие в одну стадию.
Сложные реакции протекают в несколько стадий. Подразделяются на:
A B1
X1
A B2
X2
k
k
- последовательные
A
B
- сопряженные
a) A B
M
b) A C
N
- конкурирующие
1
- обратимые
A+B
k1
k2
2
C
C+D
- цепные
H2 Cl2 h 2HCl(газ)
- Фотохимическими называются реакции, которые протекают только при
наличии излучения в широком интервале энергий: от видимого и
ультрафиолетового до рентгеновского и -лучей.
13.
Ферментативный катализКатализатором называется вещество, которое ускоряет
реакцию, но само в ходе реакции не расходуется.
Реакции, катализируемые ферментами, обычно характеризуются очень
сильным ускорением (104 – 105 раз) и высокой специфичностью. Под
специфичностью здесь понимают способность ферментов ускорять реакцию
только между определенными веществами, называемыми субстратами.
где E, S – фермент и субстрат;
P – продукт реакции;
ES – фермент-субстратный комплекс.
E+S
ES
P+E
Скорость ферментативного процесса можно
рассчитать по уравнению Михаэлиса-Ментен:
v vmax
C(S)
ks C(S)
где С(S) – концентрация субстрата;
vmax
– максимальная скорость реакции, т. е. скорость, когда весь фермент
находится в составе фермент-субстратного комплекса.
14.
ХИМИЧЕСКОЕ РАВНОВЕСИЕ15.
Химические реакции бывают необратимыми иобратимыми.
Необратимыми называют реакции, которые протекают только
в одном направлении.
BaCl2 K2SO4 BaSO4 2KCl
Na2CO3 2HCl
2NaCl CO2 H2O
Обратимыми называют реакции, которые одновременно
протекают в двух противоположных направлениях.
N2 3H2 ⇄ 2NH3
H2 I2 ⇄ 2HI
2NO O2 ⇄ 2NO2
16.
Термодинамика равновесных процессовaA bB ⇄ cC dD , при T = const и p = const
Изменение энергии Гиббса при протекании химической реакции можно определить
по формуле:
ΔG р и ΔG
0
р и
C c (C) C d (D)
RTln
C a (A) C b (B)
- изотерма Вант-Гоффа
где c(A), c(B), c(C) и c(D) текущие концентрации веществ
Химическое равновесие это динамическое состояние системы, которое характеризуется:
1. Энергетической выгодностью, т.е. минимальным значением и отсутствием изменений энергии
Гиббса (G Gmin, G 0).
2. Постоянством параметров и функций состояния, в том числе концентраций исходных веществ и
продуктов реакции.
Поскольку в состоянии химического равновесия G 0, можем записать:
ΔG 0р и R T ln
[C] c [D] d
[A] a [B] b
или ΔG 0р и R T lnK
или
ΔG 0р и 0,0191 T lgK
Если G 0р и 0, то К 1 и равновесие устанавливается при практически полном стехиометрическом
израсходовании исходных веществ.
Если G 0р и 0, то К 1 и исходные вещества практически не взаимодействуют друг с другом.
17.
Кинетика равновесных процессовДля гомогенной реакции: aA bB ⇄ cC dD,
vпр. kпр. C (A) C (B);
скорость прямой реакции:
vобр. kобр. C c (C) C d (D).
скорость обратной реакции:
В состоянии химического равновесия мы имеем:
vобр. vобр. , т.е. kпр. [A] a [B] b kобр. [C] c [D] d или
a
Kp
d
pCc pD
p Aa pBb
b
k пр.
kобр.
[C] c [D] d
Kc .
[A] a [B] b
- для реакций, протекающих между газами
1. Численное значение константы равновесия зависит от природы реагирующих веществ и от
температуры, но не зависит от концентраций реагентов (парциальных давлений для газофазных
реакций).
2. Катализатор не влияет на величину константы равновесия. Присутствие катализатора в системе
лишь приближает момент наступления равновесия.
3. Численное значение константы равновесия при стандартных условиях можно найти из
термодинамических данных, не проводя химических экспериментов. Действительно, по
уравнению:
ΔH 0р и
ΔS 0р и
или
lnK
R T lnK ΔG 0 ΔH 0 T ΔS 0
р и
р и
р и
R T
R
4. Величина K никогда не бывает равной нулю или бесконечности, т.е., для любой реакции выход
отличается от нуля, хотя положение равновесия может быть сильно сдвинуто в любую сторону.
18.
Смещение химического равновесия. Принцип Ле Шателье:Если на систему, находящуюся в состоянии химического равновесия, оказано внешнее
воздействие, то равновесие сместится в направлении той реакции, которая ослабляет
это воздействие.
1. Влияние изменения концентрации.
Введение в равновесную систему дополнительных количеств любого из реагирующих
веществ ускоряет ту реакцию, в которой оно расходуется.
2NO O2 ⇄ 2NO2 повышение концентраций NO или O2 смещает равновесие вправо,
повышение концентрации NO2 – влево. Равновесие смещается вправо также при уменьшении
концентрации NO2, а при уменьшении концентрации NO или O2 – влево.
2. Влияние температуры.
Повышение температуры смещает равновесие в сторону эндотермической реакции.
CO(газ) H2O(пар) ⇄ CO2(газ) H2(газ); H0р и 43,0 кДж при увеличении температуры равновесие
сместится в сторону эндотермической, т.е., обратной реакции, а уменьшение температуры сместит
равновесие в сторону экзотермической (прямой) реакции.
2. Влияние давления.
При увеличении давления равновесие смещается в сторону образования меньшего числа
моль (молекул) газа.
N2 3H2 ⇄ 2NH3 из четырех молекул в левой части (одной молекулы азота и трех молекул водорода)
образуются две молекулы аммиака. Таким образом, повышение давления смещает равновесие вправо,
а понижение давления – влево.
















 physics
physics chemistry
chemistry








