Similar presentations:
Зависимость скорости реакции от температуры. Лекция 8
1.
МИНОБРНАУКИ РОССИИфедеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
«Санкт-Петербургский государственный технологический институт
(технический университет)»
(СПбГТИ(ТУ))
Факультет химии веществ и материалов
Кафедра физической химии
Зависимость скорости
реакции от температуры
Тема:
Лекция 8
2.
3.
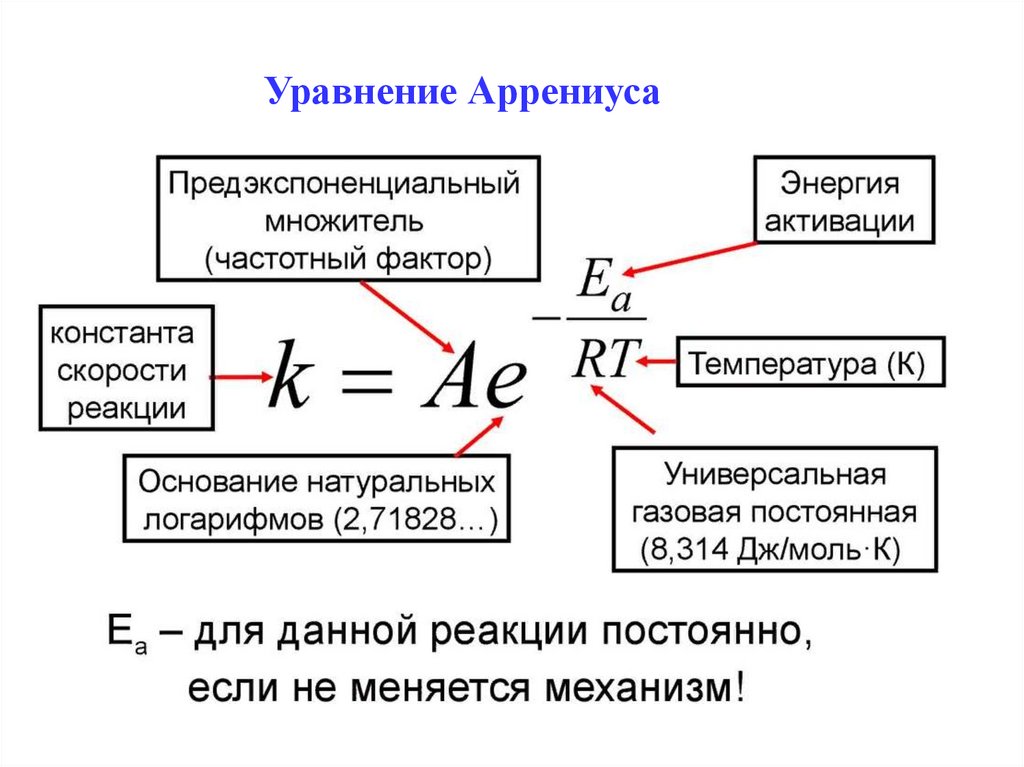
Уравнение Аррениуса4.
Физический смысл, составляющихуравнение Аррениуса
5.
Согласно уравнению изобары Вант-ГоффаПоскольку константа равновесия есть отношение констант
скоростей прямой и обратной реакции:
Представив изменение энтальпии реакции ΔHº в виде
разности двух величин E1 и E2, получаем:
здесь С – некоторая константа.
6.
Постулировав, что С = 0, получаем уравнение Аррениуса, гдеEA – энергия активации:
Проинтегрируем:
уравнение Аррениуса
7.
8.
Математический способ нахождения Еаиз уравнения Аррениуса
9.
РассмотримВ равновесии
Прологарифмируем и продифференцируем по температуре:
Для каждой стадии:
Следовательно:
10.
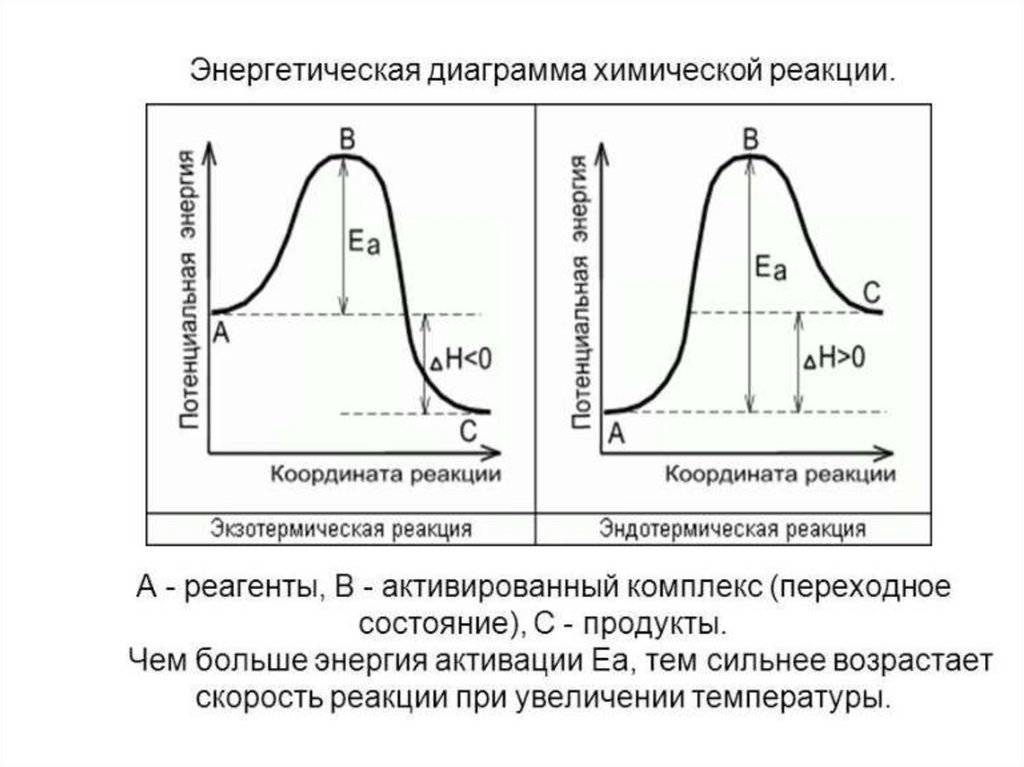
При постоянной температуре, чем выше энергия активации,тем меньше скорость реакции.
Е акт. зависит от природы реагирующих веществ и
служит характеристикой каждой реакции
Еакт = 80-240 кДж/моль для элементарных хим.реакций
Еакт <60 кДж/моль для реакций с участием атомов и радикалов
Е акт > 150 кДж/моль такие реакции при н.у. е протекают
11.
12.
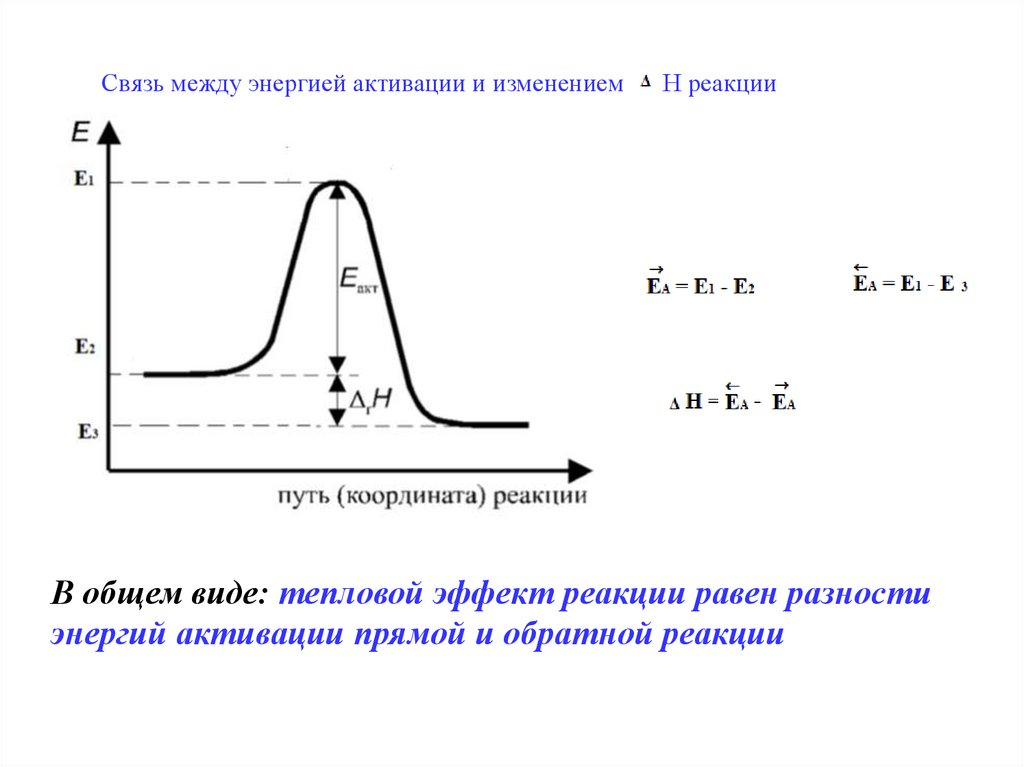
Связь между энергией активации и изменениемН реакции
В общем виде: тепловой эффект реакции равен разности
энергий активации прямой и обратной реакции
13.
14.
ТЕОРИИ ЭЛЕМЕНТАРНОГО АКТА ХИМИЧЕСКОЙРЕАКЦИЙ. (ТАС)
В теории сделаны следующие допущения:
1. Скорость химической реакции равна числу соударений активных
частиц.
Число активных частиц определяется по уравнению Больцмана:
2. Реагирующие частицы рассматриваются как шарики,
независимо от их структуры.
15.
ТАС16.
17.
18.
19.
20.
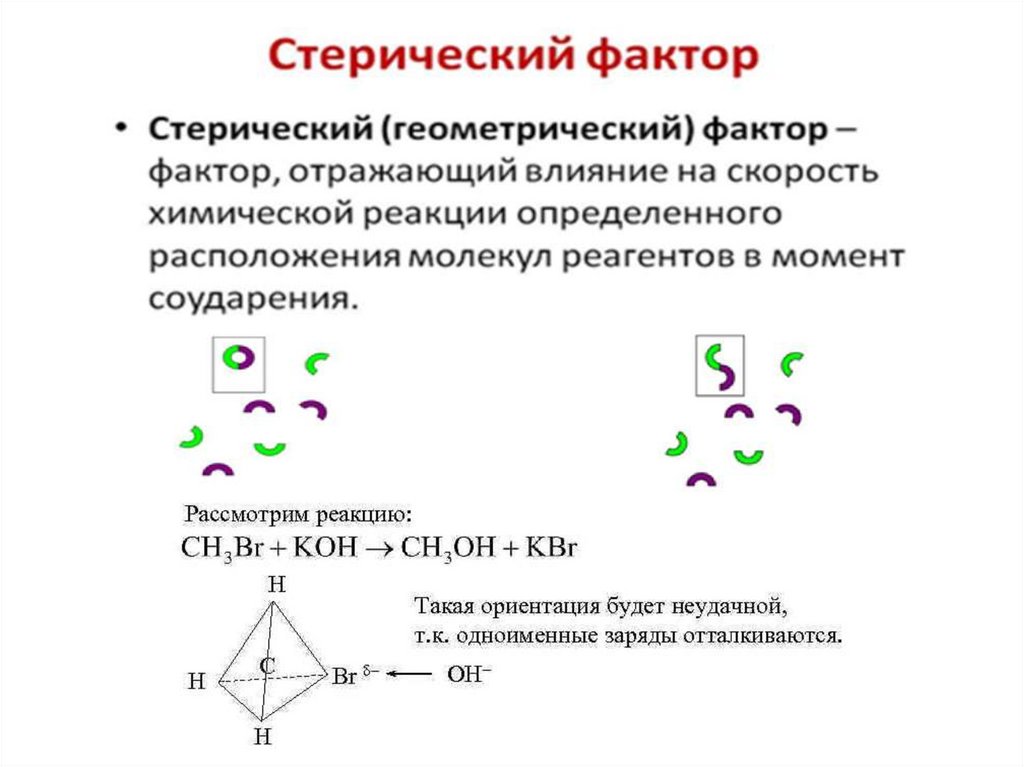
Если р = 1, то наблюдается соответствие А теор. и А эксп.р < 1, влияет фактор, взаимной определенной ориентации
сталкивающихся молекул, при которой происходит разрыв
и образование новой связи в молекуле.
р > 1 реакция протекает по цепному механизму
21.
Пример:K + Br2 KBr + Br
реакция протекает по «гарпунному механизму».
При сближении атома калия и молекулы брома
электрон может перейти по туннельному механизму от
атома K к Br2.
В результате образуются ионы K+ и Br 2 и между
ними возникает электростатическое притяжение
(«гарпун»), которое способствует столкновению
заряженных частиц, что приводит к увеличению р.
22.
Столкновения в растворе отличаются от столкновения в газах.Молекулы должны прокладывать себе путь через растворитель, который
имеет вязкость во много раз большую, чем газ.
Частота столкновений в растворе значительно меньше, чем в газе.
присутствует другой важный фактор, который получил название
клеточного эффекта.
Две частицы растворенного вещества, находясь вблизи друг
от друга, как бы попадают в «клетку» из молекул растворителя
и не могут сразу разойтись на значительное расстояние. Пока
частицы находятся в «клетке», увеличивается вероятность их
.
соударения
.
Основные положения теории в принципе правильные
23.
Представления об энергетическом барьере – энергии активации и об«активных» молекулах хорошо объясняют ряд фактов:
Факторы:
1. Химическая реакция всегда протекает с несоизмеримо
меньшей скоростью, чем это соответствует расчету с
предположением результативности каждого соударения.
2. Для сходных реакций при одинаковых температурах и
концентрациях число соударений приблизительно
одинаково, а скорость может отличаться в десятки
тысяч раз.
3. Число соударений с изменением температуры на 10°
изменяется на 2–3%, однако скорость реакции
изменяется в 2–4 раза.
24.
ТАСТеория активных соударений (ТАС) позволила
- наметить путь теоретического расчета константы
скорости реакции;
- предсказала правильный ход зависимости константы
скорости от температуры;
- позволила рассчитать для ряда реакций константы
скорости по известному значению энергии активации.
25.
Недостатки ТАС:1) Не может быть объяснена резкая температурная
зависимость скорости реакции, вследствие того, что
величина Z слабо изменяется с изменением температуры.
2) Не позволяет рассчитывать значение энергии
активации исходя из параметров молекул реагирующих
веществ.
26.
27.
Теория активированного комплекса (ТАК)28.
29.
Основным представлением ТАК является положение отом, что
всякая химическая реакция протекает через
образование некоторого переходного состояния,
которое затем распадается на продукты данной
реакции.
30.
31.
32.
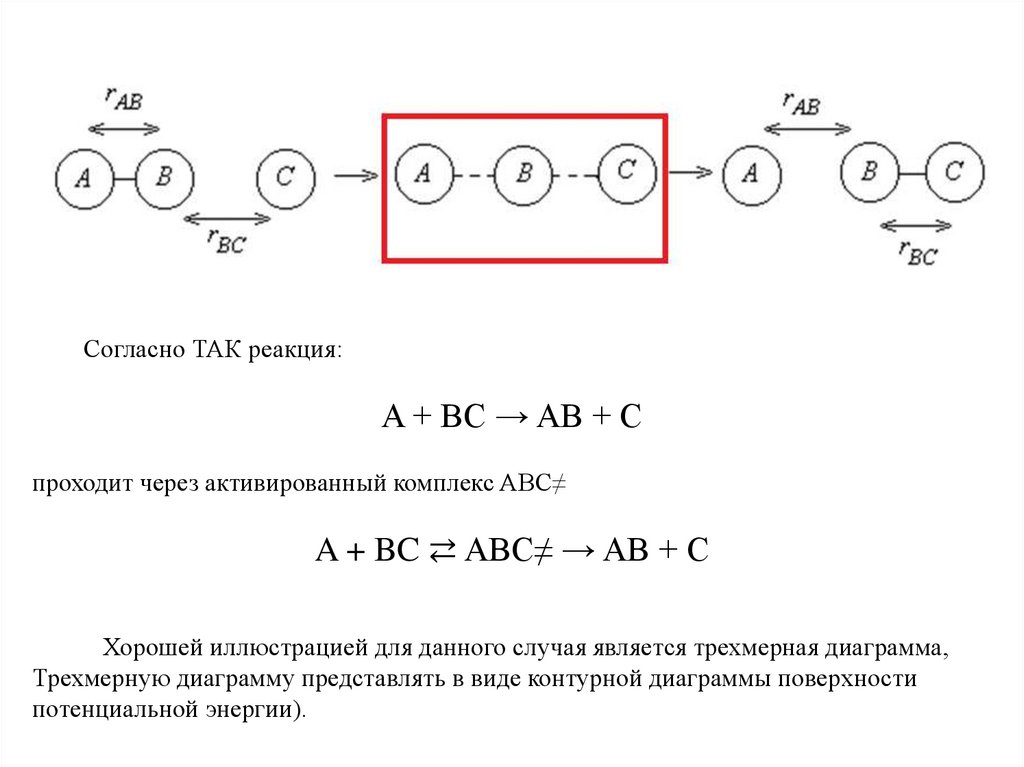
1 В ходе процесса молекулы постепенноприближаются друг к другу, в результате чего
меняются межъядерные расстояния.
2 В ходе реакции образуется активированный
комплекс, когда один из атомов становится как
обобществленным, и межъядерное расстояние
становится одинаковым.
3 Активированный комплекс превращается в
продукты реакции.
33.
34.
35.
Согласно ТАК реакция:A + BC → AB + C
проходит через активированный комплекс ABC≠
A + BC ⇄ ABC≠ → AB + C
Хорошей иллюстрацией для данного случая является трехмерная диаграмма,
Трехмерную диаграмму представлять в виде контурной диаграммы поверхности
потенциальной энергии).
36.
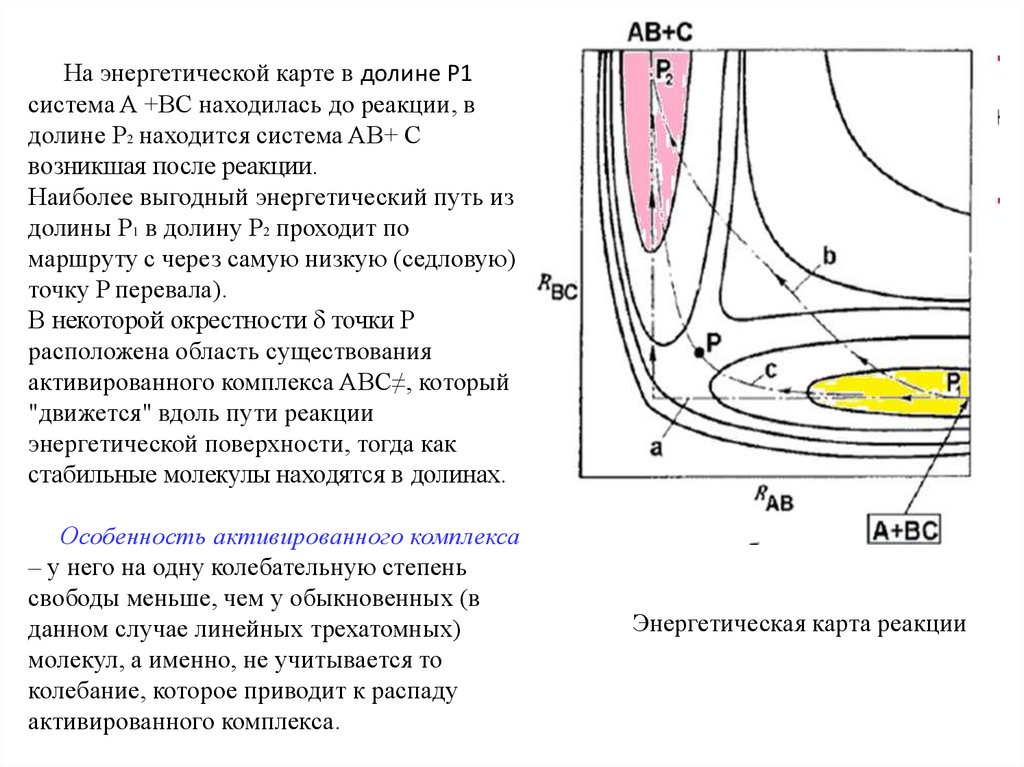
На энергетической карте в долине P1система A +BC находилась до реакции, в
долине P2 находится система AB+ C
возникшая после реакции.
Наиболее выгодный энергетический путь из
долины P1 в долину P2 проходит по
маршруту c через самую низкую (седловую)
точку P перевала).
В некоторой окрестности δ точки P
расположена область существования
активированного комплекса ABC≠, который
"движется" вдоль пути реакции
энергетической поверхности, тогда как
стабильные молекулы находятся в долинах.
Особенность активированного комплекса
‒ у него на одну колебательную степень
свободы меньше, чем у обыкновенных (в
данном случае линейных трехатомных)
молекул, а именно, не учитывается то
колебание, которое приводит к распаду
активированного комплекса.
Энергетическая карта реакции
37.
38.
Изменение энергии Гиббса в ходе химической реакции∆G*исх. ∆G*кон. – это работы связанные с переводом с переводом
исходного вещества или продукта в переходное состояние




































 chemistry
chemistry








