Similar presentations:
Зависимость константы скорости химической реакции от температуры
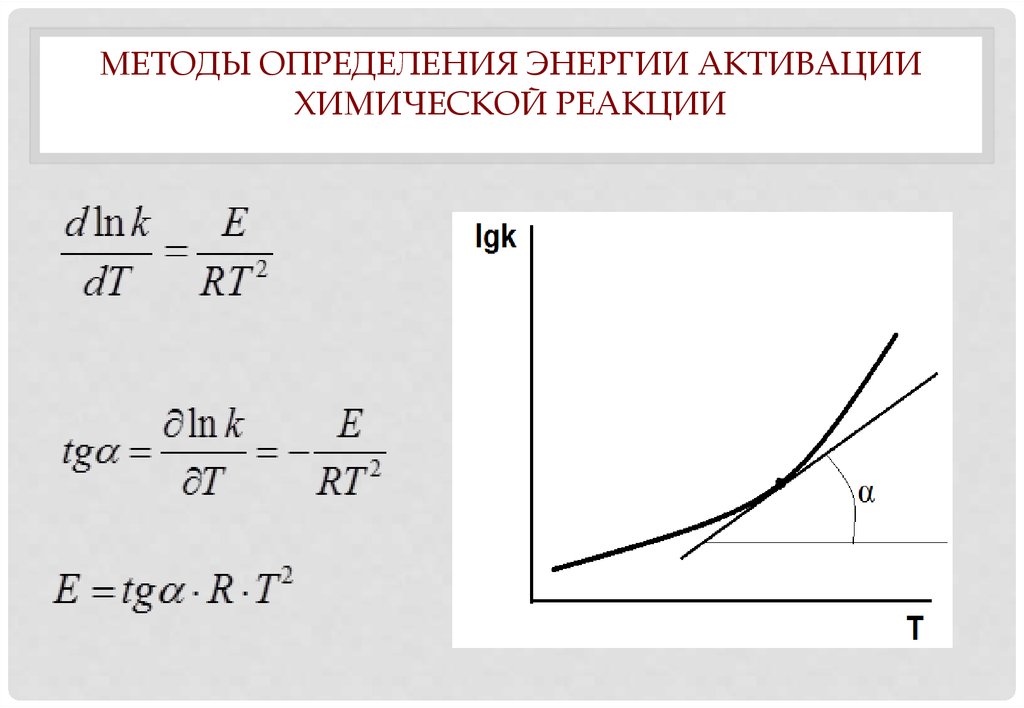
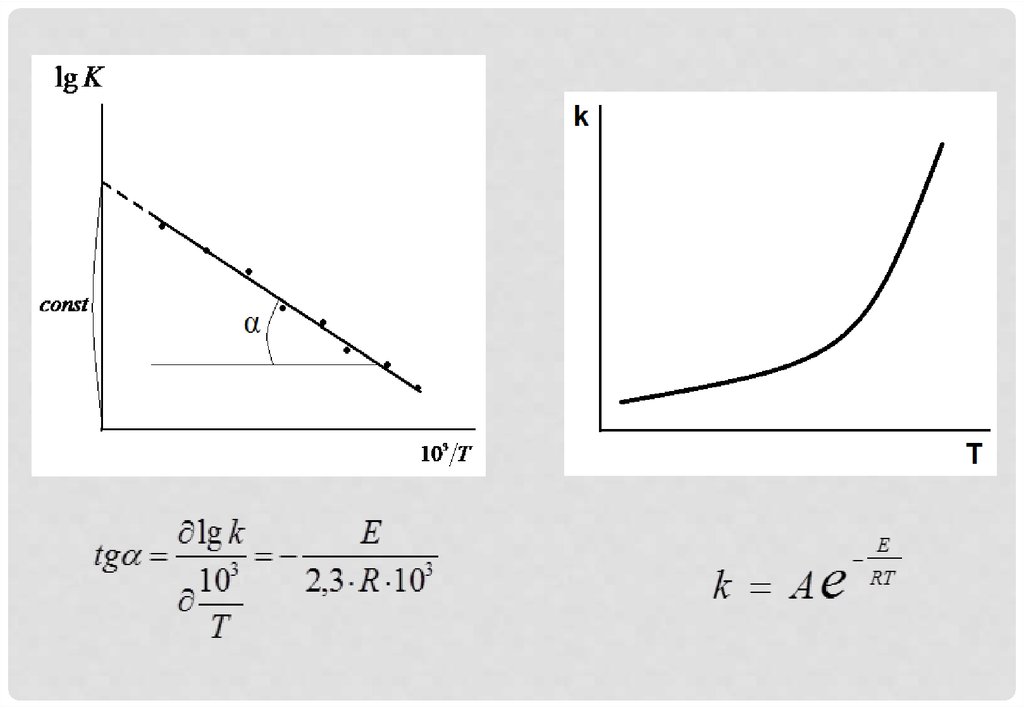
1. Зависимость константы скорости химической реакции от температуры
ЗАВИСИМОСТЬ КОНСТАНТЫСКОРОСТИ ХИМИЧЕСКОЙ
РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ
2. Правило Вант-Гоффа
ПРАВИЛО ВАНТ-ГОФФА• При увеличении температуры на 10
скорость реакции возрастает в 2-4 раза.
градусов
(1)
ln kT+10 – ln kT = ln k = ln / : T=10
(1a)
(2)
(3)
3.
Если считать, что в пределах 10 градусов температурныйкоэффициент остается постоянным, можно от конечных
изменений перейти к бесконечно малым:
(4)
(5)
(6)
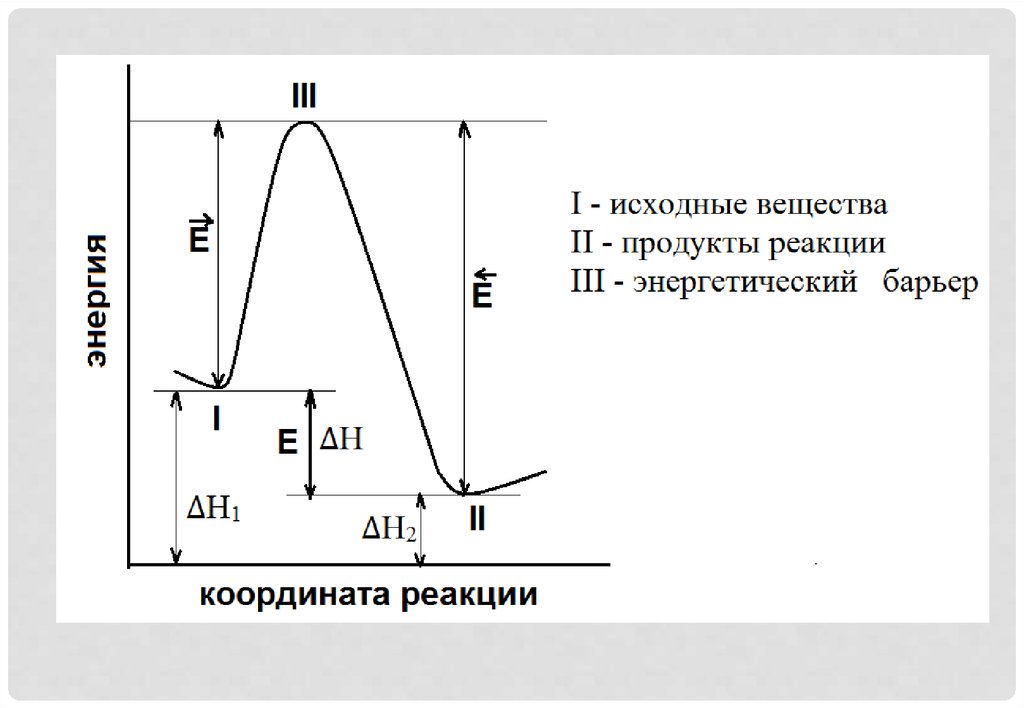
4. Теория Аррениуса. Энергия активации реакции
ТЕОРИЯ АРРЕНИУСА.ЭНЕРГИЯ АКТИВАЦИИ РЕАКЦИИ
Основные
модельные
представления
теории:
• В реакцию способны вступать лишь те
частицы реагентов, которые обладают
некоторой
избыточной
энергией,
позволяющей
им
преодолеть
энергетический барьер.
• Минимально необходимый запас энергии
называют энергией активации.
5.
• Энергию активации (Е) можно трактовать какизбыток энергии по сравнению со средней
энергией молекул при данной температуре,
которой должны обладать молекулы, чтобы
они могли вступить в химическую реакцию.
• Источники получения избыточной энергии:
1) термическая активация;
1) действие
различных
излучений
(свет,
ультразвук, радиация);
2) действие быстрых частиц (радикалов).









 chemistry
chemistry








