Similar presentations:
Кинетика химических реакций
1. Лекция 7. Кинетика химических реакций.
Белорусский национальный технический университетКафедра ЮНЕСКО “Энергосбережение и
возобновляемые источники энергии”
Топливо и его
использование
Лекция 7. Кинетика химических реакций.
2. Скорость химических реакций
Скорость химических реакцийЛекция 6Скорость гомогенной реакции – количество
вещества, реагирующего в единице объема за
единицу времени, т.е. изменение концентрации
одного из компонентов реагирующей смеси за
единицу времени.
Концентрация вещества СА – количество (масса)
вещества в единице объема, кмоль/м3; кг/м3.
Скорость гетерогенной реакции – количество
вещества, реагирующего на единице поверхности за
единицу времени.
3.
Лекция 7Скорость гомогенной реакции
A B
M N
можно выразить как через скорость
образования одного из продуктов реакции, так
и через скорость расходования какого-либо
исходного вещества:
dCM dCN
;
d
d
dC A dCB
или
;
d
d
4.
В соответствии с уравнением реакции, накаждый израсходованный в реакции моль А
расходуется
молей вещества В
и образуется
молей продукта М,
и молей продукта N.
При скорости расхода А в единице объёма за
dC A
единицу времени
, скорость расхода В
1 dCВ
1 dC A
dCВ
dC A ,dоткуда
d
d
d
d
5.
Лекция 6Для скоростей образования продуктов по
аналогии получаем
1 dCA
1 dCB
1 dCM 1 dCN
d
d
d
d
Поэтому скорость горения топлива можно
выразить через скорость расходования горючих
элементов или их смеси в целом, скорость
расходования окислителя или скорость образования
продуктов сгорания
dC A
dCB dCM dC N
d
d
d
d
6. Классификация химических реакций
Лекция 7Классификация химических реакций
Реакции в зависимости от числа вступающих в
них молекул подразделяются на:
мономолекулярные реакции, в которых
реагирует один род молекул, давая при этом
одну или несколько новых молекул
(диссоциация);
бимолекулярные реакции, в которых взаимно
реагируют две однородные или различные
молекулы, давая одну или несколько новых
молекул;
тримолекулярные реакции и т.д.
7.
Лекция 7Для протекания мономолекулярной
реакции достаточно, чтобы один род
молекул был способен вступать в реакцию
(пришел в реакционноспособное состояние).
Би- и тримолекулярные реакции могут
происходить при столкновении
соответствующего числа реагирующих
молекул; они протекают через
последовательные простые реакции
(стадии цепного механизма) и называются
сложными.
8.
Лекция 6Экспериментально установлено, что скорость
многих реакций может быть представлена
уравнением вида
dC A
n1
n2
kCA CB
d
показатели степеней n1, n2, … принято называть
порядком реакции по реагентам А, В, …
Сумма n1 + n2 +… называется порядком
реакции в целом.
В
реакциях
горения
порядок
реакции,
найденный опытным путем, ниже, чем следует из
закона действующих масс: (n1 + n2) < (α + β).
9. Зависимость скорости химической реакции от температуры. Закон Аррениуса
Лекцияот6
Зависимость скорости химической реакции
температуры. Закон Аррениуса
При заданной концентрации реагирующих веществ
скорость реакции характеризуется константой скорости
реакции, зависящей от температуры.
Зависимость константы скорости от температуры
предложена Свáнте Аррéниусом (нобелевский лауреат 1903 г)
в виде
E
RT
0
0
k k e
E
k exp(
)
RT
E
ln k ln k0
RT
или в дифференциальной форме:
d ln k
E
2
dT
RT
10.
Лекция 7E – энергия активации (кДж/моль),
k0 – предэкспоненциальный множитель,
Размерность k0 зависит от порядка реакции
E, k0 – кинетические константы (опытные
значения);
R = 8,314 кДж/(моль·К) – универсальная
газовая постоянная,
Т – абсолютная температура, К
E/(RT) – безразмерная величина.
11.
Лекция 7Зависимость константы скорости реакции от
температуры в "аррениусовых" координатах
ln k
E
tg
R
ln k0
E
ln k ln k0
RT
0
1/T
Гомогенная реакция 1-го порядка: [k] =[k0]= 1/с;
n-го порядка: 1/[c(моль/м3)n-1]
12. Физический смысл энергии активации
Лекция 7Физический смысл энергии активации
Для начала реакции необходимо
столкновение реагирующих молекул. Однако
не все столкновения между молекулами
приводят к реакции между ними. Если бы
все столкновения приводили к реакции, то
реакции протекали бы почти мгновенно.
Для реакций с конечной скоростью число
столкновений между молекулами,
приводящих к химическому
взаимодействию,– лишь часть общего числа
столкновений.
13.
Лекция 7Эффективными оказываются лишь
столкновения между активными
молекулами, которые в момент столкновения
обладают некоторым избытком энергии по
сравнению со средним ее значением (для
данной температуры).
Энергия активации – избыточное
количество энергии, которым должны
обладать молекулы в момент столкновения,
чтобы быть способным к данному
химическому взаимодействию.
14.
Лекция 7Активация – процесс, при котором
изменяется энергия молекул без
химического превращения.
Теплота активации – теплота,
поглощаемая при образовании активных
молекул.
Между активными и нормальными
молекулами существует равновесие,
константа которого сильно зависит от
температуры.
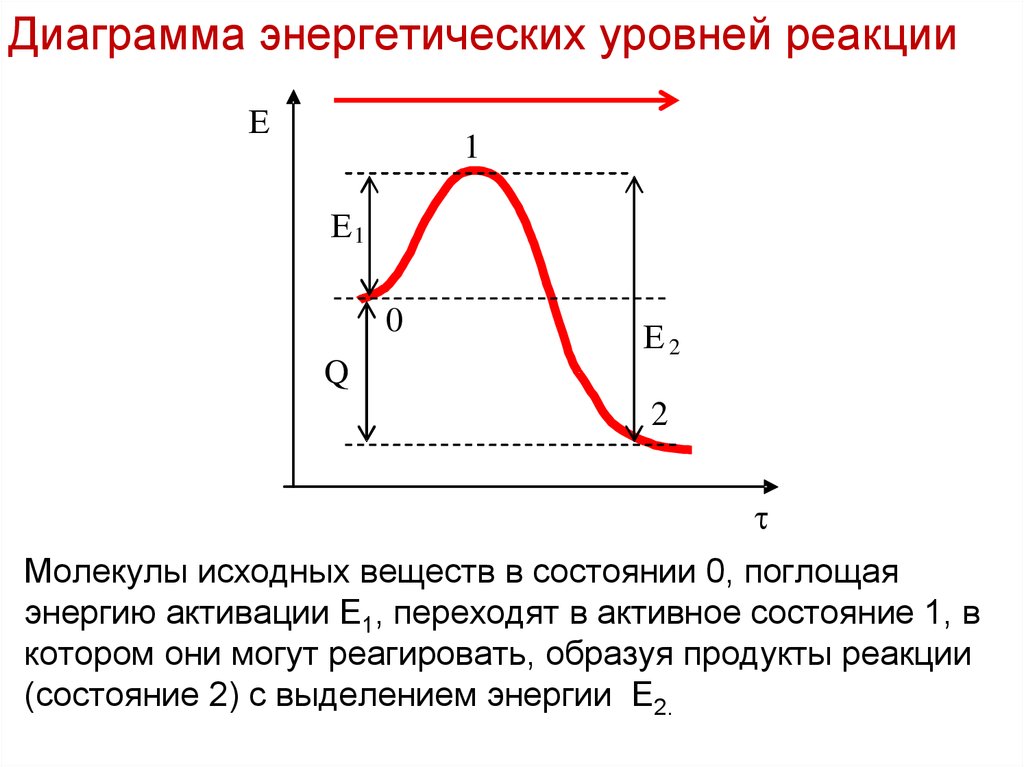
15. Диаграмма энергетических уровней реакции
Лекция 6Диаграмма энергетических уровней реакции
Е
1
Е1
0
Е2
Q
2
Молекулы исходных веществ в состоянии 0, поглощая
энергию активации Е1, переходят в активное состояние 1, в
котором они могут реагировать, образуя продукты реакции
(состояние 2) с выделением энергии Е2.
16.
В экзотермических реакциях энергия Е2, Лекция 7выделяемая на участке 1-2, больше, чем Е1,
поглощаемая при активации на участке 0-1;
при этом разность (Е2 – Е1) положительна и по
абсолютной величине равна тепловому эффекту
реакции Q , который условно считается
отрицательным, т.к. тепло, выделяющееся в
реакции, отводится от системы к окружающей
среде.
С учётом химической обратимости, одновременно
в обратном направлении идёт эндотермическая
реакция, для которой энергия активации |Е2|> |Е1|
A B
M N
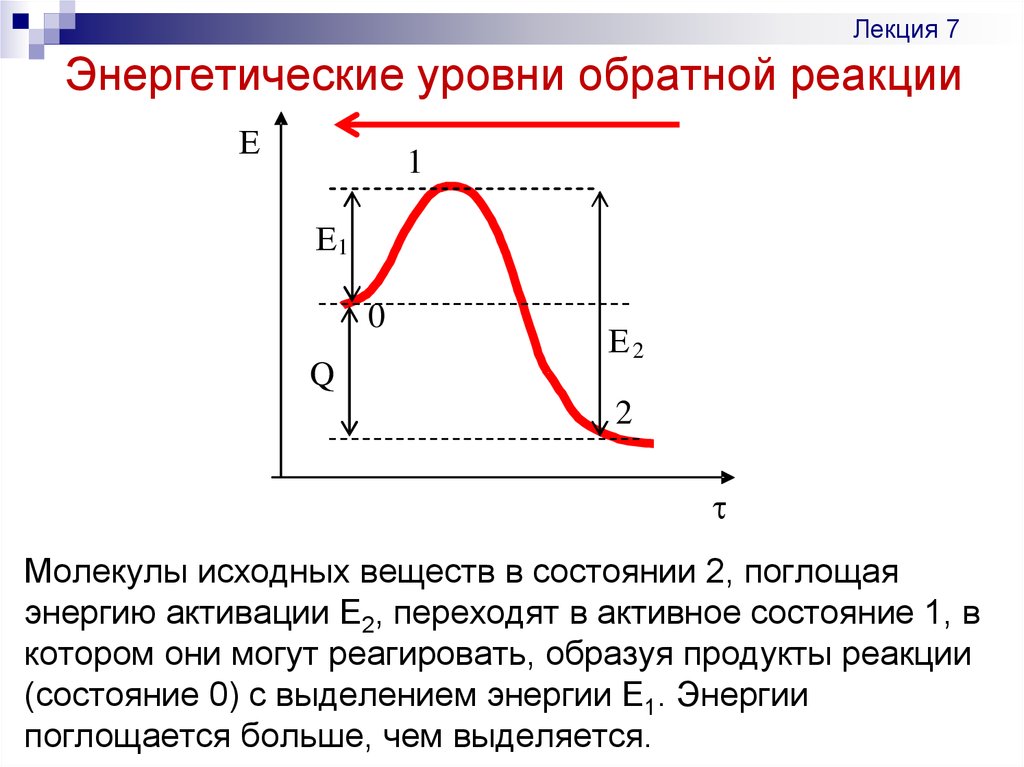
17. Энергетические уровни обратной реакции
Лекция 7Энергетические уровни обратной реакции
Е
1
Е1
0
Q
Е2
2
Молекулы исходных веществ в состоянии 2, поглощая
энергию активации Е2, переходят в активное состояние 1, в
котором они могут реагировать, образуя продукты реакции
(состояние 0) с выделением энергии Е1. Энергии
поглощается больше, чем выделяется.
18. Аррениусовская экспонента
k/k0 = exp(–E/RT)Лекция 6
Т : exp( E / RT ) 1
1
Точка перегиба
2
d E /( RT )
e
Т пер
2
dT
E /( RTпер )
E E
2 e
0
3
RTпер RTпер
Тпер
Т
Tпер
E
2R
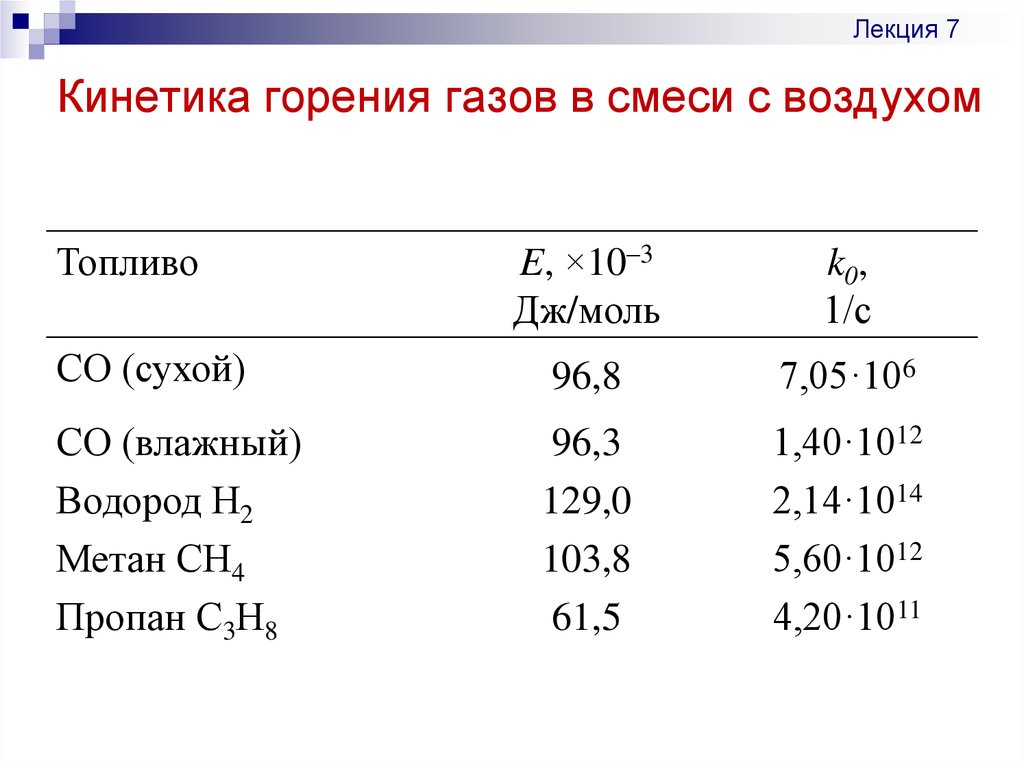
19. Кинетика горения газов в смеси с воздухом
Лекция 7Кинетика горения газов в смеси с воздухом
E, ×10–3
Дж/моль
k0,
1/с
СО (сухой)
96,8
7,05·106
СО (влажный)
Водород Н2
Метан СН4
Пропан С3Н8
96,3
129,0
103,8
61,5
1,40·1012
2,14·1014
5,60·1012
4,20·1011
Топливо
20.
Лекция 7Гетерогенная реакция 1-го порядка
(горение непористой частицы углерода)
C + O2 CO2
dC O2
d
dC C
kCO2 ,пов F , моль/с
d
Размерность константы скорости реакции и
[k] =[k0]= м/с
F – площадь внешней поверхности частицы, м2
предэкспоненциального члена

















 chemistry
chemistry








