Similar presentations:
Скорость химических реакций
1.
СКОРОСТЬХИМИЧЕСКИХ
РЕАКЦИЙ.
2.
Для чего нужны знания о скоростихимической реакции?
Приведите примеры химических
реакций, идущих с разной
скоростью.
Предположите, чем можно
измерить скорость химической
реакции?
3.
Химические реакции - этопроцессы, в результате
которых из одних веществ
образуются другие,
отличающиеся от них по
составу и (или) строению.
4.
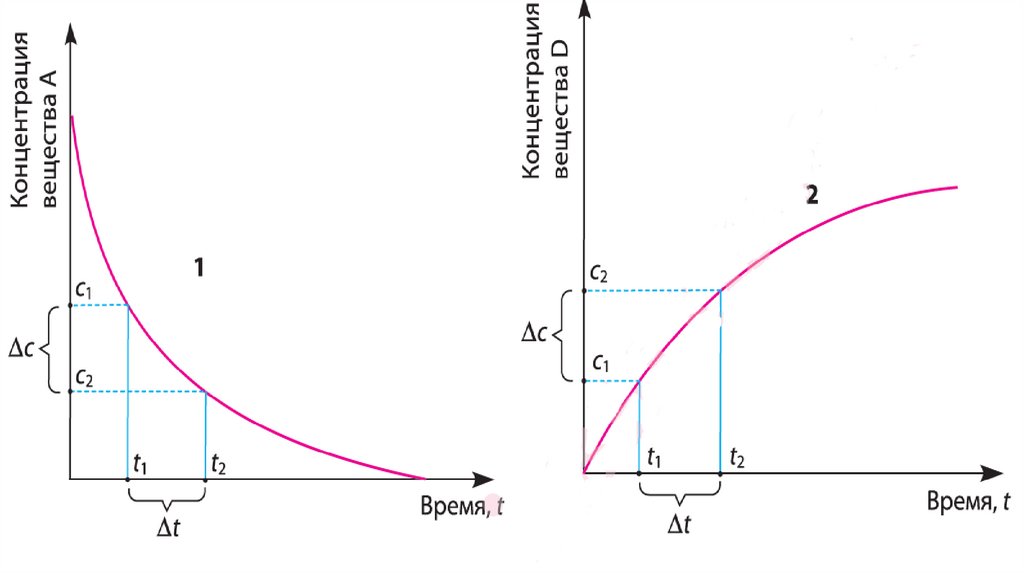
А + В = С + D.С течением времени химические количества
исходных веществ п(А) и п(В) уменьшаются, а
химические количества продуктов реакции п(С) и
п(D) увеличиваются. Чем быстрее происходит это
изменение, тем больше скорость химической
реакции, и наоборот — чем медленнее изменяются
количества веществ в ходе реакции, тем меньше её
скорость.
5.
Для определения величины скорости химической реакции v нужно знатьизменение химического количества Δп какого-либо одного вещества (А,
В, С или D),
произошедшее за интервал времени Δt, и объём сосуда V, в котором вдет
реакция.
Соотношение этих величин, записанное в виде дроби
является математическим выражением скорости химической реакции в
указанном интервале времени.
6.
7.
8.
Скорость химической реакции —величина, равная отношению изменения молярной концентрации вещества
к интервалу времени, в течение
которого
произошло
данное
изменение.
9.
10.
Поскольку вещество А, вступая в реакцию, постепеннорасходуется, изменение его концентрации Δс (А) = с2(А)
— с1(A) имеет отрицательное значение. С учётом того,
что скорость реакции — только положительная величина,
в уравнении скорости реакции перед дробью ставится
знак « - »:
11.
Вто
же
время
продукты
реакции
накапливаются,
поэтому
изменение
их
концентраций,
например
Δc(D),
имеет
положительное значение, и в уравнении
скорости реакции перед дробью ставится знак
« + »:
12.
13.
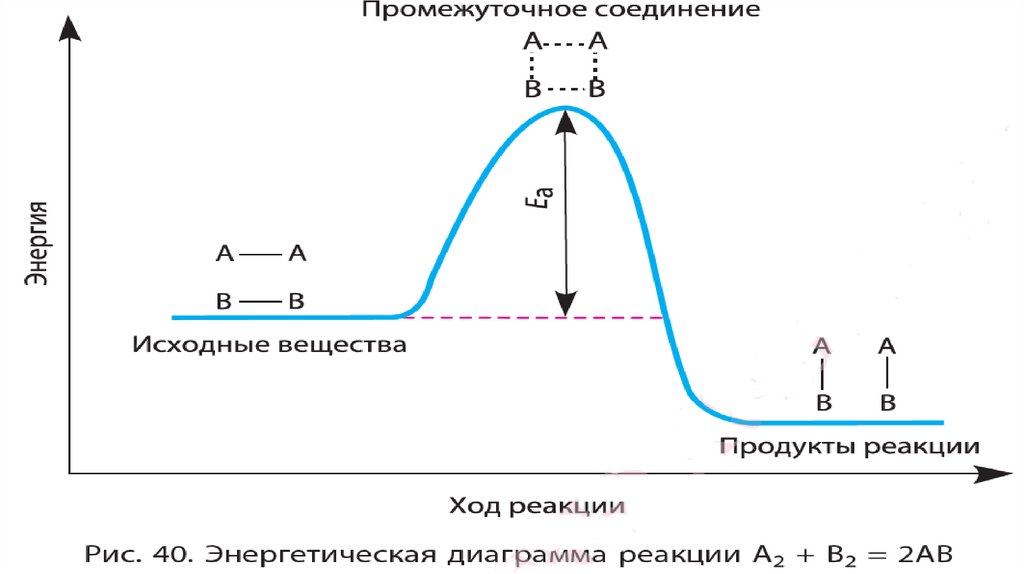
Энергия активации – это таэнергия, которую молекулы
должны «потратить» для того,
чтобы началась химическая
реакция между ними.
14.
15.
ТемператураХимическая природа реагирующих
веществ (энергия активации)
Концентрация реагирующих веществ
Катализаторы
Площадь
поверхности
соприкосновения реагирующих веществ
16.
Правило Вант-Гоффа (голландский химик 1852-1911 гг.) формулировка:в интервале температур от 0°С до 100°С при повышении температуры
на каждые 10° С скорость многих химической реакции увеличивается в 24 раза.
В виде математической формулы правило Вант-Гоффа выражается
следующей зависимостью
где
v1 и v2 — скорости реакции при температурах t1 и t2;
t1 – начальная температура;
t2 – конечная температура;
γ – температурный коэффициент от 2 до 4 (непостоянен и вычисляется
экспериментально – опытным путём), который показывает во сколько раз
возрастает скорость химической реакции при повышении температуры на
10°С.
17.
Химические реакции с участием молекул сложной формы (такихкак, белков) не подчиняются правилу Вант-Гоффа.
Уравнение Аррениуса, математическое выражение:
K – константа скорости реакции;
А — коэффициент Аррениуса;
Е — энергия активации;
R — универсальная газовая постоянная;
Т — температура, К.
18.
ЗадачаПри температуре 20 градусов некоторая реакция
заканчивается за 40 минут. Вычислите за какое время
закончится эта реакция при температуре 80 градусов.
Температурный коэффициент скорости реакции равен 2.
Дано
τ1=40 мин.
t1=20 0C
t2=80 0C
γ=2
τ2-?
19.
РешениеОпределим во сколько раз возрастет скорость реакции
при увеличении температуры с 20 до 80 градусов.
Найдем за какое время закончится эта реакция
20.
Домашнеезадание:
параграф 20
№10 стр 115.





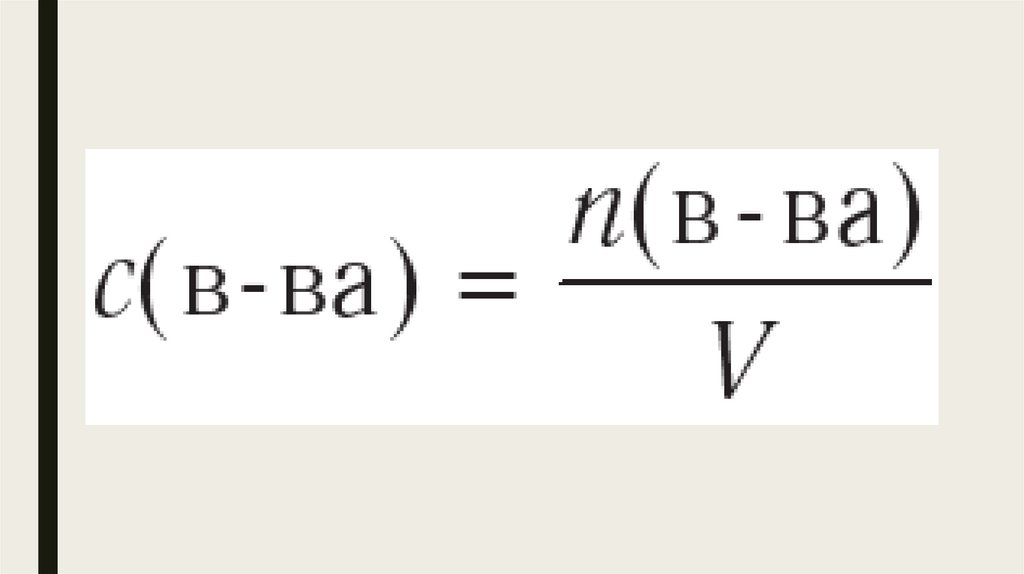
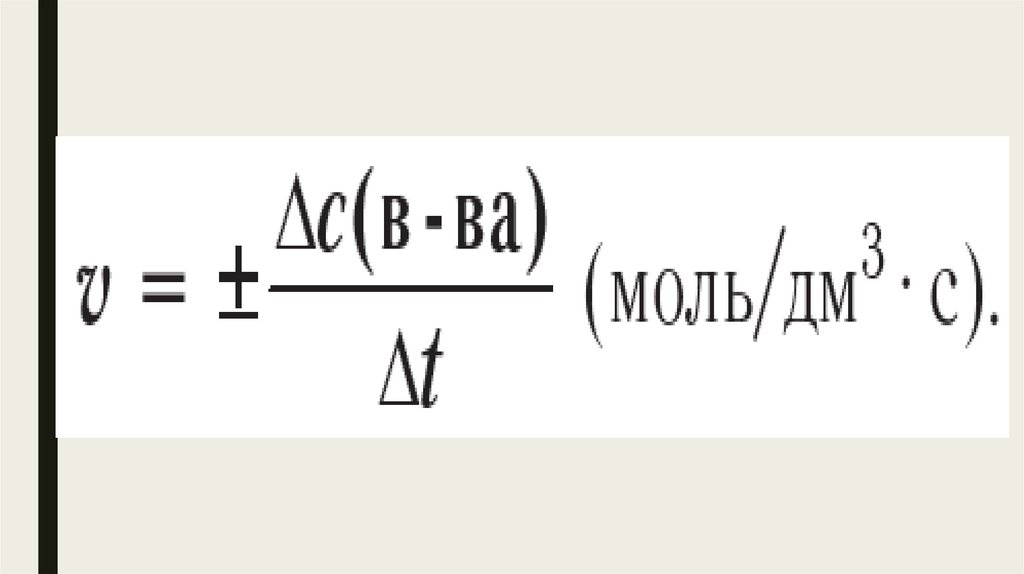










 chemistry
chemistry








