Similar presentations:
Скорость химических реакций
1.
Лекция 4Скорость химических реакций
Рассматриваемые вопросы:
1. Химическая кинетика и её основные задачи.
2. Классификация типов реакций.
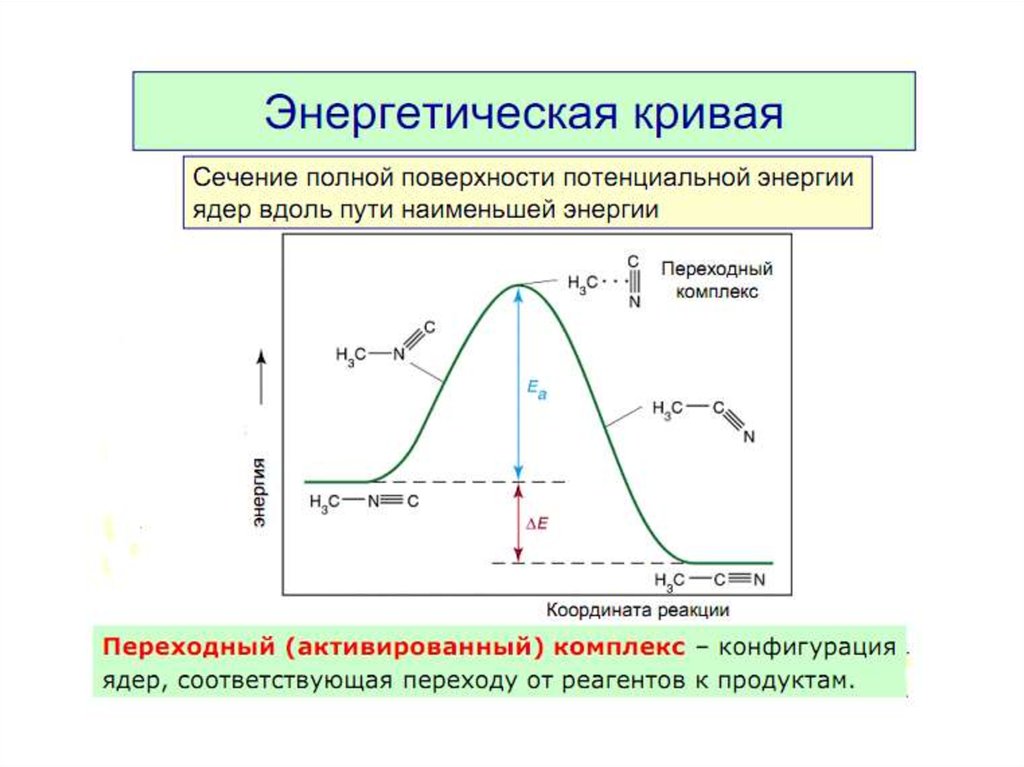
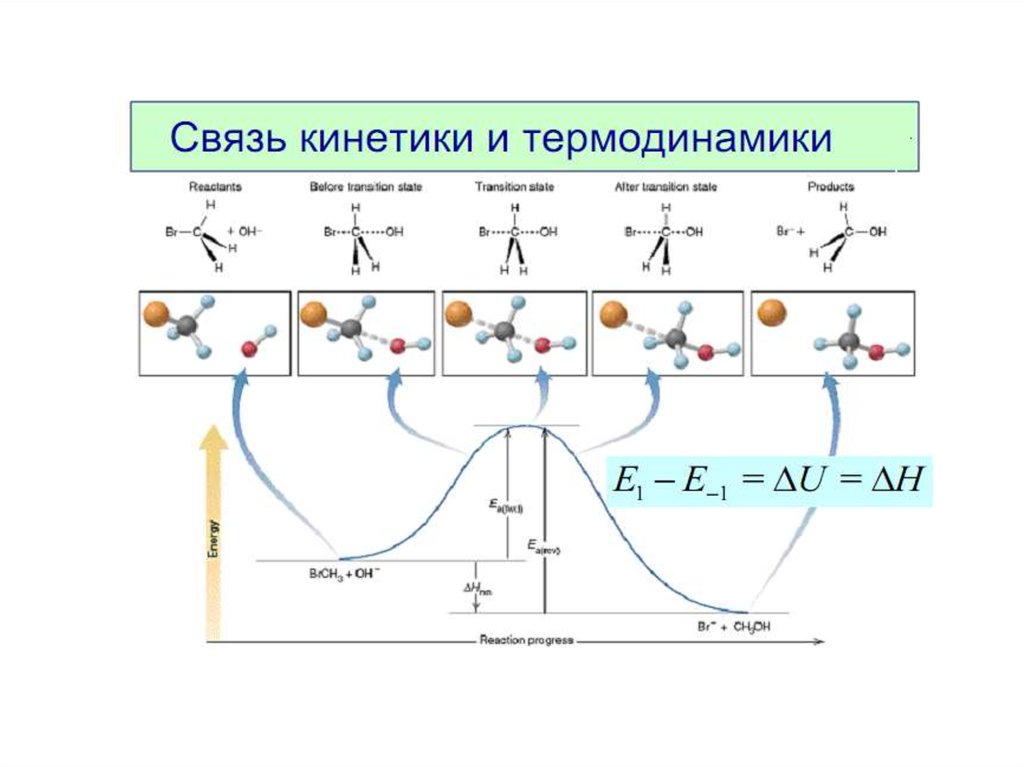
3. Энергия активации. Энергетическая кривая реакции.
4. Почему идут химические реакции?
5. Основные законы и принципы химической кинетики.
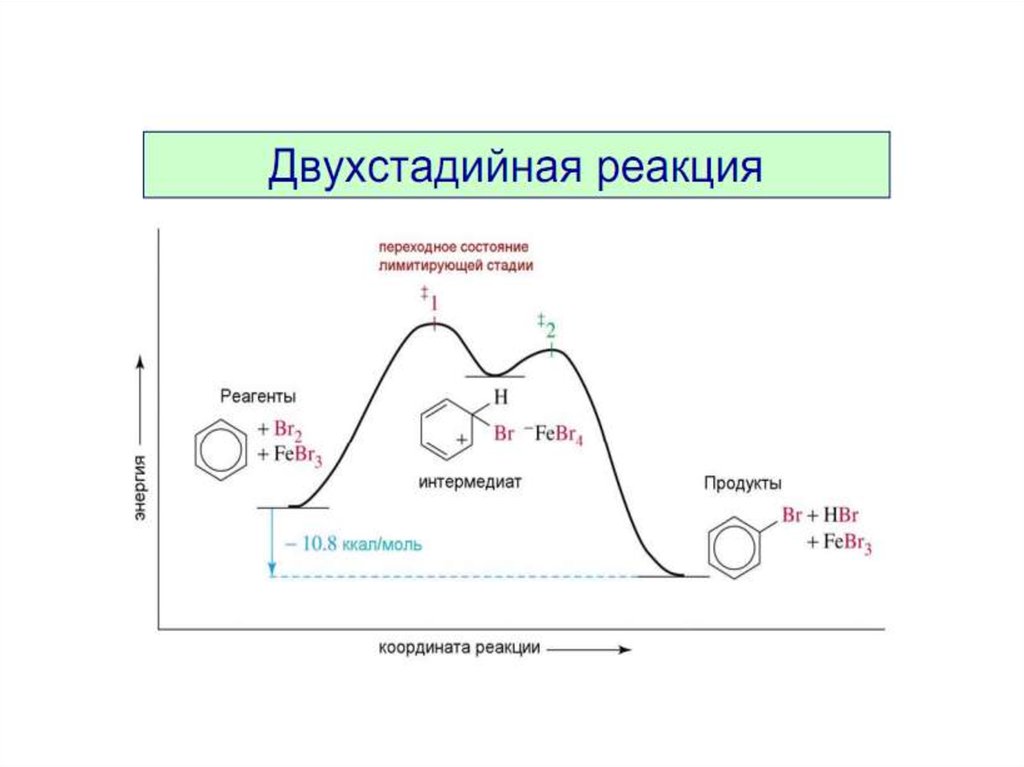
6. Механизм реакции. Лимитирующая стадия.
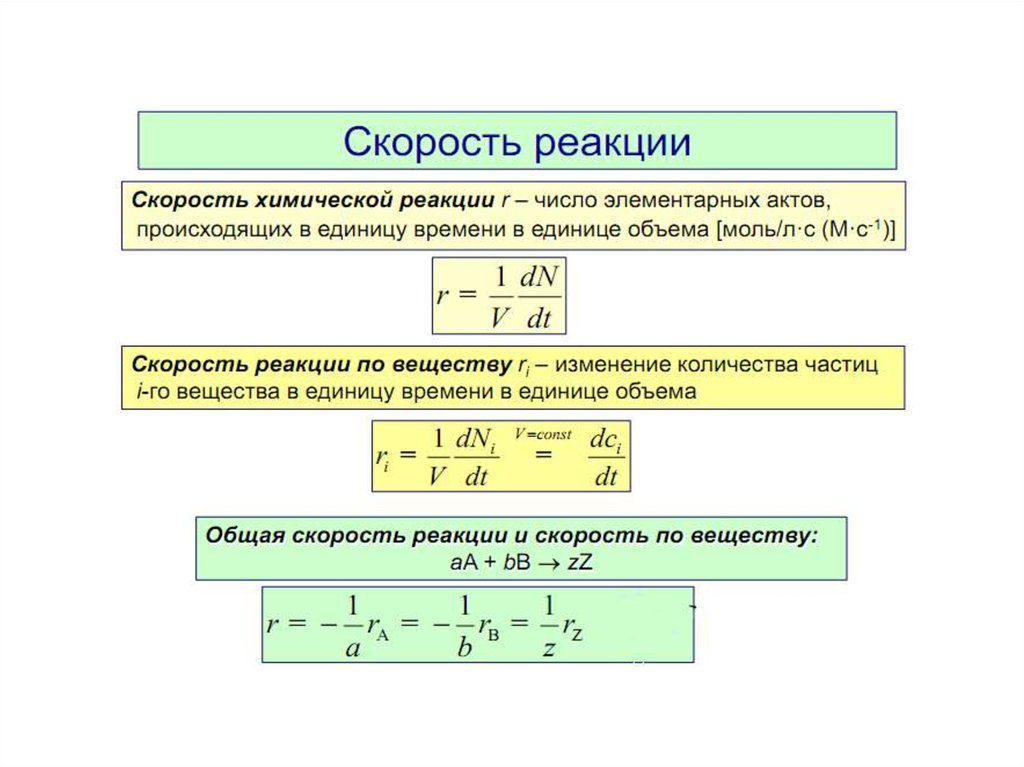
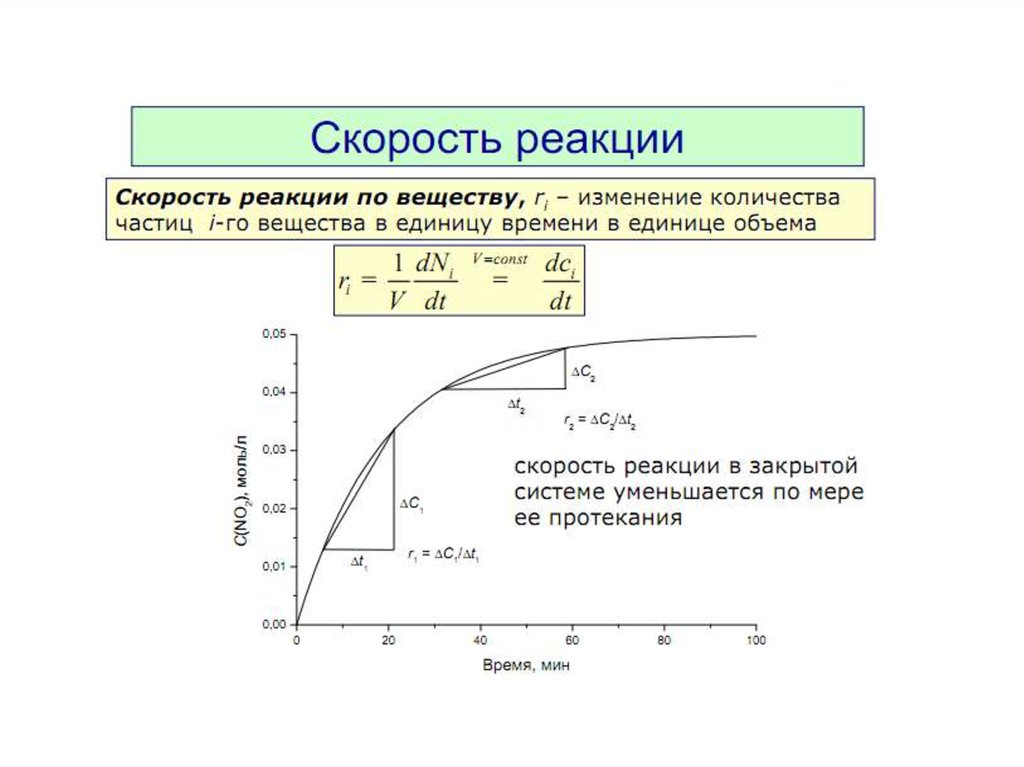
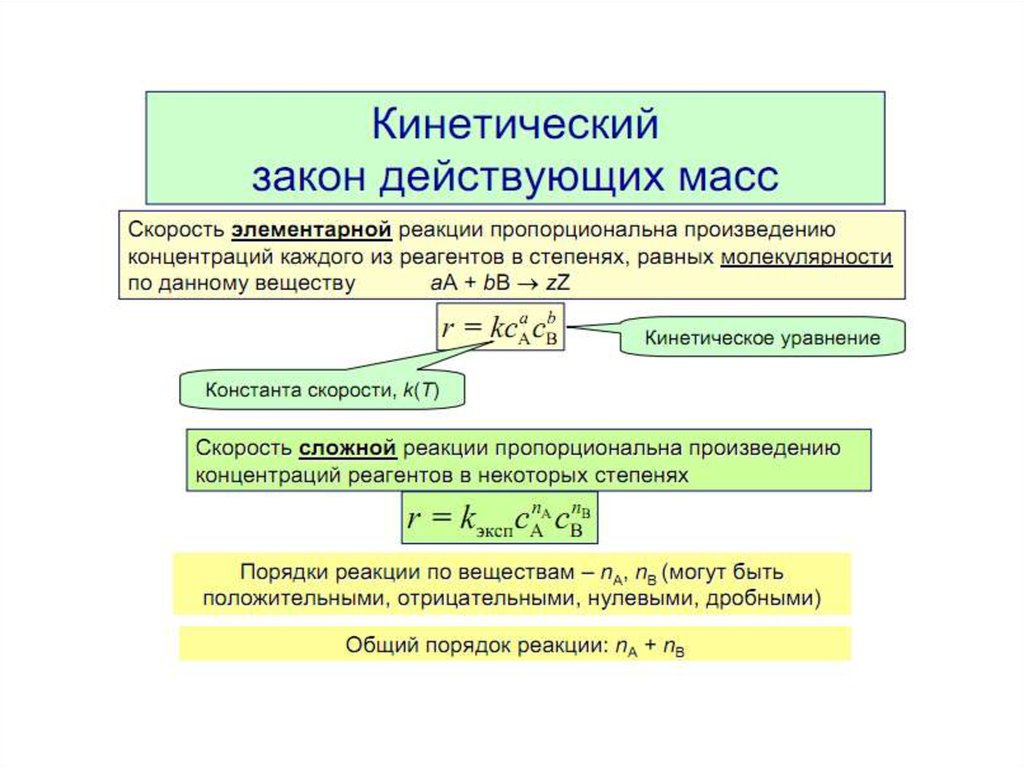
7. Скорость реакции. Закон действующих масс. Факторы,
влияющие на скорость.
8. Порядок и молекулярность реакции.
9. Зависимость скорости реакции от температуры и природы
веществ. Уравнение Аррениуса. Правило Вант-Гоффа.
10. Химическое равновесие. Принцип Ле-Шателье.
2.
3.
4.
5.
6.
7.
8.
Энергия активации Еа — это энергия, которую надосообщить 1 моль вещества, чтобы его молекулы
стали активными, [кДж/моль].
Это энергетический барьер, который должны
преодолеть молекулы реагентов, чтобы
превратиться в молекулы продуктов.
Чем больше Еа , тем меньше в системе активных
молекул.
В большинстве случаев
50 кДж/моль > Еа > 100 кДж/моль
Если Еа > 120 кДж/моль — процесс идет годами.
Если Еа = 0, то?
9.
10.
11.
12.
13.
14.
15.
Механизм реакции. Лимитирующая стадия.H2 + I2 = 2HI
1) I2
hν
I· + ·I
2) ·I + H–H
3) I ̵ ̵ H ̵ ̵ H + ·I
4) I ̵ ̵ H ̵ ̵ H ̵ ̵ I
I̵ ̵H̵ ̵H
I̵ ̵H̵ ̵H ̵ ̵I
HI + HI
Какая из стадий будет самой медленной?
16.
17.
18.
19.
20.
21.
22.
23.
24.
Порядок реакции — это сумма степеней вкинетическом уравнении для элементарной стадии
процесса.
Формальным порядком реакции называется
показатель степени в кинетическом уравнении
реакции, определяемый экспериментально.
25.
Два способа экспериментального определения порядкареакции:
1) составляются кинетические уравнения для реакций
1-го, 2-го и 3-го порядков. После интегрирования и
преобразования получаем выражения:
1 c0
k1 ln
,
c
1 1 1
k II ( )
c c0
k III
1 1 1
( 2 2)
2 c c0
1
[c ],
[л моль–1 с–1]
[л2 моль–2 с–1]
26.
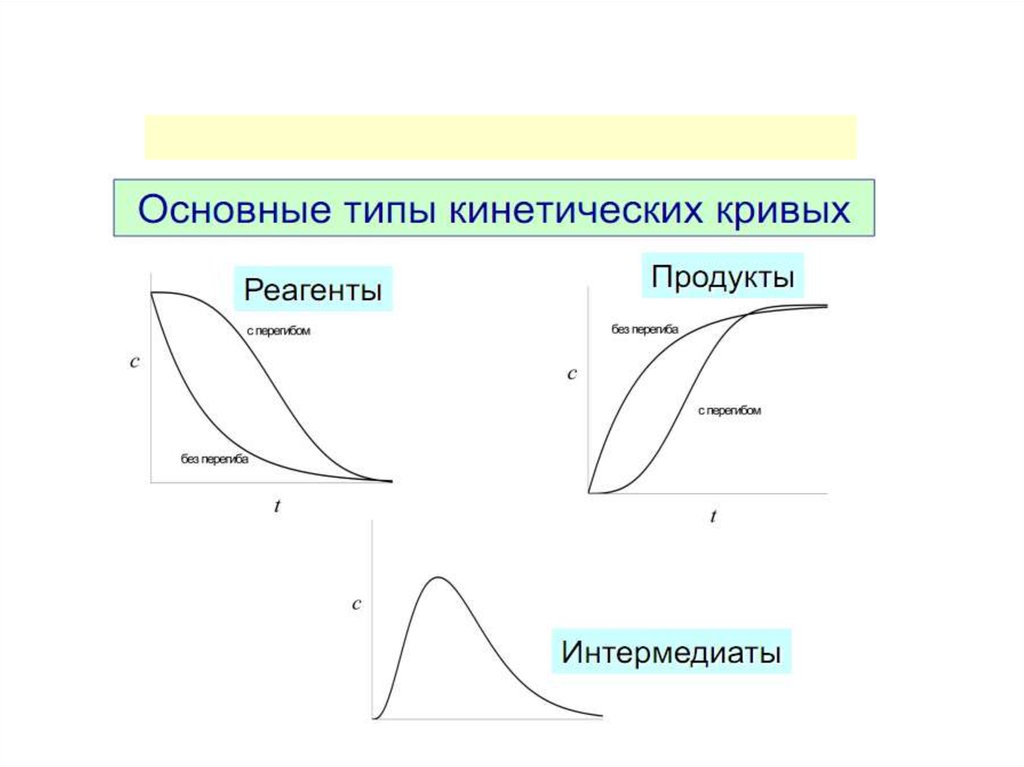
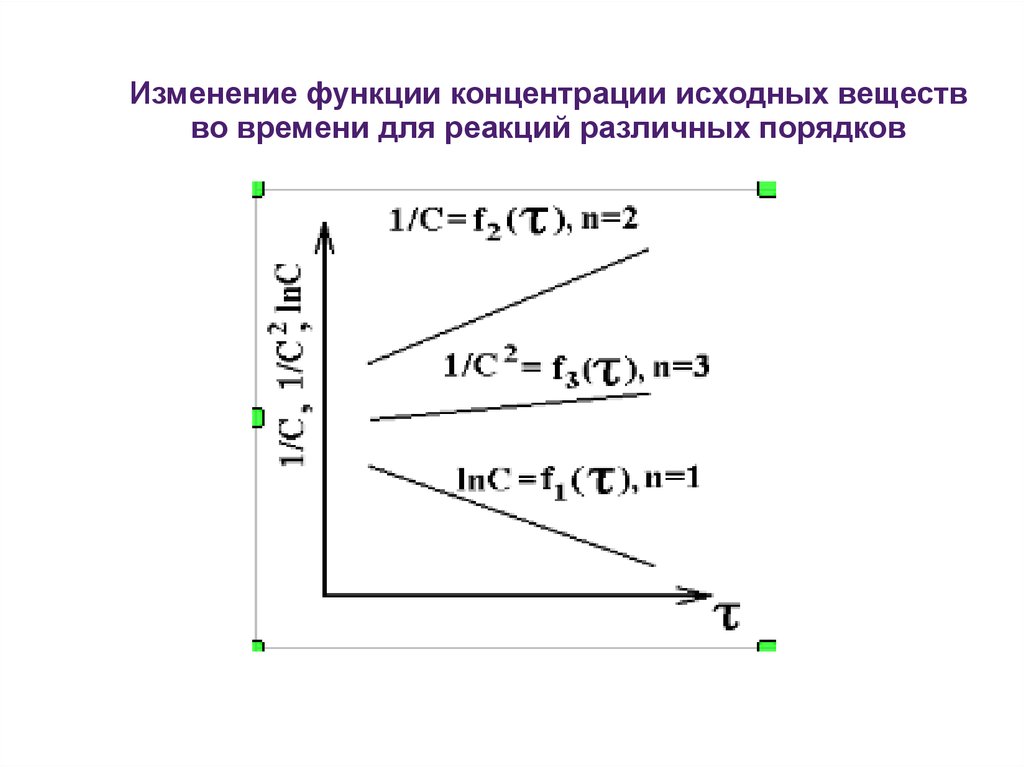
Изменение функции концентрации исходных веществво времени для реакций различных порядков
27.
2) Используя логарифмическую форму кинетическогоуравнения r = k·cn ,
lgr = lgk + n·lgc из линейной зависимости получаем
lg k и n = tg .
28.
Молекулярность реакции — число молекул, принимающихучастие в элементарном акте химического превращения.
Существуют одно-, двух- и трехмолекулярные реакции.
Молекулярность и порядок реакции не совпадают если:
- уравнение реакции описывает процесс в целом и не
отражает истинного механизма реакции;
2N2O5 = 4NO2 + O2
Молекулярность равна 2, порядок 1.
- концентрация одного из реагентов много больше
концентрации другого.
29.
Зависимость скорости реакции оттемпературы и природы реагирующих
веществ описывает уравнение
Аррениуса:
k= A⋅ e
− Ea
R⋅ T
k — константа скорости реакции
A — предъэкспоненциальный множитель,
отражающий ОБЩЕЕ число соударений в системе
Еа — энергия активации
R — универсальная газовая постоянная
Т — температура, К
е — ДОЛЯ активных соударений в системе
30.
Каким образом можно ускорить реакцию?- увеличить температуру
- снизить энергию активации
Катализаторы — вещества, участвующие в
реакции, но не расходующиеся в ней.
Катализаторы бывают положительными и
отрицательными (ингибиторы).
31.
Энергетическая диаграмма реакции безкатализатора и с катализатором.
32.
Энергия активации количественнохарактеризует природу вещества:
Калий в воде
Ложка из нержавеющей
стали в воде
33.
Определение энергии активации поконстантам реакции, определенным при двух
температурах:
k 2 (T2 T1 )
ln
Ea .
k1
RT2 T1
Ea
R T1 T2 ln(k T 2 / k T1 )
T2 T1
.
34.
Если Еа лежит в диапазоне 50-100 кДж/моль, товлияние температуры на скорость можно оценить по
эмпирическому правилу Вант-Гоффа:
увеличение температуры реакции на каждые 10
градусов ускоряет реакцию в 2-4 раза.
k t 10
(2 4),
kt
kt2
k t1
(t 2 t 1 )/10
,
kt2
t 2 t1
lg
lg ,
k t1
10
35.
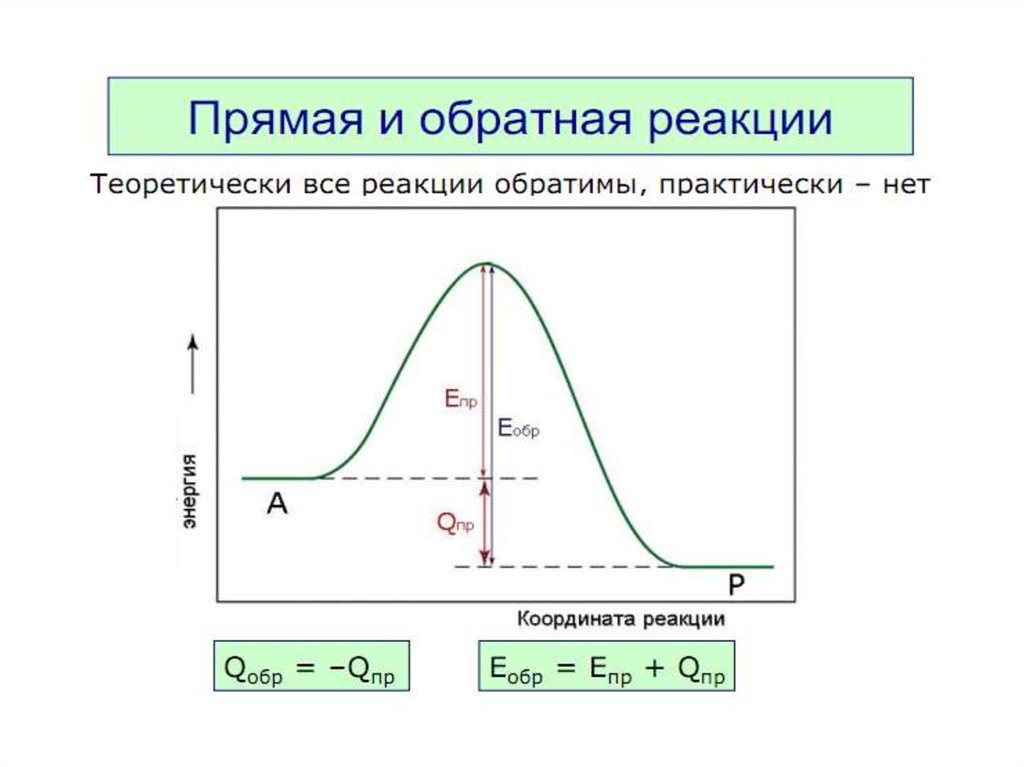
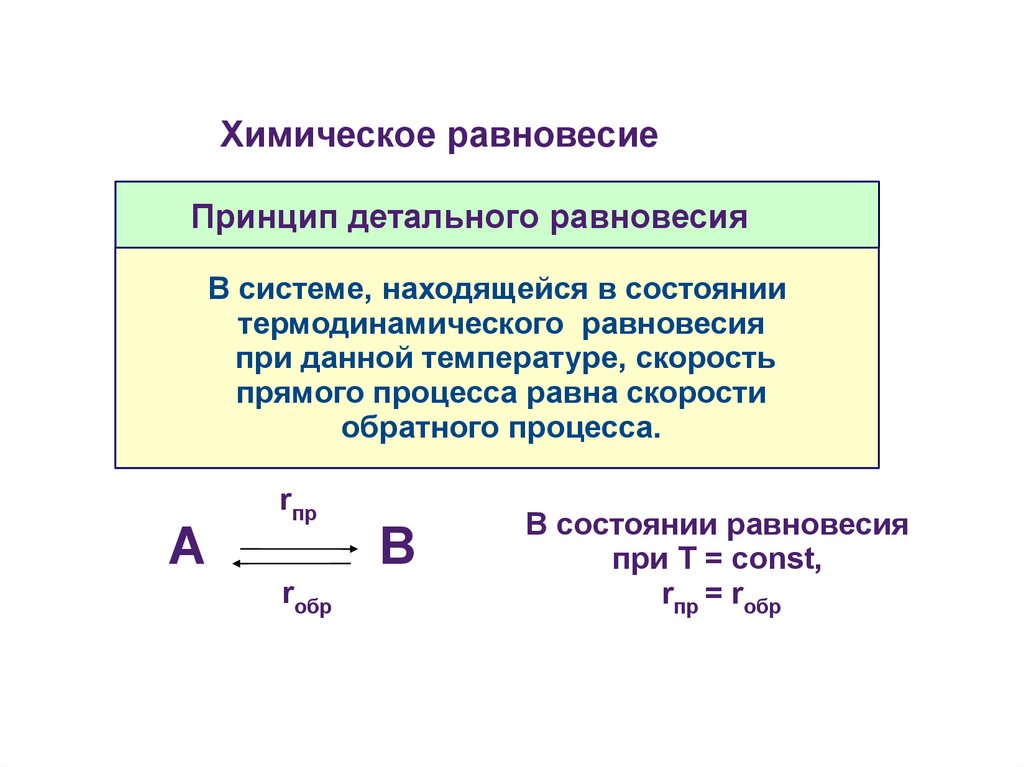
Химическое равновесиеПринцип детального равновесия
В системе, находящейся в состоянии
термодинамического равновесия
при данной температуре, скорость
прямого процесса равна скорости
обратного процесса.
А
rпр
rобр
В
В состоянии равновесия
при Т = const,
rпр = rобр
36.
Принцип Ле-ШательеЕсли на систему, находящуюся в равновесии,
оказывается внешнее воздействие (Т, р, С),
равновесие системы смещается в сторону той,
из двух противоположных реакций, которая
ослабляет это воздействие.
37.
Задача:В реакции синтеза
аммиака исходные
Задача:
концентрации
азота
В реакции
СО и+ водорода
Н2О ↔ СО2составляли
+ Н2
соответственно
5 и 10 моль/л.
Известно,
что к
Исходные
концентрации
реагентов
составляли
по 1 моль/л.
равновесия
равна 4.
моментуКонстанта
наступления
равновесия
прореагировало
50% исходного
азота.
Определить
все равновесные
концентрации.
Определите константу равновесия.
38.
В лекции использованы материалы профессорахимического факультета МГУ им. Ломоносова
Еремина Вадима Владимировича
Спасибо
за внимание!




























 chemistry
chemistry








