Similar presentations:
Добування кисню
1.
2.
У лабораторії кисень отримують з оксигеновмісних сполук:калій перманганат KMnO4
калій хлорат KClO3
калій нітрат KNO3
меркурій оксид HgO
гідроген пероксид
Н2О2
3.
Добування кисню з гідроген пероксиду у присутності каталізатора MnO2:Каталізатори – це речовини, здатні прискорювати
хімічні реакції і не входять ні до складу реагентів, ні продуктів реакції
4.
Добування кисню з гідроген пероксиду у присутності каталізатора MnO2:2 Н2О2
MnО2
2 Н2О + O2
5.
Добування кисню з гідроген пероксиду у присутності каталізатора С:6.
Добування кисню з гідроген пероксиду у присутності каталізатора КІ(«зубна паста для слона»):
7.
Наявність кисню перевіряють тліючою скіпочкою –у присутності кисню вона яскраво спалахує
8.
Добування кисню з інших складних сполук:t
KNО2 + O2
KNО3
t
KMnО4
K2MnО4 + MnO2 + O2
t
KClО3
HgО
t
KCl + O2
Hg + O2
9.
Добування кисню з інших складних сполук:t
2 KNО3 2 KNО2 + O2
t
2 KMnО4
K2MnО4 + MnO2 + O2
t
2 KClО3
2 HgО
t
2 KCl + 3 O2
2 Hg + O2
Реакція розкладу - хімічна реакція, під час якої з молекул однієї складної
речовини утворюються молекули кількох простих або складних речовин
10.
Добування киснюу промисловості:
1. Перегонка рідкого повітря
- 190°C
- 200°C
- 185°C
11.
Добування киснюу промисловості:
2Н2О
2. Електроліз водного розчину
лугу NaОН
електричний
струм
2Н2 + O2
Електроліз - спосіб розкладання речовин
за допомогою постійного електричного струму
12.
Підіб’ємо підсумки!1. У лабораторії кисень отримують шляхом розкладу оксигеновмісних сполук:
2Н2О2
кат.
2Н2О + О2
2. Речовини, що прискорюють хімічні реакції, називаються каталізаторами.
3. Кисень збирають шляхом витіснення води і шляхом витіснення повітря.
4. У промисловості кисень отримують в результаті перегонки рідкого повітря
або гідролізу розчину NaOH.







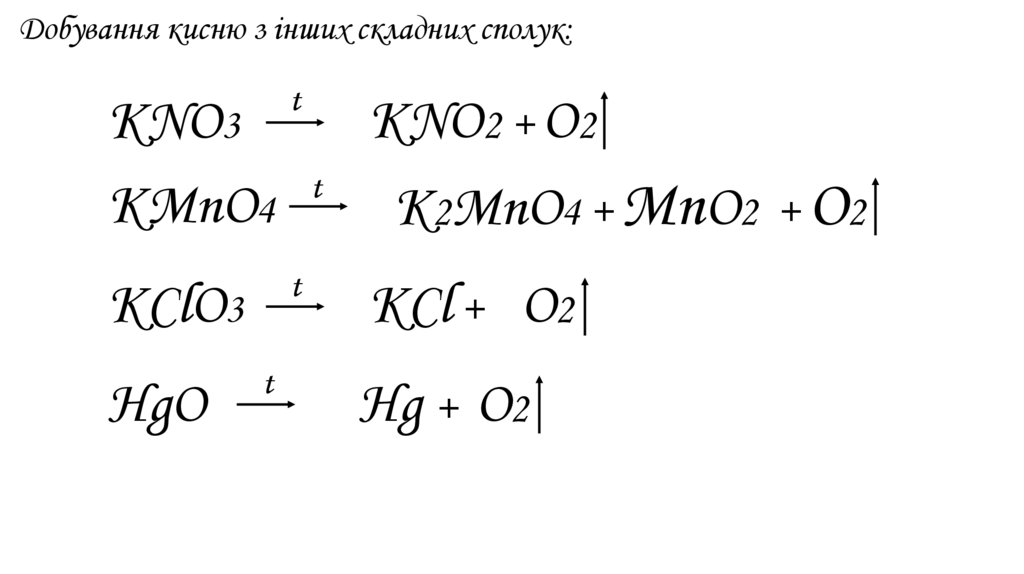




 chemistry
chemistry








