Similar presentations:
Листериоз. Листерии
1. Листериоз
Мека-Меченко Татьяна Владимировна главный научныйсотрудник лаборатории природно-очаговых бактериальных
инфекций д.м.н.
E-mail: tmeka-mechenko@kscqzd.kz
2.
Листерии давно известны микробиологам, эпидемиологам иклиницистам всего мира. Еще в 1926 г. E.G. Murray и соавт.
выделили данный возбудитель во время эпизоотии
лабораторных животных в питомнике Кембриджа.
Название Listeria monocytogenes было дано в 1940 г. в честь
английского хирурга D. Lister (1827-1912), разработавшего
метод антисептики, и одновременно указывало на наличие
моноцитоза, характерного для заболевших кроликов и
морских свинок.
В 1929 г. листерии впервые выделены от больного человека, а
также от овец – одного из основных хозяев листерий, с
которыми соприкасается человек.
2
3.
Листериоз (листереллез, болезнь реки Тигр,невреллез, гранулематоз новорожденных, listeriosis
–
лат.)
–
природно-антропургическая
инфекционная
болезнь,
характеризующаяся
множеством источников инфекции, многообразием
факторов и путей передачи возбудителя, а также
полиморфной клинической картиной.
Листериоз – заболевание, вызываемое микроорганизмами рода Listeria, поражающее человека,
сельскохозяйственных
и диких животных, в
настоящее время является одной из широко
распространенных бактериальных инфекций.
3
4. Первые сведения о возбудителе листериоза были опубликованы Гюльдерсом в 1911 году. Ученый обнаружил мелкие палочковидные
образования вгнойном
узелке
печени
павшего
кролика.
Позже французские врачи Дюмон и Котонни
выделили листерии из спинномозговой жидкости
больного, погибшего от менингита.
4
5.
Начало систематическому изучению листериоза в 1924 г.положили работы английского исследователя Мюррея и его
коллег, выделивших возбудитель листериоза от кроликов и
морских свинок в виварии Кембриджского университета.
Учитывая способность микроба вызывать моноцитоз,
авторы назвали его Bacterium monocytogenes. В 1927 году
Пири, исследуя напоминавшую чуму болезнь диких
грызунов в южноафриканском институте им. Листера,
определил возбудителя и назвал его в честь Листера (с 1940
года – род Listeria).
5
6.
Три основных этапа во взаимоотношениилистерий и человеческой популяции.
П е р в ы й – до 50-х годов 20 века, когда в
мире было выявлено не более 70 случаев
листериоза,
как
правило,
у
людей,
непосредственно
контактировавших
с
зараженными
животными
(работники
скотобоен, фермеры-животноводы, доярки).
6
7.
В т о р о й – 50-70-е годы 20 века. Числослучаев листериоза достигает нескольких
тысяч. Эта инфекция рассматривается как
весьма
опасный
зооноз
с
высокой
летальностью, но большинство случаев попрежнему связаны с сельскохозяйственными
регионами и употреблением сырого молока,
контактом с больными животными, в том
числе с грызунами.
7
8. Т р е т и й – 80-е годы 20 века – по настоящее время. Многочисленные эпидемические вспышки и спорадические случаи листериоза в
высокоразвитыхстранах
мира
(США,
Великобритания,
Швейцария,
Канада,
Франция) были связаны с употреблением
готовых продуктов пищевой индустрии
(сыры,
особенно
мягкие,
мясные
полуфабрикаты, салаты и др.), после чего
данное заболевание стали рассматривать
как одну из важных пищевых инфекций в
мире.
8
9.
Регистрировалисьвнутрибольничные
вспышки,
смертность при которых достигала 30-50 %, после чего
данное заболевание стали рассматривать как одну из
важных пищевых инфекций в мире.
Это повысило актуальность
проблемы листериоза в
медицинском и ветеринарном аспектах. Но несмотря на
это, до сих пор листериоз остается малоизвестным не
только для населения, но и для медицинских работников. А
между тем листериоз зарегистрирован в 60 странах мира
(Бакулов, 1972), в разных климатических районах планеты
(Дунаева с соавт., 1967), а возбудитель его выделен от 103
видов животных (Гуславский, 1980; Бакулов с соавт., 1994).
9
10.
Естественныминосителями
возбудителя
листериоза являются не только большинство
теплокровных животных, но и амфибии, рыбы, а
также
представители
различных
групп
членистоногих.
Высокая адаптация листерий к биотическим и
абиотическим факторам внешней среды,
способность
к
паразитированию
на
различных
видах
домашних
и
диких
животных,
обуславливают
стойкое
сохранение возбудителя в природе и
повышает возможность заражения человека.
10
11.
До недавнего времени листериоз у людей недиагностировался, хотя несомненно был, но проходил
под другими диагнозами (Seeliger, 1988). За последние
несколько лет болезнь стала регистрироваться чаще.
H.Hof (1988) считает, что рост заболеваемости людей
листериозом
связан
с
изменениями
условий
окружающей среды,
с изменившимся рационом
питания и повышенной восприимчивостью носителей
к заражению возбудителем. Известно, что у человека
инфекция
развивается
чаще
всего
в
виде
спорадических,
иногда
массовых,
групповых,
семейных заболеваний, поражая все возрастные
группы.
11
12. По количеству выявленных случаев листериоз значительно уступает сальмонеллезам и кампилобактериозам, но превосходит их по
летальности и тяжестиклинического течения.
Так, из 2518 больных листериозом,
выявленных в США в 1997 г., у 20%
наступил летальный исход, а
госпитализация больных требовалась
в 92% случаев
12
13. В Российской Федерации заболеваемость листериозом официально регистрируется с 1992 г. Как правило, диагностика листериоза
В Российской Федерации заболеваемостьлистериозом официально регистрируется с
1992 г. Как правило, диагностика листериоза
связана либо с работой ветеринаров, либо с
энтузиазмом
отдельных
исследователей.
Отсутствие эффективной системы санитарноэпидемиологического надзора за листериозом
и
неудовлетворительное
качество
лабораторной
диагностики
обусловили
"своеобразный вакуум" между реальной
ролью листерий в инфекционной патологии
человека и практическими исследованиями в
этой области клинической микробиологии в
России.
13
14.
Изучениемлистериоза
занимаются
специалисты
медицинского
и
ветеринарного профиля. В большинстве
стран
листериоз
официально
регистрируется. В Казахстане листериоз
официально регистрируется только с 2002
г. ( Приказ МЗ и МСХ № 946/326 от
17.10.2002 «О профилактике листериоза в
Республике Казахстан»).
14
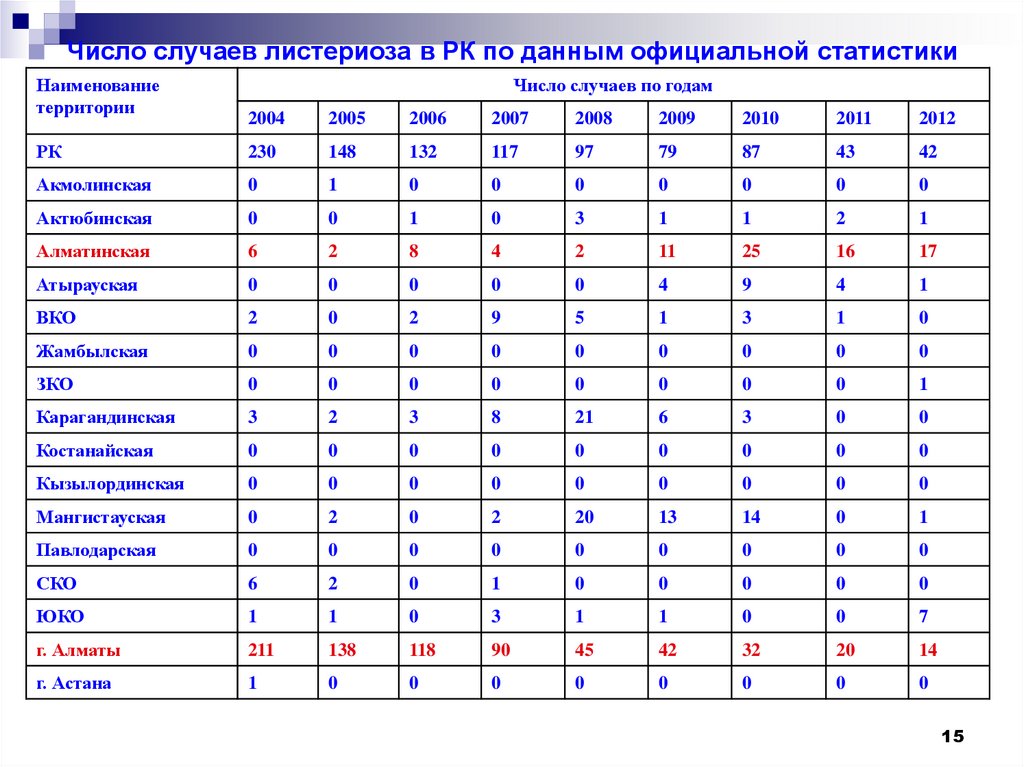
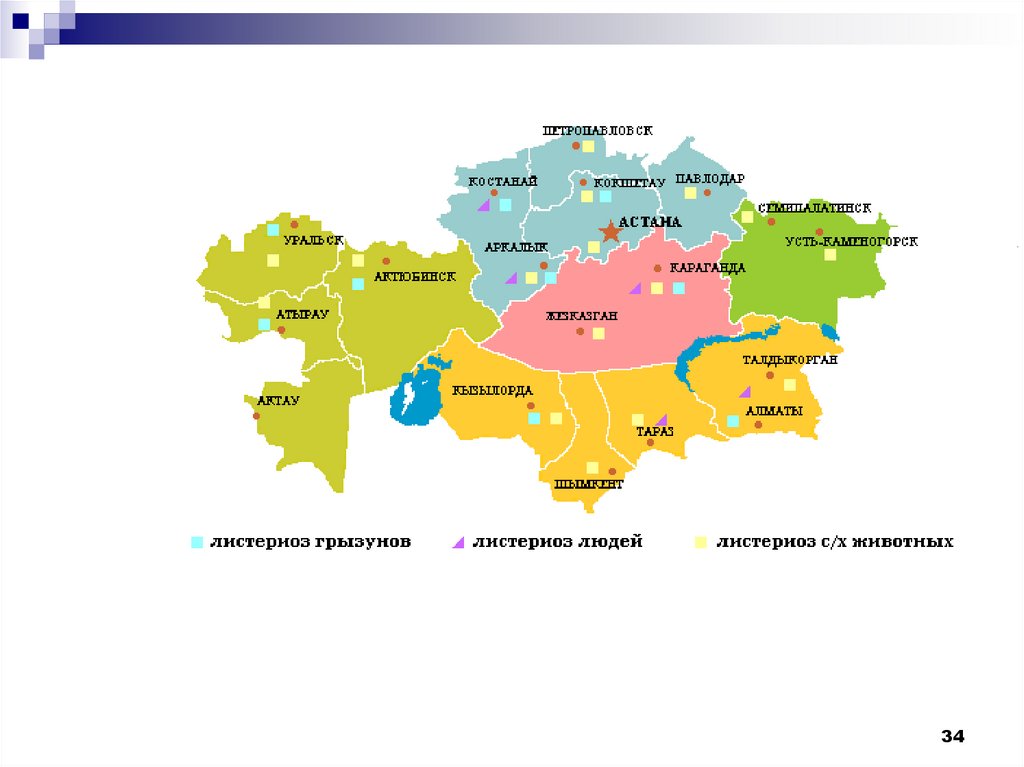
15.
Число случаев листериоза в РК по данным официальной статистикиНаименование
территории
Число случаев по годам
2004
2005
2006
2007
2008
2009
2010
2011
2012
РК
230
148
132
117
97
79
87
43
42
Акмолинская
0
1
0
0
0
0
0
0
0
Актюбинская
0
0
1
0
3
1
1
2
1
Алматинская
6
2
8
4
2
11
25
16
17
Атырауская
0
0
0
0
0
4
9
4
1
ВКО
2
0
2
9
5
1
3
1
0
Жамбылская
0
0
0
0
0
0
0
0
0
ЗКО
0
0
0
0
0
0
0
0
1
Карагандинская
3
2
3
8
21
6
3
0
0
Костанайская
0
0
0
0
0
0
0
0
0
Кызылординская
0
0
0
0
0
0
0
0
0
Мангистауская
0
2
0
2
20
13
14
0
1
Павлодарская
0
0
0
0
0
0
0
0
0
СКО
6
2
0
1
0
0
0
0
0
ЮКО
1
1
0
3
1
1
0
0
7
г. Алматы
211
138
118
90
45
42
32
20
14
г. Астана
1
0
0
0
0
0
0
0
0
15
16. Эпидемиологические и клинические особенности листериоза Листериоз- одна из широко распространенных бактериальных инфекций,
зарегистрированных в 60 странах мира, вразличных климатических зонах планеты.
16
17.
Особенностилистериоза
определяются
устойчивостью возбудителя во внешней среде,
обуславливающей широкий круг источников и
факторов передачи возбудителя человеку (Гершун с
соавт., 1979; Бакулов с соавт., 1980; Гершун, 1981;
Lamont, 1988; Прозоровский с соавт., 1993).
Листериоз относится к зоонозным природноочаговым
заболеваниям
(Олсуфьев,
1970;
Гершун,1979;
Елизарова с соавт., 1979; Тихонов, 1979; Занина,
1981). В то же время листерии не имеют какого-либо
определенного хозяина, вызывая у всех животных и
человека сходный спектр патологических изменений
(Gerhard et al., 1978; Сомов, 1984).
17
18.
Данные отечественных и зарубежных исследователейпоследних лет свидетельствуют об исключительно
широких
адаптивных
способностях
листерий,
позволяющих им размножаться в сапрофитической
среде
в
различных
природных
субстратах
(растительных, почвенных, водных).
Листерии способны к размножению в широком
диапазоне температуры (4-45oС), рН (4,8-9,0) и
влажности, в присутствии NaCl (20%) и 15% СО2.
Высокая метаболическая пластичность листерий
обусловливает
возможность
перехода
их
от
сапрофитической фазы к паразитической и наоборот.
18
19.
Листериоз зарегистрирован у 12 видовдомашних животных и птиц (овцы, козы,
крупный рогатый скот, свиньи лошади, куры,
гуси и др. и 91 вида диких животных (лисы,
еноты,соболи,косули, дикие свиньи, обезьяны
и др.) и птиц (глухари, тетерева, фазаны и др.),
рыб.
19
20.
Распространенностьполевых грызунов.
листериоза
среди
В настоящее время листериоз обнаружен у больших,
краснохвостых, полуденных песчанок, лесных,
полевых, домовых мышей, пеструшек, полёвок,
серых и водяных крыс, леммингов, тушканчиков,
шиншилл, белок, сусликов, тарбаганов, зайцев,
хорьков, ласок, соболей, норок, скунсов, енотов,
дикой кошки, лисиц, корсаков, песцов, енотовидной
собаки, леопарда, косуль, лани, серны, джейрана,
сайгаков, дикой свиньи, куторы, бурозубки, ежа,
летучих мышей, воробьев, канареек, дроздов,
скворцов, сорок, серых и белых куропаток, фазанов,
тетеревов, глухарей, диких уток, попугаев, полярных
сов, орлов, рыб и морских млекопитающих и др.
20
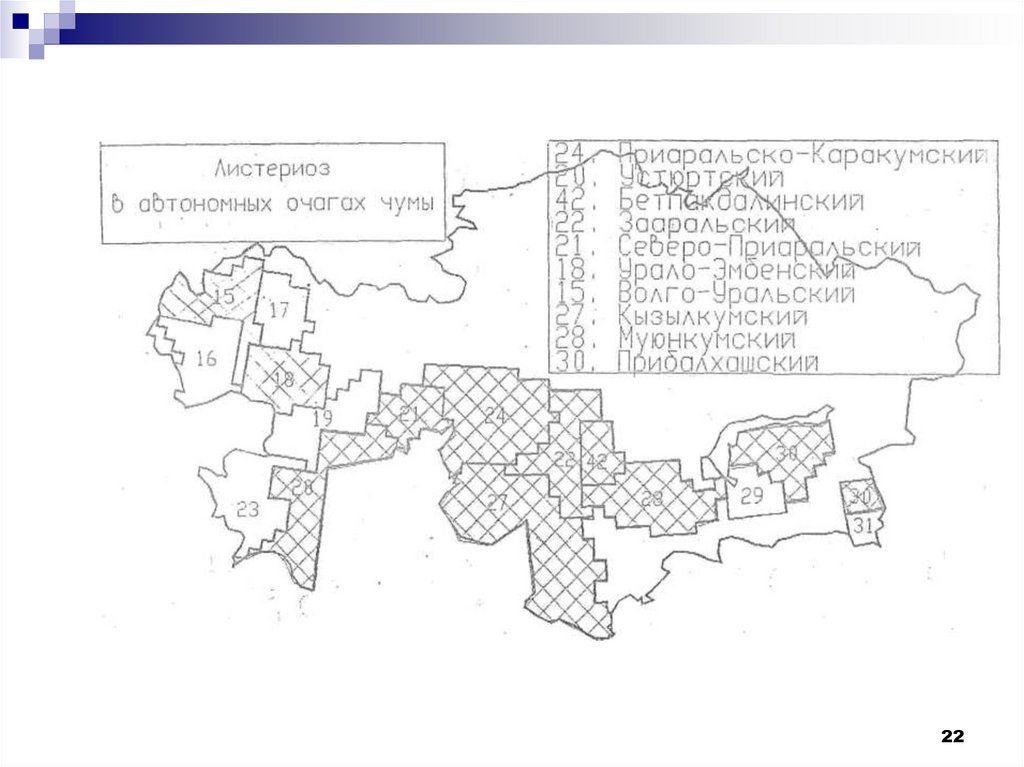
21.
В Казахстане возбудитель листериоза довольно широкораспространен среди грызунов в очагах чумы (Занина с соавт.,
1981; Радченко, 1988; Степанов с соавт., 1988; Некрасова, 1989;
Цепко, 1993; Безверхний с соавт., 1994; Соколов с соавт., 1995;
Мека-Меченко, 1997 и др.).
Листерии выявлены у грызунов в Приаральско-Каракумском
(зараженность 0,7 ±0,02%), Устюртском (зараженность 0,5 ±0,02%),
Бетпакдалинском
(зараженность 0,2 ±0,05%), Зааральском
(зараженность 0,1 ±0,03%), Северо-Приаральском (зараженность
0,03±0,006%),
Урало-Эмбенском (зараженность 0,01±0,004%), в
Волго-Уральском, Кзыл-Кумском, Мойынкумском (0,04±0,01%).
В Прибалхашском автономном очаге 1 штамм возбудителя
листериоза был выделен от ондатры (Некрасова, с соавт., 1989).
Наиболее высокий процент зараженности (0,7±0,02%) отмечен в
Приаральско-Каракумском автономном очаге (Мека-Меченко,
1997).
21
22.
2223.
Зараженностьотдельных
видов
животных
листериозным микробом была в среднем не очень
высокой, но круг этих животных достаточно обширен.
Наиболее пораженным видом оказалась большая
песчанка
(зараженность 0,3 ±0,004 %),
а ее
зараженность в Приаральских Каракумах составила
1,3 ±0,05 %. Среди других видов грызунов, от которых
выделялся возбудитель листериоза были: малый
суслик
(0,03
±0,01%),
гребенщиковая
песчанка
(0,1 ±0,04%); единичные культуры выделялись от
полуденной песчанки,
общественной полевки,
ондатры. От двух особей емуранчиков, пойманных в
Устюртском автономном очаге выделены 2 культуры
возбудителя
листериоза
(Некрасова,
1989).
В
Мойынкумском автономном очаге исследовались
сайгаки
23
24.
В Казахстане возбудитель листериоза довольно широкораспространен среди грызунов в очагах чумы.
Зараженность грызунов составила:
Приаральско-Каракумском
0,7±0,02%
Устюртском
0,5±0,02%
Бетпакдалинском
0,2±0,05%
Зааральском
0,1±0,03%
Северо-Приаральском
0,03±0,006%
Урало-Эмбенском
0,01±0,004%
Волго-Уральском
0,04±0,01%
Кзыл-Кумском
0,04±0,01%
Мойынкумском
0,04±0,01%
В Прибалхашском автономном очаге 1 штамм
возбудителя листериоза был выделен от ондатры.
24
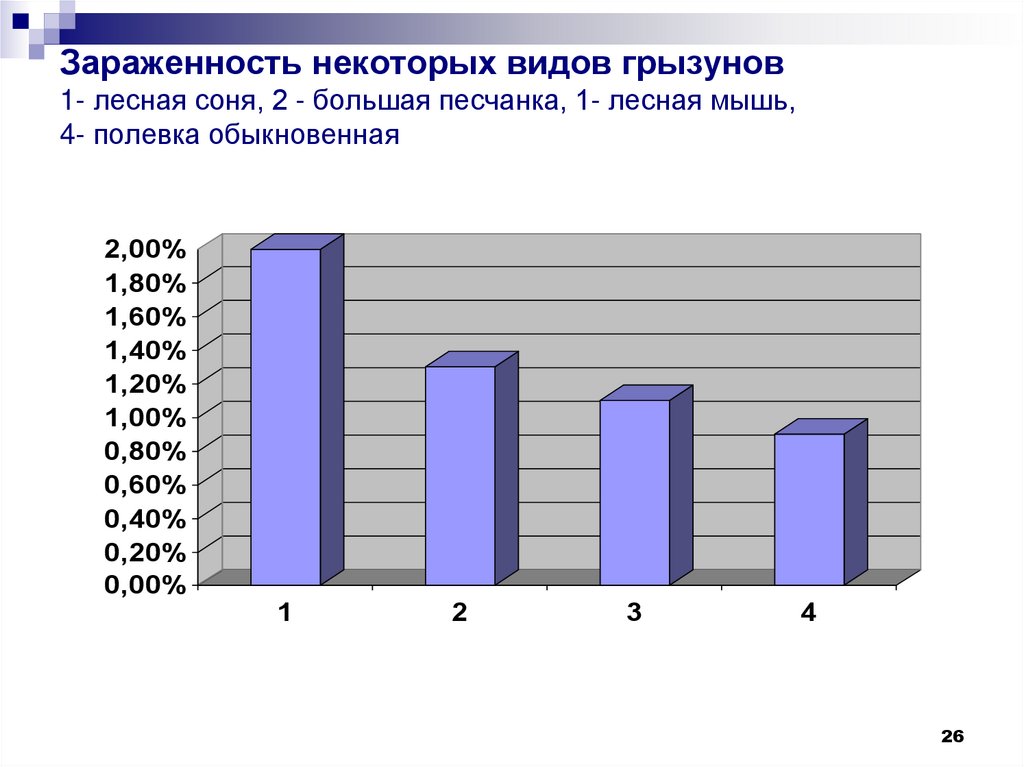
25.
В Казахстане листерии выделенысотрудниками КНЦКЗИ у 14 видов
грызунов: большой и гребенщиковой
песчанки, серебристой, обыкновенной и
общественной полевки, домовой и
лесной
мыши,
лесной
сони,
толстохвостого
тушканчика,
серой
крысы, ондатры, емуранчика, малого
суслика, полуденной песчанки .
25
26. Зараженность некоторых видов грызунов 1- лесная соня, 2 - большая песчанка, 1- лесная мышь, 4- полевка обыкновенная
2,00%1,80%
1,60%
1,40%
1,20%
1,00%
0,80%
0,60%
0,40%
0,20%
0,00%
1
2
3
4
26
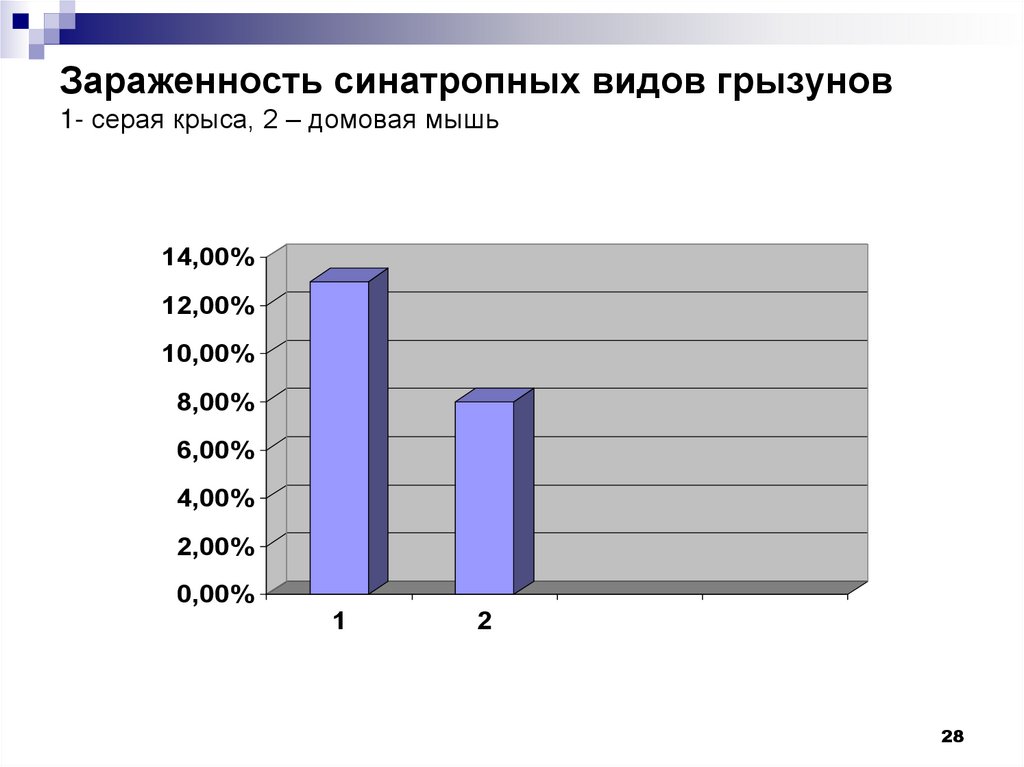
27.
Многочисленные исследования отечественных и зарубежныхавторов (Бакулов, 1967; Айзин с соавт., 1968 и др.)
свидетельствуют о том, что одним из основных резервуаров
листериозной инфекции являются синантропные грызуны.
Листерии были найдены синантропных у грызунов в
Алматинской (Степанов с соавт., 1988), Атырауской (Радченко,
1985), Актюбинской (Некрасова, 1989), Западно-Казахстанской
(Цепко, 1993), Кызылординской (Степанов с соавт., 1991),
Семипалатинской областей (Искаков, 1964). Зараженность
грызунов
возбудителем
листериоза в различных
областях
Казахстана различна. Выше всего она в
Кызылодинской области (0,9 ±0,06)
несколько
ниже
этот
показатель в Западно-Казахстанской (0,3±0,02%), Алматинской
(0,1±0,01%), Атырауской (0,07±0,00) и Актюбинской (0,03 ±0,005%)
областях.
27
28. Зараженность синатропных видов грызунов 1- серая крыса, 2 – домовая мышь
14,00%12,00%
10,00%
8,00%
6,00%
4,00%
2,00%
0,00%
1
2
28
29. Грызуны –резервуар листериозной инфекции. Это реальная угроза заражения листериозом сельскохозяйственных и людей. Синатропные
грызуны формируют в городахантропургические очаги листериоза.
Грызуны – фактор распространения листериоза
среди с/х животных, т.к. заражают корма и воду.
29
30.
Кроме того, листерии выделены отнасекомоядных (бурозубки).
Виды блох, от которых выделены
листерии в Казахстане:
N. fidus,
N. teratura,
X. hirtipes,
X. gerbilli minax.
30
31.
Чувствительны к листериознойинфекции и лабораторные
животные.
Листерии могут вызвать массовую
гибель этих животных
31
32. Листериоз у грызунов регистрируется в течение года. Инфицированность домовых мышей была выше весной, серых крыс – летом и
осенью.Штаммы листерий от синантропных
грызунов обладают высокой
вирулентностью (LD50 300 м.к.)
32
33.
В регионах Казахстана, гдерегистрировался листериоз среди
грызунов, его наблюдали и среди
сельскохозяйственных животных.
Зараженность составила:
МРС – 4,8%
Свиньи – 4,7
КРС – 3,5%
Лошади – ед. случаи
33
34.
3435.
Листерииобнаружены
в
различных
продуктах,
преимущественно
животного
происхождения, в том числе в продуктах
питания, готовых к употреблению.
Листерии, подобно иерсиниям, хорошо
сохраняются и размножаются при низких
температурах. В связи с этим благоприятные
условия для существования и размножения
листерии имеются в овощехранилищах и
хладокомбинатах,
где
поддерживаются
низкие температуры.
35
36.
Выделение листерий от куриных эмбрионов наодной из птицефабрик г. Алматы указывает на
трансовариальную передачу данной инфекции.
Зараженность куриных эмбрионов
возбудителем
листериоза создает значительную опасность для
населения.
36
37. Важную роль в зооантропонозной природе листериоза играет сохранение листерий в объектах внешней среды. Этот микроорганизм
удается выделить изпроб почвы и воды там, где регистрируется
листериоз грызунов.
37
38. Заражение листериями в естественных условиях происходит через: - пищеварительный тракт, - дыхательные пути, - поврежденную кожу
и слизистые оболочки половыхпутей.
Заражение человека происходит либо в результате
соприкосновения с больными домашними
животными, либо при употреблении в пищу мяса в
недостаточно термически обработанном виде, а
также молока, сыра, овощей. Заражение человека
происходит либо в результате соприкосновения с
больными домашними животными, либо при
употреблении в пищу мяса в недостаточно
термически обработанном виде, а также молока,
сыра, овощей.
38
39.
Значение пищевого пути передачи листериоза хорошоиллюстрируют данные Центров по контролю и профилактике
заболеваний (CDC, США), показавшие, что 11% всех продуктов,
хранящихся в домашних холодильниках, контаминированы
листериями!
У 64% больных листериозом в холодильнике был найден по
меньшей мере один продукт, контаминированный листериями. В
33% случаев выделенные штаммы L.monocytogenes от больных,
а также из продуктов, хранившихся в холодильнике, имели
идентичный молекулярно-генетический профиль при
рестрикционном анализе пульс-электрофорезом.
Наконец, более 30% спорадических случаев листериоза в США
были связаны с хранившимися в холодильнике мягкими сырами
или полуфабрикатами мясных продуктов!
39
40.
При исследовании пищевых продуктов авторами вКазахстане выявлена наибольшая
зараженность
листериозным микробом баранины.
Известен
случай семейной вспышки листериоза при разделке
зараженного мяса. Был также зарегистрирован факт
заражения листериозом трех членов одной семьи,
употреблявших в пищу салат из свежей капусты
(Мека-Меченко, 1997).
40
41. Проблема пищевого листериоза помимо медицинского приобретает и существенное социально-экономическое значение. Изъятие
зараженных партий продуктов изторговли, ограничение их ввоза и вывоза,
остановка производства наносят ущерб в
сотни
миллионов
долларов
США
и
европейским странам – экспортерам сыра и
мясных продуктов.
41
42. Крупнейшей и наиболее известной является вспышка листериоза в 1985 г. в Лос-Анджелесе (США),связанная с употреблением в пищу
Крупнейшей и наиболее известной являетсявспышка листериоза в 1985 г. в ЛосАнджелесе (США),связанная с употреблением
в пищу сычужного мексиканского сыра,
контаминированного
L.monocytogenes,
серотип 4в. Всего было выявлено 142
больных листериозом, из них 48 – со
смертельным исходом, 130 – с перинатальной
и неонатальной патологией. Эта и другие
вспышки, менее значительные по своим
масштабам, но также с высокой летальностью
исходов (20-44%), показали, что в самой
технологии приготовления ряда продуктов
содержится
опасность
контаминации
листериями и их размножения до высоких
42
концентраций.
43.
При листериозе у взрослых инкубационный периодварьирует от 11 до 70 дней.
Различают
следующие
клинические
формы
листериоза: кожная, бубонная, глазная, ангинозная,
пневмоническая,
генитальная,
нервная,
сепсис
новорожденных.
Заболевание может протекать как острая, подострая,
хроническая
или
абортивная
инфекции.
Симптоматика при листериозе обычно стертая, в
связи с чем его клиническая диагностика затруднена.
Несмотря на то, что клинически диагноз листериоза
предполагался не всегда, бактериологическими
методами довольно часто регистрируется листериоз.
43
44. В литературе нет данных о контагиозности при листериозе. Зараженный человек или носитель инфекции может быть источником только
при возникновении неонатальной иперинатальной патологии. Наблюдается
вертикальная передача от матери к плоду,
возможно заражение новорожденного при
прохождении через родовые пути.
Листерии выделяют из 5-6% образцов кала
здоровых людей.
44
45. Частота случаев оппортунистического листериоза не уступает, а, по данным ряда исследователей, превосходит таковую при
перинатальной и неонатальной патологии.Наиболее часто листериоз развивается на
фоне онкологических заболеваний, почечной
или сердечной недостаточности, диабета.
Листерии не являются ведущими возбудителями при
ВИЧ-инфекции. Но у этой группы пациентов листериоз
встречается в 150-300 раз чаще, чем в общей
популяции.
Разнообразные клинические проявления листериоза
на фоне снижения клеточного иммунитета при
лимфомах,
СПИДе,
беременности,
иммуносупрессивной
терапии
наряду
с
экспериментальными
данными
подтверждают
45
46. Особенно опасен листериоз беременнвх. Листериозная инфекция может развиваться на протяжении всего периода беременности, хотя
большаячасть случаев приходится на третий триместр. Болезнь,
как правило, протекает как средней тяжести течения
гриппоподобная инфекция. У рожениц, имевших в
анамнезе нарушения функции иммунной системы,
листериоз протекает особенно тяжело (диарея со
спазмами мышц живота, рецидивирующими болями) и
приводит к гибели плода.
Парадоксально, но поражение центральной нервной
системы – наиболее распространенная клиническая
форма листериоза – у беременных выявляется крайне
редко. Более 20% случаев перинатального листериоза
завершается внутриутробной гибелью плода.
46
47. Эндокардиты составляют 5-10% случаев листериозной инфекции у взрослых. Острый гастроэнтерит описывают при эпидемических
вспышкахлистериозного сепсиса и при поражении нервной
системы. У ранее здоровых людей листериозный
гастроэнтерит крайне редок.
В последние 10-15 лет наиболее значительный рост
числа случаев листериоза отмечается у лиц пожилого
возраста
на
фоне
сопутствующих
заболеваний,
иммуносупрессивной терапии. На фоне сопутствующих
заболеваний
или
иммуносупрессивной
терапии
выявляют такие клинические проявления листериоза,
как инфекция кожи, абсцессы печени и селезенки,
пневмония,
миокардит,
остеомиелит,
воспаление
суставов и др.
47
48.
За период 1993-2000 г. выявлено в г. Алматы 207 больных слабораторно подтвержденным диагнозом листериоза, у которых
клинически диагноз листериоза предполагался не всегда,
а
бактериологическими
методами
довольно
часто
удавалось
изолировать возбудитель листериоза.
У больных наблюдалась различная клиническая картина и
соответственно разнообразные
диагнозы:
пиодермия, ангина,
иерсиниоз, пастереллез и др. В 7,3±2,4% случаев у больных выявился
контакт с домашними животными, отмечена связь заболевания с
пищевыми продуктами в 26,8±7,7%,
зафиксированы 2 семейные
вспышки листериоза, в каждой заболели одновременно по 3 члена
семей.
У двух больных характер заболевания был профессиональным
(работница птицефабрики и фермер).
48
49.
Как известно, особенно тяжело листериоз протекает уноворожденных.
Следует особо выделить случаи бактериологически
подтвержденного врожденного листериоза у четырех
грудных детей в г. Алматы (один - с летальным
исходом); в трех случаях источником инфцирования
детей были их матери.
49
50. Терапия больных листериозом При листериозе терапией выбора является сочетание ампициллина [взрослые – 8-12 г/сут в 4 введения;
Терапия больных листериозомПри
листериозе
терапией
выбора
является
сочетание
ампициллина
[взрослые – 8-12 г/сут в 4 введения; дети –
200 мг/(кг·сут) в 4 введения] и гентамицина
[5 мг/(кг·сут) в 3 введения] в течение 2-6
нед в зависимости от клинических
проявлений.
При
наличии
противопоказаний
к
ампициллину
используют
монотерапию
котримоксазолом 15 мг/(кг·сут) в 3 введения
50
51.
Профилактика листериоза сводится к осуществлению общего комплексаветеринарно-санитарных мероприятий, соблюдению обычных мер
предосторожности при уходе за больными животными и птицами, а
также к проведению дератизации в жилых, складских помещениях, на
фермах и мясокомбинатах, к уничтожению бродячих собак и кошек,
защите источников воды от загрязнения их грызунами. В местах, где
выявлен листеhиоз животных необходим тщательный контроль
качества продуктов питания. Молоко следует допускать к употреблению
после термической обработки. В родильных домах соблюдают обычные
меры предупреждения распространения инфекции
в случаях
мертворождений или листреиозных заболевнаниях новорожденных.
Следует особо подчеркнуть
листериоз беременных женщин.
необходимость
обследования
на
Важно предварительное серологическое обследование беременных
женщин,
а
в случае
положительных находок и полное
бактериологическое обследование.
51
52. Биология и факторы патогенности листерий
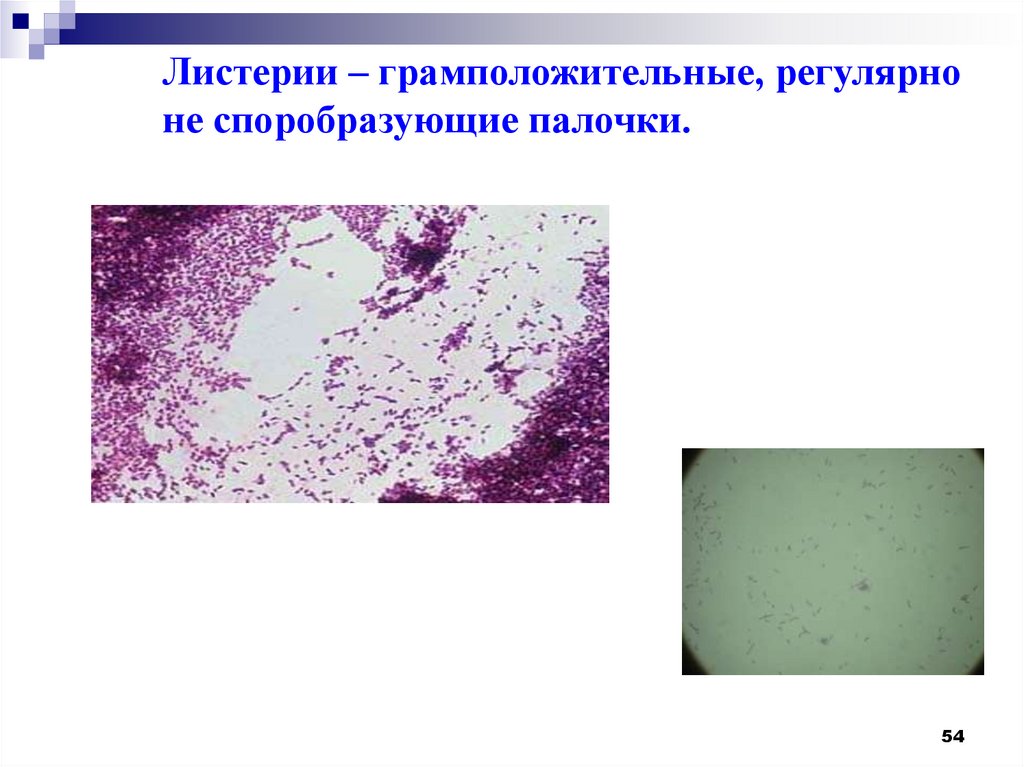
5253. Listeria monocytogenes – небольшая грамположительная неспорообразующая палочка, факультативный анаэроб
5354.
Листерии – грамположительные, регулярноне споробразующие палочки.
54
55.
Способность окрашиваться по Граму свойственнапреимущественно молодым культурам независимо
от питательной среды и условий культивирования,
старые же культуры имеют неопределенную окраску,
иногда даже грамотрицательную (Свинцов, 1946;).
Листерии могут вести себя
грам-лабильно в
зависимости от температуры их культивирования.
Клетки, выращенные при температуре +37 0 плохо
красятся по Граму, а выращенные при +2О 5о 0,
имеют грамположительную окраску.
55
56.
Суточные культуры листерий на чашках сагаром
представляют
собой
мелкие,
круглые, слабовыпуклые, с ровным краем,
полупрозрачные,
слабохромогенные
колонии, диаметром О,2 - О,4 мм
56
57.
S-форма листерий57
58.
Через 3-4 дня колонии увеличивается вдиаметре до 3 мм, приобретают сероватобелый цвет и неровные расплывчатые края.
Культура имеет характерный резкий запах
кислого молока, творога или сметаны
58
59.
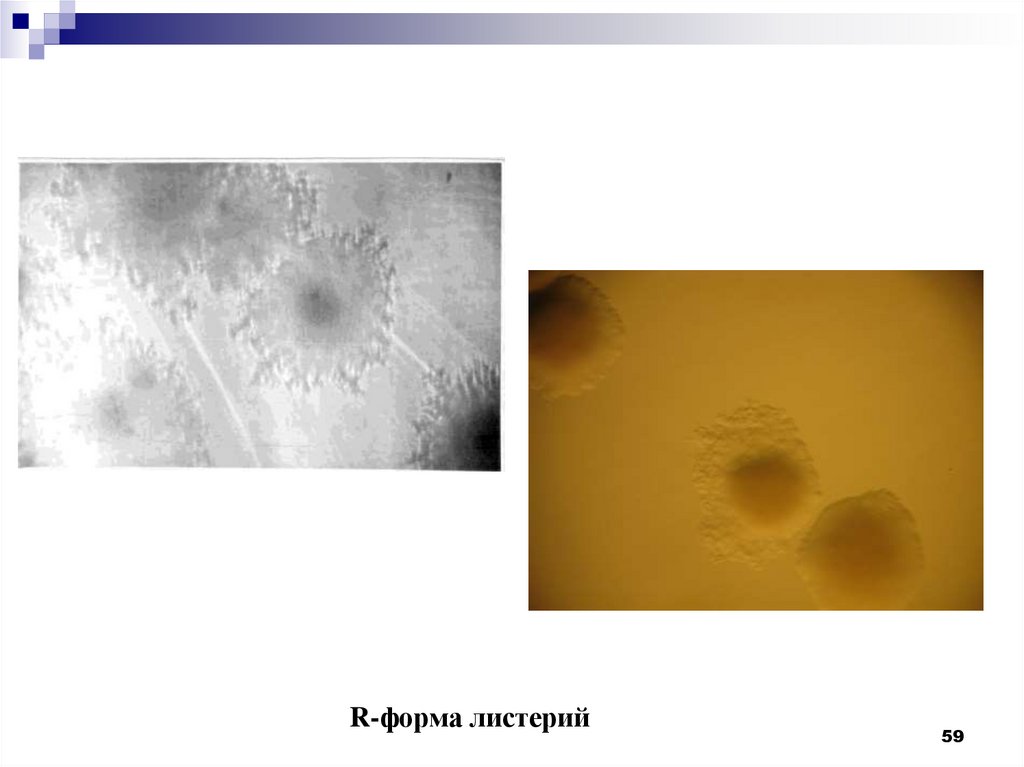
R-форма листерий59
60.
Придлительном
культивировании
появляются R-формы колоний, имеющие
шероховатую, гранулярную поверхность с
прозрачным
однородным центром
и
сплющенной
волнистой
или
зубчатой
периферией, при этом происходит потеря
вирулентности
и
гемолитической
активности, снижение агглютинабельности.
60
61.
R-форма листерий61
62.
6263.
Известны в настоящее время 6 видовлистерий:
L.monocytogenes
L.ivanovii
L.innocua
L.seeligeri
L.welshimeri
L. grayi
63
64.
4 вида листерий вызывают заболевания:только у людей - L.seeligeri
только у животных - L.innocua
патогенны для человека и животных L.monocytogenes, L.ivanovii
Подавляющее большинство заболеваний у людей
(98%) и животных (87%) обусловлено штаммами
L. monocytogenes.
64
65.
Факторы патогенности L.monocytogenesБелок
Молек.
масса, кДа
Ген
Функция
Prfa
27
prfa
Регуляция
транскрипции
генов вирулентности
Листериолизин О
58
hly
Лизис
первичной
вторичной фагосом
PICA
(фосфатидилинозитол
-специфичная
фофсфолипаза С)
36
plcA
Лизис фагосомы
Лецитиназа
33
plcB
Лизис вторичной фагосомы
Металлопротеаза
57
mpl
Посттрансляционная
модификация лецитиназы
ActA
67
actA
Полимеризация актина
88,65
inlA, inlB
Индукция фагоцитоза
Интерналин, InlB
и
65
66.
Подвижность, капсуло- и спорообразованиеЛистерии подвижны,
хотя
подвижность
их
выражена слабо. Вместе с тем - это важный
дифференциально-диагностический
признак,
отличающий
их
почти
от
всех
сходных
коринебактерий
и
возбудителя
рожи
свиней.
Подвижность наблюдается в течение первых суток
в случае выращивания культуры листерий в жидких
питательных средах при комнатной температуре не
выше +22 градусов (Seeliger et al., 1974).
66
67.
Спор листерии не образуют, а в отношении образованиякапсулы
имеются
различные
мнения.
Одни
исследователи считают, что листериям не свойственно
образование капсулы (Бакулов с соавт., 1959; Seeliger,
1968), другие (Smith et Mеtinger,
1963) напротив
настаивают на наличии мукополисахаридной капсулы у
листерий, кроме того, работы зарубежных авторов,
связанные с устойчивостью листерий при пастеризации
молока, наводят на мысль об образовании у них
капсулы,
которая и обеспечивает им высокую
устойчивость (Bockemuhi, 1967; Garayzаbal et al., 1986).
67
68.
Дыхание листерий и условия культивирования.Листерии факультативные анаэробы,
микроаэрофилы
(Бакулов,1967; Калишин, 1978; Вlobel, 1980).
Температурный диапазон роста листерий от +1 до +44 градусов, при
оптимуме в пределах между 30-37o С, однако культуры листерий
остаются жизнеспособными и при более высокой температуре (70-71
градусах С) (Калишин, 1978; Бакулов, 1978; Blobel, 1980; Олейник,
1981; Сомов, 1984).
Листерии могут расти на средах, содержащих до 10% хлористого
натрия, некоторые штаммы выдерживают даже 20-24% концентрации
поваренной соли (Эскин, 1976; Васильев, 1994; и др).
Листерии хорошо выдерживают низкие температуры.
68
69.
Листериозные бактериофаги.В 1945 г. был открыт первый
листериозный бактериофаг, после чего выделено 219 фагов
от
листерий, кроме L.murrayi и L.grayi (Ralovich, 1975). В настоящее
время описано 8 фаготипов листерий. Известно, что выделенные из
листерий бактериофаги по разному лизируют штаммы, относящиеся к
разным серогруппам ( Щеглова, 1963). Многим исследователям
удалось обнаружить фаги у листерий посредством ультрафиолетового
облучения и использовать их для обнаружения возбудителя (Бакулов
с соавт., 1984; Rocourt et al., 1985).
По данным Т.В.Мека-Меченко (1997) устойчивость к листериозным
фагам отмечена у 5,9±0,5% выделенных в Казахстане культур. Все
эти культуры по комплексу признаков идентифицированы как
фагоустойчивые штаммы листерий. У 5 музейных культур листерий со
сроком хранения более 3 лет также возникла устойчивость к действию
листериозного бактериофага, но после их пассажа через организм
белых мышей культуры вновь приобрели свойство лизироваться
фагом.
69
70.
Ферментативные свойства.Желатину листерии не разжижают (Сахаров, Гудкова,
1959; Seeliger, 1959 и др.). Через 1О-12 суток по уколу
в желатине образуется рост в виде мелких, пушистых
гранул, позднее, в отдельных случаях, в верхней
части укола могут появиться небольшие пучки очень
тонких пушистых нитей, отходящих перпендикулярно
от укола, но никогда не достигающих пышности,
свойственной
желатиновым
культурам
эризипелотриксов.
70
71.
Способность сбраживать углеводы и спирты улистерий
умеренная,
для
этой
цели
вполне
применимы обычные среды Гисса (Бакулов, 1967;
Котляров с соавт., 1973; Лемешкина, 1974; Гершун с
соавт., 1975).
Листерии ферментируют до кислоты:
глюкозу,
мальтозу, рамнозу, салицин, левулёзу, трегалозу,
замедленно разлагают глицерин, крахмал, некоторые
штаммы замедленно ферментируют сахарозу, маннит,
лактозу, восстанавливают нитраты в нитриты,
не ферментируют арабинозу, дульцит, инулин, сорбит,
раффинозу.
Листерии вызывают медленное кислотообразование
без свёртывания лакмусового молока, редуцируют
метиленовую синь.
71
72.
Листерии обладают каталазной активностью, невыделяют уреазу,
не образуют индол,
продуцируют ацетил-метил-карбинол.
Сероводород на обычных средах не образуют,
но выделяют его на средах с достаточным
количеством
серосодержащих
аминокислот
(Захаров с соавт., 1982; Головачева с соавт.,
1984). Листерии
каталазоположительны
и
оксидазоотрицательны.
72
73. Биохимические свойства Listeria monocytogenes
На рисунке представлены слева направо пробирки : 1,2 – глюкоза (аэробно,анаэробно), 3 - рамноза, 4 – мальтоза, 5 – салицин, 6 – сахароза, 7 –
денитрификация, 8 – раффиноза, 9 - арабиноза, 10 - ксилоза
73
74. Антигенные свойства. Современная антигенная схема рода "Листерия" состоит из 16 серовариантов, включающих 15 соматических и 5
Антигенные свойства.Современная антигенная схема рода
"Листерия" состоит из 16 серовариантов,
включающих 15 соматических и 5 жгутиковых
(флагеллярных) антигенов.
Известно не менее 16 сероваров
L.monocytogenes, большая часть случаев
заболеваний связана с сероварами 4b, 1/2а,
1/2b.
74
75.
На территории стран СНГ преобладающимиявляются листерии 1 серотипа, Значительно
реже - типа 4.
Кроме того, наряду с типичными в
серологическом отношении штаммами
встречаются культуры, имеющие в своем
составе антигены типов 1 и 4.
75
76. Серология видов рода Listeria Вид/Серотипы L.monocytogenes 1/2A, 1/2B, 1/2C, 3A, 3B, 3C, 4A, 4/AB, 4B, 4C, 4D, 4E, 7 L.ivanovii
5L.innocua
AB, 6A, 6B
L.welshimeri
6A, 6B
L.seelegeri
1/2B, 4C, 4D, 6B
76
77.
Чувствительность к антибиотикам. Влияние антибиотиковна листерии испытывалось в экспериментах как in vitro, так и in
vivo.
Данные по изучению чувствительности к антибиотикам
листерий (Мека-Меченко, 1997, Битюкова,1974), выявили в
большинстве случаев сходную чувствительность штаммов
листерий различного происхождения. Разброс
чувствительности по отношению к антибиотикам отмечен среди
штаммов, выделенных от людей.
Отмечена чувствительность листерий к ампициллину,
амоксициллину, гентамицину, сифлоксу, эритромицину,
тетрациклину.
77
78.
Вирулентность листерий.Вирулентность листерий для лабораторных
животных - это видовой признак. Листерии патогенны для многих видов
млекопитающих,
в том числе для грызунов,
насекомоядных, хищных,
копытных, а также для птиц. Но большинство видов животных проявляют к
листериозу умеренную чувствительность.
Среди лабораторных животных наиболее чувствительными к листериозу
являются белые мыши и морские свинки, кролики недельного возраста менее
чувствительны. Белые крысы являются весьма устойчивыми к возбудителю и
не могут быть удобной моделью при работе с листериозом (Малахов, 196О).
Патологоанатомические изменения
у
экспериментально заражённых
лабораторных животных сходны. Они проявляются, в основном, увеличением
печени и селезёнки с характерными серо-белыми узелками на органах.
Для оценки патогенности листерий используют также кератоконъюнктивальную
пробу. Для ее постановки они рекомендуют использовать кроликов и морских
свинок.
Вирулентные штаммы листерий
дают
положительную
кератоконъюнктивальную пробу и дермонекротическую пробы.
78
79.
Листериине
образуют
фибринолизина,
гиалуронидазы, плазмокоагулазы и ДНК-азы, но у них
определен фактор распространения (Котылев с соавт.,
1969; Котылев, 1974; Бакулов, 1974).
По мнению D.N.Prasad и R.K.
Gupta (1990)
вирулентность L.monocytogenes определяется 2
типами токсинов:
гемолизином и цитотоническим
холероподобным токсином,
а также фосфатазной
активностью.
79
80. Запомнить! Листерии – грамположительные палочки. Листерии ферментируют глюкозу (аэробно- и анаэробно), каталазоположительны,
Листерии–
Запомнить!
грамположительные
палочки.
Листерии ферментируют глюкозу (аэробно- и
анаэробно), каталазоположительны, оксидазоотрицательны. Оптимальная температура роста –
30-37oС, хотя листерии как психрофильные
микроорганизмы
могут
расти
в
широком
диапазоне температуры, начиная от +4oС.
При температуре 20-25oС листерии подвижны
(оптимум
22oС)
за
счет
образования
немногочисленных перитрихиальных жгутиков.
При температуре 37oС жгутики, как правило, не
образуются, и листерии неподвижны
80
81.
По данным Т.В. Мека-Меченко (1997), шаммы,выделенные в Казахстане
обладали достаточной
вирулентностью, (LD50 5600 микробных клеток).
Наибольшей
вирулентностью
обладал
штамм,
выделенный
из
мозга
барана,
высокая
вирулентность отмечалась у штаммов, выделенных
от больного человека, сайги, ондатры и домовой
мыши.
81
82. Лабораторная диагностика Листерии не относятся к числу микроорганизмов, культивирование которых представляет какие-либо
трудности.Для этого можно использовать
широкий спектр питательных сред
– мясопептонный агар, агар
Хоттингера, кровяной агар,
триптически-соевую среду и т. д.
82
83.
Постановка диагноза листериоза возможна только при использованиилабораторных методов исследований.
С целью лабораторной диагностики листериоза применяют биологический,
бактериологический и серологический методы.
Объекты исследования на листериоз разнообразны. к ним относятся трупы
павших или домашних животных, у которых для исследования берут кусочки
головного мозга, селезенки, печени, почек, легкого. Для исследований
необходимо забирать измененные участки органов с точечными некрозами,
кровоизлияниями или отечные.
В случае необходимости прижизненной диагностики листериоза у животных в
лабораторию направляют истечения из половых органов абортировавших
самок, молоко (при наличии мастита), кровь.
При подозрении на листериоз у людей исследованию подвергают кровь при
всех клинических проявлениях, слизь из носоглотки и зева - при ангинозной
форме, выделяемое из глаз - при глазной форме, ликвор – при менингитах и
энцефалитах, меконий – при заболеваниях новорожденных, околоплодную
жидкость, плаценту, отделяемое родовых путей – у женщин, родивших
мертвых или больных детей, а также другой материал в зависимости от
клинических проявлений листериоза.
83
84.
Бактериологический метод. Наиболее достоверным является выделениекультуры листерий из органов больных животных или при исследовании
патологического материала у больных людей Успех выделения возбудителя из
патологического материала зависит от периода и формы проявления болезни,
количества микроорганизмов в исследуемой пробе, от использованных
питательных сред и т.д.
Материал от больного должен быть взят в возможно более ранние сроки
заболевания (первые 7-10 дней) в достаточном количестве (кровь 5-10 мл,
спинномозговая жидкость - 2-5 мл) до применения
антибактериальной
терапии.
Рост листерий в посевах подавляет сопутствующая
микрофлора,
размножающаяся быстрее листерий, поэтому материал, в котором может
содержаться смешанная микрофлора (слизь из зева, мазки из влагалища, кал,
меконий), рекомендуют высевать на питательные среды с добавлением
ингибиторов (полимиксин,
теллурит калия,
налидиксовая кислота,
трипафлавин).
Листерии неприхотливы к питательным средам. Рост может быть ускорен
благодаря добавлению крови (дефибринированной или гемолизированной),
84
глюкозы, сыворотки.
85.
Вспомогательное значение имеет бактериоскопический метод,особенно при исследовании спинномозговой жидкости и мекония,
т.е. в тех случаях, когда исследуемый материал не содержит других
возбудителей.
При листериозе новорожденных в мазках из мекония обнаруживается
большое количество грамположительных палочек. Обнаружение
грамположительных, иногда кокковидных, коротких палочек говорит о
подозрении на листериоз.
Специфичность такого исследования повышается при использовании.
85
86. Выделение возбудителя из клинического материала и продуктов питания оказалось малоэффективным без селективных компонентов и
методов. Поэтому в 80-е годы былисозданы селективные среды и методы,
значительно повышающие
эффективность выделения и
сократившие сроки идентификации
L.monocytogenes
86
87.
Агглютинабельностьспецифическими
сыворотками.
Принадлежность выделенных культур к листериям
подтверждала положительная реакции агглютинации на
стекле
с
рабочим
разведением
поливалентной
агглютинирующей
листериозной
сывороткой.
95,6%
штаммов были отнесены к I серовару, серовар не удалось
определить у 4,4% штаммов, выделенных от грызунов.
Следовательно преобладающее большинство изученных
культур листерий вне зависимости от источника их
выделения относились к первому серовару.
87
88.
Биологический метод.При исследовании материала,
загрязненного посторонней микрофлорой и особенно при
незначительном обсеменении его листериями необходимо
использовать биологический метод. Он позволяет
выделить листерии с большей вероятностью, поскольку в
ряде
случаев
в
первых
генерациях
данные
микроорганизмы плохо
приспосабливаются
к
искусственным питательным средам. Для биологической
пробы обычно используют белых мышей.
Чувствительность метода биопробы можно повысить
путем однократного введения мышам кортизона или
гидрокортизона.
88
89.
Идентификация культур листерий.По краткому определителю Берги
(198О) для рода Listeria характерно образование кислоты из глюкозы,
наличие каталазной активности, гидролиз эскулина. Индол листерии не
образуют, мочевину,желатину, казеин, молоко не гидролизуют.
Johnson S.L. et al. (1992) предложили новый метод характеристики листерий
с использованием биохимичекой панели. С помощью этой панели можно
изучать 95 фенотипических признаков в течение минимального времени (4
часа инкубации).
89
90.
ПризнакиL.monocytogenes
L.grayi
L.innocua
L.ivanovii
L.seeligeri
L.welshimeri
b-Гемолиз
+
-
-
+
+
-
САМР-тест
(Staphylococcus
aureus)
+
-
-
-
+
-
САМР-тест
(Rhodococcus equi)
±
-
-
+
-
-
маннитола
-
+
-
-
-
-
a-метил-Dманнозида
+
+
+
-
-
+
L-рамнозы
+
±
d
-
-
d
растворимого
крахмала
-
+
-
-
D-ксилозы
-
-
-
+
+
+
Гидролиз гиппурата
+
-
+
+
Восстановление
нитрата
-
±
-
-
Патогенность для
мышей
+
-
-
+
-
-
Образование кислоты из:
"+" – 90% и более штаммов положительные; "–" – 90% и более штаммов отрицательные;
d – 11-89% штаммов положительные;
пробел означает, что определений не проводили;
"±" – вариабельный результат
90
91.
Серологические методы диагностики.За последнее десятилетие возросла диагностическая ценность
серологических реакций. Использование бактериологического метода
диагностики для раннего выявления заболевания мало эффективно изза длительности исследования и трудности выделения возбудителя,
методы серологической диагностики, напротив, позволяют
быстро
поставить предварительный диагноз.
Применяются реакция иммунофлюоресценции (экспресс-диагностика),
РА на стекле и объемная, РСК, РНГА.
91
92. Специфика антигенной структуры листерий повлияла и на разработку экспресс-методов диагностики листериоза и выявления
возбудителя в продуктахпитания.
Молекулярные
методы
экспрессдиагностики листериоза разрабатываются
с
большей
интенсивностью,
чем
иммунологические.
Тем не менее в практике отечественных
бактериологов серологические методы
остаются основными. Они чаще всего
используются как методы лабораторной
диагностики листериоза.
92
93. В России для серологической диагностики используют препараты для РСК, выпускаемые НИИ ветеринарной вирусологии и микробиологии
(г. Покров,Владимирская
обл.),
и
РНГА,
разработанные Омским НИИ природноочаговых
болезней.
КНЦКЗИ
выпускает
листериозный
антигенный
эритроцитарный
диагностикум.
93
94. Метод холодового обогащения при температуре +4oС, основанный на психрофильности листерий, весьма эффективен, но из-за
длительных сроковинкубации (10-60 дней) не может быть
рекомендован
для
клинической
диагностики.
В современных схемах выделения
листерий обычно используют инкубацию
при температуре 30oС в течение 24-48 ч в
бульоне с селективными добавками для
обогащения исследуемого образца
94
95. Среди широкой гаммы селективных агентов, использовавшихся в разное время для выделения листерий, наибольшее значение сохраняют
ингибиторы сопутствующей микрофлоры идифференцирующие индикаторы:
Основные селективные агенты, используемые при
выделении листерий
Теллурит калия
Налидиксовая кислота
Хлорид лития
Акрифлавин
Эскулин
Красители (фенилрот)
Антибиотики (цефтазидим, полимиксин B)
Циклогексимид
95
96. Наибольшее распространение за рубежом для выделения листерий получили Оксфорд агар и PALCAM агар
9697. В состав Оксфорд агара входят следующие селективные добавки (в г/л): эскулин – 1,0 цитрат железистого аммония – 0,5
В состав Оксфорд агара входят следующиеселективные добавки (в г/л):
эскулин – 1,0
цитрат железистого аммония – 0,5
хлорид лития – 15,0
циглогексимид – 0,4
колистин – 0,02
акрифлавин – 0,005
цефотетан – 0,002
фосфомицин – 0,01
В состав PALCAM агара входят (в г/л):
эскулин – 0,8
цитрат железистого аммония – 0,5
хлорид лития – 15,0
акрифлавин – 0,005
полимиксин В – 0,01
цефтазидим – 0,02
фенилрот – 0,08
97
98. Схемы выделения листерий в зависимости от степени контаминации и количества листерий в исследуемом материале включают либо
непосредственныйвысев на селективный агар, либо
обогащение исследуемого образца
на
селективном
бульоне
при
температуре 30oС в течение 24-48 ч
с
последующим
высевом
на
селективный агар.
98
99. На Оксфорд агаре вырастают черные колонии L.monocytogenes, окруженные черным ореолом. На PALCAM агаре колонии листерий
На Оксфорд агаре вырастают черныеколонии L.monocytogenes, окруженные
черным ореолом.
На PALCAM агаре колонии листерий серозеленые с черным вогнутым центром.
Для них также характерен черный ореол
на красном фоне агара. Последующий
анализ
характерных
колоний,
утилизирующих эскулин (в результате
чего и происходит почернение среды),
позволяет на основании ограниченного
числа тестов идентифицировать культуру
L.monocytogenes
99
100.
100101. Помимо теста на подвижность методом укола в полужидкий агар при комнатной температуре (листерии подвижны при температуре 22oС и
неподвижны при 37oС)особое
значение
имеют
тесты,
позволяющие
идентификацию
L.monocytogenes
совмес-тить
с
дифференциацией
от
других
непатогенных для человека листерий
L.monocytogenes ферментирует рамнозу
и не утилизирует ксилозу и маннит,
обладает b-гемолитической активностью
на кровяном агаре.
101
102. Весьма информативен САМР-тест, в котором культура L.monocytogenes дает положительную реакцию, образуя зону усиления гемолиза с
гемолитическимштаммом Staphylococcus aureus и, в
большинстве случаев отрицательную с
Rhodococcus equi на чашках с кровяным
агаром
102
103. Для идентификации листерий в качестве дополнительных тестов используют агглютинацию с поливалентной листериозной сывороткой и
фаготипированиес
помощью
диагностического
набора
типовых
листериозных бактериофагов (L2A и L4A),
лизирующих 60-80% выделенных культур
листерий
103
104. Для ускоренной идентификации листерий можно использовать идентификационные системы АРl Listeria (Биомерье, Франция) и их
аналоги. В связи со значительными недостатками серо- ифаготипирования листерий большое внимание уделяется
молекулярному
типированию
штаммов
L.monocytogenes.
Применение пульс-электрофореза и полимеразной цепной
реакции (ПЦР) представляется наиболее перспективным для
типирования вирулентных штаммов листерий, хотя их
использование в рутинной бактериологической практике пока
ограничено
104
105. Спасибо за внимание!
Вопросы?105

































































































 medicine
medicine








