Similar presentations:
Протолиттік тепе-теңдік және процестер. Буферлік ерітінділер. №5 cабақ
1.
№5 CАБАҚПРОТОЛИТТІК ТЕПЕ-ТЕҢДІК
ЖӘНЕ ПРОЦЕСТЕР.
БУФЕРЛІК ЕРІТІНДІЛЕР
2.
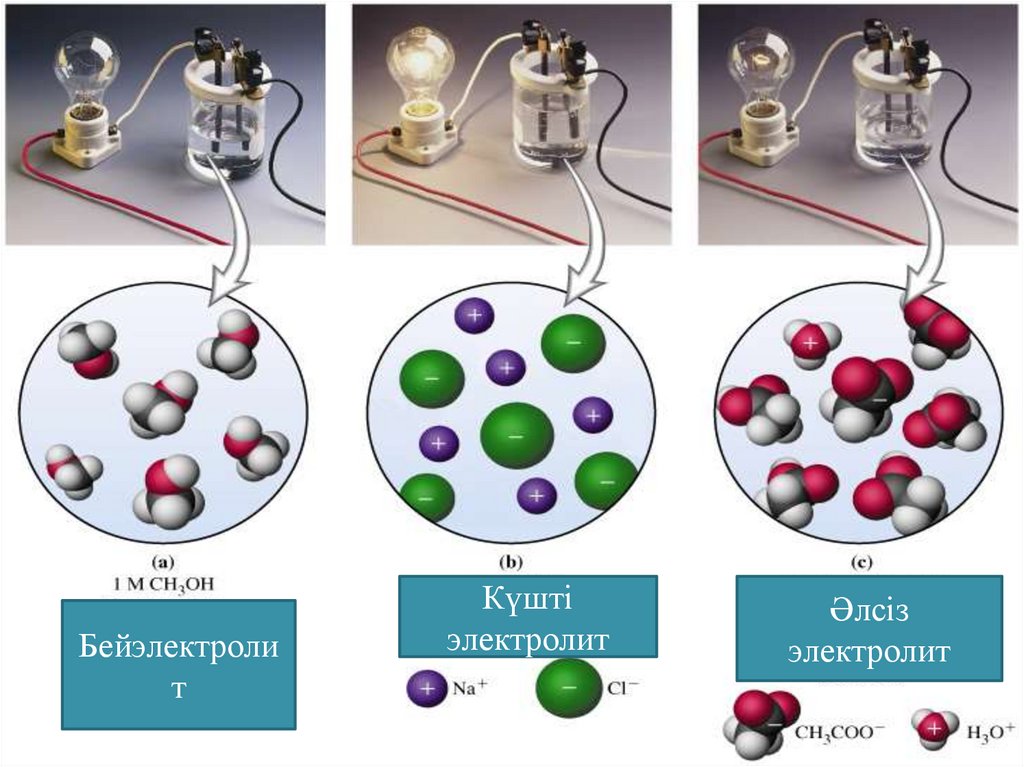
Электролиттердің жіктелуіКөптеген химиялық реакциялар ерітінділер арасында жүреді.
Ерітінділерді электролиттер деп те атайды. Электролиттер деп
еріткіш молекулаларының әсерінен иондарға ыдырап, ерітінділері
не балқымалары электр тогын өткізетін заттарды айтады.
3.
Бейэлектролит
Күшті
электролит
Әлсіз
электролит
4.
Электролиттердің ерекшеліктері:1.Ерітінділері электр
тогын жаксы өткізеді.
2.Электролиттердің
концентрациясы бірдей
ерітінділер буының
қысымы төмен, қайнау
температурасы жоғары,
қату температурасы
төмен.
3.Электролит
ерітінділерінің осмос
қысымы жоғары.
5.
6.
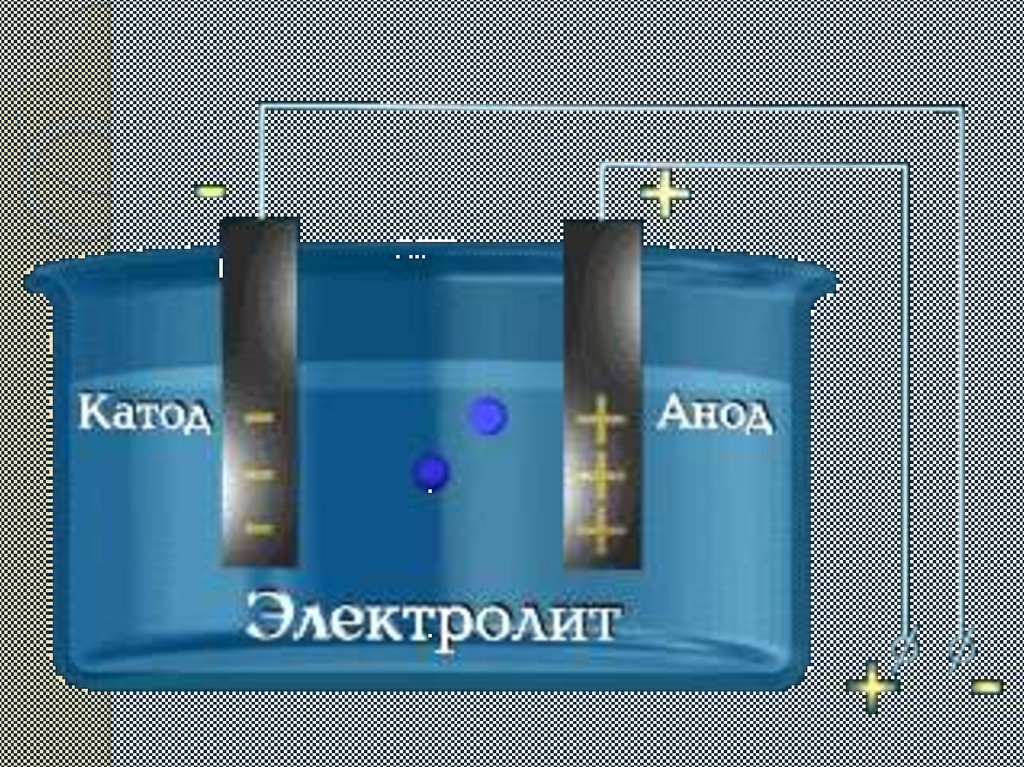
Диссоциация туралы жалпы түсінікЭлектр тоғын өткізетін заттар электролиттер, ал өткізбейтін
заттар бейэлектролиттер болады. Электролит ерітінділеріндегі
кездесетін ауытқуларды швед химигі С. Аррениус ұсынған
электорлиттік диссосация теориясы түсіндірді. Бұл теорияның
негізі мынада:
1.Электролиттік диссоциация-электролиттердің суда ерігенде
оң және теріс зарядталған иондарға ыдырауы.
2.Электр тоғының әсерінен теріс полюсқа оң зарядталған
иондар жылжиды(катиондар), ал оң полюсқа теріс
зарядталған иондар жылжиды(аниондар).
3.Диссоциация – қайтымды процесс. Молекулалардың
иондарға ыдырау процесімен қатар иондардың молекулалар
процесі
жүреді.(ассоциация).
Диссоциация
теңдеуін
құрғанда тепе-теңдік белгісін қояды (=). Мысалы КА
затының диссоциациясын былай жазуға болады:
КА =К++А-
7.
Электролиттік диссоциация теориясыЭлектролиттердің
еру
немесе
балқу процессі
электр тогын өткізе алатын
зарядталған бөлшектер түзе жүретін процесс.
Электролиттік
диссоциация
ерітіндідегі
электролиттер полярлы еріткіштердің әсерінен
иондарға
ыдырауы.
Иондар
атомдардан
ерекшеленеді.Ерітіндіде иондар ретсіз қозғалады.
Тұрақты электр тогы әсерінен электролит
ерітіндісіндегі иондар бағытталып қозғалады:
катиондар катодқа, аниондар анодқа тартылады.
С. А. Аррениус (1859- 1927)
8.
Электролиттік диссоциация дәрежесі (α) иондарғаыдыраған
молекулалардың
электролит
молекулаларының жалпы санының қатынасына тең
шама.
Мұнда
n
–
иондарға
ыдыраған
молекулалардың саны. N0 -жалпы молекулалардың
саны.
Күшті электролиттерге α › 0,3 (немесе 30%)
жоғары, ал әлсіз электролиттер үшін α
≤
0,03(немесе 3%), орташа электролиттер олардың
диссоциациялану
дәрежелері
3%
пен
30%аралығында
болады.
Электролиттік
диссоциациялану дәрежесі концентрацияға тәуелді,
концентрация төмендеген сайын α жоғарлайды.
9.
Оствальдың сұйылту заңыЭлектролиттік диссоциация дәрежесі мен диссоциация
тұрақтысының өзара байланысы сандық түрде
Оствальдтың сұйылту заңы деп аталатын теңдеуімен
беріледі:
K = α2 C/ 1- α
Әлсіз электролиттер үшін α шамасын ескермеуге болады,
онда 1-α =1 деп алса, теңдеу мына түрде жазылады:
КД ═ α2 ∙ С
Вильгельм Оствальд
10.
Электролиттік диссоциация константасыӘлсіз электролиттің иондарға ыдырау
қабілеттілігін көрсетеді.
11.
Әлсіз электролиттердің диссоциациясы қайтымдыпроцесс болғандықтан әрекеттесуші массалар заңына
бағынады: К=[H+][CH3COO-]/[CH3COOH];
К - диссоциациялану константасы.
Көп қышқылды негіздер мен көп негізді қышқылдар
біртіндеп (сатылап) иондарға ыдырайды және
сатының
әрқайсысына
тиісті
мәні
бар
диссоциациялану константасы сәйкес келеді.
H2CO3 H+ + HCO-3 К1 =4,5 10-7
HCO-3 H+ + CO32К2=4,7 10-11
12.
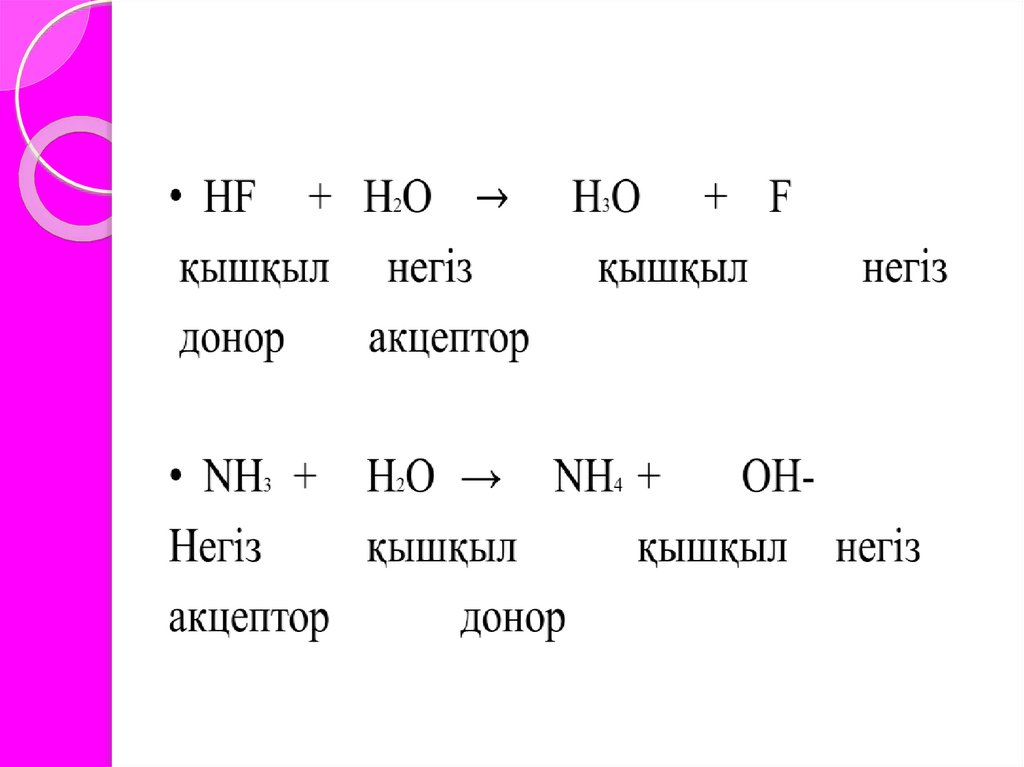
Қышқылдар мен негіздердің Аррениусжәне Льюис бойынша ілімі.
Льюс анықтамасы бойынша қышқыл болатын
қосылыстар өзіне электрон жұбын қосып алуға
қабілетті, ал негіздер – электрон жұбын беруші
қосылыстар.Мұндай әрекеттесудің нәтижесінде
коваленттік байланыс түзіледі.
13.
Льюис теориясы бойыншақышқылдар дегеніміз жұп электрон
қосып алып коваленттік байланыс
түзетін қосылыс(акцептор), негіздер
осы коваленттік байланыс түзу үшін
жұп электрондарын бере алатын
қосылыстар(донор).
14.
Қышқылдар мен негіздердің протолиттікілімі
1923 жылы Бренстед және ағылшын химигі Лоури
қышқылдар мен негіздердің протолиттік ілімін
ұсынды. Протолиттік ілім бойынша, қышқылдар
дегеніміз- иондану нәтижесінде протондар
түзетін, ал негіздер дегеніміз протонды қосып
алатын қосылыстар
15.
16.
Бренстед және Лоури (1923 ж.) ұсынған протолиттiктеория. Бұл теория бойынша протонды беретiн заттар
қышқылдар, ал протонды қосып алатын заттар негiздер деп
аталады. Протонның доноры мен соған сәйкес келетiн
протонның акцепторы қабысқан қышқылды–негiздiк жұп
түзедi.
Протолиттiк теориядан мынадай қорытындылар жасалады :
1.Қышқыл мен негiздiң ролiн иондар мен бейтарап
молекулалар атқаруы мүмкiн.
2.Бiр зат белгiлi бiр жағдайларға байланысты қышқыл
немесе негiз бола алады.
3.Қышқыл мен негiздiң әрекеттесуi нәтижесiнде жаңа
қышқыл мен негiз түзiледi.
17.
Сутектік көрсеткіш дегеніміз терістаңбамен алынған сутегі иондарының
концентрациясының ондық логарифмін
айтады.
pH = - lg [ H+]
Сутектік көрсеткіш түсінігін 1909 жылы
дат химигі Серенсен енгізді.
рН арқылы ерітінділердің реакциясы
былай сипатталады:
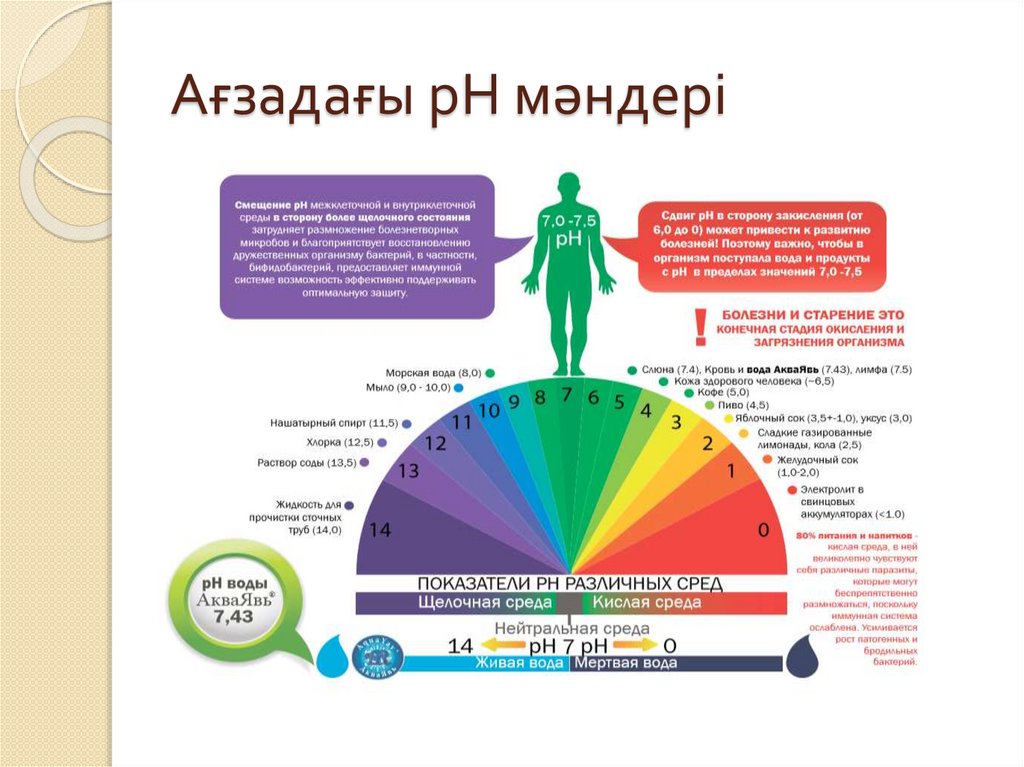
Нейрал орта рН = 7
Қышқыл орта рН < 7
Сілтілі орта рН > 7
18.
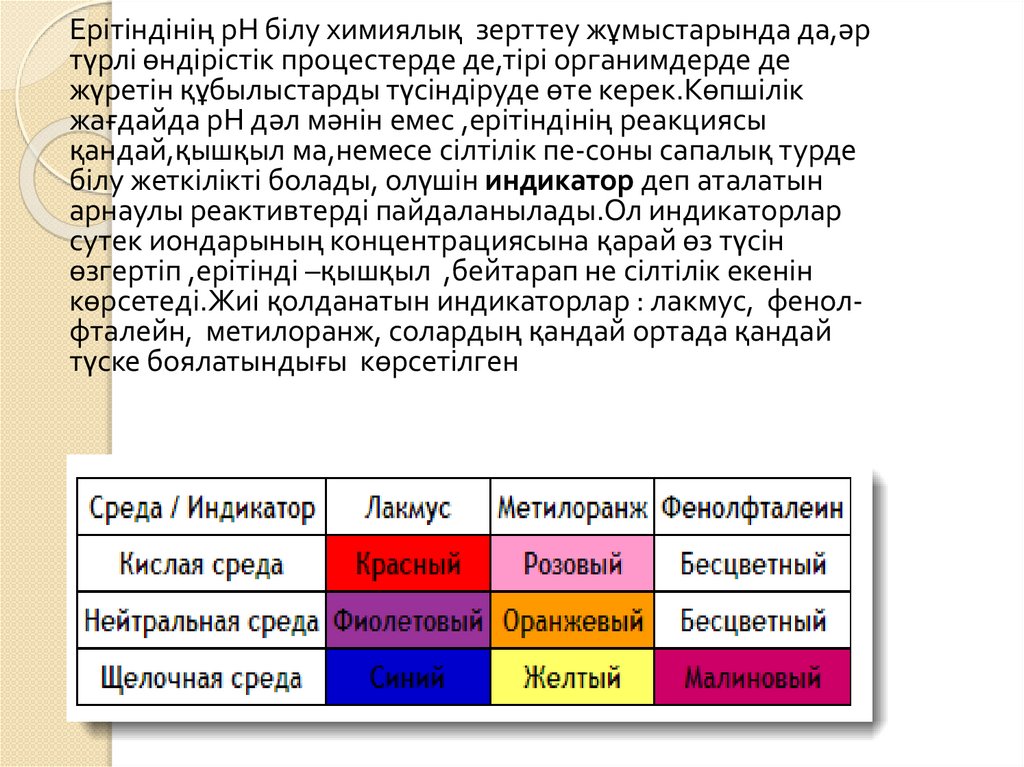
Ерітіндінің рН білу химиялық зерттеу жұмыстарында да,әртүрлі өндірістік процестерде де,тірі органимдерде де
жүретін құбылыстарды түсіндіруде өте керек.Көпшілік
жағдайда рН дәл мәнін емес ,ерітіндінің реакциясы
қандай,қышқыл ма,немесе сілтілік пе-соны сапалық турде
білу жеткілікті болады, олүшін индикатор деп аталатын
арнаулы реактивтерді пайдаланылады.Ол индикаторлар
сутек иондарының концентрациясына қарай өз түсін
өзгертіп ,ерітінді –қышқыл ,бейтарап не сілтілік екенін
көрсетеді.Жиі қолданатын индикаторлар : лакмус, фенолфталейн, метилоранж, солардың қандай ортада қандай
түске боялатындығы көрсетілген
19.
Кейбір ерітінділердің рН мәндері:Асқазан шырыны рН=1,7 (күшті
қышқылдық реакция)
Шымтезек суы
рН =4 (әлсіз
қышқылдық реакция)
Жаңбыр суы
рН=6 (әлсіз
қышқылдық реакция)
Құбыр суы
рН=7,5 (әлсіз сілтілік
реакция)
Қан
рН=7,4 (әлсіз сілтілік)
Сілекей
рН=6,9 (әлсіз
қышқылдық)
Көз жасы
рН =7 (бейтарап
реакция)
20.
21.
22.
1.8 10 -5Мыс. : 0.1 M CH 3 COOH (HAc), h =
100 1.32%.
0.1
[ H ] 1.8 10 -5 0.1 1.33 10 3 M .
рН 2.88.
23.
Мыс.: 0.1 M H3PO4,h
7 10 3
100 27% 5%.
0.1
7 10 3 ( 7 10 3 ) 2 4 7 10 3 0.1
[H ]
2.33 10 2 M .
2
pH 1.63.
24.
Тірі ағзадағы электролиттер25.
Ағзадағы рН мәндері26.
(рН=3.75 - 4.75)[H ] Ka
НА / А (кыш.буфер )
[ HAc]
CHAc
5 0.1
K
1
.
8
10
1.8 10 5 M .
a
[ Ac ]
CNaAc
0.1
рH pK a lg
CHA
C A
(рН=8.25 - 9.25)
NH4Cl + NH3
NH 3 H 2O NH 4 OH (1)
NH 4 H 2O NH3 H 3O (2)
[OH ] Кb
[ NH 4 ] [OH ]
Кb
.
[ NH 3 ]
CNH 3
[ NH3 ]
5 0.1
К
1
.
8
10
1.8 10 5 M .
b
[ NH 4 ]
CNH
0.1
pOH 4.75.
4
В / ВН (нег.буфер)
pH 4.75.
pH pKW pKb lg
CB
.
CBH
pH 9.25.
27.
28.
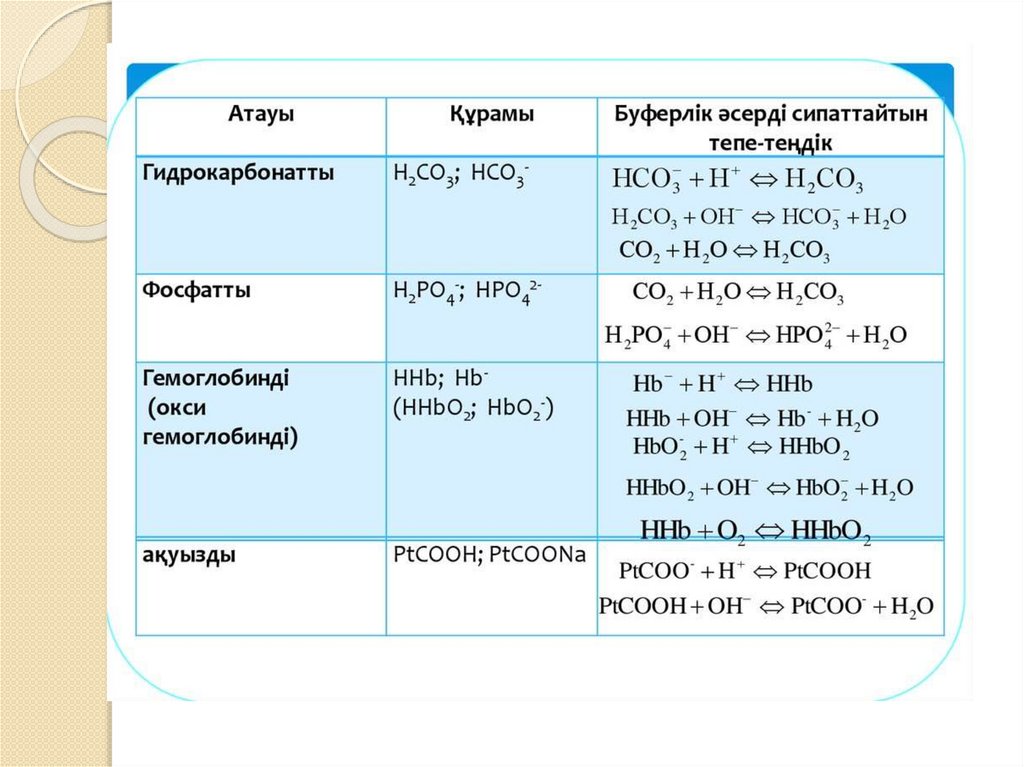
Буферлік жүйелер мен ерітінділертуралы түсініктер, олардың құрамы
және жіктелуі
Сұйылтқанда немесе қышқыл не сілті қосқанда рН–ы
өзгермейтiн ертiндiлер буферлiк жүйелер деп аталады.
Буферлiк жүйенiң құрамында протонның доноры және
протонның акцепторы болады. Құрамына байланысты
буферлiк жүйелер қышқылдық, негiздiк және амфолиттiк
болып бөлiнедi.
Қышқылдық буферлiк жүйе донор болып есептелетiн әлсiз
қышқылдан және акцептордың ролiн атқаратын анионы бар
осы қышқылдың тұзынан тұрады. Мысалы, ацетатты,
бикарбонатты буферлік жүйелер.
29.
30.
Негіздік буферлік жүйе әлсізнегізден (акцептор) және осы
негiздiң катионы (донор) бар
тұздан
тұрады.
Мысалы,
аммиакты буферлік жүйе.
Ацетатты:
CH3COOH – протонның
доноры;
CH3COO– – протонның
акцепторы.
Бикарбонаты:
H2CO3 – протонның
доноры;
HCO3– – протонның
акцепторы.
NH4OH
–
протонның
акцепторы;
NH4+ – протонның доноры.
31.
Буферлер құрамына қарай з кебөлінеді
Қышқыл
дық
Негiздiк
Амфолитт
iк
32.
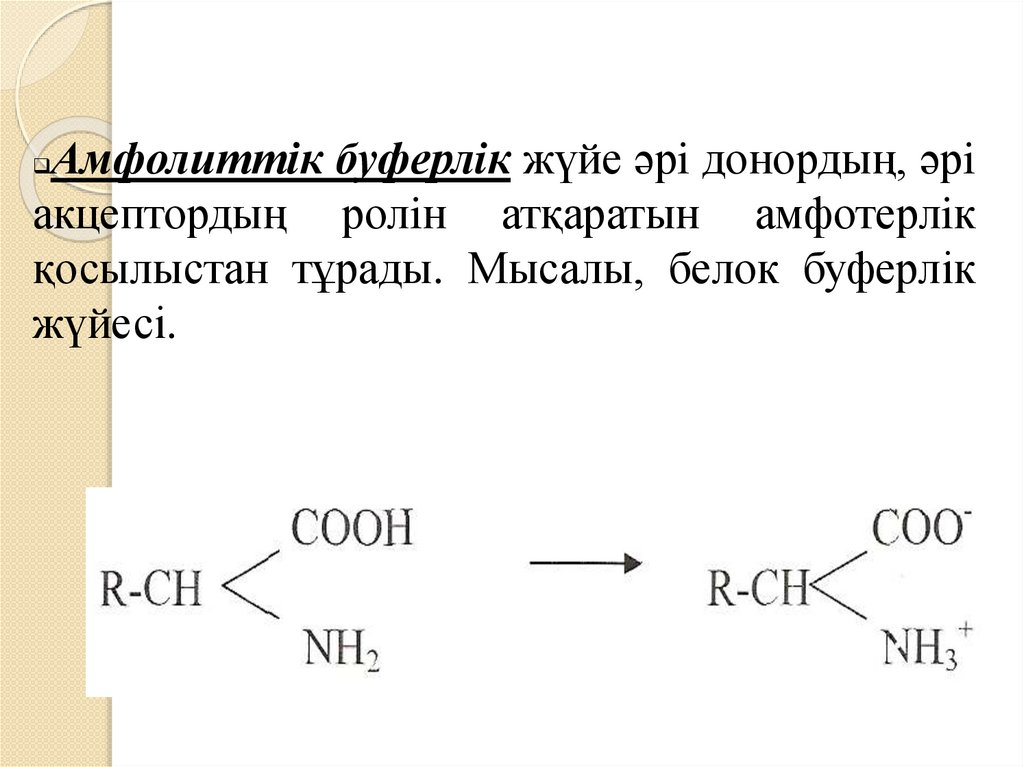
Амфолиттік буферлiк жүйе әрi донордың, әрiакцептордың ролiн атқаратын амфотерлiк
қосылыстан тұрады. Мысалы, белок буферлік
жүйесі.
33.
Маңызды буферлі ерітінділердідайындау
34.
Буферлiк жүйелердiң рН–ына әсер ететiнфакторлар
Буферлiк ертiндiлердiң рН–ы Гендерсон–Гассельбах теңдеуi бойынша
анықталады.
Қышқылдық буферлiк ертiндiлердiң рН–ы мына теңдеумен
есептеледi:
немесе
Негiздiк буферлiк ерiтiндiлер үшiн мына теңдеу қолданылады:
35.
Буферлiк ерiтiндiлердiң әсер ету механизмiнiң жалпықағидалары
Күштi қышқыл немесе сiлтi
қосқанда буферлiк жүйелердегi
сутегi
иондары
концентрациясының
өзгермеуi
олардың негiзгi қасиетi болып
табылады.
Күштi
қышқыл
қосқанда сутегi иондары буферлiк
жүйедегi протонның акцепторымен
әрекеттеседi, соның нәтижесiнде
сутегi
иондарының
концентрациясы өзгермейдi. Сiлтi
қосқанда
гидроксид–иондар
буферлiк
жүйедегi
протонның
донорымен
әрекеттеседi,
сол
себептi рН өзгермейдi. Мысалы:
Негiздiк буферлiк жүйеде бұл
процесс былай жүредi:
NH4OH + HCl = NH4Cl + H2O
NH4OH + H+ + Cl– = NH4+ + Cl– +
H2O
NH4OH + H+ = NH4+ + H2O
NH4Cl + NaOH = NH4OH + NaCl
NH4+ + Cl– + Na+ + OH– = NH4OH + Na+ +
Cl–
NH4+ + OH– = NH4OH
36.
Қышқылдық буферлiк жүйелердегi қорғаныс процесiнбылай көрсетуге болады, мысалы :
СН3COONa + HCl = CH3COOH + NaCl
CH3COO– + Na+ + H+ + Cl– = CH3COOH + Na+ + Cl–
CH3COO– + H+ = CH3COOH
Буферлiк жүйе күштi қышқылды әлсiз қышқылға айналдырады, сол
себептi рН онша өзгермейдi.
CH3COOH + NaOH = CH3COONa + Н2О
CH3COOH + Na+ + OH– = CH3COO– + Na+ +
H2O
CH3COOH + OH– = CH3COO– + H2O
Буферлiк жүйе OH– ионды суға айналдырады, сол себептi pH өзгермейдi.
Осылайша, кез келген буферлiк жуйеге күштi қышқыл қосқанда буферлiк
ерiтiндiдегi протонның акцепторы, ал сiлтi қосқанда протонның доноры
буферлiк жүйенi қорғайды.
37.
Организмнің буферлiк жүйелерi. Бикарбонаттықжәне фосфаттық буферлiк ерiтiндiлердiң әсер ету
механизмi
Организмде биологиялық орталардың қышқылдылығын тұрақты ұстап
тұратын тең процестер болады. Олардың тұрактылығы буферлiк
жүйелердiң әсер ету механизмiмен тiкелей байланысты.
Бикарбонаттық
буферлiк
жүйе
қан
плазмасының негiзгi жүйесi болып есептеледi.
Бұл жүйе әлсіз көмiр қышқылынан (К = 3,3·10–7)
және нaтрий бикарбонатынан тұрады.
H2CO3 – протонның доноры;
HCO3– – протонның акцепторы.
Қандағы буферлiк қатынас мынадай:
H2CO3 = 1
NaHCO3 = 20
38.
Қышқыл заттар көп мөлшерде қанға бөлiнгенде, сутегi иондарыбикарбонат ионымен әрекеттесiп, әлсiз көмiр қышқылын түзедi:
H2 + HCO3– = H2CO3
Көмiр қышқылының артық мөлшерi карбоангидраза (КА) ферментiнiң
әсерiнен ыдырайды (t=370C):
H2CO3 = CO2 + H2O
CO2 гипервентилляция нәтижесiнде өкпе арқылы сыртқа шығады.
Егер қандағы OH– иондардың концетрациясы жоғарыласа, олар әлсiз
көмiр қышқылымен әрекеттеседi:
OH– + H2CO3 = HCO3– + H2O
Буферлiк жүйедегi қалыпты қатынас сақталу үшiн қышқылды-негiздiк
теңдiктiң физиологиялық механизмдерi iске қосылады: өкпенiң
гиповентилляциясы нәтижесiнде қанда аз мөлшерде болса да CO2
сақталады.
39.
Фосфаттық буферлiк жүйе жасуша iшiлiк және тканьдiк негiзгi жүйеболып есептеледi. Бүйректе жүретiн физиологиялық процестерде
маңызды роль атқарады. Бұл жүйе 2 тұздан тұрады:
NaH2PO4 (H2PO4– - протонның доноры)
Na2HPO4 (HPO42– – протонның акцепторы)
H2PO4– = H+ + HPO42–
pH = 7,4 болғанда, NaH2PO4 = 4
Na2HPO4 = 1
Тканьдiк метаболизмнiң қышқыл туындылары гидрофосфатпен
нейтралданады:
HPO42– + H+ = H2PO4–
Сiлтiлiк туындылар дигидрофосфатпен әрекеттеседi:
OH– + H2PO4– = HPO42– + H2O
Түзілген өнiмдер бүйректе жиналып, несеппен сыртқа шығады.
40.
Буферлiк сиымдылық – буферлiк әсердiң өлшемiБуферлiк сиымдылық буферлiк жүйелердiң маңызды сипаттамасы болып
есептеледi. Ортаның реакциясын ығыстыруға қарсы жасайтын буферлiк
жүйенiң әсерi буферлiк сиымдылық деп аталады. Буферлiк сиымдылық
1л буферлiк ерiтiндiге оның pH-ын 1-ге өзгерту үшiн қосылатын күштi
қышқылдың немесе сiлтiнiң 1 моль эквивалент мөлшерiмен өлшенедi.
Қышғылдық және сiлтiлiк буферлiк сиымдылықтар болады.
Буферлiк
сиымдылық
буферлiк
жүйедегi
компоненттердiң
концентрацияларының абсолюттiк шамасына тәуелдi болады.
Компоненттердiң концентрациялары неғұрлым жоғары болса, қышқыл
немесе сiлтi қосқанда рН өзгерiсi соғұрлым аз болады. Буферлiк
жүйедегi компоненттердiң қатынасы 1–ге тең болғанда, буферлiк
сиымдылық ең жоғарғы шегiне жетедi. Буферлiк сиымдылық ертiндiнi
сұйылтқанда төмендейдi, себебi ол компоненттердiң концентрациясына
тәуелдi болады.
41.
42.
Гомеостаз43.
Ле Шателье принципі44.
Буферлік сыйымдылыққа әсерететін факторлар
45.
Қанның буферлік жүйесі46.
47.
Лечение алкалоза48.
Лечение метаболитическогоацидоза









































 chemistry
chemistry








