Similar presentations:
Первое начало термодинамики и газовые законы
1.
2.
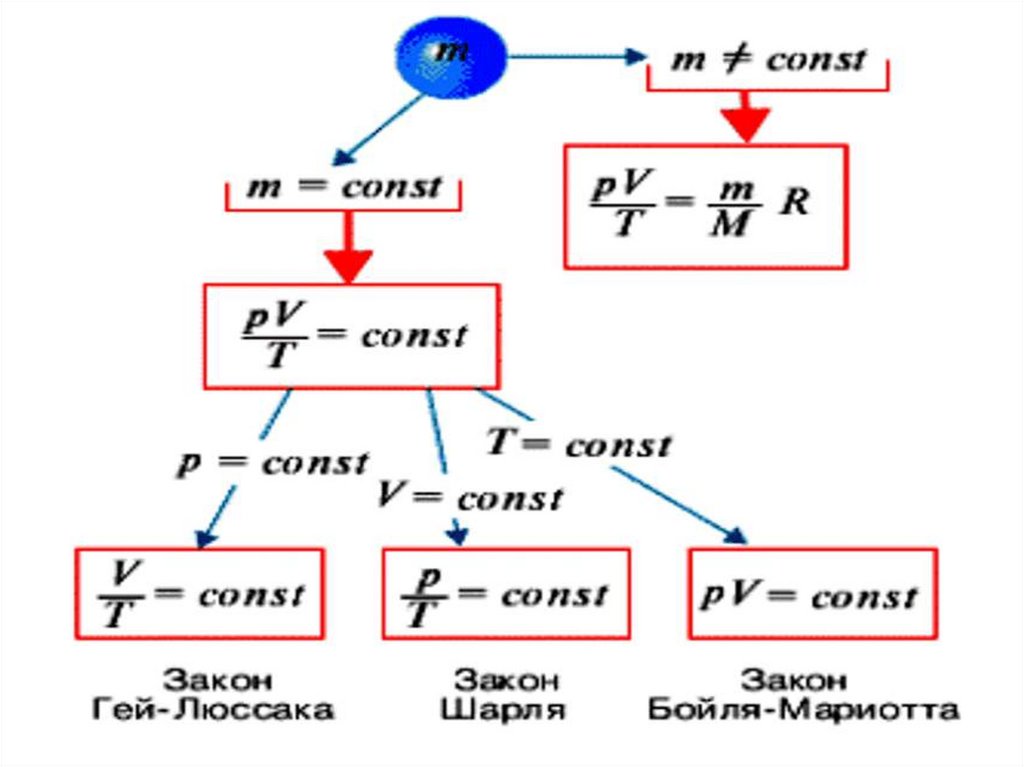
Состояние газа определяютпараметрами:
Температура (T)
Давление (P)
Объём (V)
Количество вещества
равно 1 моль
3.
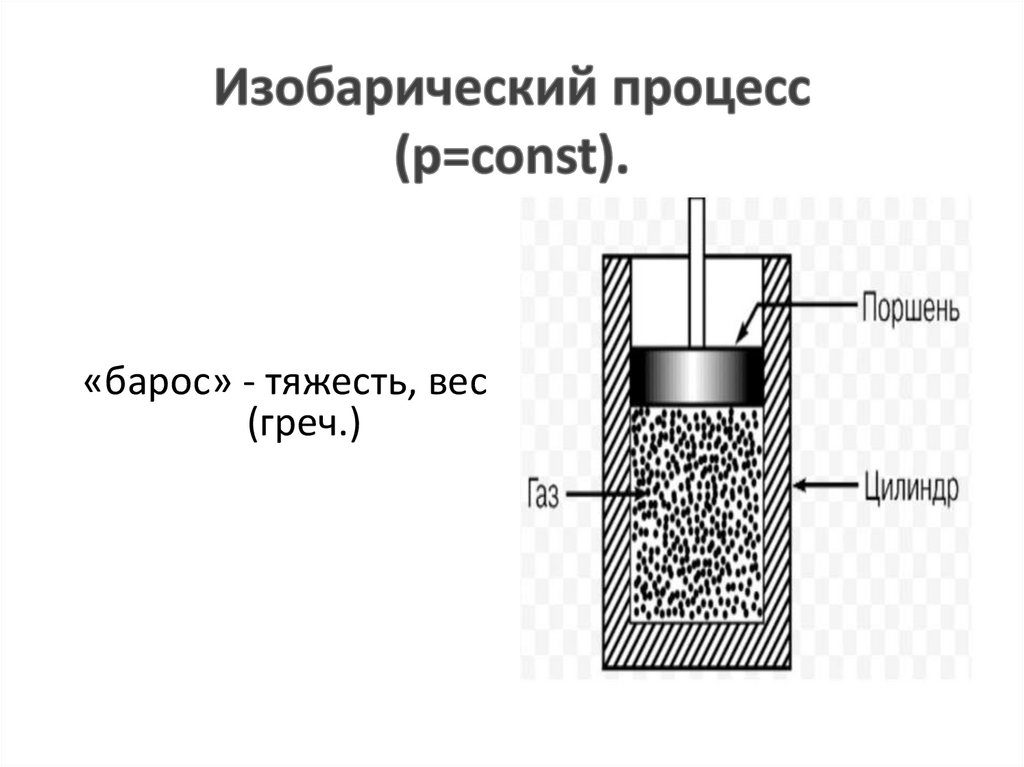
«хорема» - вместимость (греч.)4.
Жак Алекса́ндрСеза́р Шарль (12
ноября 1746,
Божанси, Луаре —
7 апреля 1823,
Париж) —
французский
изобретатель и
учёный.
5.
Закон Шарля• Для газа данной массы
отношение давления к
температуре
постоянно, если
объем газа не
меняется.
V const
p p0 (1 V t )
p
const
T
6.
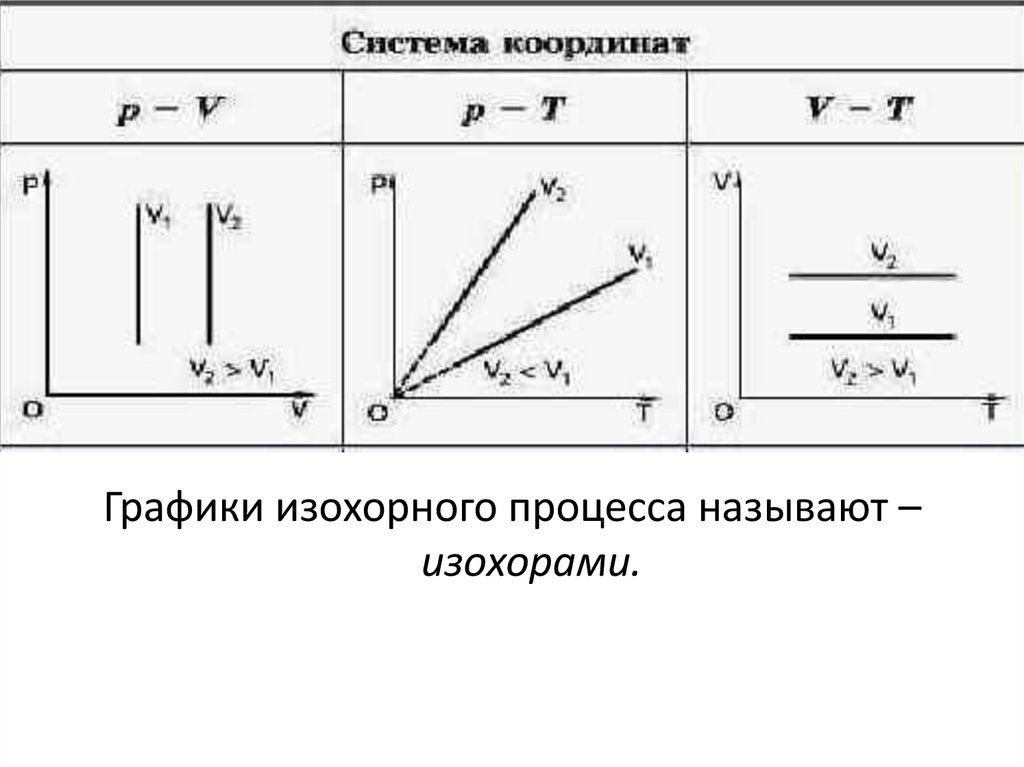
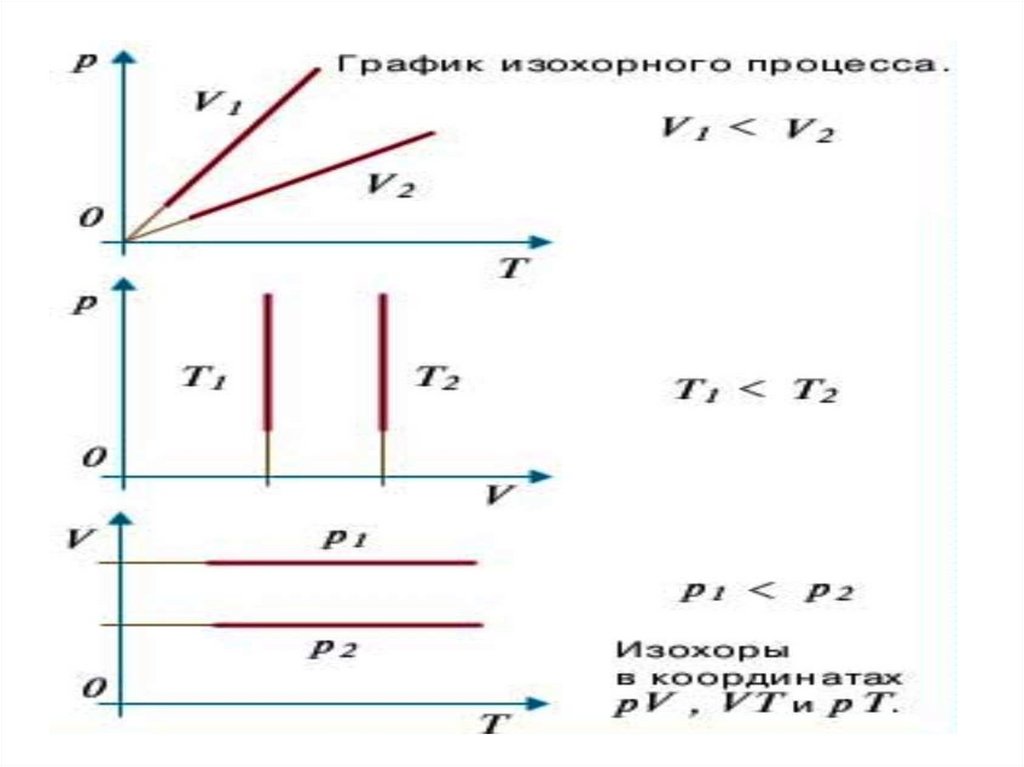
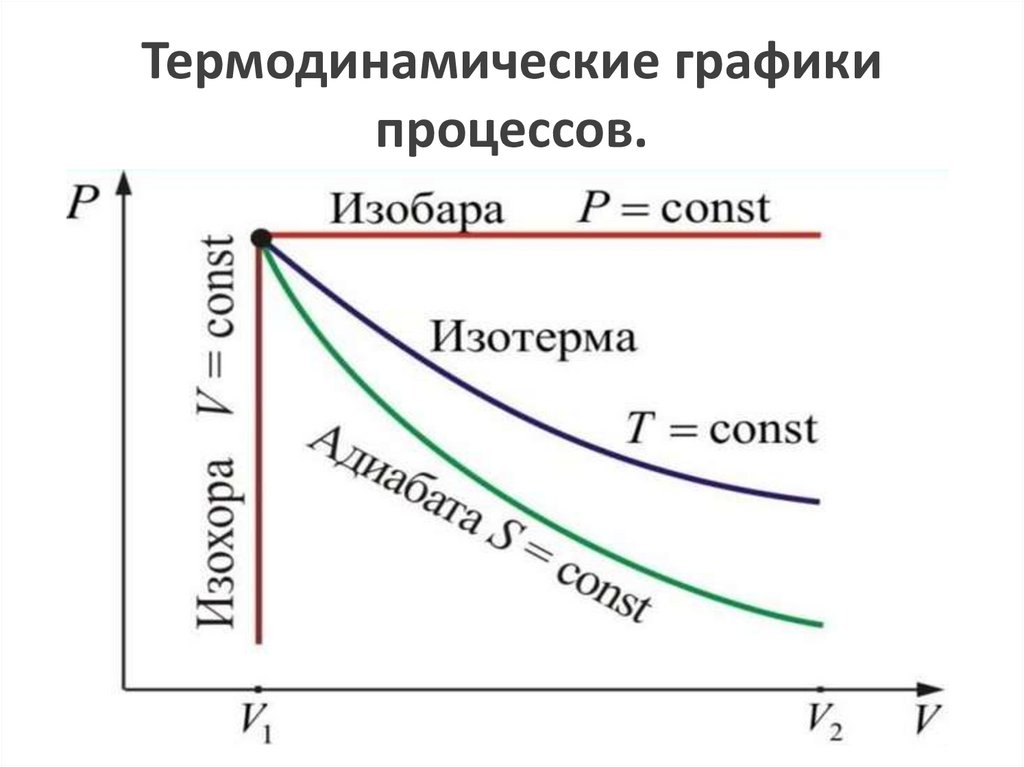
Графики изохорного процесса называют –изохорами.
7.
8.
A p V 0i
U R T V p
2
Q U
9.
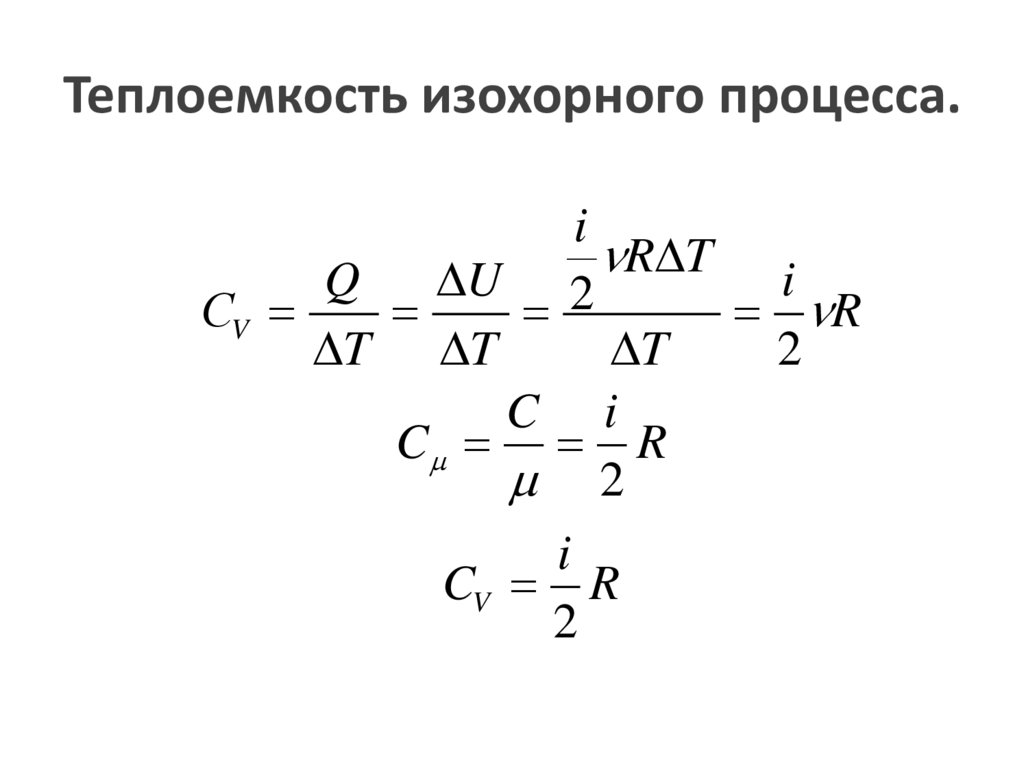
Теплоемкость изохорного процесса.i
R
T
Q
U 2
i
СV
R
T T
T
2
C i
C R
2
i
CV R
2
10.
«барос» - тяжесть, вес(греч.)
11.
Жозе́ф Луи́ ГейЛюсса́к (6 декабря1778, Сен-Леонарде-Нобла — 9 мая
1850, Париж) —
французский химик
и физик, член
Французской
Академии наук
(1806).
12.
Закон Гей-Люссака• Для газа данной массы
отношение объема к
температуре
постоянно, если
давление газа не
меняется.
p const
V V0 (1 p t )
V
const
T
13.
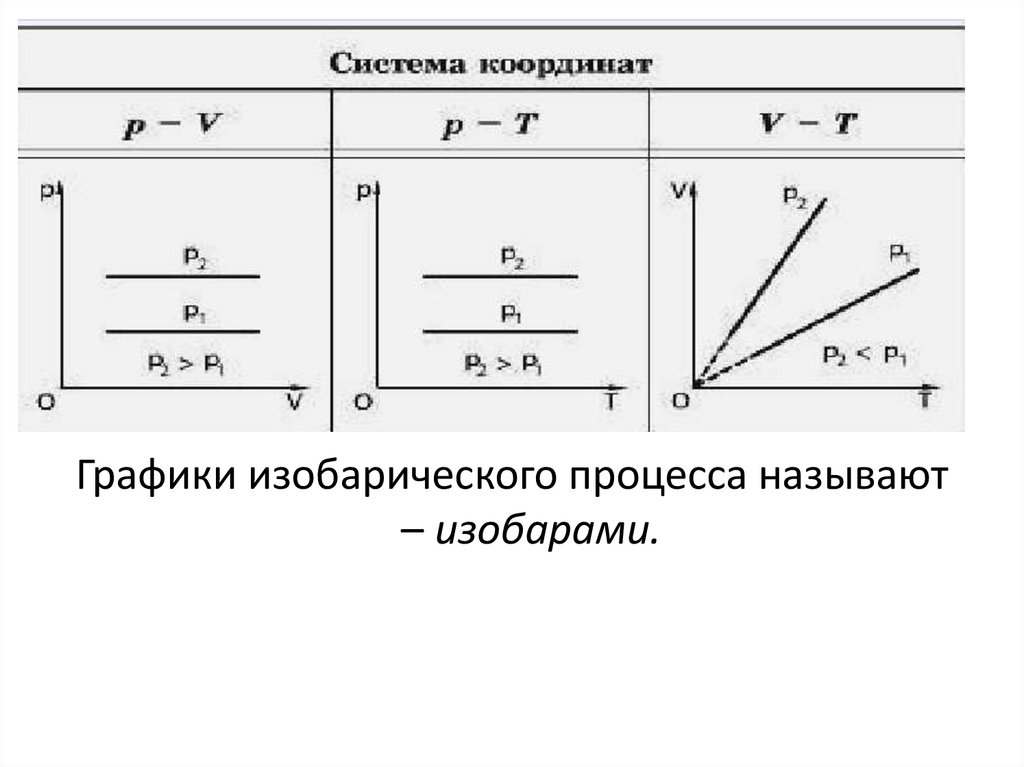
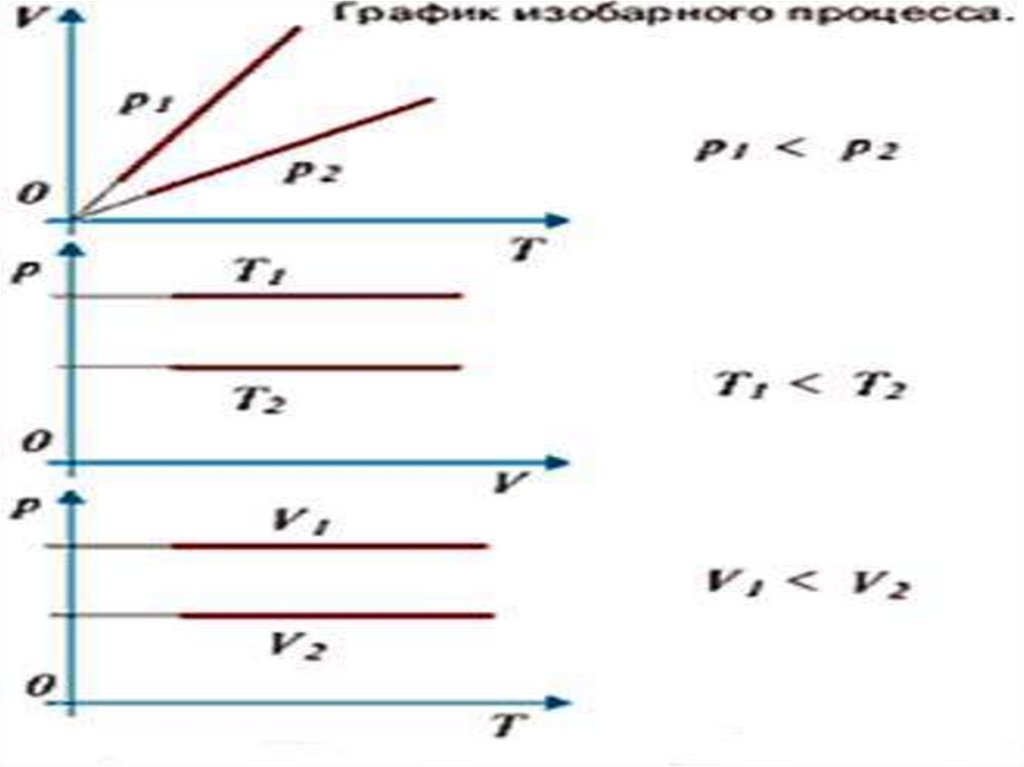
Графики изобарического процесса называют– изобарами.
14.
Графики изобарического процесса называют– изобарами.
15.
A p Vi
i
U R T p V
2
2
i
Q A U p V R T
2
i 2
i 2
U
A
i
2
16.
Теплоемкость изобарическогопроцесса.
Q
U
A i 2
Cp
R
T T T
2
Уравнение Майера.
C p CV R
17.
«терма» - баня,промывочная (греч.)
18.
Роберт Бойль — англоирландский натурфилософ,физик, химик и богослов.
Седьмой сын Ричарда Бойля, 1го графа Коркского, вельможи
времён Елизаветы Английской.
Эдм Мариотт — аббат,
французский физик. Родился в
1620 году в Бургундии в
Дижоне. Проживал вблизи
Дижона и был приором в
городке Сан-Мартан су Бон .
19.
Закон Бойля-МариоттаT const
pV const
Для газа данной массы
произведение давления
газа на его объем
постоянно, если
температура газа не
меняется.
20.
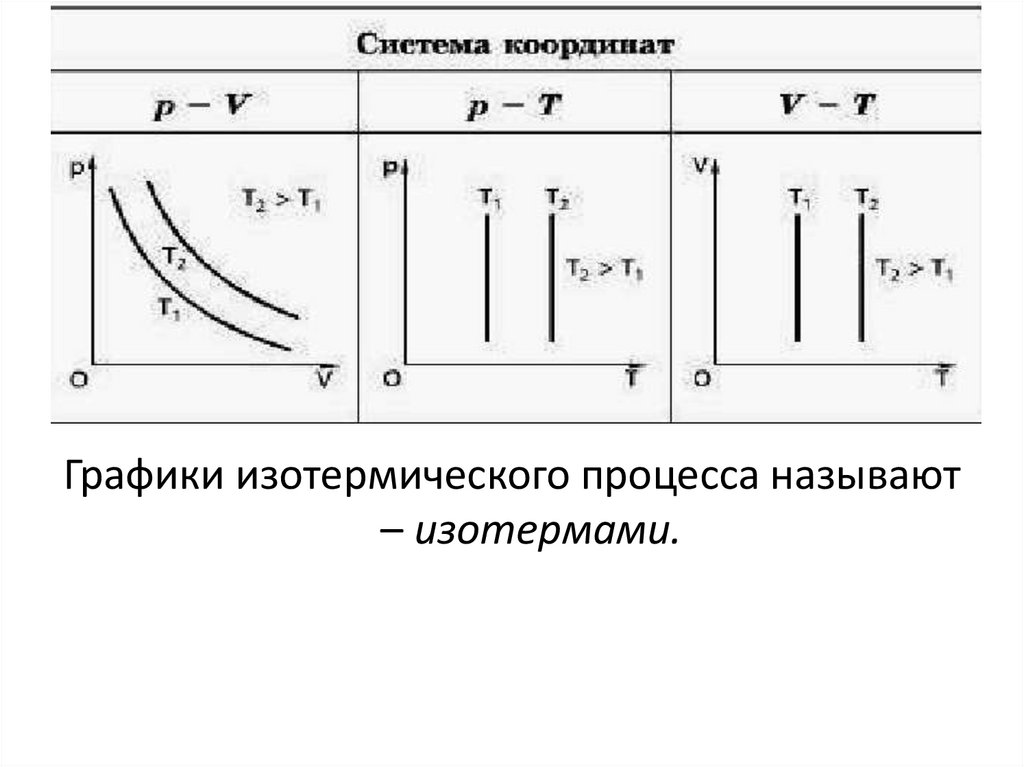
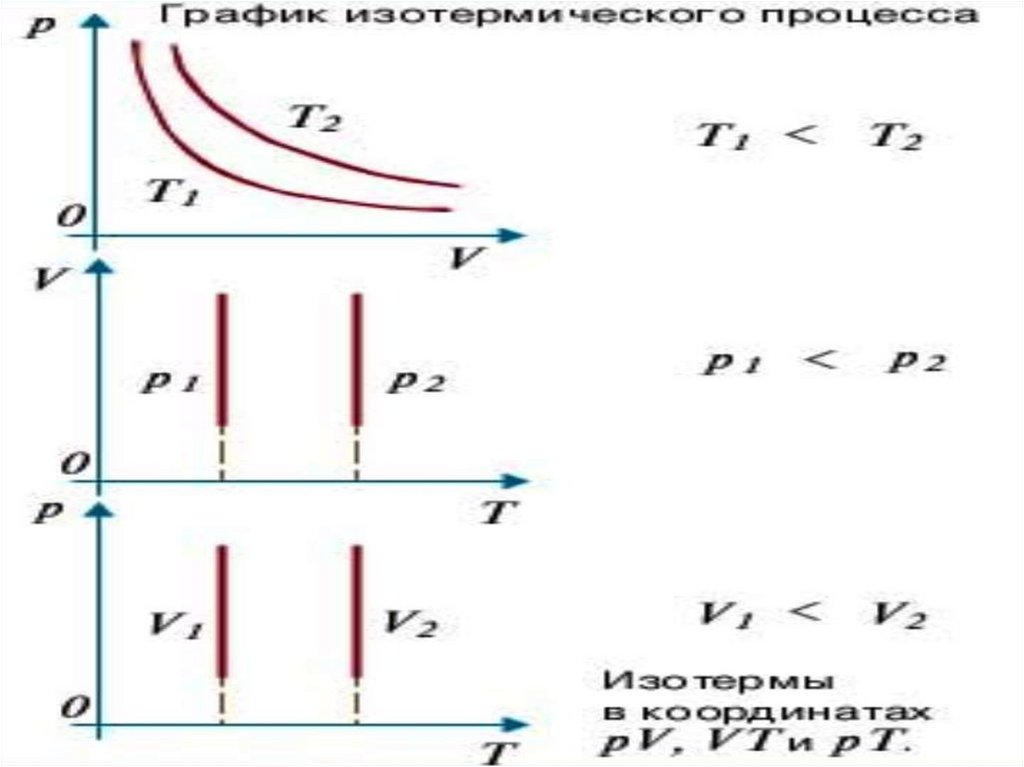
Графики изотермического процесса называют– изотермами.
21.
22.
iU R T 0
2
V2
p2
A RT ln
RT ln
V1
p1
Q A
23.
Теплоемкость изотермическогопроцесса.
Q
CT
T
Не возможность определения теплоемкости
навело на мысль о не возможности реализации в
природе этого процесса.
24.
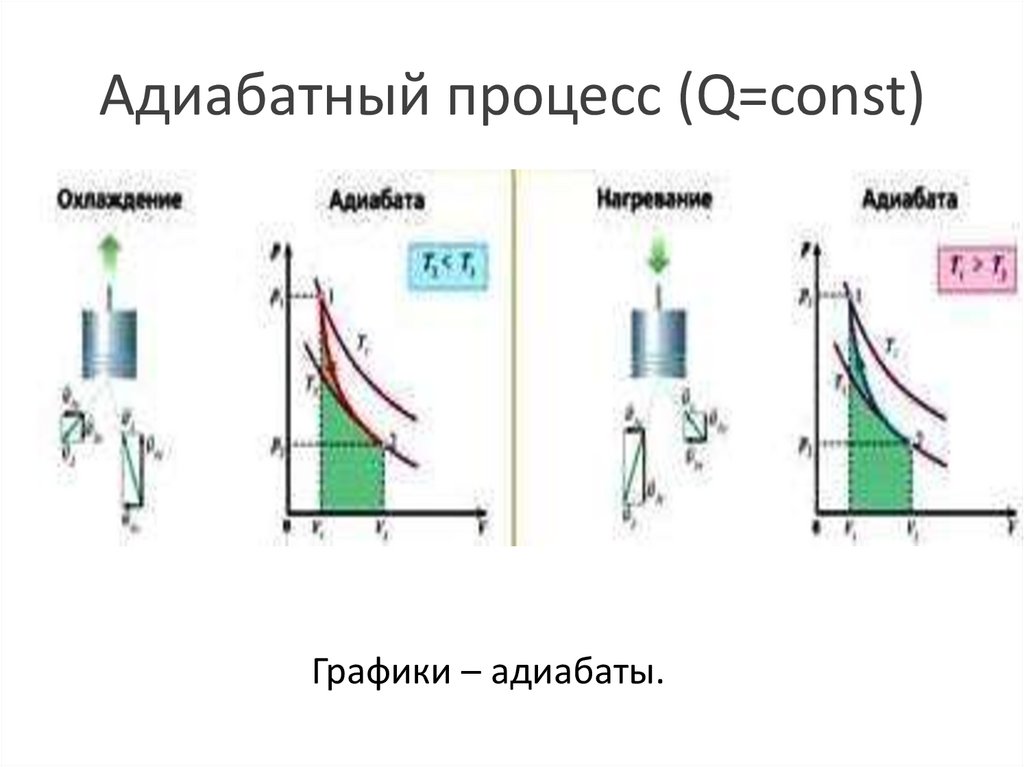
Адиабатный процесс..
Термодинамический
процесс, при
котором
отсутствует
теплообмен
между газом и
окружающими
телами.
Q 0
25.
Адиабатный процесс (Q=const)Графики – адиабаты.
26.
Уравнение адиабаты(Уравнение Пуассона).
dA dU
pdV dU CV dT
pV RT
pdV Vdp RdT
Сp
CV
pV const
27.
Первое начало термодинамики:U A A
Теплоемкость адиабатического процесса
Q
CQ
0
T
28.
Идеализация процессов.Изотермический и адиабатический процессы
являются идеализированиями, в природе
они либо не реализуются (не наблюдаются)
совсем либо время их протекание очень
мало (они скоротечны). Новый термический
процесс?
29.
Политропный процессили политропический процесс —
термодинамический (реальный) процесс,
во время которого теплоёмкость газа
остаётся неизменной.
C const
30.
Уравнение политропы.pV const
n
n показатель политропы
1 изотермические свойства
n
адиабатические свойства
31.
Термодинамические графикипроцессов.
32.
Бенуа́ Поль Эми́ль Клапейро́н(26 февраля1799,
Париж - 28 января
1864, Париж) –
французский физик и
инженер. Членкорреспондент Петерб
ургской академии
наук.
33.
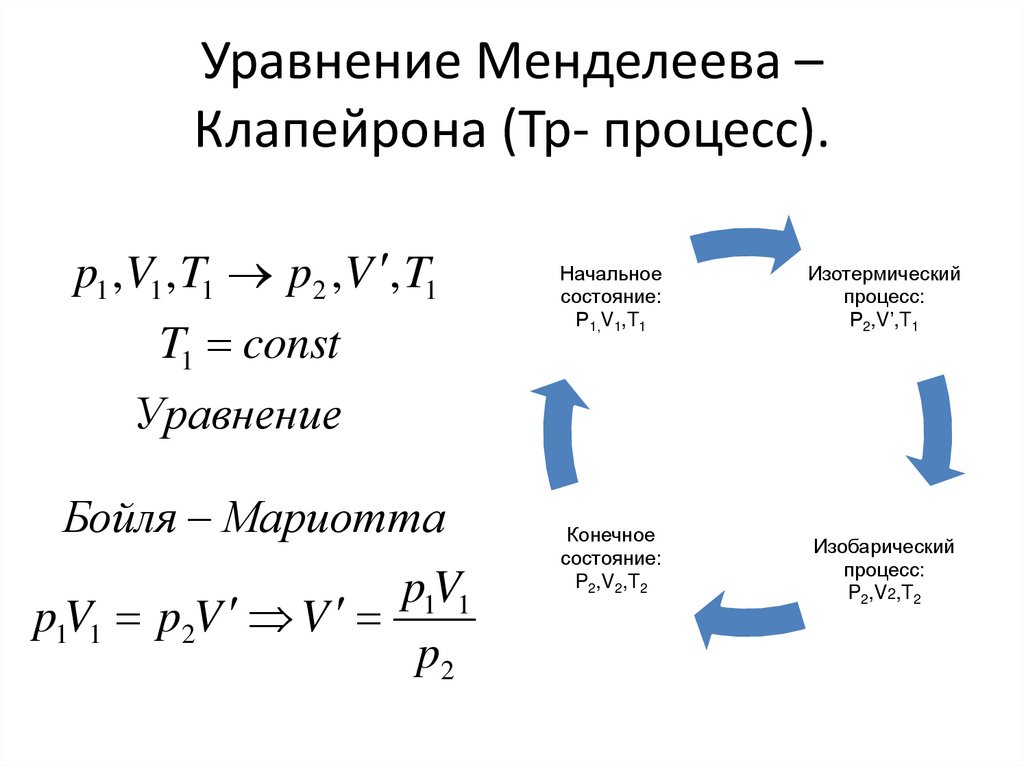
Уравнение Менделеева –Клапейрона (Тр- процесс).
p1 ,V1 , T1 p2 ,V , T1
T1 const
Начальное
состояние:
Р1,V1,T1
Изотермический
процесс:
Р2,V’,T1
Уравнение
Бойля Мариотта
p1V1
p1V1 p2V V
p2
Конечное
состояние:
P2,V2,T2
Изобарический
процесс:
P2,V2,T2
34.
p2 ,V , T1 p2 ,V2 , T2p2 const
Уравнение Гей Люссака
V V2
p1V1 V2
T1 T2
p2T1 T2
pV
const
T
35.
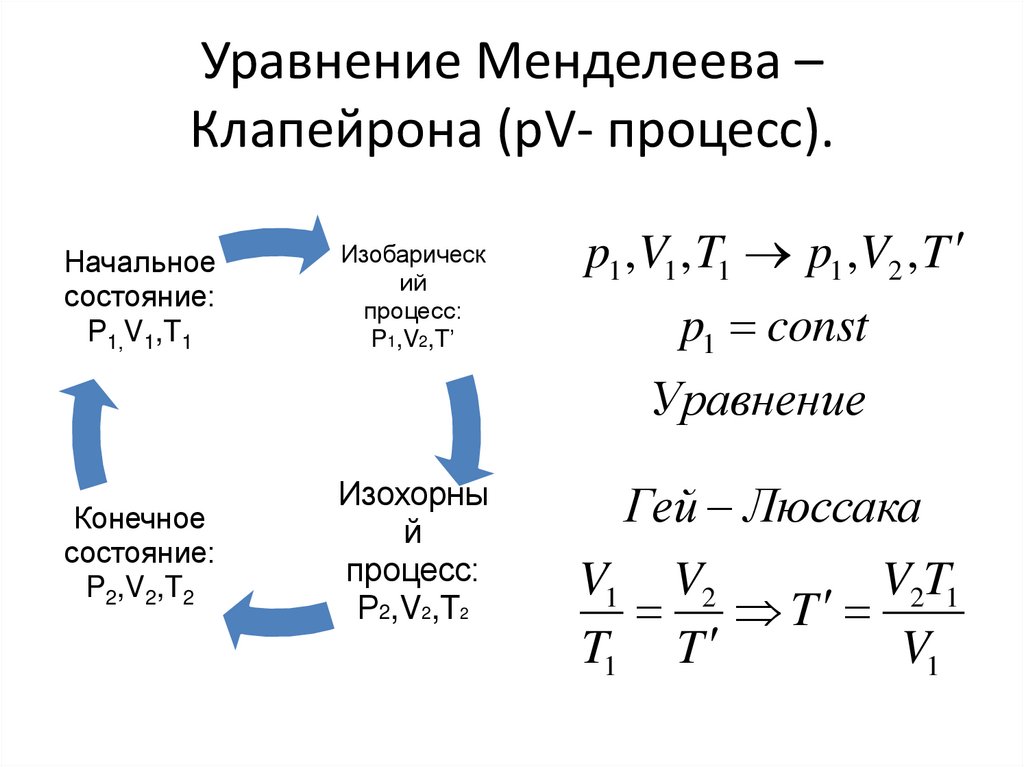
Уравнение Менделеева –Клапейрона (рV- процесс).
Начальное
состояние:
Р1,V1,T1
Изобарическ
ий
процесс:
P1,V2,T’
p1 ,V1 , T1 p1 ,V2 , T
p1 const
Уравнение
Конечное
состояние:
P2,V2,T2
Изохорны
й
процесс:
Р2,V2,T2
Гей Люссака
V1 V2
V2T1
T
T1 T
V1
36.
p1 ,V2 , T p2 ,V2 , T2V2 const
Уравнение Шарля
p1 p2
p1V1 p2
T T2
V2T1 T2
pV
const
T
37.
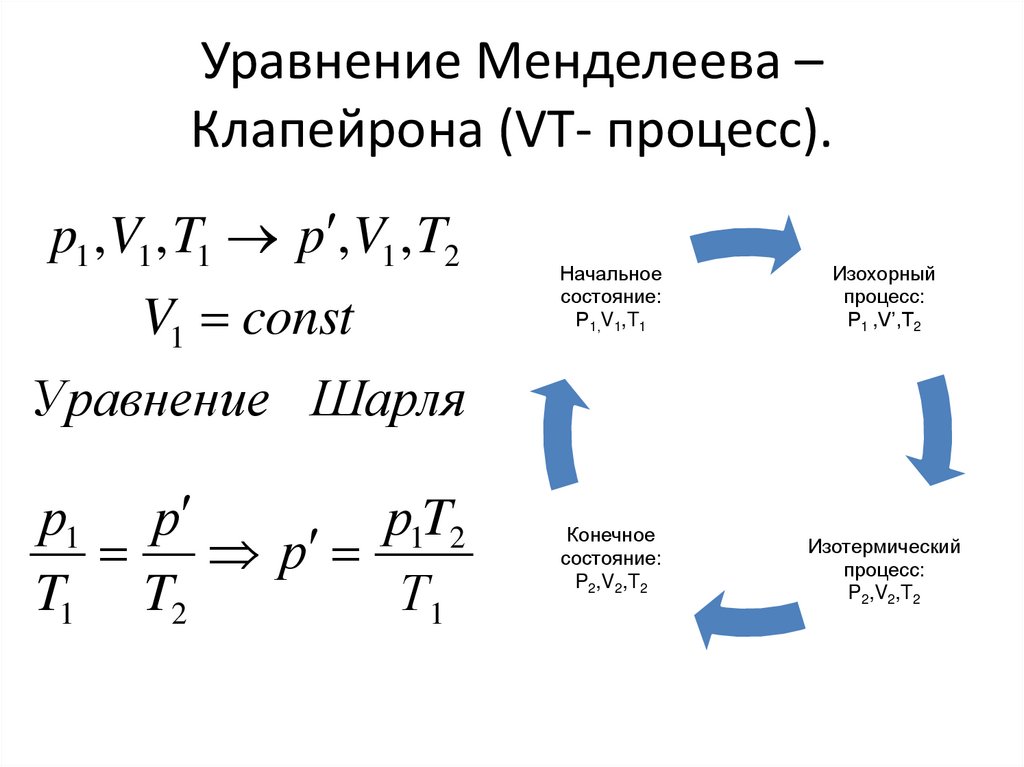
Уравнение Менделеева –Клапейрона (VT- процесс).
p1 , V1 , T1 p , V1 , T2
V1 const
Начальное
состояние:
Р1,V1,T1
Изохорный
процесс:
Р1 ,V’,T2
Уравнение Шарля
р1 р
р1T2
р
T1 T2
Т1
Конечное
состояние:
P2,V2,T2
Изотермический
процесс:
P2,V2,T2
38.
p , V1 , T2 p2 , V2 , T2Т 2 const
Уравнение Бойля Мариотта
p1V1T2
p V1 p2V2
p2V2
T1
pV
const
T
39.
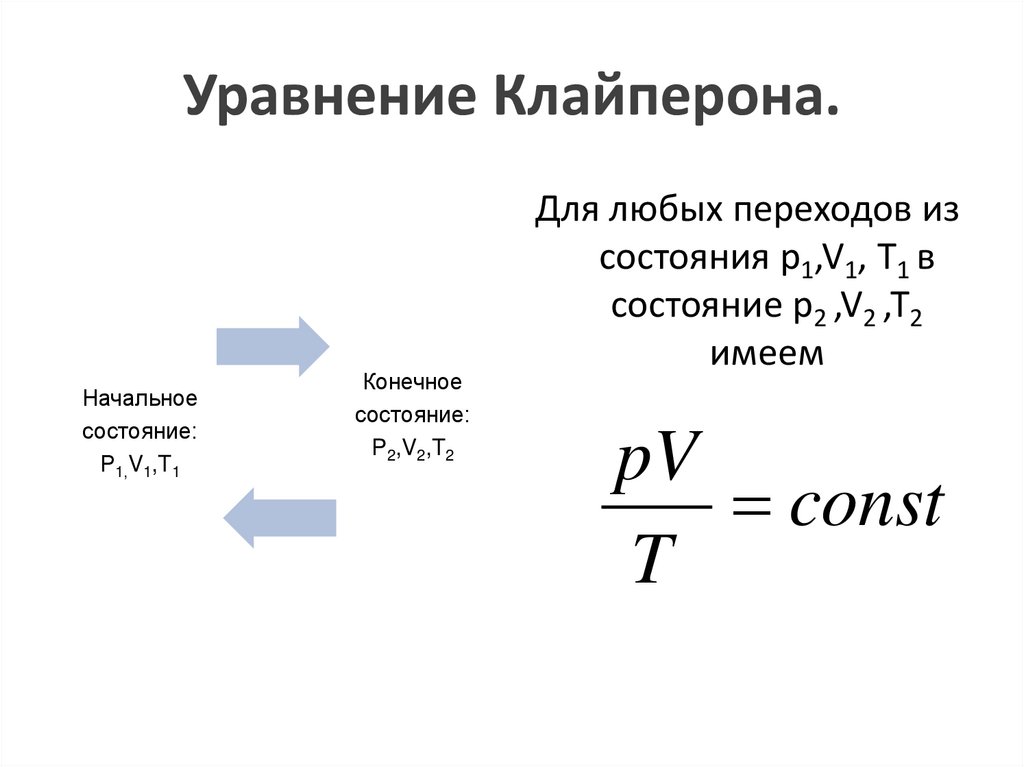
Уравнение Клайперона.Начальное
состояние:
Р1,V1,T1
Конечное
состояние:
P2,V2,T2
Для любых переходов из
состояния p1,V1, T1 в
состояние p2 ,V2 ,T2
имеем
pV
const
T
40.
Дмитрий Иванович Менделеев(27 января 1834 20 января 1907) -русский
ученый, энциклопедист,
химик, метролог,
экономист, технолог, геолог,
метеоролог, нефтяник,
педагог, воздухоплаватель,
приборостроитель.
Профессор Императорского
Санкт-Петербургского
университета: член корреспондент (по разряду
«физический») Император
ской Санкт-Петербургской
Академии наук.
41.
Универсальная газовая постоянная(Постоянная Менделеева).
R k NA
Дж
1
23
1,38 10
6,02 10
K
моль
Дж
8,31
моль К
23
Универсальная газовая постоянная, численно равная
работе одного моля идеального газа при
изобарическом нагревании на 1 К.
A
p V pV R T
R
T
T
T
T
42.
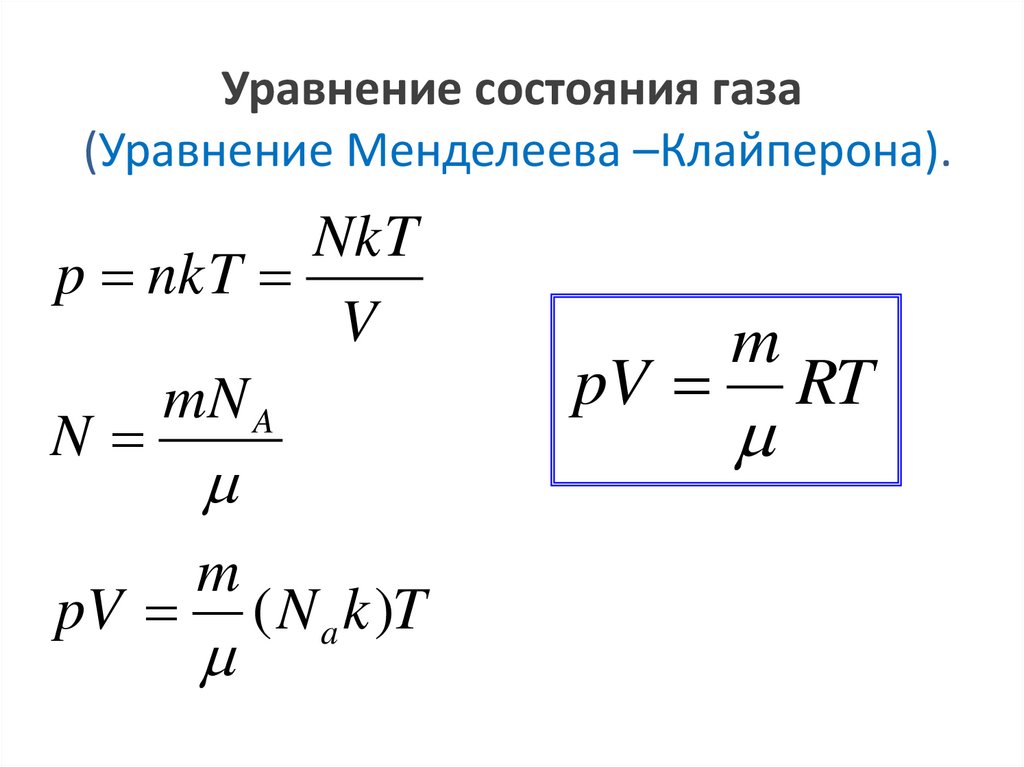
Уравнение состояния газа(Уравнение Менделеева –Клайперона).
NkT
p nkT
V
mN A
N
pV
m
( N a k )T
pV
m
RT





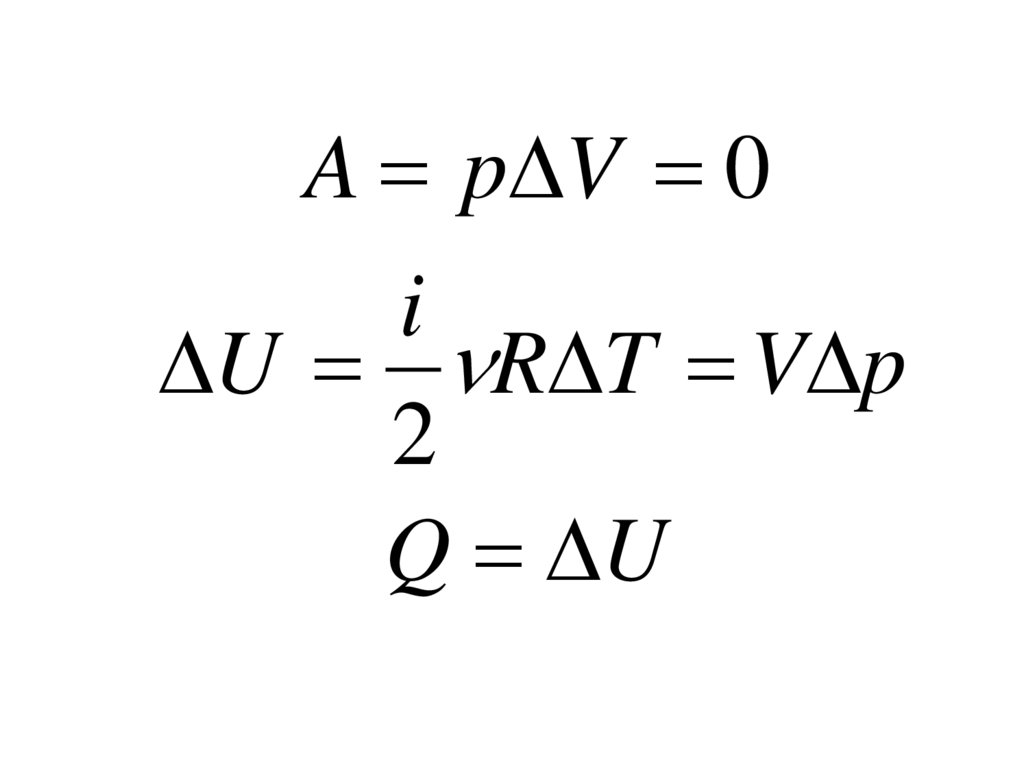


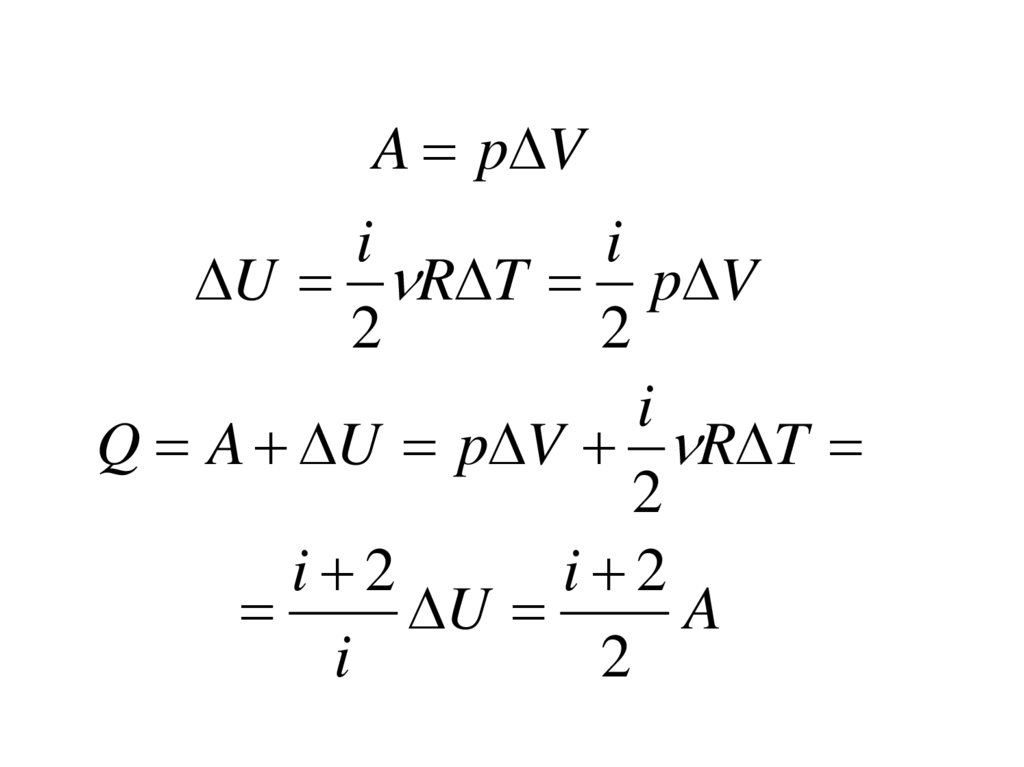




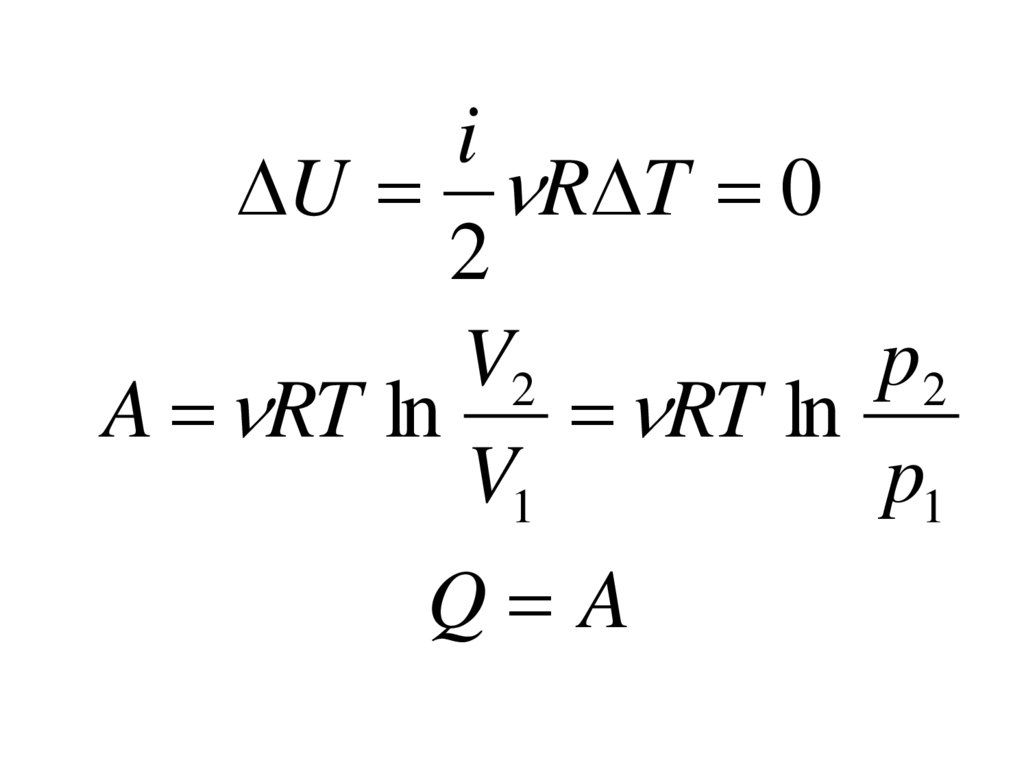



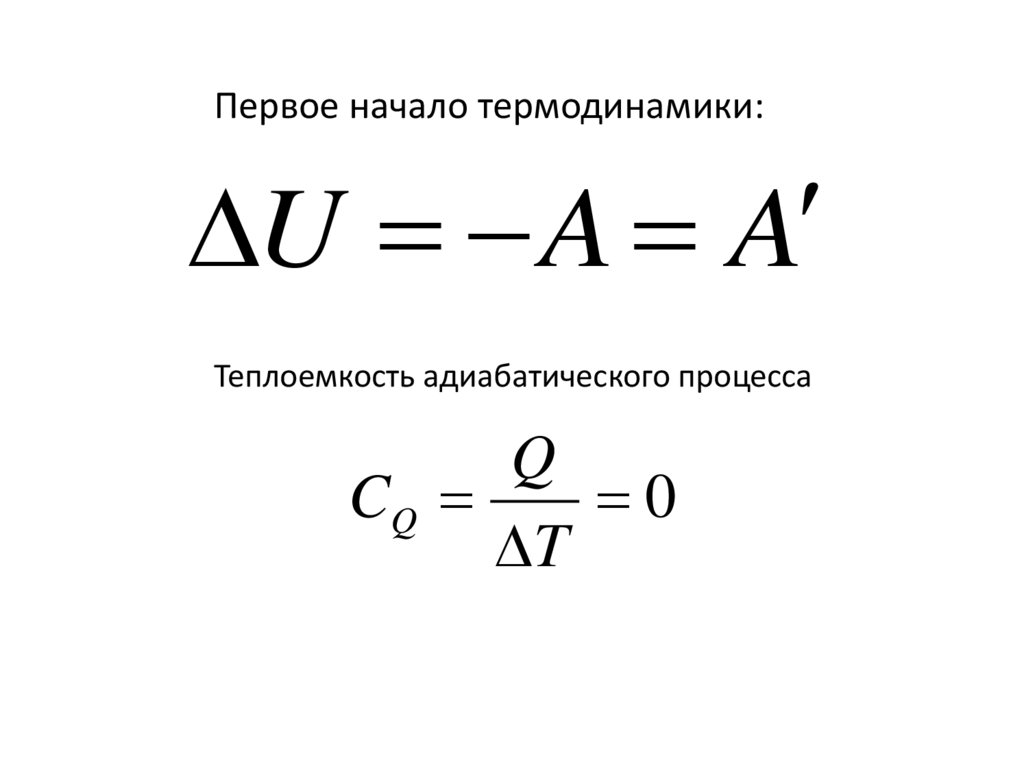





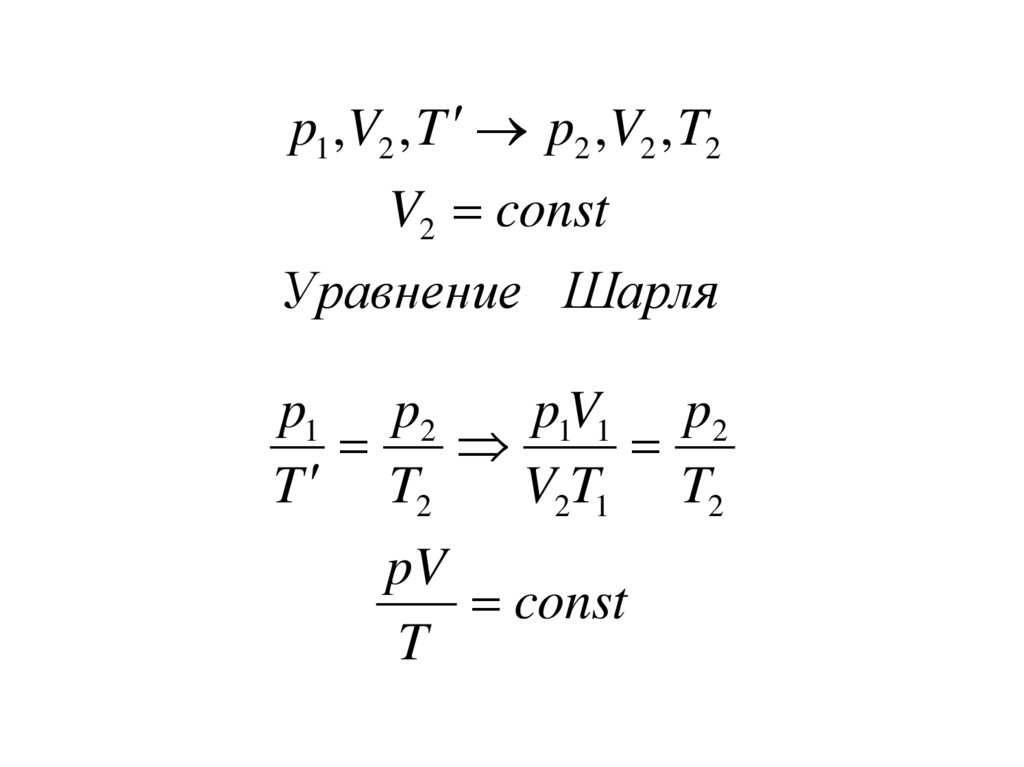
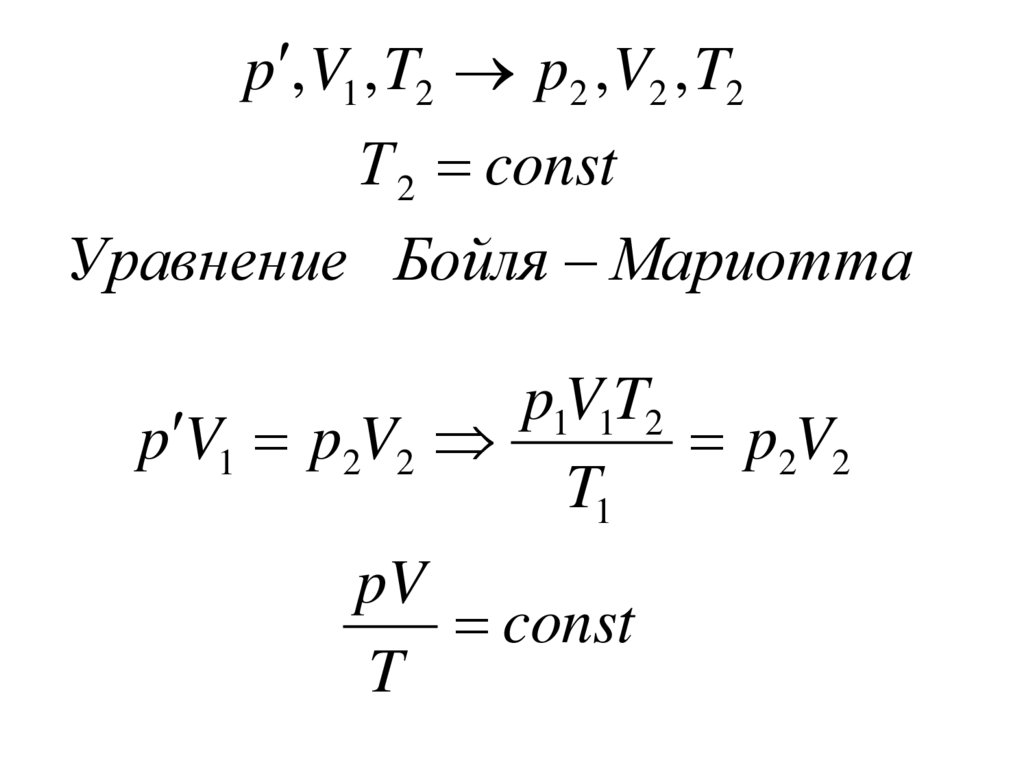


 physics
physics








