Similar presentations:
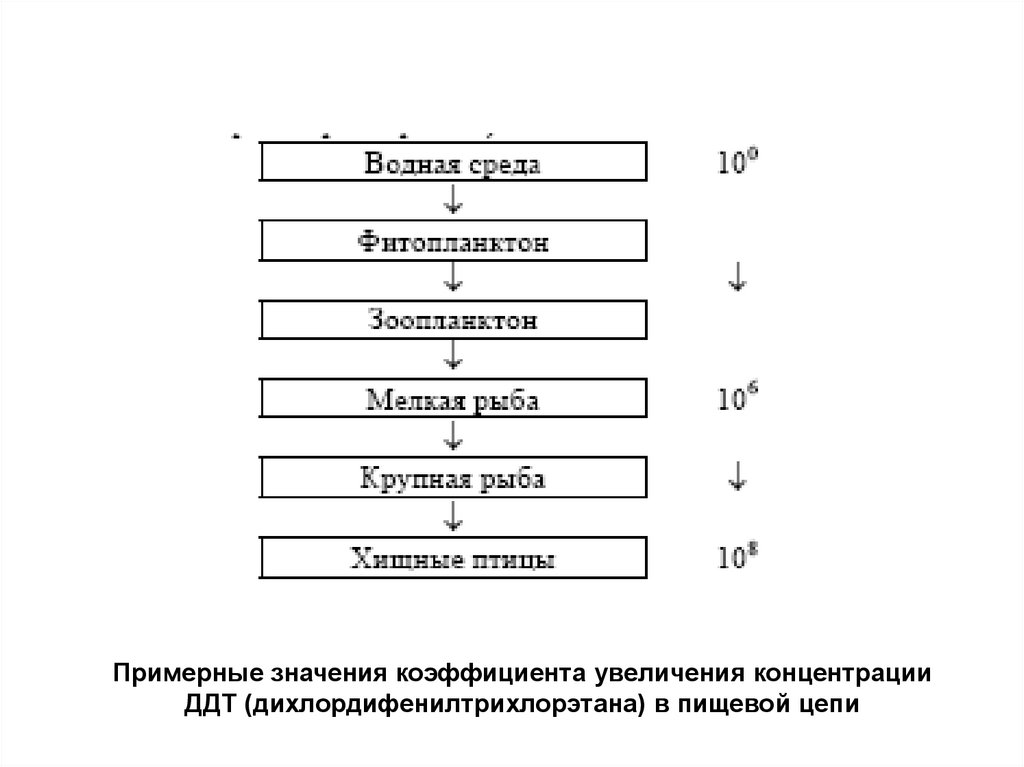
Примерные значения коэффициента увеличения концентрации ДДТ (дихлордифенилтрихлорэтана) в пищевой цепи
1.
Примерные значения коэффициента увеличения концентрацииДДТ (дихлордифенилтрихлорэтана) в пищевой цепи
2.
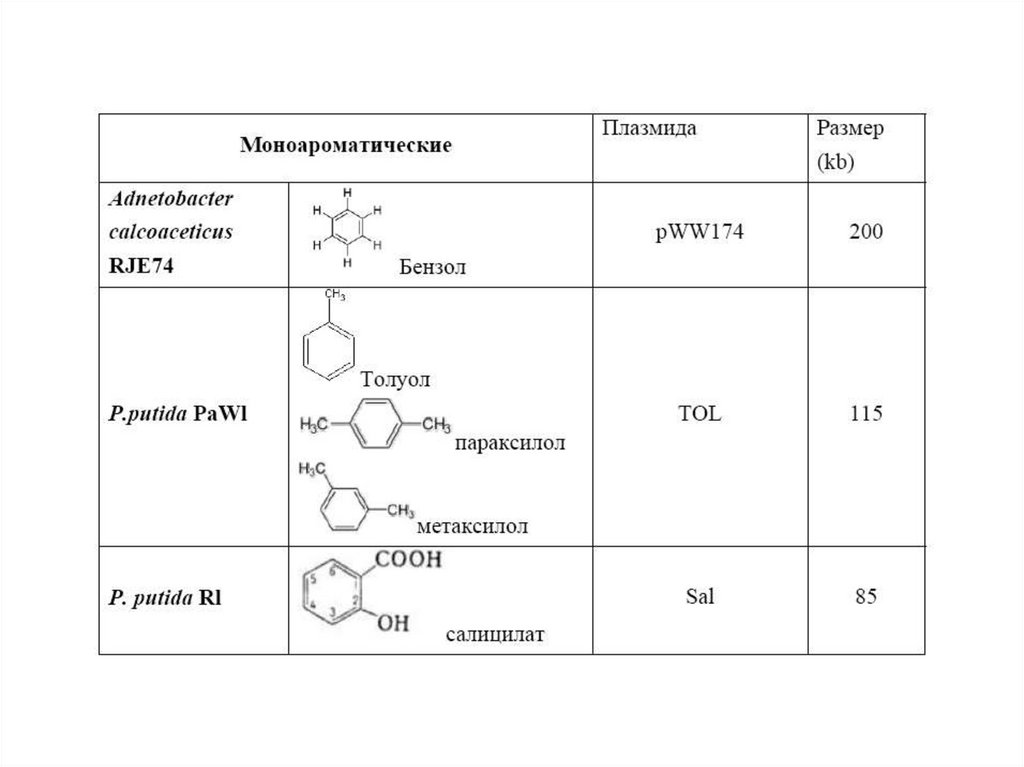
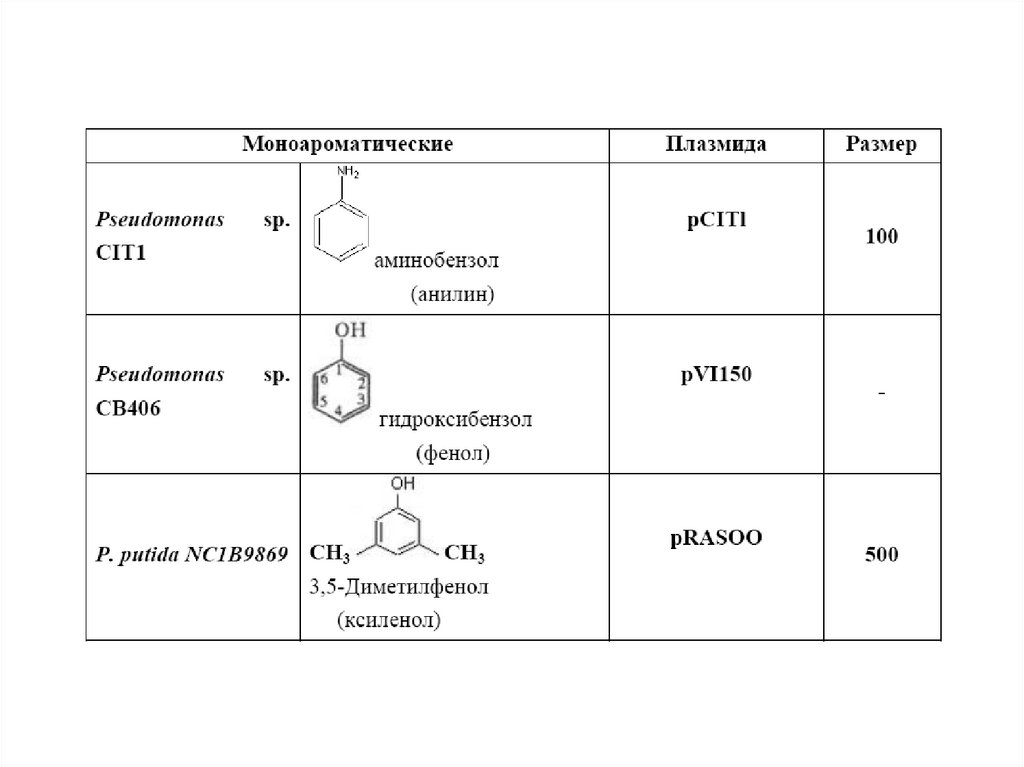
Плазмиды биодеградации3.
4.
5.
6.
7.
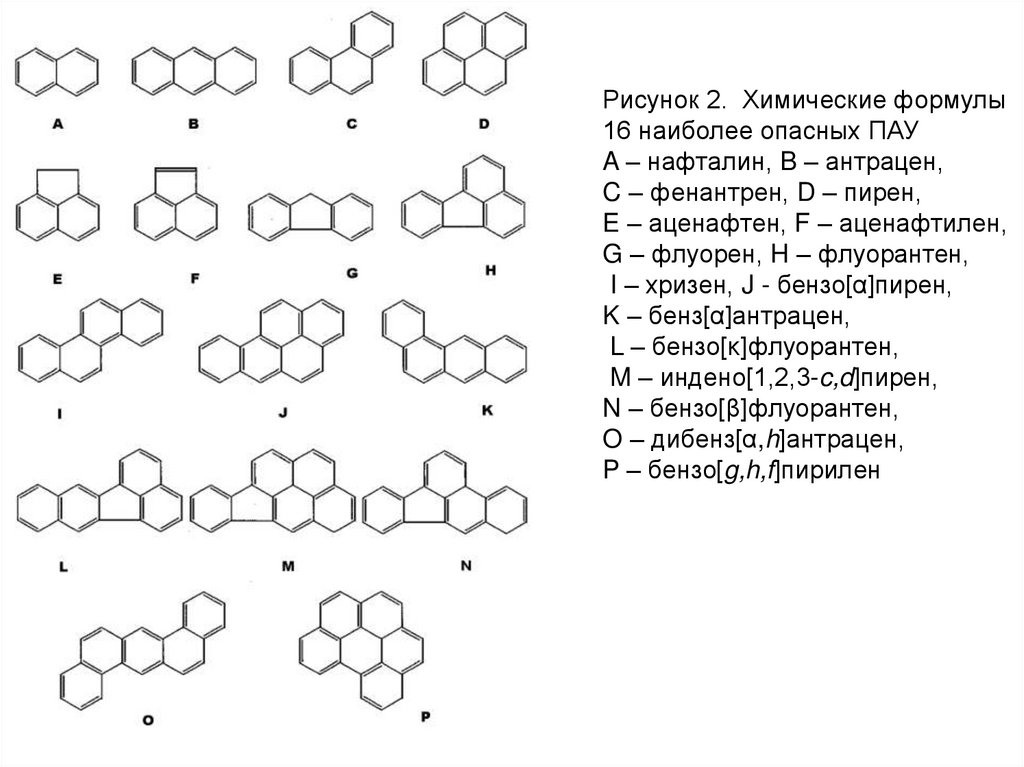
Рисунок 2. Химические формулы16 наиболее опасных ПАУ
A – нафталин, B – антрацен,
C – фенантрен, D – пирен,
E – аценафтен, F – аценафтилен,
G – флуорен, H – флуорантен,
I – хризен, J - бензо[α]пирен,
K – бенз[α]антрацен,
L – бензо[κ]флуорантен,
M – индено[1,2,3-c,d]пирен,
N – бензо[β]флуорантен,
O – дибенз[α,h]антрацен,
P – бензо[g,h,f]пирилен
8.
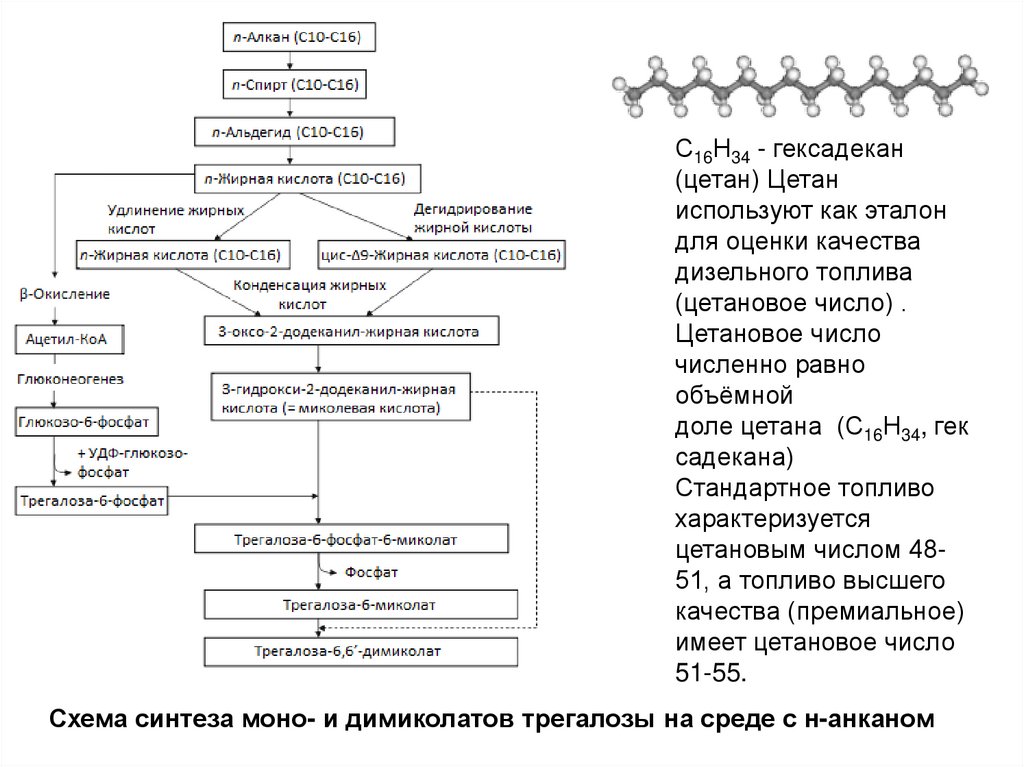
С16Н34 - гексадекан(цетан) Цетан
используют как эталон
для оценки качества
дизельного топлива
(цетановое число) .
Цетановое число
численно равно
объёмной
доле цетана (С16Н34, гек
садекана)
Стандартное топливо
характеризуется
цетановым числом 4851, а топливо высшего
качества (премиальное)
имеет цетановое число
51-55.
Схема синтеза моно- и димиколатов трегалозы на среде с н-анканом
9.
Генетическая организациягенов alkB у бактерий рода
Rhodococcus
10.
11.
12.
28 °СWT
rifR
alkB2
. alkB6
WT
rifR
alkB2
alkB6
13.
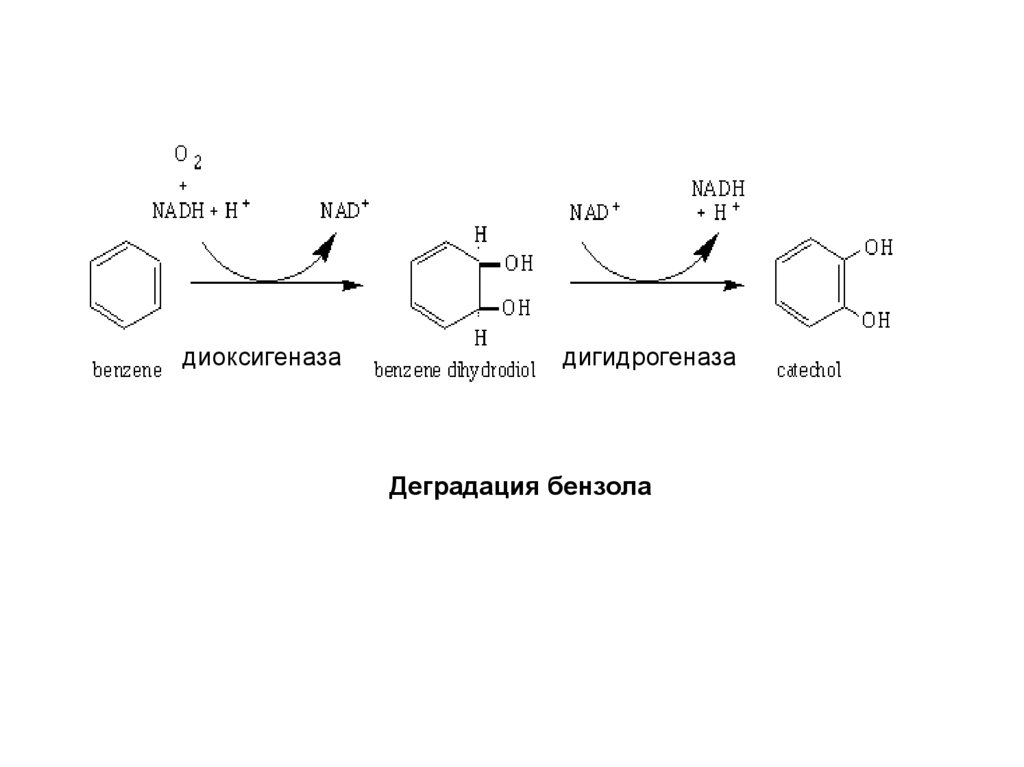
Cхема переноса электронов диоксигеназамиДестабилизация бензольного кольца осуществляется путём введения в него двух
атомов кислорода в результате диоксигеназной реакции с образованием
дигидродиола. Катализирующие эту реакцию диоксигеназы представляют собой
многокомпонентные системы, состоящие из трех компонентов: флавопротеин
принимает электроны от NADH и передает их через ферредоксин на
диоксигеназу, которая далее взаимодействует с кислородом и ароматическим
субстратом.
14.
диоксигеназадигидрогеназа
Деградация бензола
15.
Более сложно происходит утилизация алкилбензолов, такихкак толуол, ксилолы, и этилбензол. Некоторые представители
родов Pseudomonas, Achromobacter и Nocardia способны
использовать эти соединения в качестве единственного
источника углерода. При этом расщепление этих веществ
может начинаться с окисления или боковой цепи, или
ароматического кольца.
16.
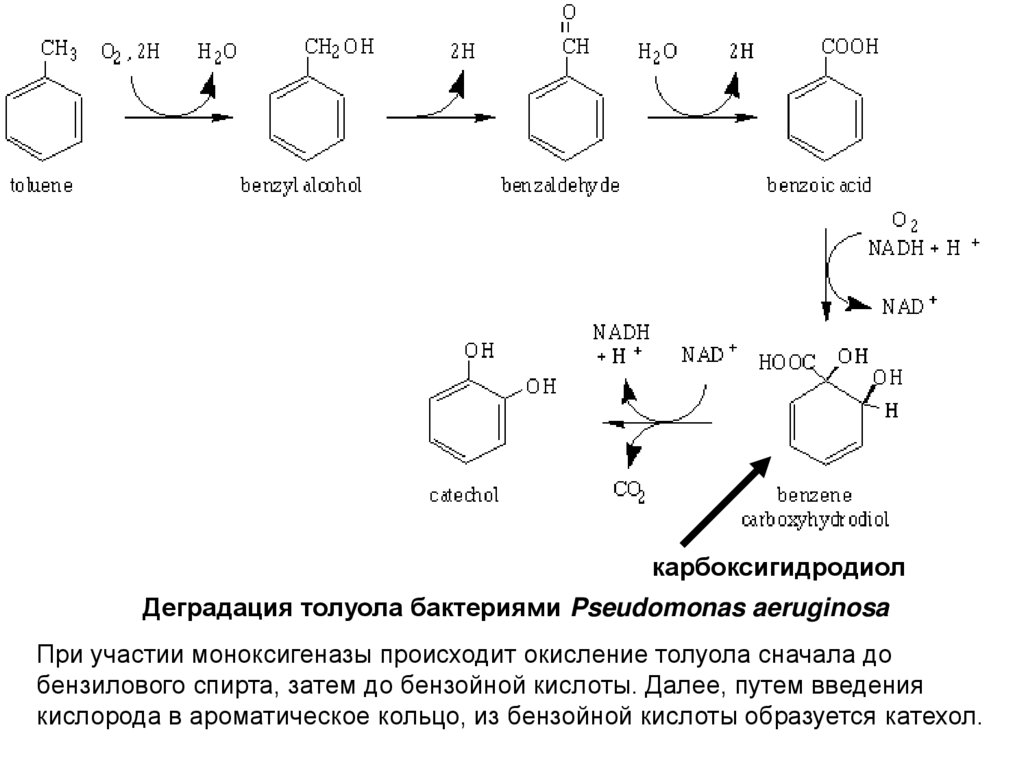
карбоксигидродиолДеградация толуола бактериями Pseudomonas aeruginosa
При участии моноксигеназы происходит окисление толуола сначала до
бензилового спирта, затем до бензойной кислоты. Далее, путем введения
кислорода в ароматическое кольцо, из бензойной кислоты образуется катехол.
17.
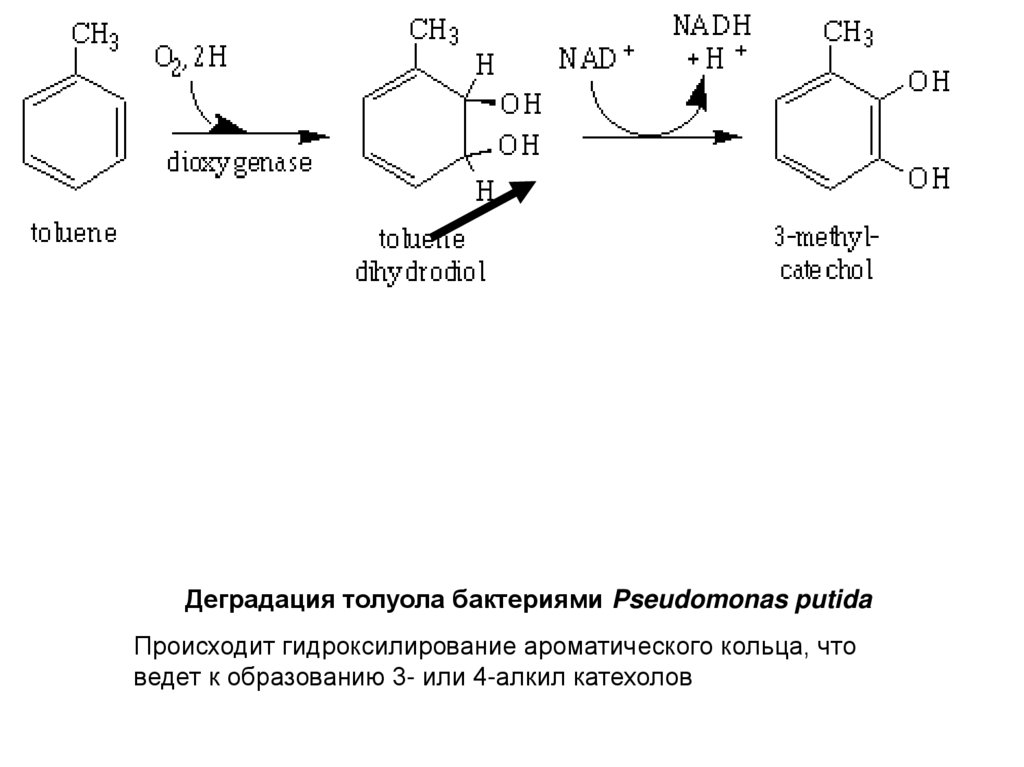
Деградация толуола бактериями Pseudomonas putidaПроисходит гидроксилирование ароматического кольца, что
ведет к образованию 3- или 4-алкил катехолов
18.
Дальнейшее превращение катехола может происходить двумяпутями:
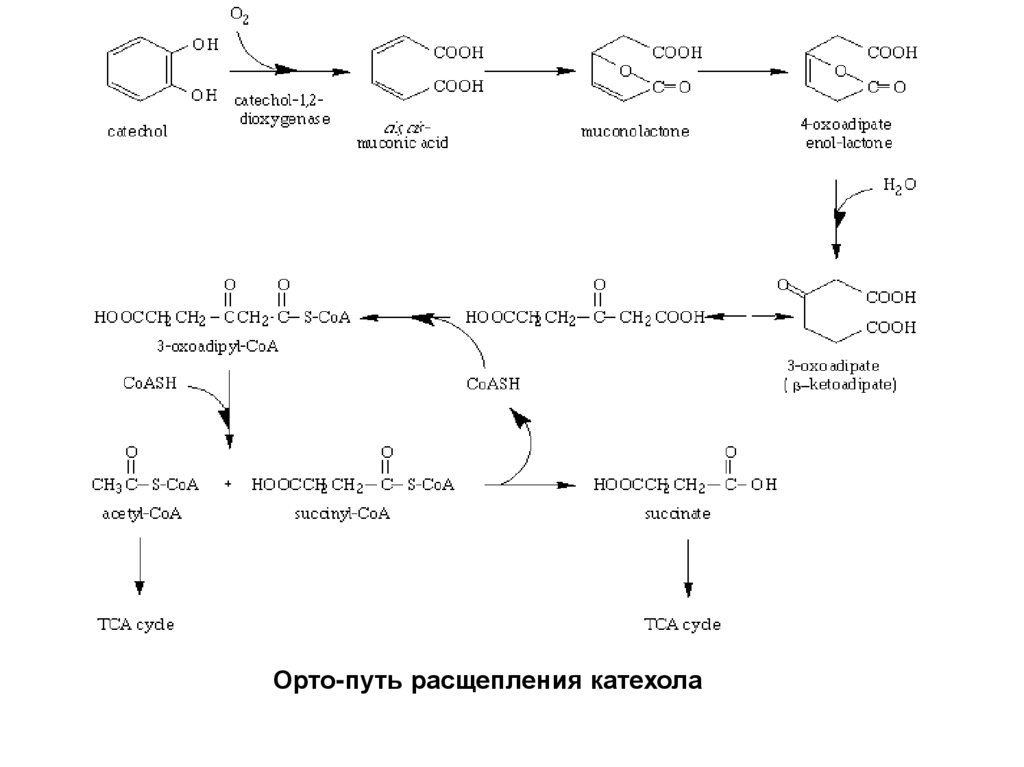
1. Орто-расщепление, при котором связи в бензольном
кольце рвутся между двумя гидроксилированными
атомами углерода
2. Мета-расщепление, при котором связь рвется между
гидроксилированным и соседним незамещенным атомом.
Любая из реакций расщепления бензольного кольца
катализируется диоксигеназами. Дальнейшие реакции
могут различаться, но все они ведут к интермедиатам
Цикла трикарбоновых кислот (напр. сукцинат) или
веществам, которые могут быть включенными в этот цикл
в результате несложных преобразований (пируват,
ацетальдегид).
19.
Орто-путь расщепления катехола20.
Мета-путь расщепления катехолов21.
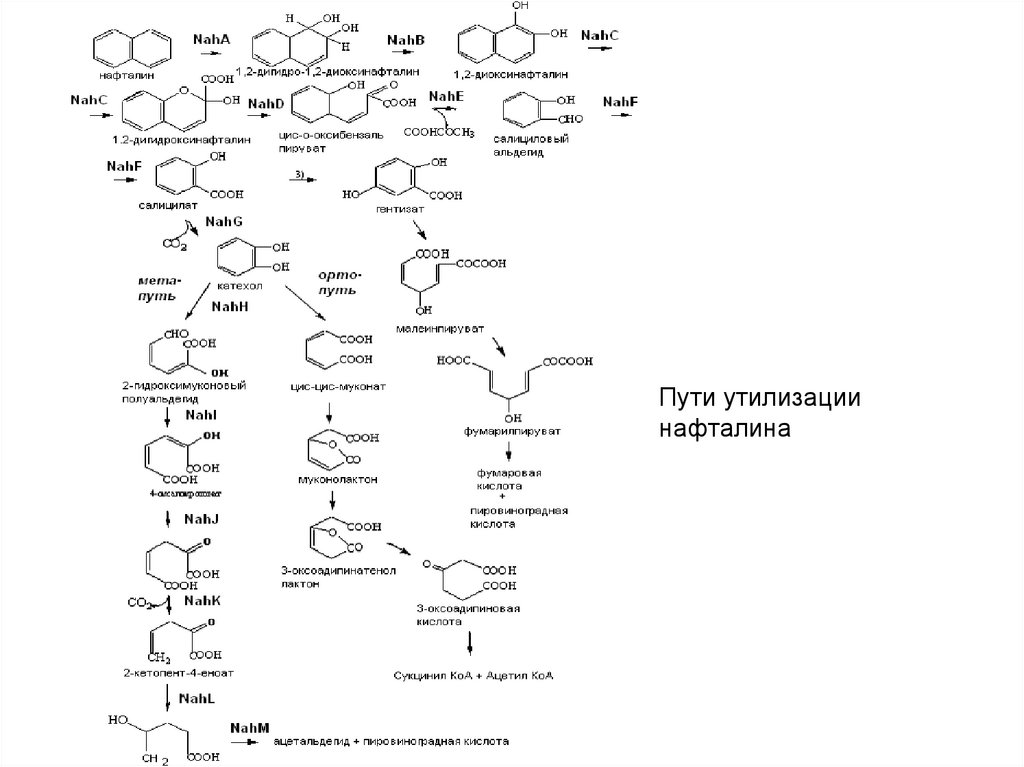
4 способа катаболизма нафталина аэробными бактериями:1. Неполное окисление нафталина до салициловой кислоты, с
высвобождением пирувата и накоплением салициловой кислоты в
ростовой среде
2. Полный катаболизм
расщепления катехола
нафталина
через
салицилат
по
мета-пути
3. Полный катаболизм нафталина через орто-путь расщепления катехола
4. Полный катаболизм нафталина через гентизиновую кислоту
22.
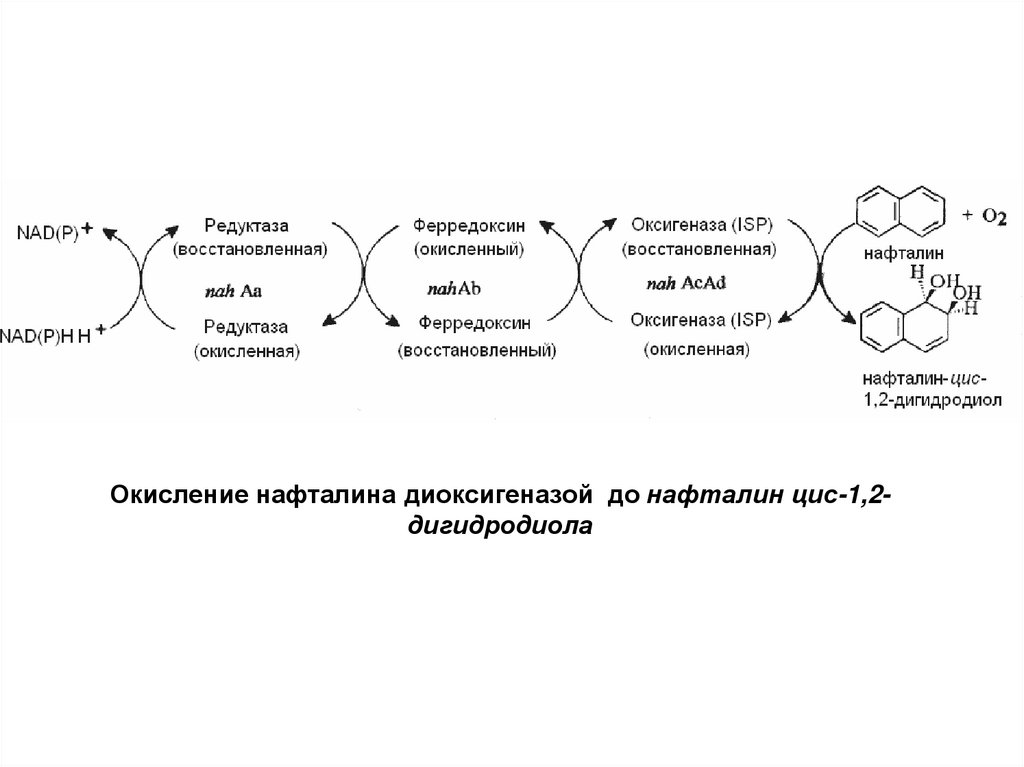
Окисление нафталина диоксигеназой до нафталин цис-1,2дигидродиола23.
Пути утилизациинафталина
24.
Гены,детерминирующие
синтез
ферментов
утилизации нафталина, входят в состав двух
оперонов. Установлено, что «верхний» оперон
является достаточно консервативным и, как
правило,
имеет
плазмидную
локализацию.
Продуктом
окисления
нафталина,
детерминируемым генами «верхнего» оперона,
является салициловая кислота, за дальнейшее
расщепление которой отвечает «нижний» оперон.
Было установлено, что мета-путь всегда кодируется
плазмидными генами, а орто-путь метаболизма
катехола определяется, как правило, хромосомными
детерминантами и очень редко генами плазмидного
происхождения.
25.
Гены биодеградации плазмид NAH7 и pDTG1организованы в 2 оперона. В частности, у плазмиды
pDTG1 9 генов составляют так называемый оперон
«верхнего»
пути
или
nah–оперон
(nahAaAbAcAdBFCED), катализирующий окисление
нафталина до салицилата, остальные 11 генов
(nahGTHINLOMKJY) входят в оперон «нижнего» пути
(sal-оперон),
кодирующий
ферменты
окисления
салицилата по мета-пути. Мутации генов первого и
второго оперонов приводят к образованию ростовых
фенотипов Nah–Sal+ и Nah+Sal– соответственно.
Существование третьего фенотипа Nah–Sal– обусловлено
мутацией регуляторного гена nahR, расположенного
между оперонами в случае плазмиды NAH7 или перед
sal-опероном – у pDTG1.
26.
Гены биодеградации плазмиды pDTG1 собраны в 2кластера размером 9542 п.н. и 13381 п.н., что
составляет 27.6% от полной нуклеотидной
последовательности плазмиды. В составе плазмиды
pDTG1 был обнаружен ген nahY, кодирующий, как
предполагается, белок хемотаксиса. Было показано,
что мутанты P. putida G7 по nahY-гену сохраняют
способность расти на нафталине, но не проявляют
хемотаксиса по отношению к нему, что несколько
замедляет процесс его биодеградации.
27.
В отличие от плазмиды NAH7, оба оперона которой считываются в одномнаправлении, для pND6-1 и pDTG1 характерна разнонаправленная транскрипция:
опероны транскрибируются в направлении «навстречу друг другу»
28.
Был исследован механизм регуляции nah-генов плазмидыNAH7. В клетках P. putida (NAH7), растущих в отсутствие
салицилата, наблюдается низкий уровень транскрипции и
трансляции nah-детерминант. Добавление в среду салицилата
(или
нафталина,
который
медленно
может
быть
метаболизирован в салицилат) приводит к активации
транскрипции, опосредованной продуктом гена nahR.
Предположительно, белок NahR связывается с салицилатом или
салициловым альдегидом и переходит, согласно модели
позитивной регуляции, в активную форму, обеспечивая
активацию
транскрипции
nah-оперонов.
NahR-белок
локализован в цитолазме и принадлежит к LysR-семейству
активаторов транскрипции. Промоторы nah-оперонов содержат
канонические последовательности, проявляющие значительную
гомологию в области «- 10» и «- 35» с аналогичными
функциональными единицами промоторов E. coli.
29.
Для плазмид биодеградации нафталина характерна высокая степеньлабильности генетического материала, на что указывает наличие в их
составе повторяющихся последовательностей ДНК. Они содержат ряд
мобильных генетических элементов (в состав данных мобильных элементов
входят гены, детерминирующие белки гомологичные фаговым интегразам,
Tn5053-подобным резольвазам), а также ряд дефектных транспозонов, в
состав которых входят делетированные гены, способные детерминировать
полипептиды гомологичные известным интегразам, транспозазам,
резолвазам. В частности, для плазмиды NAH7 показано, что nah-гены
входят в состав транспозона Tn4655. Однако данный мобильный элемент
является дефектным поскольку не содержит гена tnpA, детерминирующего
синтез белка транспозиции. Перемещение данного мобильного элемента
может происходить только в присутствии полноценной tnpA-детерминанты,
локализованной вне области транспозона. Наличие повторяющихся
последовательностей в составе плазмид биодеградации нафталина
обеспечивает возможность различных генетических перестроек на уровне
отдельных генов и генома в целом, что наряду с локализацией
катаболических оперонов в составе конъюгативных плазмид и
транспозонов обеспечивает высокую эволюционную пластичность данных
функциональных единиц.
30.
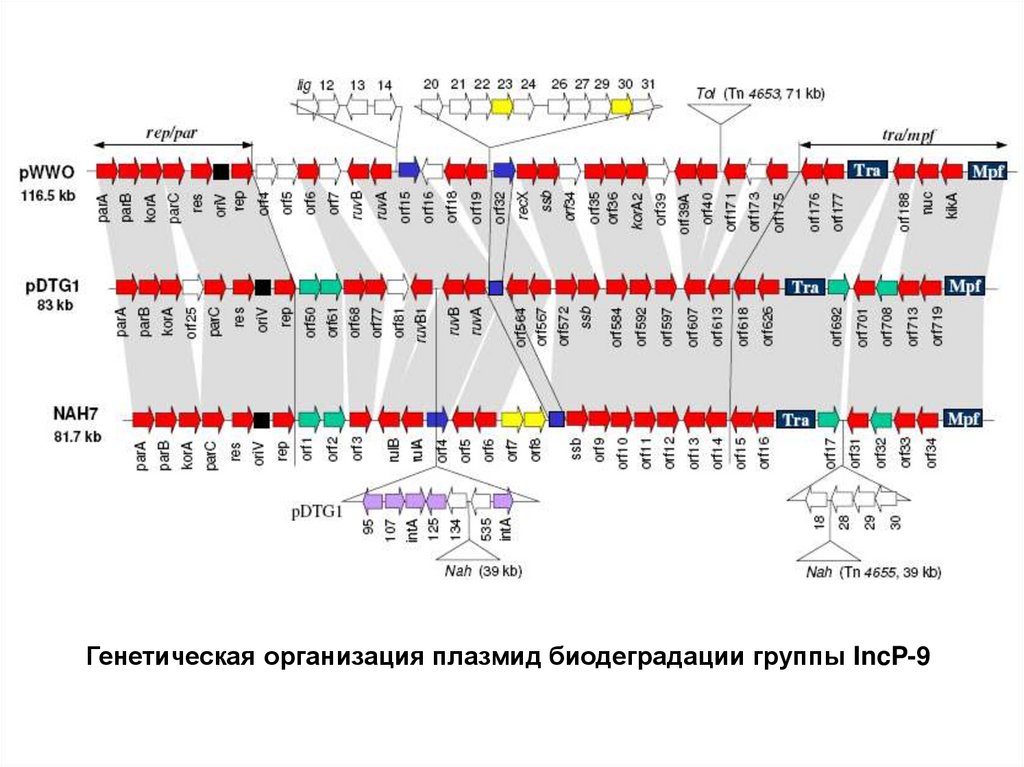
Плазмида pWWO рассматривается как архетип для целой группы плазмид,контролирующих окисление таких ароматических соединений, как мета- и
пара-ксилолы, толуол, 3-этилтолуат, 1,2,4-триметилбензол. Плазмида
pWW0, выделенная из клеток Pseudomonas putida mt-2, была первой
идентифицированной TOL плазмидой. Размер данной плазмиды составляет
116, 58 т.п.н. Анализ полной нуклеотидной последовательности выявил
присутствие в ее составе 148 открытых рамок считывания, 77 из которых
аналогичны известным последовательностям, связанным с репликацией,
стабильностью, конъюгационным переносом. Было показано, что гены
деградации толуола и ксилола входят в состав транспозонов Tn4651 и
Tn4653. Области, выполняющие функции репликации и стабильного
поддержания сходны с таковыми других плазмид группы IncP-9.
Организация генов конъюгационного переноса сходна с соответствующими
детермнантами плазмид группы несовместимости IncW. Были также
идентифицированы
гены,
определяющие
устойчивость
к
ультрафиолетовому излучению, ионам тяжелых металлов. Помимо клеток
псевдомонад, данная плазмида способна наследоваться в клетках бактерий
семейства Enterobacteriaceae (в частности E. coli и Erw. chrysanthemi).
31.
Гены pWW0, кодирующие ферменты биодеградации,организованы в два оперона: «верхний» 7 генов
(xylUWCMABN)
и
«нижний»
13
генов
(xylXYZLTEGFJQKIH). Ген xylE, кодирующий
фермент катехол-2,3-диоксигеназу, обладает 80%
гомологией с изофункциональным геном nahH
плазмиды NAH7, что свидетельствует о вероятном
происхождении их от общего предшественника.
Анализ данной детерминанты выявил ее сходство с Nконцевой последовательностью плазмиды NAH7 и с
С-концевой частью гена катехол-2,3-диоксигеназы
плазмиды деградации толуола pDK1 и, что
свидетельствует о гибридном происхождении данной
детерминанты.
32.
Генетическая организация плазмид биодеградации группы IncP-933.
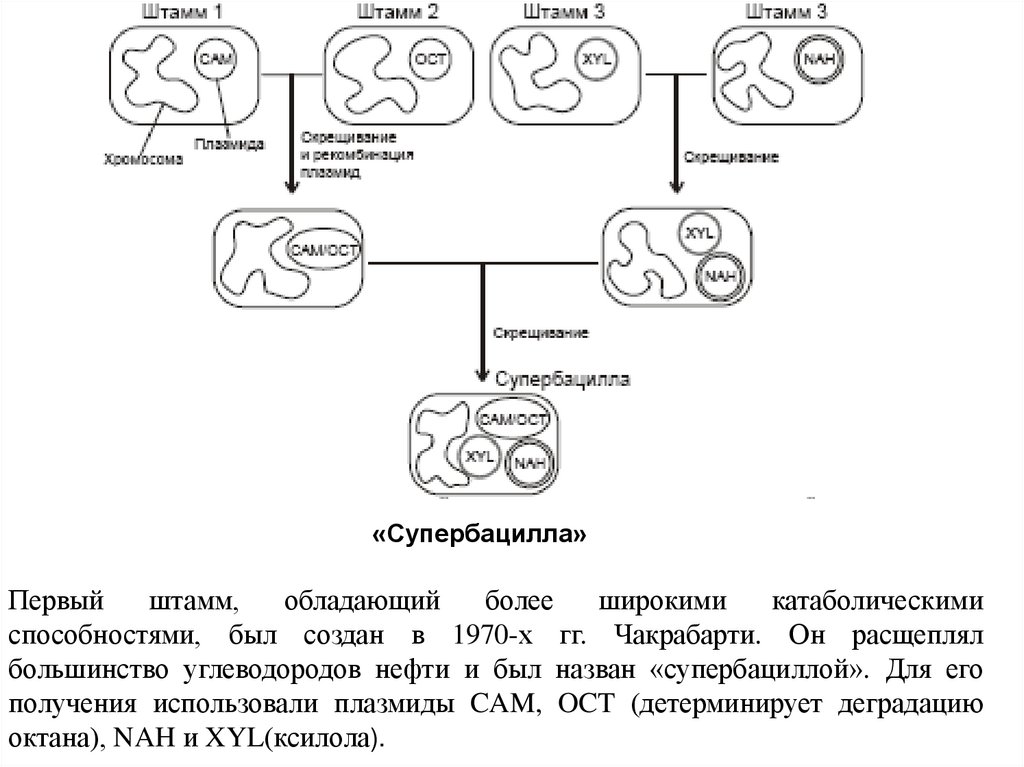
«Супербацилла»Первый
штамм,
обладающий
более
широкими
катаболическими
способностями, был создан в 1970-х гг. Чакрабарти. Он расщеплял
большинство углеводородов нефти и был назван «супербациллой». Для его
получения использовали плазмиды CAM, OCT (детерминирует деградацию
октана), NAH и XYL(ксилола).
34.
При переносе плазмиды pWRl, содержащей геныбиодеградации хлоркатехола, из Pseudomonas sp. В13 в
Alcaligenes A7, способный к росту на феноле, был получен
гибридный штамм Alcaligenes A7-2, утилизирующий все три
изомера хлорфенолов.
С помощью клонирования генов плазмид TOL (xylD, xylL) и
NAH (nahG), кодирующих ферменты с широкой субстратной
специфичностью,
были
сконструированы
гибридные
катаболические пути и получены штаммы псевдомонад,
способные деградировать различные хлорбензоаты (гены TOLплазмиды) и хлорсалицилаты (ген nahG).
35.
Исследовано разложение ДДТ (дихлордифенилтрихлорэтана),его метаболитов и аналогов (кельтана, метоксихлора и др.)
штаммами, сконструированными на основе штамма P.
aeruginosa 640x и несущими плазмиды биодеградации pBS2 и
pBS3. Оказалось, что введение плазмид и, соответственно,
взаимодействие
генетического
материала
плазмид
и
хромосомы позволило получить штаммы, обладающие
значительными отличиями в активности ферментов окисления
ароматического кольца (пирокатехазы, метапирокатехазы), а
также способны более активно разлагать ДДТ и его аналоги по
сравнению с исходным штаммом.
36.
Борониным А.М. и соавт. была получена плазмидаNPL-41, которая является регуляторным мутантом
плазмиды NPL-1 с конститутивным синтезом
ферментов
окисления
нафталина.
Штаммы,
содержащие плазмиду NPL-41, способные к росту на
нафталине, но не растущие на салицилате, могут быть
использованы для микробиологического синтеза
салициловой кислоты из нафталина, которая широко
применяется в фармацевтической и химической
промышленности.
37.
В качестве репортерных генов, продукты которых приводятк изменению окраски микроорганизмов при их росте на
соответствующих средах, используются ген xylE плазмиды
TOL и ген nahA плазмиды NAH.
Ген nahA кодирует нафталин–1,2-диоксигеназу, способную,
помимо окисления нафталина, также окислять индол с
образованием цис-2,3-дигидродиола, который затем без
участия каких-либо ферментов окисляется кислородом
воздуха и превращается в синий краситель индиго.
Бактерии, содержащие ген nahA плазмиды NAH,
приобретают голубую окраску при условии, что они
способны к синтезу индола из триптофана (E. coli) или же
при добавлении индола в среду для роста.
38.
Ген xylE кодирует катехол-1,2-диоксигеназу, котораяпревращает бесцветный субстрат катехол в ярко-жёлтый
продукт 2-гидроксимуконовый полуальдегид. Уже простое
опрыскивание раствором катехола бактериальных колоний,
содержащих ген xylE, приводит к их окрашиванию в
жёлтый цвет. Тест является очень простым и не требует
специального хромогенного субстрата, а также является
очень чувствительным и позволяет обнаружить катехол-1,2диоксигеназу при её концентрации ниже 5 миллиединиц на
1 мг белка. Ген xylE широко используется в анализе
регуляции катаболических оперонов, конструировании
векторов
для
клонирования
промоторов
для
грамположительных, грамотрицательных бактерий и
дрожжей.
39.
Помимоотдельных
структурных
генетических
детерминант
применение
находят и отдельные регуляторные элементы
плазмид биодеградации. Так, регуляторный
ген nahR (со своим промотором PsaI)
плазмиды NAH может быть использован в
системах
регулируемой
экспрессии
репортерных и (или) маркерных генов для
штаммов,
которые
применяются
в
биоремедиации.
40.
Создание сенсорных бактерий на основе штамма P. fluorescens 5Rосуществлялось в два этапа.
На первом этапе был осуществлен транспозонный мутагенез с
использованием суицидального вектора pUCD623, содержащего
транспозон Tn4431, в состав которого входили гены luxCDABE.
Данный мобильный генетический элемент был изолирован из
штамма Vibrio fischeri MJ-1, паразитирующего на световом органе
рыб Monocentris japonicas. Помимо генов luxCDABE в состав
Tn4431 входили гены транспозона Tn5 и фрагменты ДНК
бактерий E. coli D1021. В результате встраивания данного
мобильного элемента в состав плазмиды pKA1 был отобран
вариант бактерий P. fluorescens 5RL (nah+ sal− lux+), способных
биолюминесцировать в присутствии нафталина или салицилата,
но утративших свойство
деградировать
нафталин
до
интермедиатов цикла Кребса в результате встраивание lux-генов в
состав «нижнего» sal-оперона.
41.
На втором этапе транспозонсодержащий вариант плазмиды pKA1(плазмида pUTK21) был передан путем конъюгации в бактерии
P.fluorescens 18H (nah− sal+ lux−), выделенные из загрязненной
углеводородами почвы. В результате был отобран штамм
P. fluorescens HK44 (nah+ sal+ lux+), способный полностью
утилизировать нафталин и люминесцировать в присутствии
широкого спектра углеводородов. При этом регистрировали
линейную зависимость увеличения биолюминесценции от
концентрации загрязнителя. Следует отметить, что биосенсорные
бактерии P. fluorescens HK44 являются одними из первых, для
которых
показана
возможность
использования
для
количественного
и
качественного
анализа
загрязнения
окружающей среды опасными углеводородами. В настоящее время
определена полная нуклеотидная последовательность генома
данных микроорганизмов (регистрационный номер в GenBank
AFOY00000000).
42.
Несколько иной тип биосенсоров был создан на основе бактерий,содержащих плазмиды деградации капролактама. В данном случае,
для диагностики загрязнения капролактамом использовали физикохимический подход в сочетании с биологическим. Было создано два
типа сенсоров (кюветный и проточно-инжекционный), принцип
работы которых заключался в регистрации дыхательной активности
микроорганизмов (измерение концентрации кислорода) с помощью
кислородного электрода, на рабочей поверхности которого
фиксировали иммобилизованные в агаровом геле бактериальные
клетки. При добавлении раствора, содержащего капролактам,
микроорганизмы окисляли субстрат, в результате чего в
приэлектродном пространстве снижалась концентрация кислорода,
что регистрировали с помощью электрода Кларка, сопряженного с
гальваностатом-потенциостатом.
На
монитор
компьютера,
интегрированного с биосенсорной системой, выводилось
графическое отображение изменения силы тока, протекающего в
системе, во времени. Данный метод позволял обнаружить
капролактам в концентрации 0,005 мМ/л.




























 biology
biology