Similar presentations:
Производство серной кислоты
1.
Цели обучения:10.4.2.2 объяснять процесс
производства серной кислоты;
10.4.2.3 понимать данный процесс
как равновесный, и уметь
предсказывать воздействие
изменения условий на выход
целевого продукта;
10.4.2.4 знать области применения
серной кислоты в промышленности;
10.4.2.5 оценить экологические
последствия производства серной
кислоты и способы сокращения
выбросов заводами;
2.
План изученияпроизводства
Сырьё.
Химические реакции и условия их
протекания с максимальной скоростью
для получения данного продукта.
Принципы химического производства.
Технологическая схема и аппараты для
эффективного использования сырья и
энергии.
3.
Сырье для производствасерной кислоты
Сера (S)
Сульфиды цветных металлов
Cu2S, ZnS
Пирит (серный колчедан) FeS2
4.
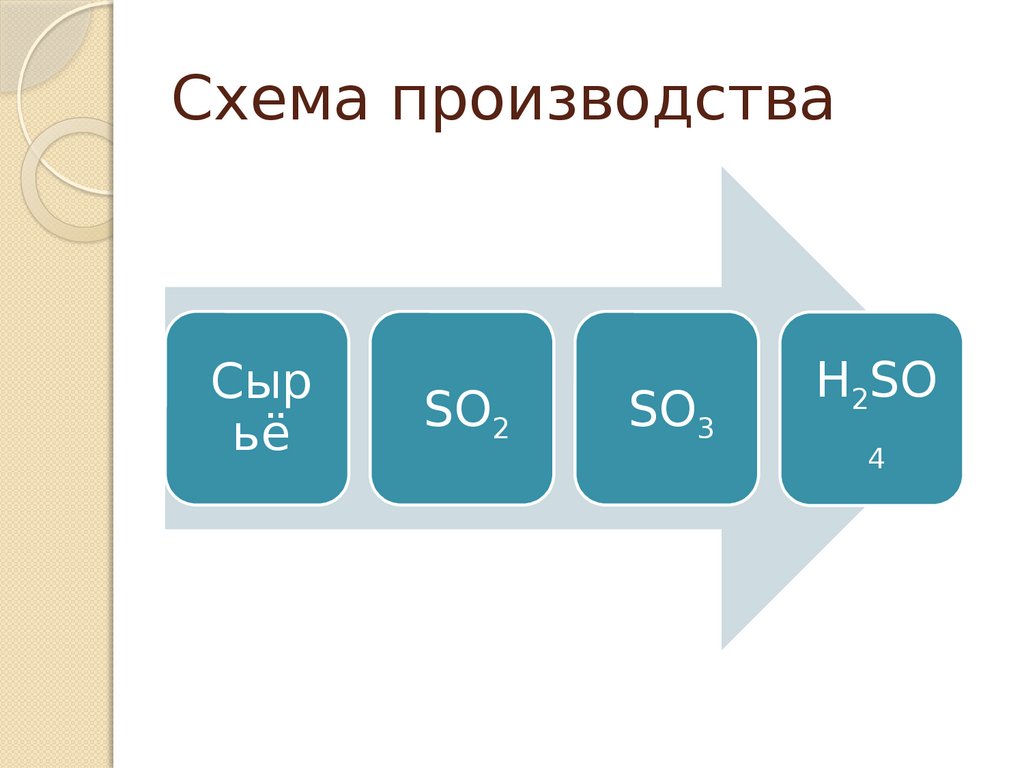
Схема производстваСыр
ьё
SO2
SO3
H2SO
4
5.
I стадия4FeS2 +11O2→2Fe2O3 + 8SO2 + Q
Печь для обжига в
«Кипящем слое»
Процесс гетерогенный
1) Измельчение пирита
2) «метод кипящего
слоя»
0
3) T=800 C, отвод
лишнего тепла
4) Увеличение
концентрации O2 в
воздухе
6.
Промежуточные стадииОчистка печного газа от загрязнения
1. Аппарат циклон
(центробежная сила)
2. Электрофильтры
(электростатическое
притяжение»
7.
Промежуточные стадииОсушение и нагревание печного газа
1. Сушильная башня
(принцип противотока,
насадки)
2. Теплообменник
8.
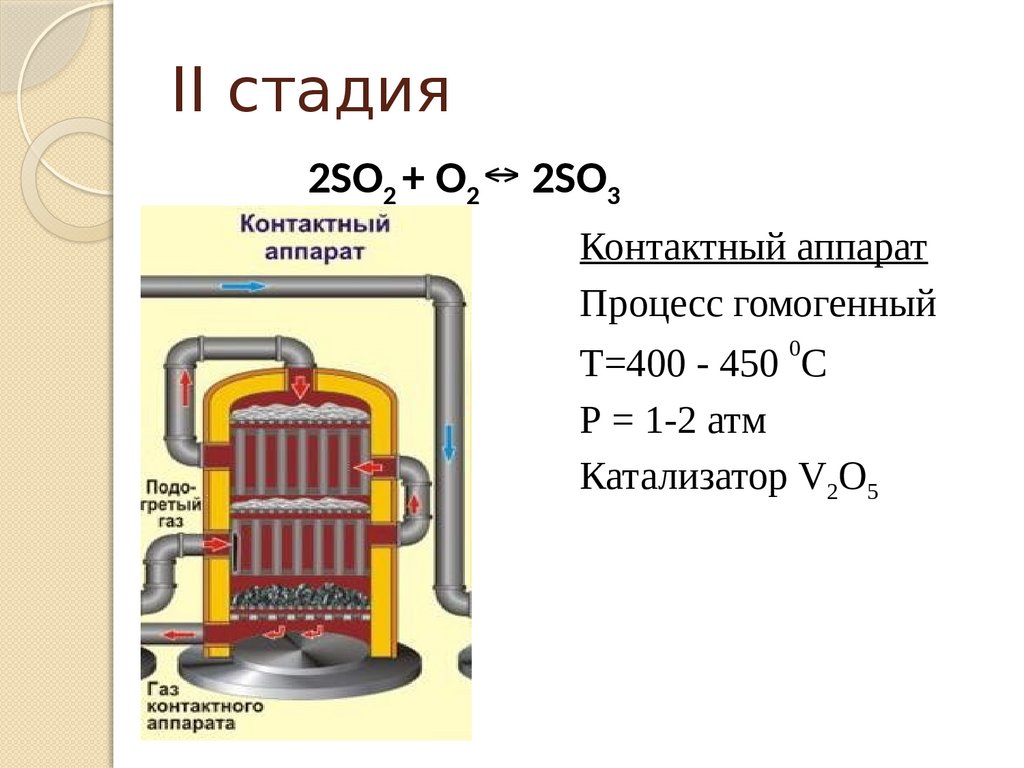
II стадия2SO2 + O2 ↔ 2SO3
Контактный аппарат
Процесс гомогенный
0
T=400 - 450 C
Р = 1-2 атм
Катализатор V2O5
9.
Задание:При каких условиях химическое
равновесие системы: 2SO2 + O2 ↔ 2SO3
+ Q сместиться в сторону
образования продукта реакции SO3?
Ответ:
1) При увеличении концентрации одного или
всех исходных веществ;
2) При понижении температуры
3) При увеличении даления
10.
III стадияSO3 + H2SO4(конц.) → H2SO4 ∙ n SO3
Поглотительная башня
H2O не используют из-за
образования сернокислотного
тумана.
Принцип противотока.
Керамические насадки.
Олеум – раствор сернистого
газа в концентрированной
серной кислоте
11.
Транспортировка сернойкислоты
Образовавшийся олеум сливают в
металлические резервуары и отправляют на
склад.
Затем олеумом
заполняют цистерны,
формируют
железнодорожные
составы и отправляют
потребителю.
12.
13.
Производство серной кислотыв разных странах
Китай 60 млн.т. в год
США 30 млн.т. в год
Марокко 11 млн.т. в год
Россия 10 млн.т. в год
14.
Производство серной кислоты в разныхстранах.
15.
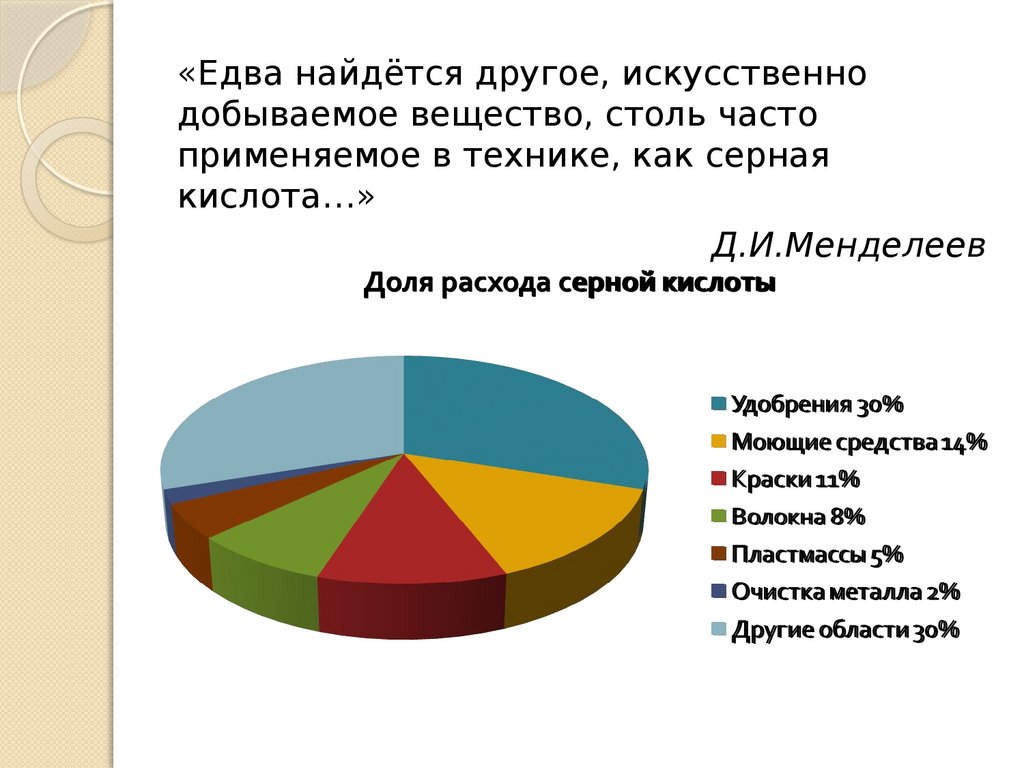
Использование сернойкислоты
Удобрения 30%
Моющие средства 14%
Краски 11%
Волокна 8%
Пластмассы 5%
Травление металлов 2%
Очистка нефти 2%
Другие области 28%
16.
«Едва найдётся другое, искусственнодобываемое вещество, столь часто
применяемое в технике, как серная
кислота…»
Д.И.Менделеев
17.
Экологические проблемыпроизводства серной кислоты
1. Металлизация атмосферы связана с обжигом серного колчедана
FeS2 и других сульфидных руд. При обжиге, протекающем в
«кипящем слое», происходит попадание в атмосферу
измельченных оксидов железа или других металлов.
2. При производстве серной кислоты в атмосферу попадает много
оксида серы (IV) – SO2 т.к. производственные установки не
всегда герметичны.
3. Взаимодействуя с другими компонентами воздуха и
атмосферной влагой, оксид серы (VI) образует мельчайшие
частицы сульфатных солей. Вместе с капельками серной
кислоты они при определенных условиях (дождях, бурях)
образуют «кислотные осадки», которые губят лесные массивы,
нарушают жизнедеятельность водных экосистем, вызывают
серьезные нарушения здоровья животных и человека, особенно
их дыхательной системы.
18.
Очистка газов методомдесульфуризации
Ca(OH)2(р-р) + SO2(г.) → CaSO3↓ + H2O
CaSO3↓ + SO2(г.) + H2O → Ca(HSO3)2(р-р)
Оксид cеры (IV) [SO2] взаймодействует с
водным раствором гидроксида
кальция Ca(OH)2 в две стадии. На первой
стадии образуется осадок
нерастворимого сульфита кальция CaSO3.
На второй стадии полученный осадок
растворяется с получением кислой соли
— гидросульфита кальция Ca(HSO3)2.
19.
20.
Мокрый метод извлечения SO2 из дымовых газовпосле сжигания — десульфуризация дымового
газа (ДДГ) — является наиболее эффективным
способом контроля содержания серы и снижения
загрязнения окружающей среды. Эффективность
метода может достигать до 99%.
Описание процесса
Дымовые газы, попадая в абсорбционную колонну
(скруббер), промываются суспензией «известь в
воде», впрыскиваемой через распылительные
форсунки. Кислые соединения, содержащиеся в
дымовых газах (HCL, HF, SO3 и SO2), вступают в
реакцию с этой суспензией. После процесса
окисления очищенный газ проходит через
каплеуловитель и выводится в атмосферу, а
гипсовая суспензия возвращается обратно в
абсорбционную колонну.
Каплеуловитель в процессе десульфуризации
осуществляет процесс выделения капельной
жидкости из очищенного газового потока перед
тем как он будет выведен в атмосферу.
21.
Домашнее задание:Нурахметов Н.Н.Химия 10
класс Выучить стадии
производства серной кислоты,
области её применения и
страны производителей


















 chemistry
chemistry








