Similar presentations:
Основные положения атомно-молекулярной теории строения вещества
1.
Основные положения атомномолекулярной теории строениявещества
Автор: Сергеева И.А.
2.
Молекулярно-кинетическая теория базируется на следующихосновных положениях:
• Все тела состоят из мельчайших частиц – атомов, молекул и
ионов.
• Частицы, образующие вещество, находятся в непрерывном
хаотическом движении, которое называется тепловым.
• Атомы, молекулы и ионы взаимодействуют друг с другом.
3.
Атом• – наименьшая часть химического элемента, способная к
самостоятельному существованию и являющаяся носителем
его химических свойств.
4.
Молекула• – это наименьшая устойчивая частица вещества,
обладающая его основными химическими свойствами.
• Молекула состоит из атомов одинаковых или различных
химических элементов.
5.
Ион• – электрически заряженная частица, которая образуется
при потере или приобретении атомами и молекулами одного
или нескольких электронов.
6.
• массы атомов и молекул чрезвычайно малы, их удобно измерятьне в килограммах, а в специальных единицах. Такой единицей
является масса атома изотопа углерода 12С:
• 1 a.e.м.= 1/12 mC ~ 1,66·10-27кг
7.
• относительной атомной массой (молекулярной массой)называется отношение массы атома (молекулы) к 1/12 массы
изотопа углерода 12С
8.
• Например, для углекислого газа (СО2) относительнаямолекулярная масса Mr равна: Мr = 12 + 16×2 = 44.
9.
• Количество вещества это число его структурных элементов(атомов, молекул, ионов, электронов и т.д.).
• Моль – это количество вещества, в котором содержится столько
же структурных элементов, сколько атомов содержится в 0,012 кг
изотопа углерода 12С.
10.
• Постоянная Авогадро – число структурных элементов (атомов,молекул, ионов или др. частиц) в 1 моле. Постоянную Авогадро
можно найти, если разделить массу одного моля углерода на
массу одного атома углерода:
11.
12.
• Количество вещества, т.е. число молей, равно отношению числамолекул N в данном теле к числу Авогадро
13.
• Молярная масса – масса одного моля вещества:• где m0 – масса молекулы. Молярная масса выражается в килограммах
на моль (кг/моль).
• Молярная масса М простым образом связана с относительной
молекулярной массой Мr
14.
15.
Модель идеальных газов• Простейшей моделью реальных газов является идеальный газ.–
это газ, для которого можно пренебречь:
• 1) взаимодействием молекул между собой
• 2) собственным объемом молекул газа по сравнению с объемом
сосуда, в котором находится газ.
16.
• Газ характеризуют следующими величинами (параметрамисостояния):
• р (Н/м2 = Па - паскаль) –
• давление – для газов это суммарная сила ударов молекул о
стенки сосуда в расчете на единицу площади поверхности;
• V (м3) - объем;
17.
• Т (К - кельвин) - абсолютная температура или температура пошкале Кельвина;
t (oC) – температура в градусах по шкале Цельсия;
Т(К) = toC + 273,15:
ΔT = Δt;
1 К = 1 oC;
18.
• m (кг) – масса газа;(кг/м3) – плотность – это масса газа, приходящаяся на
единицу объема;
(1/м3) – концентрация молекул – это число молекул в
единице объема.
19.
• Уравнение, связывающее между собой параметры состояния,называется уравнением состояния газа. Уравнение МенделееваКлапейрона:
20.
• R=8,31 Дж/(моль·К) – универсальная газовая постоянная.Используя приведенные выше формулы, уравнение состояния
идеального газа можно записать как:
21.
• Где постоянная Больцмана :22.
Давление газагде р – давление на стенки сосуда. Часто эту
формулу называют основным уравнением кинетической
теории газов. Величину давления можно выразить через
среднюю энергию, приходящуюся на одну молекулу.
23.
• где – средняя кинетическая энергия поступательного движениямолекул газа.
24.
• Числом степеней свободы ( i ) системы называется наименьшеечисло независимых величин, полностью определяющих
состояние системы. Это довольно сложное понятие. В качестве
степеней свободы можно рассматривать координаты, углы по
отношению к осям координат, моменты инерции, кинетическую
и потенциальную энергию и др.
25.
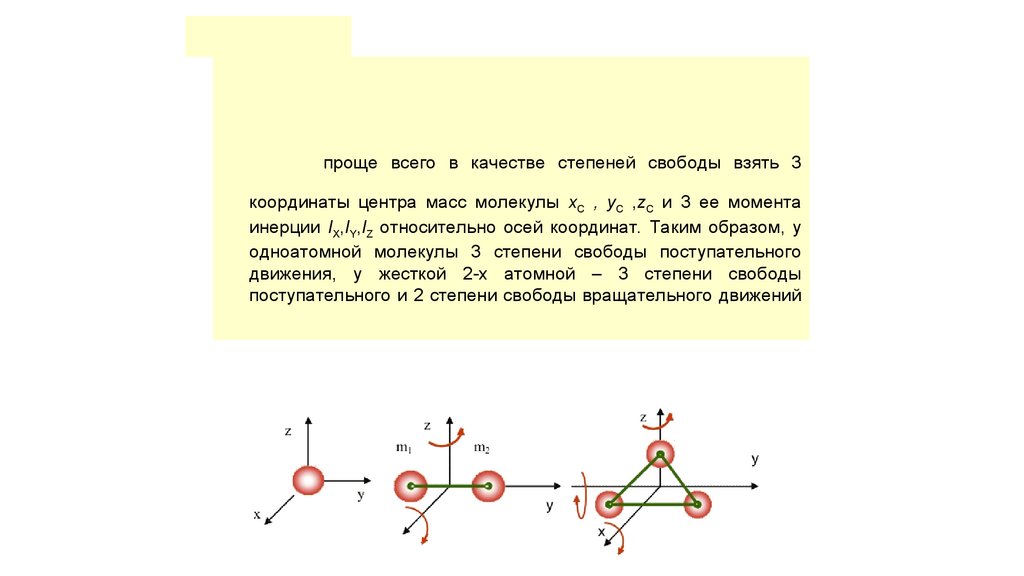
проще всего в качестве степеней свободы взять 3координаты центра масс молекулы xC , yC ,zC и 3 ее момента
инерции IX,IY,IZ относительно осей координат. Таким образом, у
одноатомной молекулы 3 степени свободы поступательного
движения, у жесткой 2-х атомной – 3 степени свободы
поступательного и 2 степени свободы вращательного движений
26.
• В молекулярно-кинетической теории существует• закон равного распределения энергии по степеням свободы
молекул:
• «В состоянии теплового равновесия на каждую степень
свободы приходится в среднем одна и та же энергия, равная
»













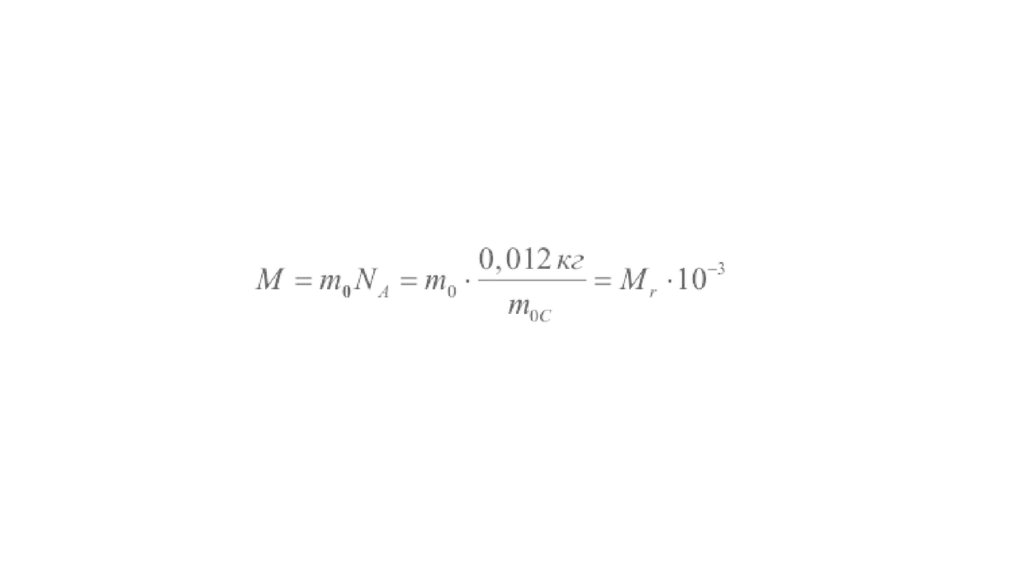











 physics
physics








