Similar presentations:
Термохимиялық реакциялар теңдеулері бойынша есептеулер (2 бөлім). 6-күн
1.
МЕКТЕПТЕГІ ХИМИЯ САБАҒЫ: БАСЫМДЫҚТАР ЖӘНЕЖЕТІЛДІРУ СТРАТЕГИЯЛАРЫ» ПЕДАГОГТЕРДІҢ БІЛІКТІЛІГІН АРТТЫРУ
КУРСЫНЫҢ БІЛІМ БЕРУ БАҒДАРЛАМАСЫ
6 күн
Термохимиялық реакциялар теңдеулері бойынша
есептеулер (2 бөлім)
2.
Мазмұны:Модуль мақсаты:
реакция жағдайларын анықтау
әдістерін талқылау; энтропия мен Гиббс энергиясының
өзгеруіне есептер шығару.
Джозайя Уиллард Гиббс
англ. Josiah Willard Gibbs
3.
Оқу бағдарламасы бойынша оқу мақсаттары10 сынып
10.3.1.5 энтропияны жүйенің ретсіздік өлшемі ретінде түсіндіру және оны
анықтамалық деректер арқылы есептеу;
10.3.1.6 Гиббстің бос энергия өзгерісін түсіндіру және анықтамалық
деректер арқылы есептеу;
10.3.1.7 термодинамикалық мәндер бойынша реакцияның өздігінен жүру
бағытын болжау
4.
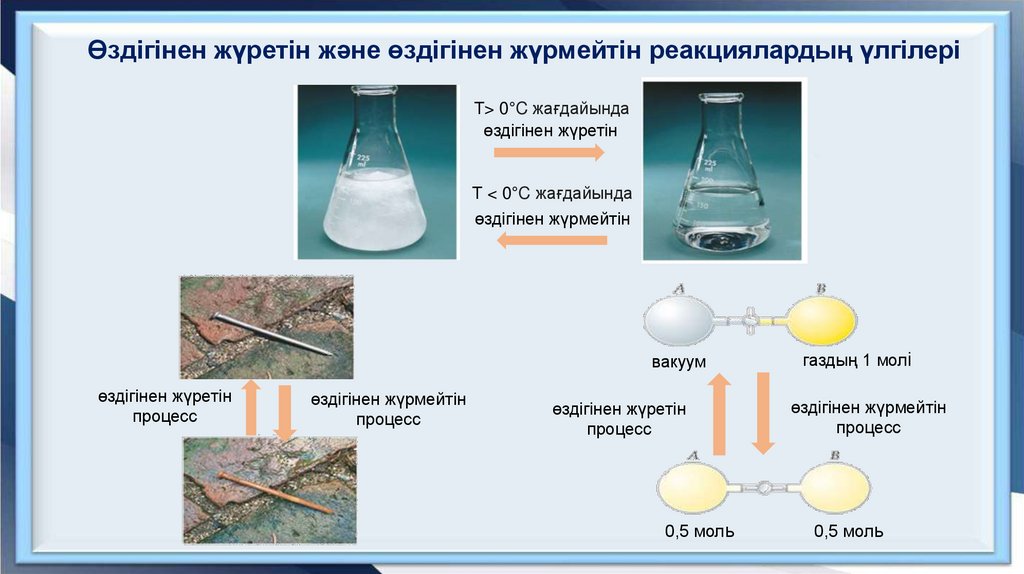
Өздігінен жүретін және өздігінен жүрмейтін реакциялардың үлгілеріТ> 0°C жағдайында
өздігінен жүретін
Т < 0°C жағдайында
өздігінен жүрмейтін
вакуум
өздігінен жүретін
процесс
өздігінен жүрмейтін
процесс
өздігінен жүретін
процесс
0,5 моль
газдың 1 молі
өздігінен жүрмейтін
процесс
0,5 моль
5.
Неліктен эндотермиялық процестер жүреді?Ba(OH)2 ·8H2O(қ) + 2NH4NO3(қ) → Ba2+(сулы) + 2NO3-(сулы) + 2NH3(сулы) + 10H2O(сұй)
DH°р = +62.3 кДж
вода
Бұл реакция қатты заттар араласқан кезде өздігінен жүреді. Реакциялық қоспаның
қоршаған ортадан жылуды сіңіретіндігі соншалық, стақан ылғал бетке қатып
қалады.
Ресурс 6.1
6.
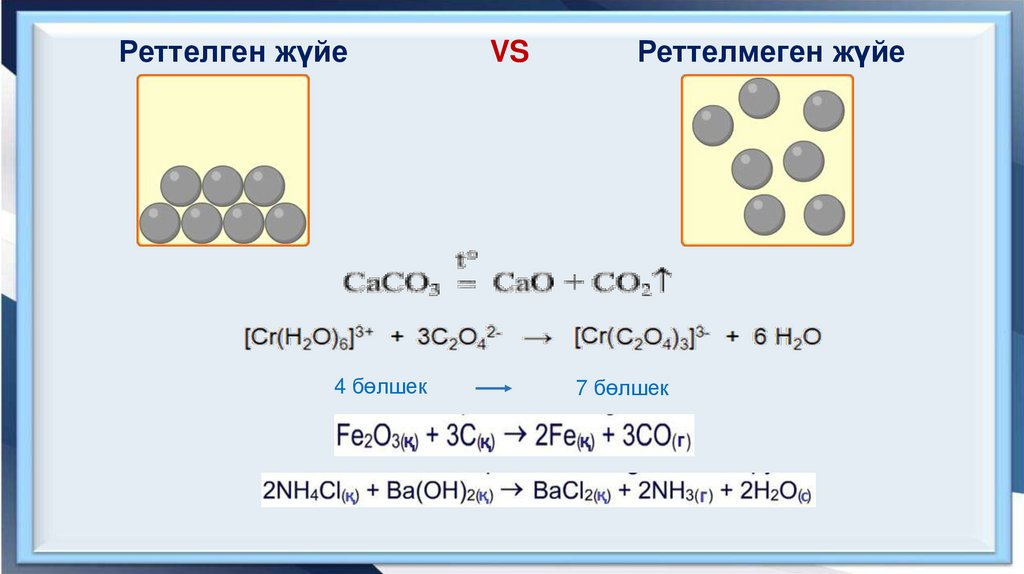
Реттелген жүйе4 бөлшек
VS
Реттелмеген жүйе
7 бөлшек
7.
Бейнеролик көрсетілімі• https://www.youtube.com/watch?v=qH7C43dqTJc
• Талдау
8.
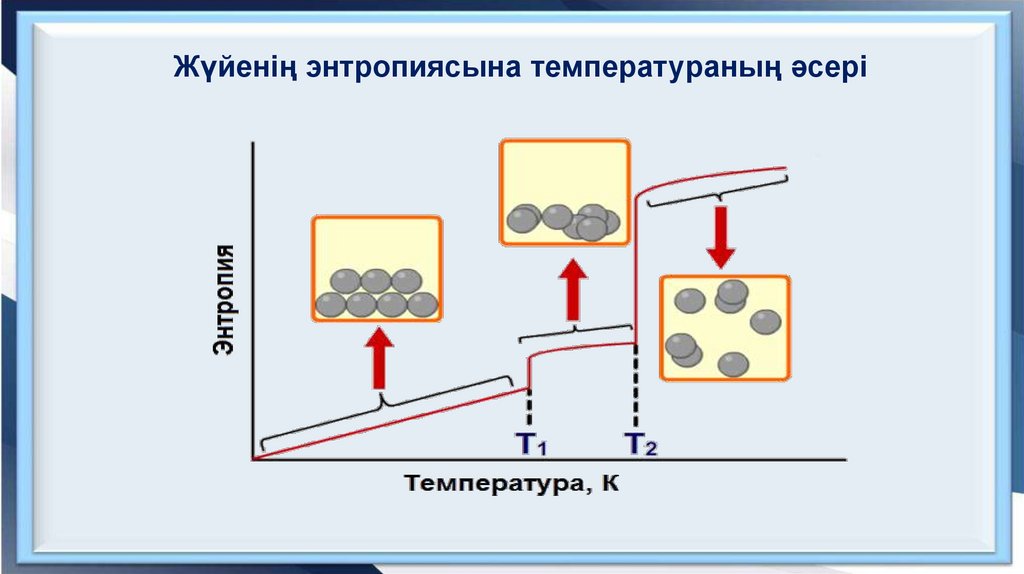
Жүйенің энтропиясына температураның әсері9.
Энтропия өзгерісін есептеуDSo = mSo(өнім) - nSo(реагент)
мұндағы m және n - теңестірілген теңдеудегі
коэффициенттермен анықталатын өнімдер
мен реактивтердің шамалары (моль)
Өлшем бірлігі : Дж/моль·K
25oC-да
Кейбір заттарға арналған стандартты энтропиялар, 298 К
Қатты заттар
Сұйықтар
Газдар
10.
Гиббс энергиясы (бос энергияның өзгеруі)Реакция өздігінен жүре ме, келесілерге
байланысты:
ΔS жүйе энтропиясының өзгеруіне
ΔH жүйе энтальписының өзгеруіне
T
температураға
∆G <0 Өздігінен жүретін
процесс үшін
∆G> 0 Өздігінен жүрмейтін
процесс үшін
∆G = 0 Тепе-теңдік процесі
үшін
ΔG = ΔH – T ΔS
DG°р = mDG°өнім - nDG°реагент
Ресурс 6.2
11.
12.
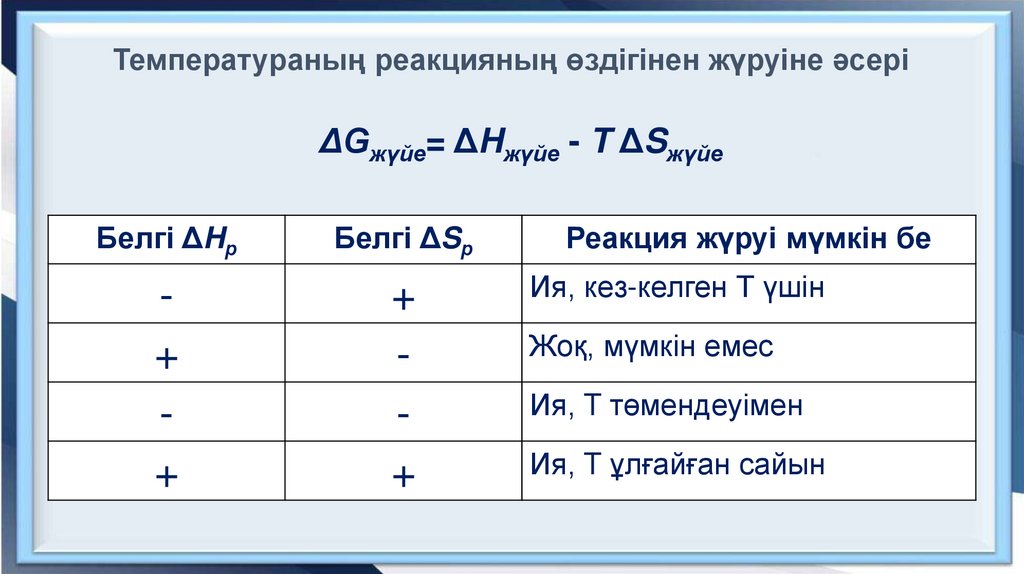
Температураның реакцияның өздігінен жүруіне әсеріΔGжүйе= ΔHжүйе - T ΔSжүйе
Белгі ΔHр
Белгі ΔSр
+
+
+
+
Реакция жүруі мүмкін бе
Ия, кез-келген Т үшін
Жоқ, мүмкін емес
Ия, T төмендеуімен
Ия, T ұлғайған сайын
13.
1.ΔH
<
ΔS
>
ΔG < 0
0
0
2.
ΔH
>
ΔS
<
ΔG > 0
0
0
C2H5–O–C2H5 + 6O2 = 4CO2 + 5H2O
(кез-келген температурада реакция жүруі
мүмкін)
реакция жүруі мүмкін емес
3.
ΔH
<
0
N2 + 3H2 = 2NH3 (төмен температурада жүруі
ΔS
<
0
мүмкін)
ΔG > 0, ΔG < 0
4.
ΔH
>
0
ΔS
>
0 N2O4(г) = 2NO2(г) (жоғары температурада жүруі
мүмкін).
ΔG > 0, ΔG < 0
14.
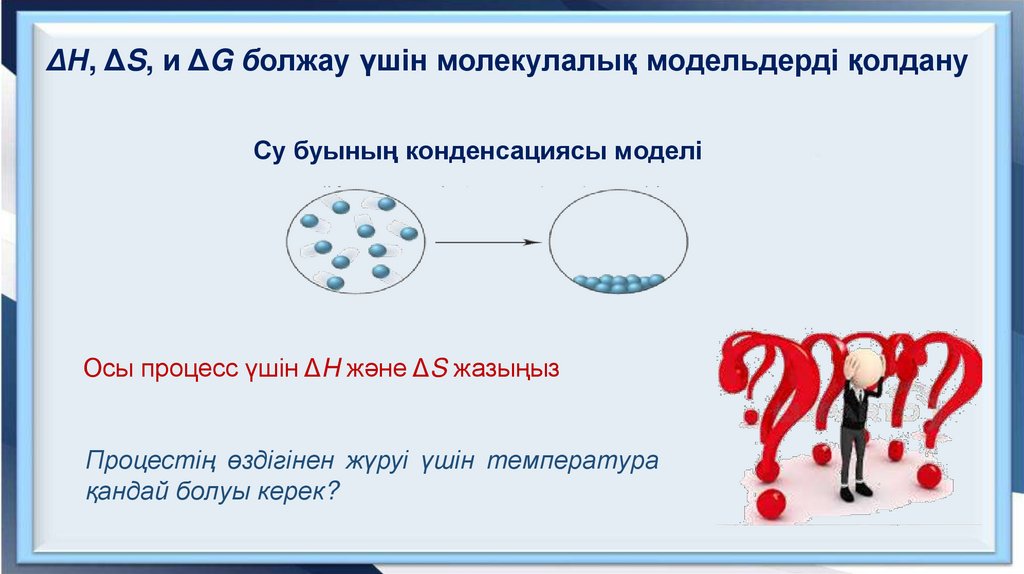
ΔH, ΔS, и ΔG болжау үшін молекулалық модельдерді қолдануСу буының конденсациясы моделі
Осы процесс үшін ΔH және ΔS жазыңыз
Процестің өздігінен жүруі үшін температура
қандай болуы керек?
15.
Бейнежазбаны көрсету және талқылауhttps://www.youtube.com/watch?v=PPfZXepxFAw
16.
Стандартты реакцияның ΔG ° мәнінен ΔGтүз ° реакциясын есептеуЕсеп:
ΔG°түз мәндерін пайдаланып, төмендегі реакция
үшін ΔG°реакцияның есептеңіз:
4KClO3 (қ)
ΔGтүз° (KClO4)
-303.2 кДж/моль
ΔGтүз° (KCl)
-409.2 кДж/моль
ΔGтүз° (KClO3)
-296.3 кДж/моль
3KClO4(қ) + KCl (қ)
17.
Энтальпия мен энтропия мәндерінен ∆G ° реакциясын есептеуТапсырма:
Кестелік
ΔHтүз°
мәліметтерді
қолданып,
ΔH°реакцияның
есептеу үшін және ΔS° мәнін ΔS°реакцияның есептеу үшін
реакцияның ΔG° анықтау.
4KClO3 (қ)
3KClO4 (қ) + KCl (қ)
ΔHтүз°(KClO4)
-432.8 кДж/моль
ΔS° (KClO4)
151.0 Дж/моль·K
ΔHтүз° (KCl)
-436.7 кДж/моль
ΔS° (KCl)
82.6 Дж/моль·K
ΔHтүз° (KClO3)
-397.7 кДж/моль
ΔS° (KClO3)
142.97 Дж/моль∙К
18.
РефлексияСөйлемдерді жалғастыру:
Бүгінгі сессияда
қайталадым…………………….
Бүгінгі сессияда мен
бекіттім……………………
Бүгінгі сессиясда мен
білдім…………………….
Бүгінгі сессияда маған ұнады ....
......................
18












 chemistry
chemistry








