Similar presentations:
Термохимия. Термохимиялық теңдеулер. Гесс заңы. Жылусыйымдылық. Реакцияның жылу эффектісінің температураға тәуелділігі
1.
ҚЕАҚ С. Ж. Асфендияров атындағы ҚазақҰлттық медицина университеті
Термохимия. Термохимиялық
теңдеулер. Гесс заңы.
Жылусыйымдылық. Реакцияның
жылу эффектісінің температураға
тәуелділігі. Кирхгоф заңы
Алматы , 2024
2.
Жоспары:1.
2.
3.
4.
Химиялық термодинамика . Негізгі
түсініктер;
Термохимия.Термохимия заңдары
Химиялық реакцияның жылу эффектісі.
Гесс заңы және одан шығатын салдарлары.
Кирхгофф заңының дифференциалдық
және интегралдық түрі
3.
3. Химиялық реакцияның жылу эффектісі. Гессзаңы және одан шығатын салдарлары. Кирхгофф
заңы
• Термохимия – химиялық реакциялар энергиясын зерттейтін химия тарауы.
• Калориметр – химиялық реакциялардың жылулық эффектісін өлшеуге арналған
құрал.
• Реакция энтальпиясы (∆Hr) – изобаралық-изотермиялық жағдайда химиялық
реакция нәтижесінде бөлінетін немесе сіңірілетін жылу мөлшері.
• Экзотермиялық процестер – жүйеден қоршаған ортаға энергия бөле жүретін
процесстер.
• Эндотермиялық процесстер – жүйенің қоршаған ортадан энергия сіңіре жүретін
процесстер.
• Термохимиялық теңдеулер – жылулық эффектілерді ескере жазылған химиялық
реакция теңдеулері.
• Химиялық қосылыстың түзілу стандартты энтальпиясы(жылуы)(∆H0r) –
стандартты жағдайда жай заттардан 1 моль күрделі зат түзілгенде бөлінетін
немесе сіңірілетін жылу мөлшері.
4.
⮚Химиялық қосылыстың ыдырау (жылуы) (∆H0ыд) –стандартты жағдайда 1 моль күрделі зат жай заттарға
ыдырағанда бөлінетін немесе сіңірілетін жылу мөлшері.
⮚Стандартты жағдайлар:
❖ зат мөлшері n=1моль;
❖қысым p=101325 Па;
❖температура T=298,15 К.
⮚Жай заттардың стандартты түзілу жылуы - қ.ж. 1 моль
күрделі зат жай заттардан түзілгендегі реакцияның жылу
эффектісі. оларға тиімді термодинамикалық күйінде
стандартты жағдайда нөлге тең деп алынады.
⮚Жану энтальпиясы (жылуы) (∆H0ж) – берілген заттың 1
молінің оттекпен жоғары оксидтер түзілгенге дейін тотығу
реакциясының жылу эффектісі.
5.
ТермохимияТермохимия –
химиялық динамиканың бөлімі, ол химмиялық
реакциялардың жылу эффектісін және
реакцияның жүру барысындағы элементтердің
физико-химиялық параметрлеріне тәуелділігін
қарастырады. Сонымен қатар термохимия
мақсатына жылудың фазалық өтулер, ерулер,
қосылу, тағы басқа процестер, жылу
сыйымдылықты меңгеру және заттардың
энтальпиясы мен энтропиясы кіреді.
6.
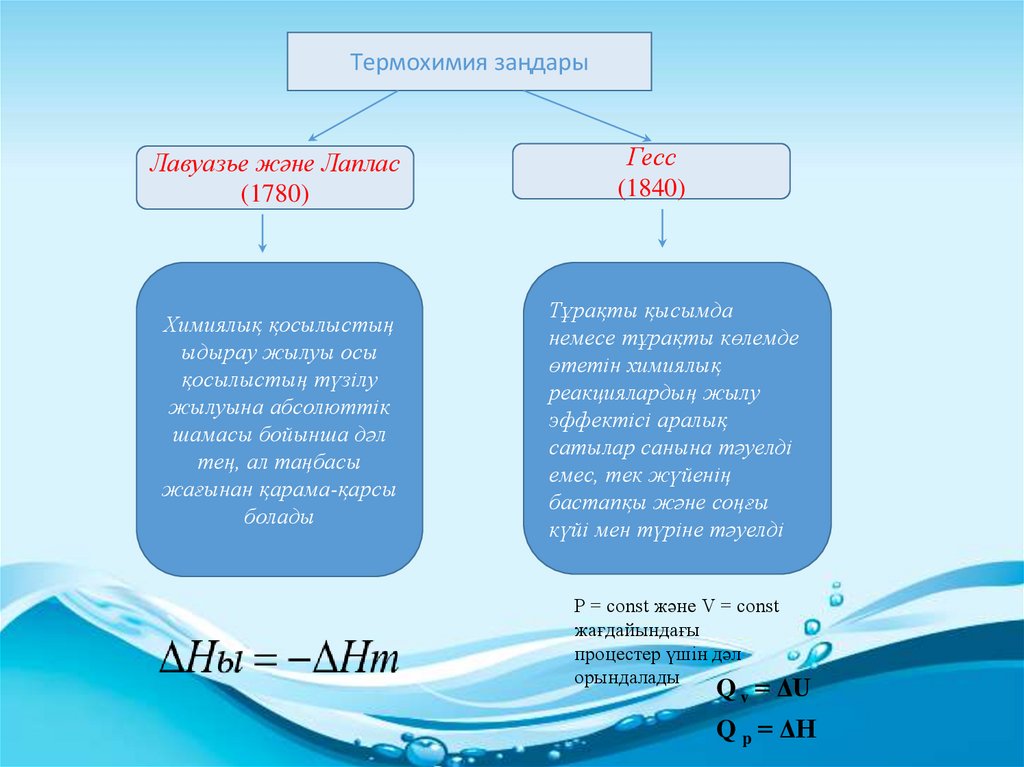
Термохимия заңдарыЛавуазье және Лаплас
(1780)
Химиялық қосылыстың
ыдырау жылуы осы
қосылыстың түзілу
жылуына абсолюттік
шамасы бойынша дәл
тең, ал таңбасы
жағынан қарама-қарсы
болады
Гесс
(1840)
Тұрақты қысымда
немесе тұрақты көлемде
өтетін химиялық
реакциялардың жылу
эффектісі аралық
сатылар санына тәуелді
емес, тек жүйенің
бастапқы және соңғы
күйі мен түріне тәуелді
P = const және V = const
жағдайындағы
процестер үшін дәл
орындалады
Q v = ΔU
Q p = ΔН
7.
Гесс заңы1840 жылы Гесс атты
химик тамаша заң ашты,
кейіннен осы заңға оның
аты беріліп, бұл заң
реакцияның жылу
эффектісін, заттардың
түзілу жылулығын немесе
олардың жануын
есептеуге мүмкіндік
береді.
8.
Гесс заңыТермохимияның негізі Гесс заңы болып саналады. Кейде
оны реакция жылулары қосындыларының тұрақтылығы
туралы заң деп те атайды және ол былайша
тұжырымдалады:
химиялық реакциялардыц жылу эффектісі реакцияға
қатысатын жэне одан алынатын заттардық табиғаты
жэне күйімен анықталады да арадағы сатылай жүретін
химиялық реакцияларға тәуелсіз, яғни әуелгі күйден соңғыға
ауысу әдісіне де байланысты емес.
9.
Гесс заңыГесс заңы химиялық реакцияның жылу эффектісін
сипаттайды.
Реакцияның жылу эффектісі – жүйенің онда болған
химиялық өзгерістер нәтижесінде сіңірген н/е бөліп
шығарған жылу энергиясының мөлшері. Жылу эффектісі
Q н/е ΔH пен белгіленеді (Q= — ΔH) . Жылу бөлінетін
реакциялар (Q>0, ΔH<0) – экзотермиялық, ал сіңіретін
реакциялар (Q<0, ΔH>0) – эндотермиялық зеакцияларға
жатады. Жылу эффектісі көрсетілген реакция теңдеуі
термохимиялық болып табылады:
CH4 + 2O2 = CO2+2H2O + Q (-ΔH)
10.
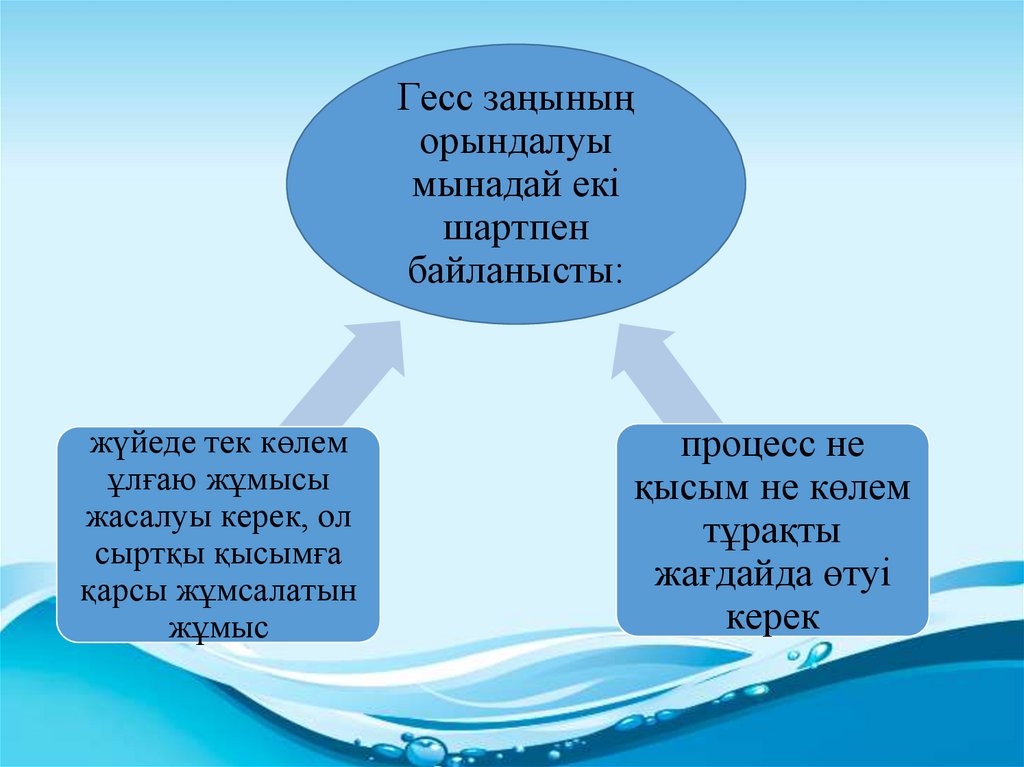
Гесс заңыныңорындалуы
мынадай екі
шартпен
байланысты:
жүйеде тек көлем
ұлғаю жұмысы
жасалуы керек, ол
сыртқы қысымға
қарсы жұмсалатын
жұмыс
процесс не
қысым не көлем
тұрақты
жағдайда өтуі
керек
11.
Энтальпия н/е жылу эффектісі — жүйеніңонда болған химиялық өзгерістер нәтижесінде
сіңірген н/е бөліп шығарған жылу энергиясының
мөлшері.
Энтальпия Qр н/е ΔH пен белгіленеді (Qр = —
ΔH) .Жылу бөлінетін реакциялар ( ΔH<0) –
экзотермиялық, ал сіңіретін реакциялар ( ΔH>0)
– эндотермиялық зеакцияларға жатады. Жылу
эффектісі көрсетілген реакция теңдеуі
термохимиялық болып табылады:
CH4 + 2O2 = CO2 +2H2O + -ΔH.
12.
Гесс заңы тұрақты көлемде жүретін процестерге (онда жылу эффектісіQV = ∆U) және тұрақты қысымда жүретін процестерге (онда жылу
эффектісі Qp = ∆Н) қолданылады.Изобарлық процестер үшін Гесс
заңының сызбнұсқасын былай түсіндіруге болады (сурет 1)
Сурет 1 – Гесс заңын түсіндіретін сызба-нұсқа
А1, А2, А3, ал В1, В2, Ві – бастапқы заттар; ∆Н1 – бірінші жолдың жылу эффектісі;
∆Н2, ∆Н3 – екінші жолдың реакцияларының жылу эффектілері; ∆Н4, ∆Н5 және ∆Н6
– үшінші жолдың жылу эффектілері.
Суретте 1 реакция өнімдерін алудың жолдары көрсетілген. Осы жылу
эффектілерінің Гесс заңы бойынша келесі қатынаста болады:
∆Н1 = ∆Н2 + ∆Н3 = ∆Н4 + ∆Н5 + ∆Н6
13.
Гесс заңын көрнекті етіп түсіндіру үшін бастапқы заттар ретінде оттек пенкөмірді (таза көміртектен тұратын болса), ал реакция өнімі ретінде
көмірқышқыл газын қарастырайық. (Сурет 2)
Сызба-нұсқада көрсетілгендей, көмірді тікелей СО2-ге дейін
тотықтыруға болады.Осы процесті алдымен көмірді көміртек (II)
оксидіне дейін, соңынан тікелей СО2-ге дейі соңынан көміртек (IV)
оксидіне дейін тотықтыру арқылы сатылап жүргізуге де болады.
Екі жағдайда да жүйенің бастапқы күйі (С, О2) мен соңғы күйі
(СО2)бірдей. Алғашқы процестің жылу эффектісі мынаған тең:
С + О2 = СО2 + 409,2 кДж
(1)
Ал екінші процесс үшін:
С + 1/2О2 = СО2 + 124,3 кДж
(2)
СО + 1/2О2 = СО2 + 284,9 кДж
(3)
Жалпы қосындысы: 409,2 кДж
14.
Гесс заңы іс жүзінде көп қолданылады. Ол кейбірхимиялық реакцияларды жүргізбей-ақ, олардың жылу
эффектілерін есептеуге мүмкіндік береді. Гесс
заңдарынан бірнеше салдар шығады.
⮚ Гесс заңынан шығатын бірінші салдар:
Реакцияның жылу эффектісі реакция өнімдерінің
түзілу жылуларының қосындысынан бастапқы заттардың
түзілу жылуларының қосындысын стехиометриялық
коэффициенттерді ескере отырып, алып тастағанға тең.
⮚ Гесс заңынан шығатын екінші салдар:
Реакцияның жылу эффектісі бастапқы заттардың
жану жылуларының қосындысынан реакция өнімдерінің
жану жылуларының қосындысын стехиометриялық
коэффициенттерді ескере отырып, алып тастағанға тең.
15.
Жылусыйымдылық түрлері⮚ Орташа молярлық жылу сыйымдылық (C) –
температурасын (∆T) өзгерту үщін 1 моль затқа
берілетін жылу мөлшеріне (Q) тең болатын жылу
сыйымдылық.
⮚ Шынайы жылу сыйымдылық – температурасын
жоғарылату үшін денеге берілген жылудың шексіз аз
мөлшеріне dQ сәйкес температура өсіміне dT
қатынасы.
16.
Жылусыйымдылық түрлері⮚Меншікті жылу сыйымдылық – зат массасының бірлігіне
қатысты анықталынған жылу сыйымдылық.
⮚Массалық жылу сыйымдылық – зат мөлшерінің бірлігіне
қатысты анықталынған жылу сыйымдылық.
⮚Молярлық жылу сыйымдылық – температурасын бірлікке
жоғарылату үшін 1 моль затқа берілетін жылу мөлшері
17.
Кирхгоф заңыОл заң былай
айтылады: процестің
жылу эффектісінің
температуралық
коэффициенті
процесс нәтижесінде
жүйенің
жылусыйымдылығын
ың өзгеруіне тең.
18.
Гесс заңының басты тәжірибелік мәні бар. Гессзаңының көмегімен жылу эффектілерін нақты өлшеу
мүмкін емес немесе қиындық туғызатын процестердің
жылу эффектілерінің шамасын есептеуге болады.
Жүйенің ішкі энергиясының тұрақты көлемде өзгеруің
температура бойынша дифференциалдағанда былай
өрнектеледі:
(d (∆U)/ dT)v =(dU2)/ dT)v – ( dU1)/ dT)v
Олай болса
dU/ dT= ∆Cv
(d (∆U)/ dT)v = ∆Cv2–∆Cv1= ∆Cv
Мұндағы Cv1 – жүйенің бастапқы қүйінің изохорлық
жылусыйымдылығы,
Cv2 – жүйенің сонғы қүйінің изохорлық
жылусыйымдылығы,
∆Cv – изохорлық жылусыйымдылығының өзгеруі.
19.
Жалпы жағдайда изохорлық жылусыйымдылықтыңөзгеруі үшін мынадай формуланы жазуға болады:
∆Cv =∑ (n∙Cv)сонғы ─ ∑ (n ∙Cv )баст
Тұрақты қысымдағы процестер үшін осыларға ұқсас
былай өрнектей аламыз:
(d (∆Н)/ dT) р= ∆Cр2–∆Cр1= ∆Cр
Кирхгоф заңының теңдеулері
20.
• Кирхгоф теңдеуінің дифференциальды формуласы:• Кирхгоф заңының дифференциальды түрдегі тұжырымы:
Процестің жылу эффектісінің температуралық коэффициенті,
осы процесс нәтижесінде жүретін жүйенің жылусыйымдылығының
өзгеруіне тең.
21.
• Кирхгоф теңдеуінің интегральды формуласы:• Кирхгофф теңдеуін қолданылады:
❖Химиялық процестерде;
❖Физикалық процестерде(булану, аллотропты түр өзгерістерді және
т.б.).
22.
Кирхгоф теңдеуін қолданып әртүрлі температуралардағы жылуэффектісін табу үшін кейде реакцияға қатысатын заттардың
әрқайсысының жылу сыйымдылығының температураға
тәуелділігін білу қажет болады. Жылу сыйымдылығының
температураға тәуелділігі мыныдай эмпирикалық теңдеумен
өрнектеледі
Мұндағы
– реакцияның жылусыйымдылығының өзгеруі.
Сонда
мұнда a, b, c, d, c1– берілген заттар үшін константалары.
23.
ҚорытындыХимиялық термодинамика
термохимия, химиялық тепе-теңдік және
ерітінділер (олардың ішінде электролиттер)
туралы ілімдермен және электродты
потенциалдар, беттік құбылыстар
термодинамикаларымен тығыз байланысты.
Гесс заңының практикадағы қолданбалы
маңызы өте зор. Оның көмегімен әлі белгісіз,
бірақ есептеу үшін не басқа мақсат-қа қажет
болатын реакциялардың жылу эффектілерін
есептеуге болады. Бұл жағдайда есептейтін
реакцияларға жанама, қосым-ша, бірақ жылу
зффектілері белгілі реакциялар пайдаланылады.





















 chemistry
chemistry








