Similar presentations:
Термодинамиканың екінші заңы. Процестің стихиялық өлшемі. Термодинамиканың біріккен заңы
1.
Қарағанды Медицина УниверситетіФармацевтикалық пәндер және химия кафедрасы
Тақырыбы: Термодинамиканың екінші заңы.
Процестің стихиялық өлшемі.
Термодинамиканың біріккен заңы.
Пән: Физикалық және коллоидтық химия
Мамандығы: Фармация және фармацевтикалық өндіріс
технологиясы
Курс: 2
Уақыты (ұзақтығы): 1 академиялық сағат
Дәріс берушілер: Аширбекова Б.Б.
2.
Термодинамиканың бірінші Заңытабиғи, технологиялық және
биологиялық процестердің
энергетикалық сипаттамаларын
сандық бағалауға мүмкіндік береді,
бірақ қандай да бір процестің
мүмкін болатындығын және ол қай
бағытта жүретінін анықтай
алмайды.
3.
Термодинамиканың екінші заңында біріншізаңға қайшы келмейтін барлық процестерді
өздігінен (тепе-теңдікке дейін қайтымсыз ағады)
және өздігінен жүрмейтін деп бөледі, және
энтропияны процестің өздігінен жүруінің
өлшемі ретінде енгізеді.
4.
Термодинамикалық процестер жүру тәсілінебайланысты болуы мүмкін:
• Өздігінен жүретін (табиғи) - өздері жүреді,
сырттан энергия шығынын талап етпейді.
• Өздігінен жүрмейтін (табиғи емес) – жүруі үшін
энергияны қажет етеді.
• Цикл дегеніміз параметрлері өзгеретін тұйық
процесс, бірақ соңында бастапқы қалпына
оралады.
• Қасиеттері уақыт бойынша тұрақты, бірақ
кеңістікте координаталық осьтер бойында әр
түрлі болатын (заттар мен энергия ағындары бар)
жүйенің күйі стационарлы деп аталады.
5.
• Жүйенің жай-күйі, оның қасиеттері уақыт пен кеңістіктетұрақты болса (зат пен энергия ағындары жоқ), тепетеңдік күйі деп аталады.
• Жүйе параметрлерінің шексіз аз өзгеруінің салдарынан
бірқатар тепе-тең күйде үздіксіз өтетін процесс жүйенің
тепе-теңдік күйі (квазистатикалық) деп аталады. Шексіз
баяу өтеді.
• Жүйе параметрлерінің соңғы өзгеруі салдарынан тепетеңдік күйінен шығатын процесс тепе-тең емес
(тұрақсыз) деп аталады, содан кейін оған қайтып
оралуға тырысады.
• Шынайы табиғи және технологиялық процестер тепетеңдік жағдайда бола алмайды.
6.
7.
Энтропия• Энтропия - бұл жүйедегі
ретсіздік функциясы.
• Термодинамиканың екінші
заңында энтропия өздігінен
жүретін процестерді анықтау
үшін қолданылады.
• Өздігінен жүру процесі
үнемі қоршаған ортаға
энергияны шығарумен және
энтропияның
жоғарылауымен жүреді.
8.
"Энтропия"терминін 1865
жылы Клаузиус
ұсынды.
9.
Энтропияның термодинамикалықанықтамасы
• Физикалық немесе
• Энтропияның өзгерісі химиялық процестің
энергияның қанша
нәтижесінде әрқашан мөлшері қоршаған ортаға
энтропияның өзгерісі жылу ретінде (белгілі бір
жүреді.
температурада) ретсіз
шашырайтынын көрсетеді.
10.
Энтропия пайдалыжұмысқа айналмай,
қоршаған ортаға
шашырайтын жылуды
сипаттайды.
11.
Энтропияның жоғары болуы,соғұрлым жүйенің ретсіздігі.
12.
ЭнтропияҚатты дене
Су
Sкристаллдың
Sсу
Газ
Sгаз
13.
ЭнтропияГаз
Энтропия, S
Қатты дене
Су
Қайнау
Балқу
Температура, К
14.
Тірі организмнің S• Тамақтың сіңірілу үдерісінде салыстырмалы үлкен
молекулалы көмірсулар, майлар, белоктар қарапайым
құрылысты мономерлер құрайды, CO2, H2O, NH3,
CO(NH2)2 және т. б. (S > 0).
• Энтропияның өзгеруі тотығу өнімдерінің қоршаған ортаға
шығарылуына байланысты (S < 0).
• Организмде тіндердің негізін құрайтын жоғары
молекулалы заттар синтезі, сондай-ақ макроэргикалық
қосылыстардың (S < 0).
• Жетілген ағзамен салыстырғанда энтропия - эмбриогенезі
және қартаю кезеңінде, жұқпалы және қатерлі аурулар
кезеңінде энтропия өндірісі артатын болады.
15.
Оқшауланғанжүйелер
үшін
энтропия бұл процестердің өздігінен
жүруінің критерийі болып табылады:
a) Стихиялық процесс
S>0
b) Стихиялық емес процесс
S<0
c) Тепе-теңдік процесі
S=0
16.
Энтропияның өсуі:1.) Ag+(еріт)+ Cl-(еріт) AgCl(к)
1) S < 0
2.) NH4Cl(к) NH3(г)+ HCl(г)
2) S > 0
3.) H2(г) + Br2(г) 2HBr(г)
3) S?
17.
Бос энергия және химиялық процестердің бағыты• P, T = const болғанда өздігімен жүретін процестердің, энтальпия
мен энтальпиялық құраушысын ескеретін критерий термодинамикалық функция ΔG, Гиббстің бос энергиясы болып
табылады:
G = H - TS
• Ал Гиббс энергиясының өзгерісі үшін:
ΔG = ΔH – TΔS
• Реакцияның Гибс энергиясының стандартты өзгерісі төменде
көрсетілген теңдеумен анықталады:
18.
Үдерістердің қозғаушы күштері• Жүйенің ішкі энергияның минималды
болуына ұмтылысы, яғни энтальпияның
төмендеуі (реакцияның энтальпиялық
факторы).
• Жүйенің энтропиясының артуы
(реакцияның энтропиялық факторы).
• Егер ΔG < 0 болса, реакция өздігінен
жүреді.
19.
Жүйе күйінің функцияларыΔG мәні процестердің өздігінен жүруінің
мүмкін болуының критериі ретінде қызмет
етеді.
Егер ΔG < 0 болса, процесс өздігінен жүреді.
ΔG > 0 болған кезде процесс өздігінен
жүрмейді.
Егер ΔG = 0 болса, онда жүйеде тепе-теңдік
күйі орнатылады.
20.
Процестің сипатына температураның әсеріЭкзотермиялық
үдеріс
Ретсіздіктің
артуы
Бұл жағдайда ΔG<0, сәйкесінше
өздігінен жүретін процесс кез
келген температурада жүреді.
21.
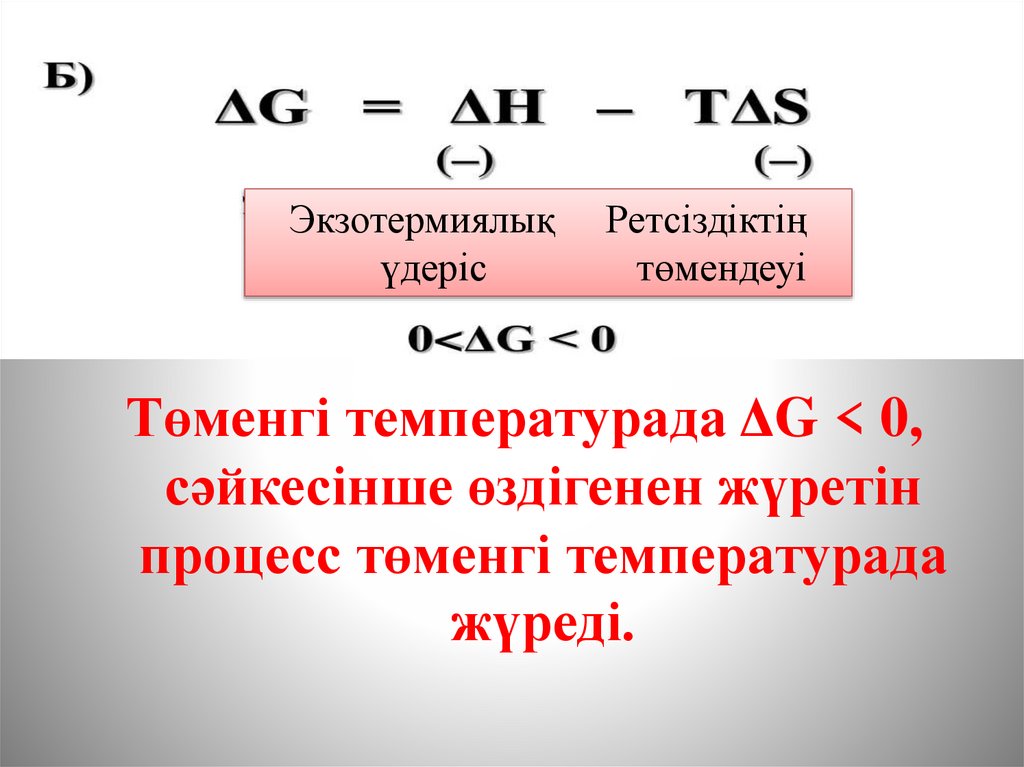
Экзотермиялықүдеріс
Ретсіздіктің
төмендеуі
Төменгі температурада ΔG < 0,
сәйкесінше өздігенен жүретін
процесс төменгі температурада
жүреді.
22.
Эндотермиялықүдеріс
Ретсіздіктің
артуы
Жоғары Т кезінде ΔG < 0,
сәйкесінше өздігінен жүретін
үдеріс жоғары температурада
жүреді.
23.
Эндотермиялықүдеріс
Ретсіздіктің
төмендеуі
Барлық температуралар үшінΔG > 0 ,
сәйкесінше үдеріс өздігінен
жүрмейді: ол термодинамика
бойынша тыйым салынған.
24.
∆G есептей отырып, мыналардыанықтауға болады:
• процестің сипатын (өздігінен немесе
өздігінен емес жүруін);
• процесс өздігінен жүретін болған кезде
жасалатын пайдалы жұмыстың
шамасын.
25.
Термодинамиканың екіншібастамасы постулаттары:
1. Жылу суық денеден жылы денеге өте алмайды
(Клаузиус);
2. Табиғат ықтималдылығы аз жағдайлардан
ықтималдылығы неғұрлым жоғары жағдайға өтуге
ұмтылады (Больцман);
3. Екінші түрдегі мәңгілік қозғалтқышты жүзеге
асыру мүмкін емес (Клаузиус);
4. Жылу қозғалтқышының циклін жоғары
температуралы жылу көзінен төмен температуралы
жылу көзіне белгілі мөлшерін ауыстырусыз жүзеге
асыру мүмкін емес (Томпсон).
26.
Термодинамиканың 2заңының статистикалық
сипаты:
• Табиғаттың абсолюттік заңы емес, тек
макроскопиялық жүйелерге ғана қолданылады.
• Энтропия - тәртіпсіздік шарасы . Бөлшектер
саны аз ТДЖ үшін "тәртіпсіздік" ұғымы жоқ.
• Шағын бөлшектерлі ТДЖ үшін P және Т мәнін
жоғалтады, яғни жылу мен жұмыс арасындағы
айырмашылық жоғалады.
27.
Энтропияның статикалық түсінігіЭнтропияның
статикалық түсінігі
негізін 1904 жылы
Л.Больцман қалады.
28.
Больцман теңдеуіМұнда, k - Больцман тұрақтысы
29.
W - темодинамикалықмүмкіндік, яғни берілген
макрокүйді жүзеге асыруға
мүмкіндік беретін түрлі
микрожағдайлар санын
(микрокүйдің) көрсететін
шама.
30.
Микрожағдай - бұл жылдамдық,энергия, қозғалыс импульсі және
әрбір құрылымдық бөліктің
басқа да сипаттамалары.
Микрожағдайдың саны
неғұрлым аз болса, соғұрлым
жүйенің реттілігі жоғары болып
келеді.
31.
Статистикалықтермодинамика - жүйенің
энергетикалық жағдайын,
оның құрылымдық
бірліктерінің
жағдайларын қарастыра
отырып зерттейді.
32.
Биоэнергетика32
33.
Тақырыптың медициналық-биологиялықмаңызы
Термодинамикалық зерттеу әдісі
тірі организмдердегі метаболизм
мен энергияны зерттеудің ең сенімді
әдістерінің бірі болып табылады.
Тірі организмдерде
болатын энергияның
түрленуі
биоэнергетиканың
мәні болып табылады.
34.
Тірі жүйелерді ұйымдастырудың ерекшеліктері:Биологиялық жүйелер
ашық.
Тірі жүйелердегі процестер,
сайып келгенде, қайтымсыз.
Тірі жүйелер тепе-теңдікте
емес.
Барлық биологиялық
жүйелер гетерогенді.
35.
Адамның энергетикалықшығындары:
* көмірсулар 55-60%,
* майлар 20-25%,
* ақуыз 15-20%.
36.
Алынған қуат:тыныс алу, қан айналымы,
метаболиттер, шырындар секрециясы
және т.б. байланысты ішкі ағзалардың
жұмысын орындауға,
адамның барлық қозғалыстарына және
оның еңбек әрекетіне байланысты
сыртқы жұмыстарды орындауға,
жұтылған ауаны, тұтынылатын су мен
тамақты жылытуға жұмсалады.
37.
Адам ағзасындағытағамның химиялық
энергиясын
түрлендірудің тиімділігі
~ 25%.
38.
Осылайша, организмніңэнтропиясың жоғалуы
75% құрайды. Күніне
адам ағзасы шығаратын
жылуға назар аударсаңыз,
онымен 20 литр су
қайнатуға болады.
39.
Биожүйелерде өтетін химиялықреакцияларды биохимиялық деп
атайды (in vivo).
БИОХИМИЯЛЫҚ РЕАКЦИЯЛАР:
Экзергоникалық (өздігінен жүретін)
Эндергоникалық (өздігінен жүрмейтін)
40.
Назарларыңызғарахмет!!!






































 chemistry
chemistry








