Similar presentations:
Равновесие с переносом электронов
1.
Кафедра химииТема лекции:
Равновесие с переносом электронов
1
2.
СХЕМАОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЙ РЕАКЦИИ
m Aox + n Bred m Ared + n Box
Aox (Box) – окисленная форма вещества А (В)
Ared (Bred) – восстановленная форма вещества А (В)
Направление
окислительно-восстановительных реакций
универсальный критерий
1. G < 0
только
2. = ox - red > 0 для редокс-реакций
ox/red
окислительно-восстановительный
(электродный, редокс) потенциал
2
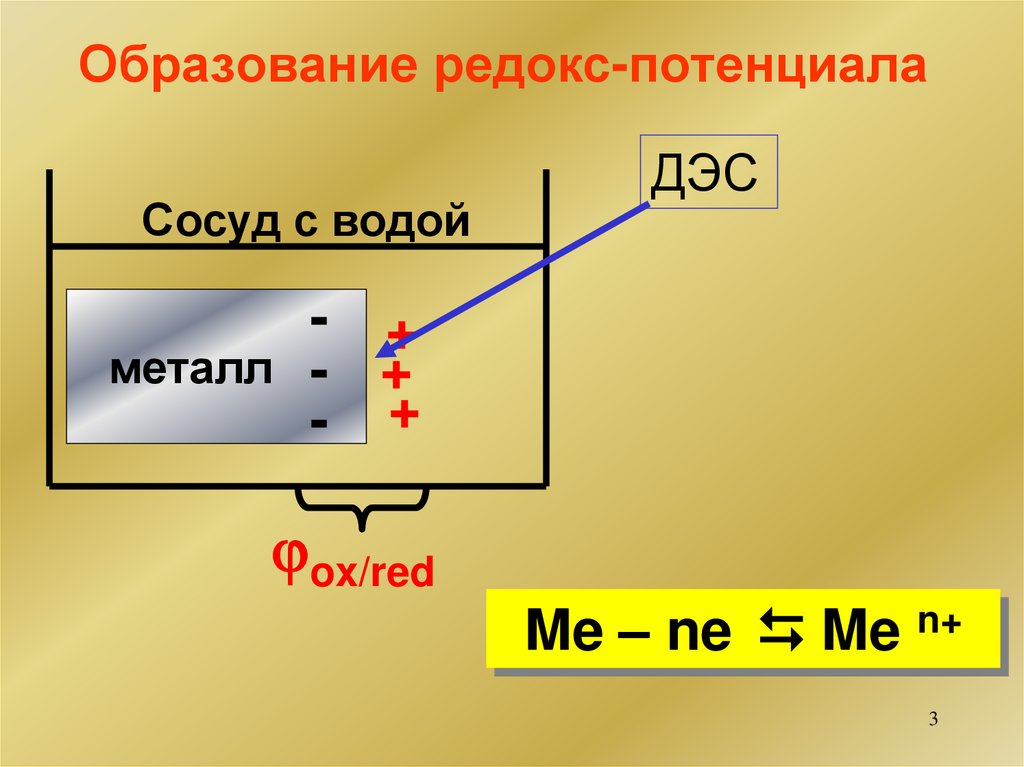
3. Образование редокс-потенциала
Сосуд с водойДЭС
- +
металл - +
- +
ox/red
Me – ne Me n+
3
4. Абсолютная величина ox/red не может быть определена опытным путем или рассчитана.
Электродный потенциал ox/red –разность электростатических
потенциалов между электродом и
находящимся с ним в контакте
электролитом.
Абсолютная величина ox/red не
может быть определена опытным
путем или рассчитана.
4
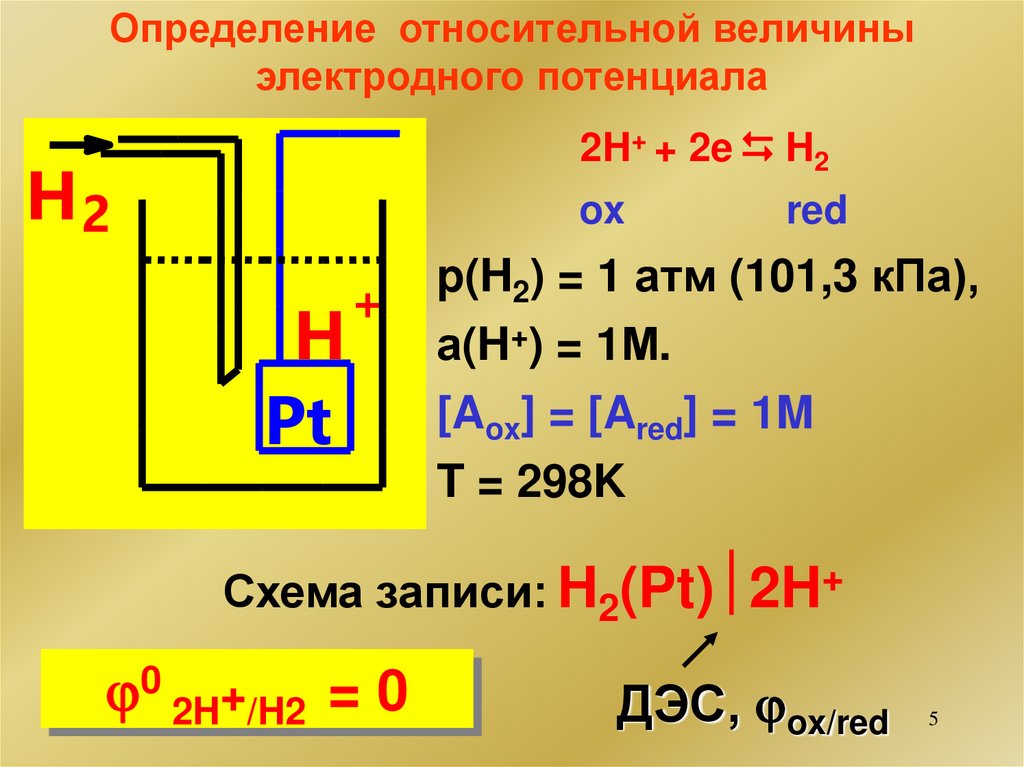
5.
Определение относительной величиныэлектродного потенциала
2H+ + 2e H2
H2
ox
H
Pt
+
red
p(H2) = 1 атм (101,3 кПа),
а(H+) = 1М.
[Aox] = [Ared] = 1M
T = 298K
Схема записи: H2(Pt) 2H+
0 2H+/H2 = 0
ДЭС, ox/red
5
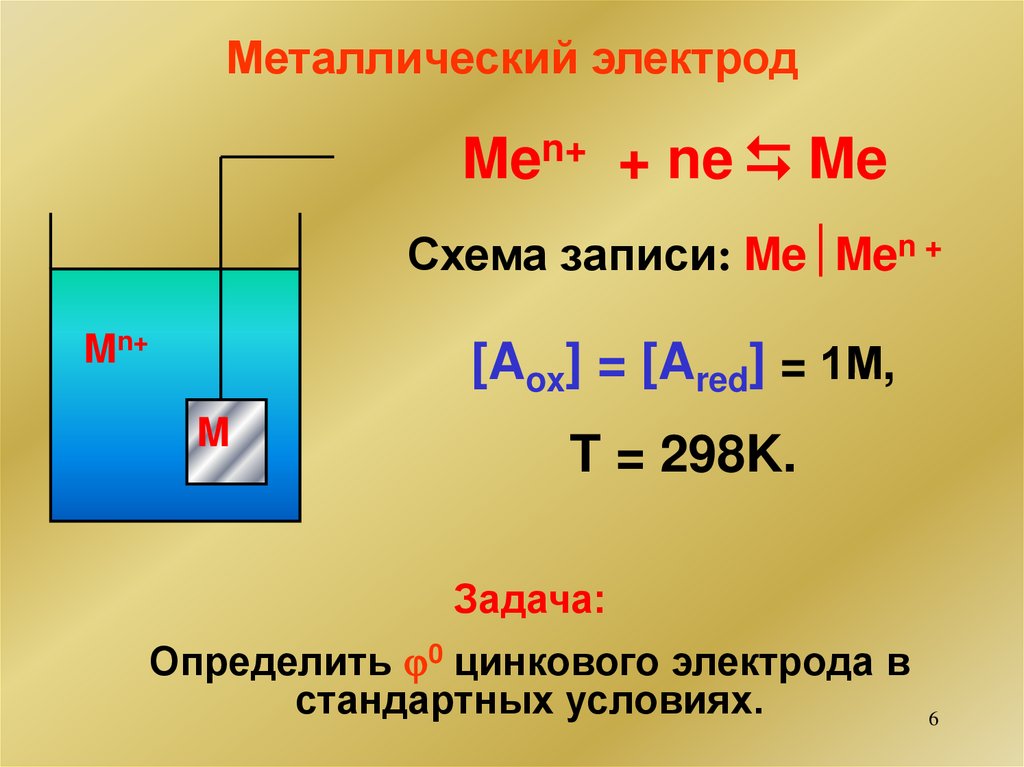
6.
Металлический электродMen+ + ne Me
Схема записи: Me Men +
Mn+
[Aox] = [Ared] = 1М,
M
T = 298K.
Задача:
Определить 0 цинкового электрода в
стандартных условиях.
6
7.
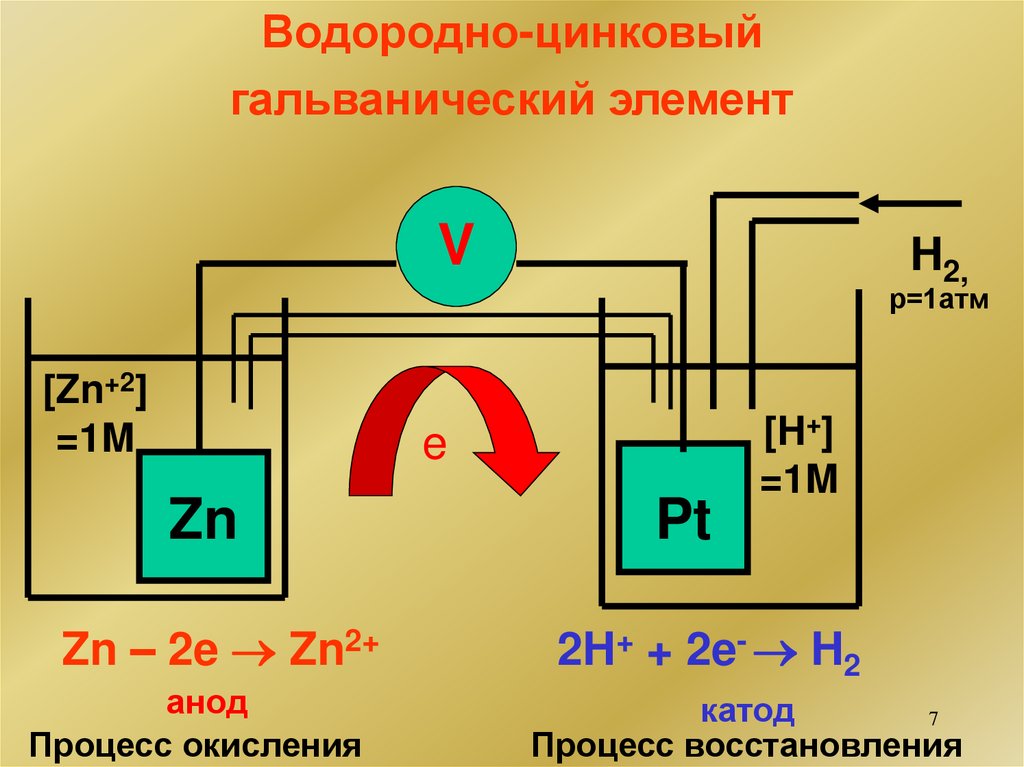
Водородно-цинковыйгальванический элемент
V
H2,
р=1атм
[Zn+2]
=1M
e
[H+]
=1M
Zn
Pt
Zn – 2e Zn2+
2H+ + 2e- H2
анод
Процесс окисления
катод
7
Процесс восстановления
8.
Схема записи цепи:-анод
анодный
раствор
катодный
+
катод
раствор
Солевой мостик
Расчет э.д.с. (Е) цепи: Е = +катода - -анода
-Zn Zn+2 H+ H (Pt)+
2
E(опыт) = 0,76В = +2H+/H2 - -Zn2+ /Zn
0
Zn / Zn = - 0,76В
2+
8
9.
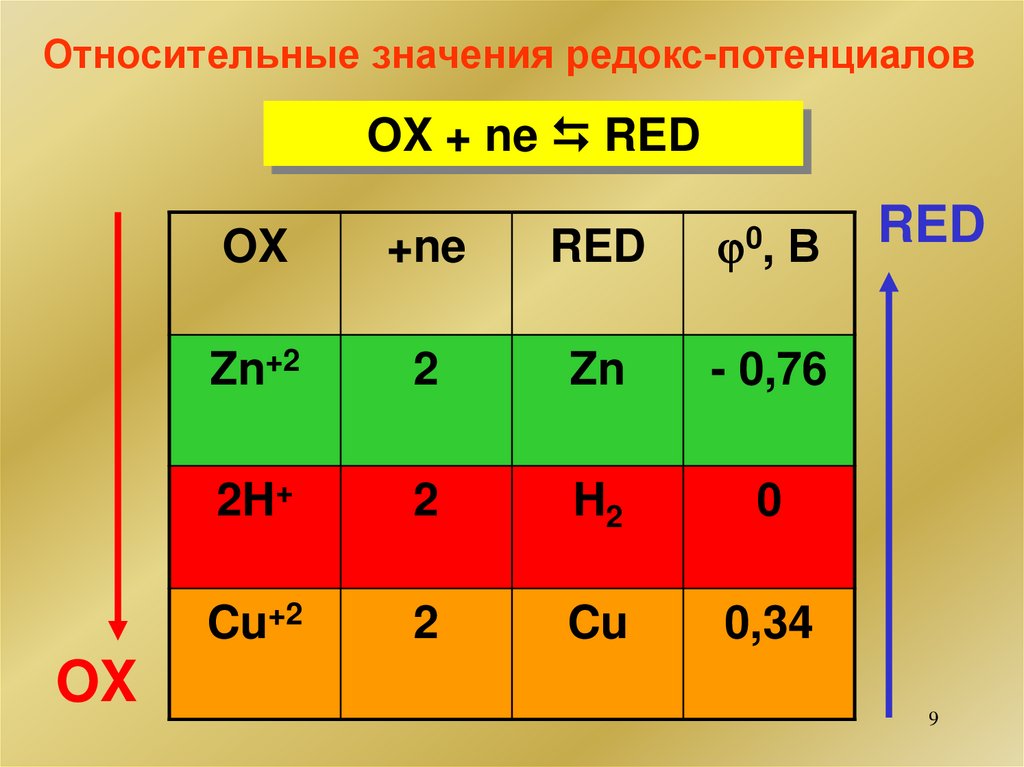
Относительные значения редокс-потенциаловOX + ne RED
OX
OX
+ne
RED
0, В
Zn+2
2
Zn
- 0,76
2H+
2
H2
0
Cu+2
2
Cu
0,34
RED
9
10.
Ряд напряжений металловM /M n +
o, в
M /M n +
o, в
L i/L i+
K /K +
N a /N a +
C a /C a 2 +
M g /M g 2 +
M n /M n 2 +
Z n /Z n 2 +
F e /F e 2 +
-3 .0 0
-2 .9 2
-2 .7 1
-2 .3 7
-2 .3 6
-1 .1 8
-0 .7 6
-0 .4 4
N i/N i2 +
S n /S n 2 +
P b /P b 2 +
C u /C u 2 +
A g /A g +
H g /H g 2 +
P t/P t2 +
A u /A u +
-0 .2 5
-0 .1 4
-0 .1 3
+ 0 .3 4
+ 0 .8 0
+ 0 .8 5
+ 1 .2 0
+ 1 .7 0
Бекетов Н.Н. (1827-1911)
10
11.
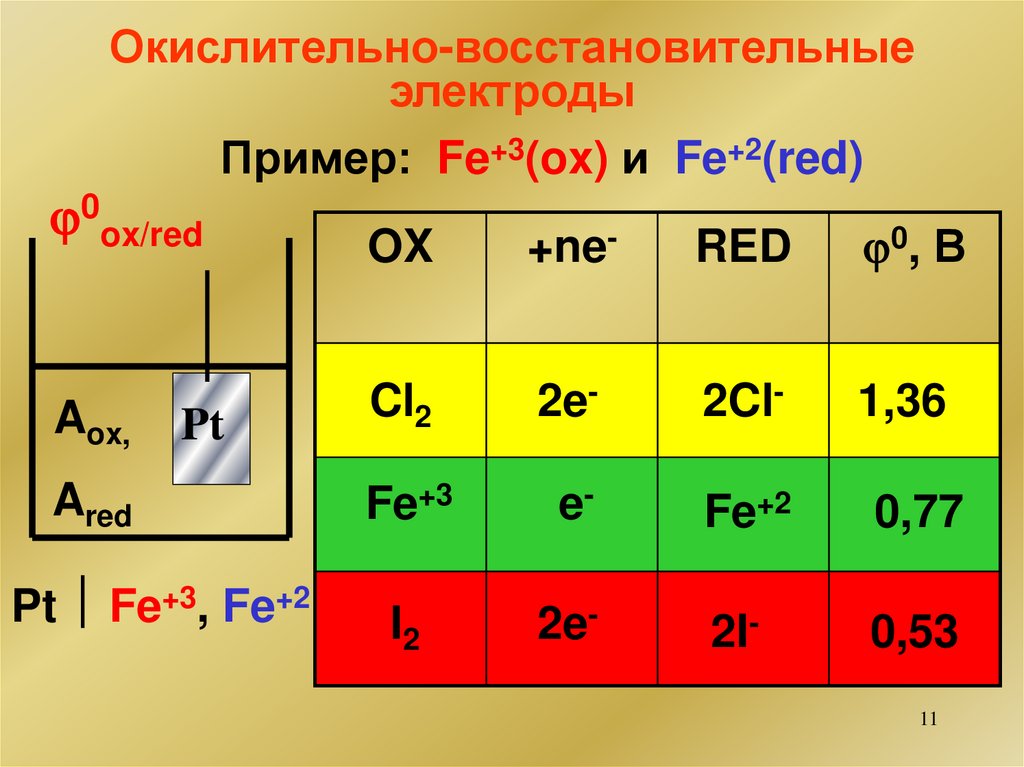
Окислительно-восстановительныеэлектроды
Пример: Fe+3(ox) и Fe+2(red)
0ox/red
OX
+ne-
RED
0, В
Aox,
Cl2
2e-
2Cl-
1,36
Fe+3
e-
Fe+2
0,77
I2
2e-
2I-
0,53
Pt
Ared
Pt Fe+3, Fe+2
11
12.
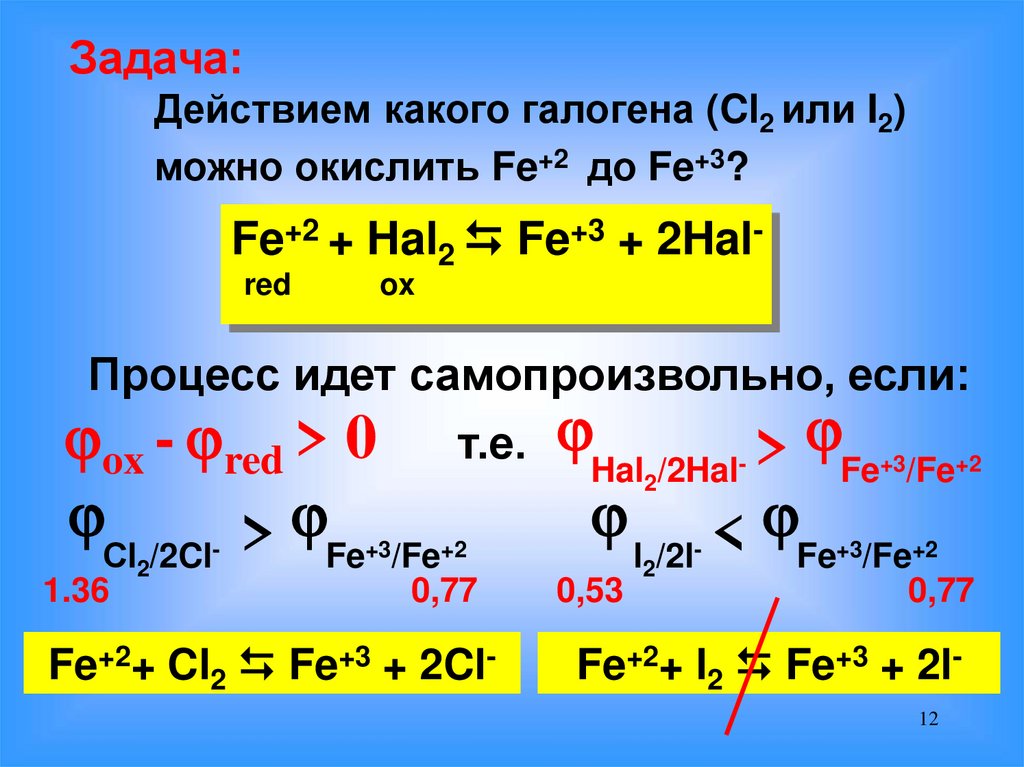
Задача:Действием какого галогена (Cl2 или I2)
можно окислить Fe+2 до Fe+3?
Fe+2 + Hal2 Fe+3 + 2Halred
ox
Процесс идет самопроизвольно, если:
+3 +2
ox - red > 0 т.е.
->
Сl2/2Cl-
1.36
Hal2/2Hal
> Fe /Fe
+3
+2
0,77
Fe+2+ Cl2 Fe+3 + 2Cl-
0,53
l2/2l-
Fe /Fe
< Fe /Fe
+3
+2
0,77
Fe+2+ l2 Fe+3 + 2l12
13.
Равновесиев окислительно-восстановительных реакциях
mOx1 + nRed2 nOx2 + mRed1
m Ox1 + ne Red1
n
Red2 - me Ox2
n
m
[ Ox 2 ] [Re d1]
кравн
m
n
[ Ox1] [Re d2 ]
G0 = -RT ln Kравн.
G0 = -RT . 2,303 lg Kравн.
13
14. Расчет константы равновесия
K равн. eG
RT
o
Универсальная
формула
Kравн. = 1017nE( )
( - для полупары)
Т – 298 К (25 0С)
Для редокссистем
Равновесие в окислительно-восстановительных реакциях
наблюдается при условии:
Е < 0.2 в
14
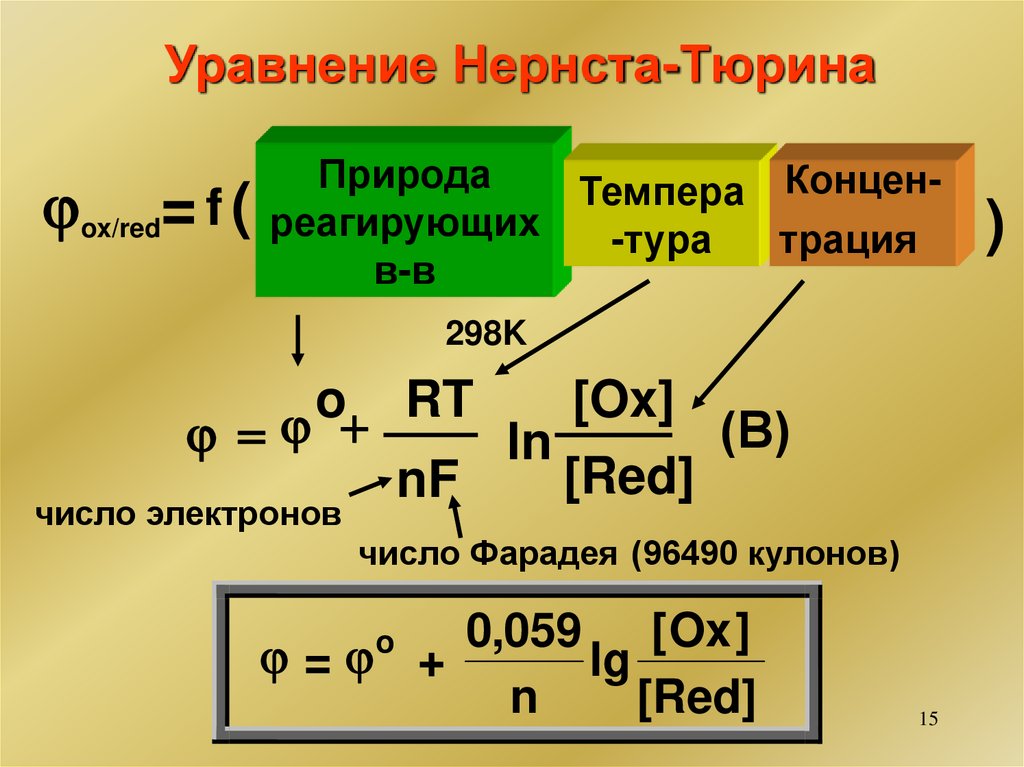
15.
Уравнение Нернста-ТюринаПрирода
КонценТемпера
ox/red= f ( реагирующих -тура трация
в-в
298K
o
RT
[Ox]
(В)
+
ln
[Red]
nF
число электронов
число Фарадея (96490 кулонов)
0,059 [ Ox ]
= +
lg
n
[Red]
o
15
)
16.
Зависимость редокс-потенциалаот рН среды
Ox + ne- + mH+ Red + m/2 H2O
m
[H+]
0
,
059
[
Ox
]
= +
lg
n
[Red]
o
При [Ox] = [Red]
= 0 + 0,059 m lg[H+]
n
= 0 - 0,059 m pH
n
16
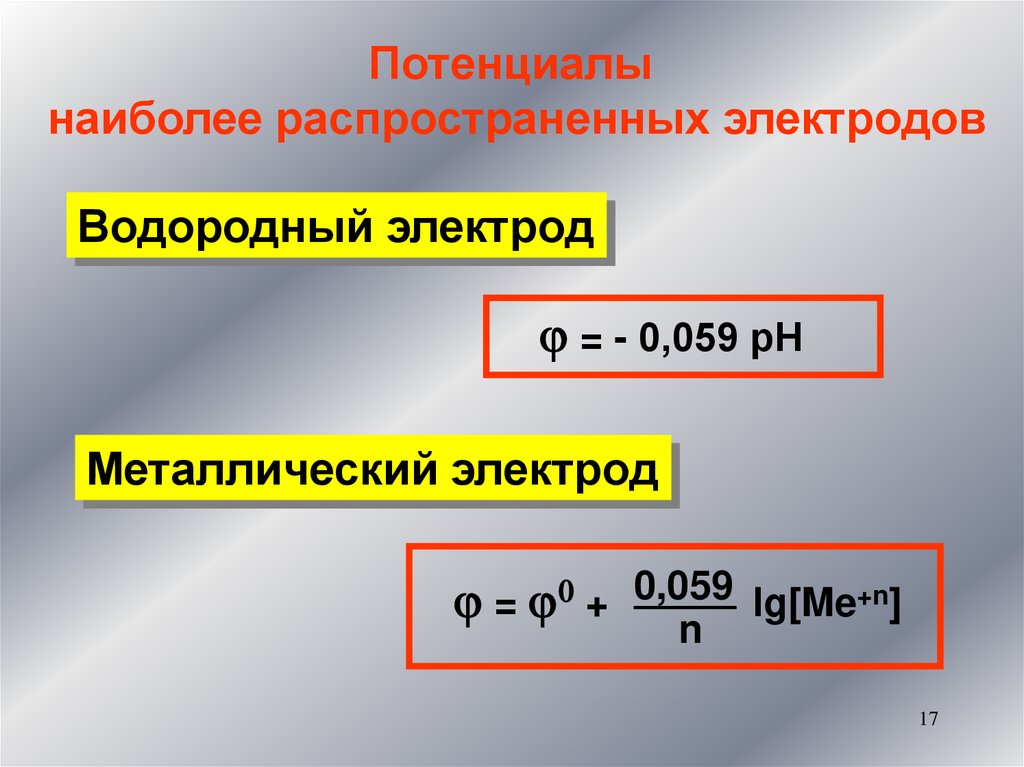
17.
Потенциалынаиболее распространенных электродов
Водородный электрод
= - 0,059 рН
Металлический электрод
= 0 + 0,059 lg[Me+n]
n
17
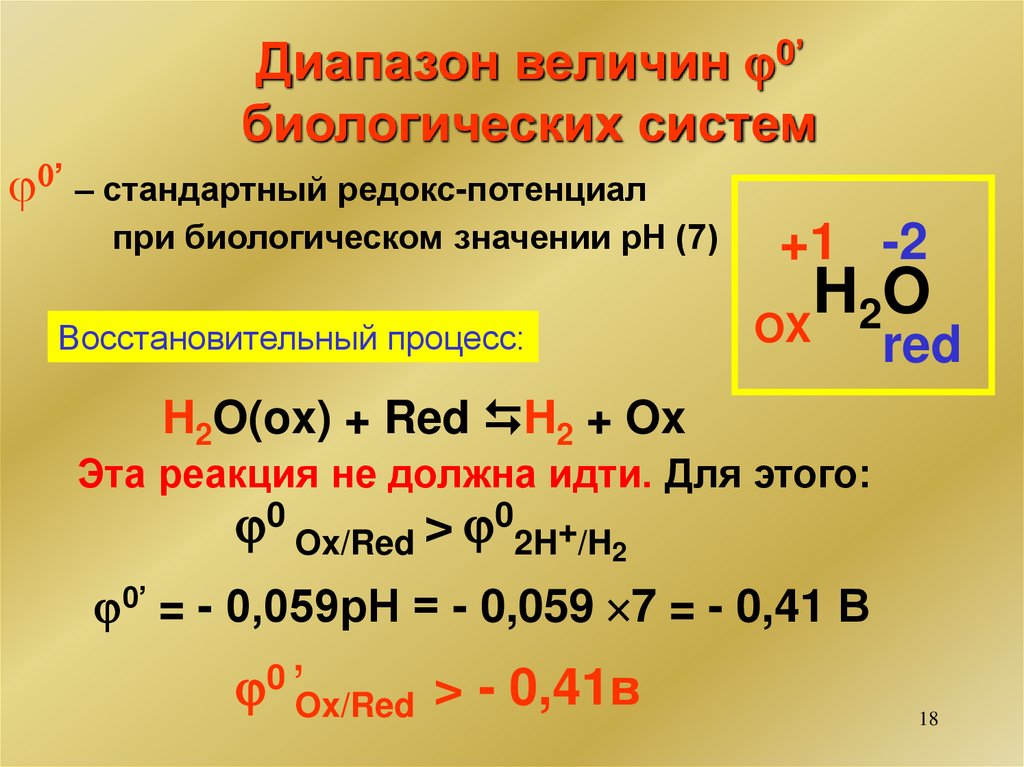
18.
Диапазон величин 0’биологических систем
0’ – стандартный редокс-потенциал
при биологическом значении рН (7)
Восстановительный процесс:
+1 -2
H
O
2
OX
red
H2O(ox) + Red H2 + Ox
Эта реакция не должна идти. Для этого:
0 Ox/Red > 02H+/H2
0’ = - 0,059рН = - 0,059 7 = - 0,41 В
0
,
Ox/Red > - 0,41в
18
19.
Окислительный процесс:H2O(red) + Ox O2 + Red
Эта реакция не должна идти. Для этого:
0 Ox/Red < 0O2/H2O
O2 +4H+
+ 4e
H2O +H2O
+ 4
0
,
059
[
O
][
H
]
o
2
+
lg
4
[H2O]2
0O2/H2O = 1,24- 0,059 7 = 0,83 в
Диапазон приемлемых потенциалов биосистем:
- 0,41В < 0 Ox/Red < 0,83 В
19
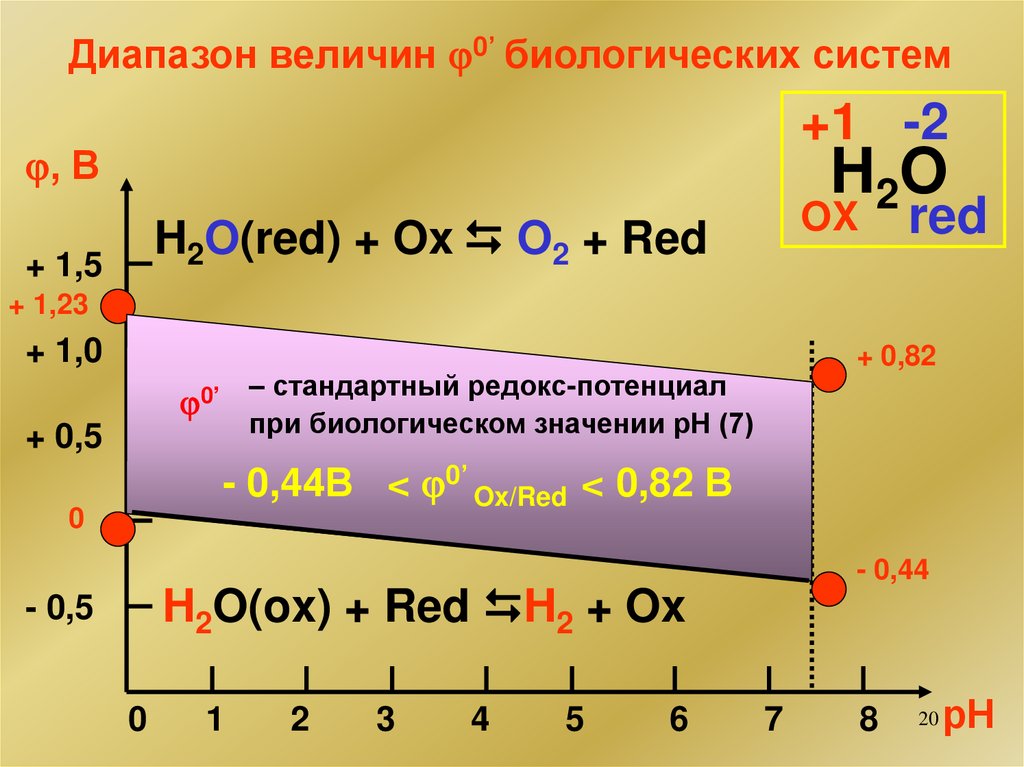
20.
Диапазон величин 0’ биологических систем+1 -2
, В
H2O
H2O(red) + Ox O2 + Red
+ 1,5
red
OX
+ 1,23
+ 1,0
+ 0,82
– стандартный редокс-потенциал
при биологическом значении рН (7)
0’
+ 0,5
- 0,44В < 0’ Ox/Red < 0,82 В
0
- 0,44
H2O(ox) + Red H2 + Ox
- 0,5
0
1
2
3
4
5
6
7
8
20
рН
21.
Редокс-потенциалы дыхательнойцепи
Дыхательная цепь митохондрий
Система
НАД+/НАДH2
ФАД/ФАДH2
КoQ/КoQН2
цитохром b
цитохром с1
цитохром с
цитoхромоксидаза
O2/H2O
Полуреакция
НАД+ + H+ + 2e НАДH
ФАД + 2H+ + 2e ФАДH2
КoQ+ 2H+ + 2e КoQН2
Fe2+ + e Fe3+
Cu2+ + e Cu1+
O2 + 4H+ + 4e 2H2O
Перенос электронов
’, В
-0.32
-0.30
-0.04
+0.07
+0.23
+0.25
+0.55
+0.82
21
Дыхание










 chemistry
chemistry