Similar presentations:
Эволюция подходов к терапии гепатита С у детей и подростков
1. Эволюция подходов к терапии гепатита С у детей и подростков
А.Т. ГалиеваРеспубликанский научно практический семинар
«Актуальные вопросы профилактики и лечения коинфекции
ВИЧ/ВГС»
Главный детский инфекционист МЗ
РБ, заместитель главного врача по
медицинской части Министерство
здравоохранения
Республики Башкортостан
Государственное бюджетное
учреждение здравоохранения
РЕСПУБЛИКАНСКАЯ КЛИНИЧЕСКАЯ
ИНФЕКЦИОННАЯ БОЛЬНИЦА
Уфа, 27 июля 2022 г.
Данная презентация
поддерживается компанией АО
«Р-Фарм»
2.
Информация предоставлена в качестве информационной и образовательнойподдержки врачей. Мнения, высказанные на слайдах и в выступлении, отражают точку
зрения докладчиков, которая не обязательно отражает точку зрения компании АО «РФарм».
АО «Р-Фарм» не рекомендует применять препараты способами, отличными от
описываемых в инструкции
по применению. В связи с различиями в требованиях регулирующих инстанций в
разных странах, зарегистрированные показания и способы применения препаратов,
упоминаемые в данной презентации, могут различаться.
Перед назначением любых препаратов, пожалуйста, ознакомьтесь с локальными
инструкциями по медицинскому применению, предоставляемыми компаниямипроизводителями. Полные инструкции по медицинскому применению доступны по
запросу.
Информация о раскрытии финансовой заинтересованности.
Настоящим лектор подтверждает, что он оказывает услуги в области научной и
образовательной деятельности (включая, среди прочего, подготовку обзоров научной
литературы, обучающих и информационных материалов, участие в клинических
исследованиях и экспертных советах и пр.) АО «Р-Фарм».
Данная презентация
поддерживается компанией АО
«Р-Фарм»
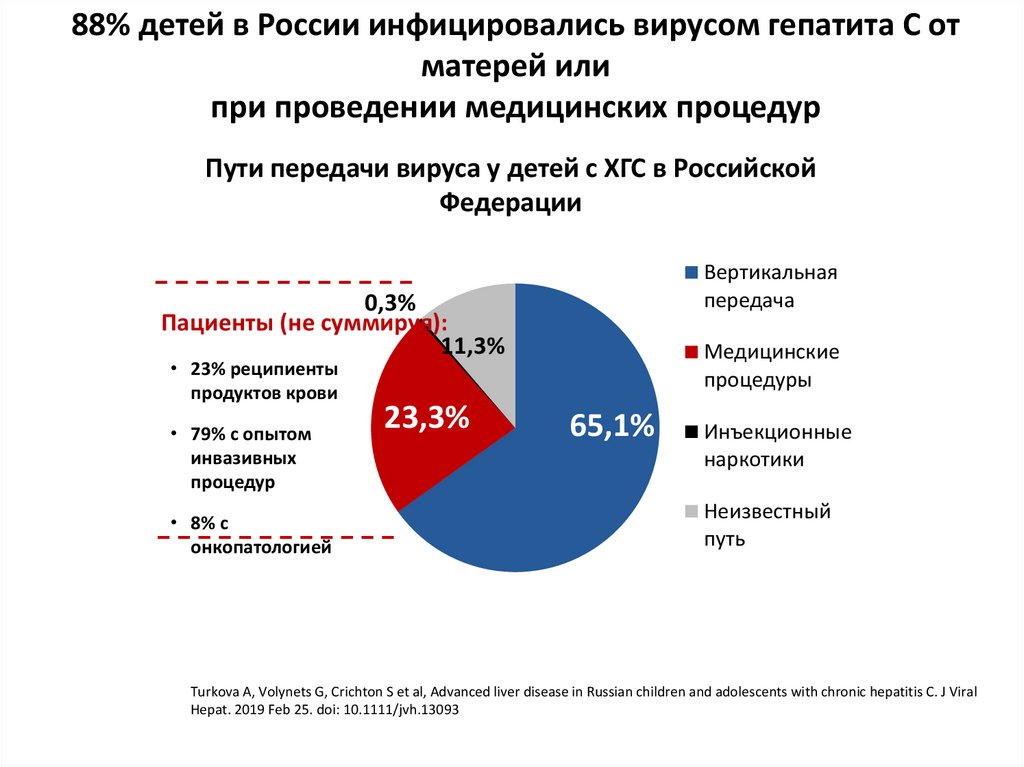
3. 88% детей в России инфицировались вирусом гепатита С от матерей или при проведении медицинских процедур
Пути передачи вируса у детей с ХГС в РоссийскойФедерации
Вертикальная
передача
0,3%
Пациенты (не суммируя):
11,3%
• 23% реципиенты
продуктов крови
• 79% с опытом
инвазивных
процедур
• 8% с
онкопатологией
23,3%
Медицинские
процедуры
65,1%
Инъекционные
наркотики
Неизвестный
путь
Turkova A, Volynets G, Crichton S et al, Advanced liver disease in Russian children and adolescents with chronic hepatitis C. J Viral
Hepat. 2019 Feb 25. doi: 10.1111/jvh.13093
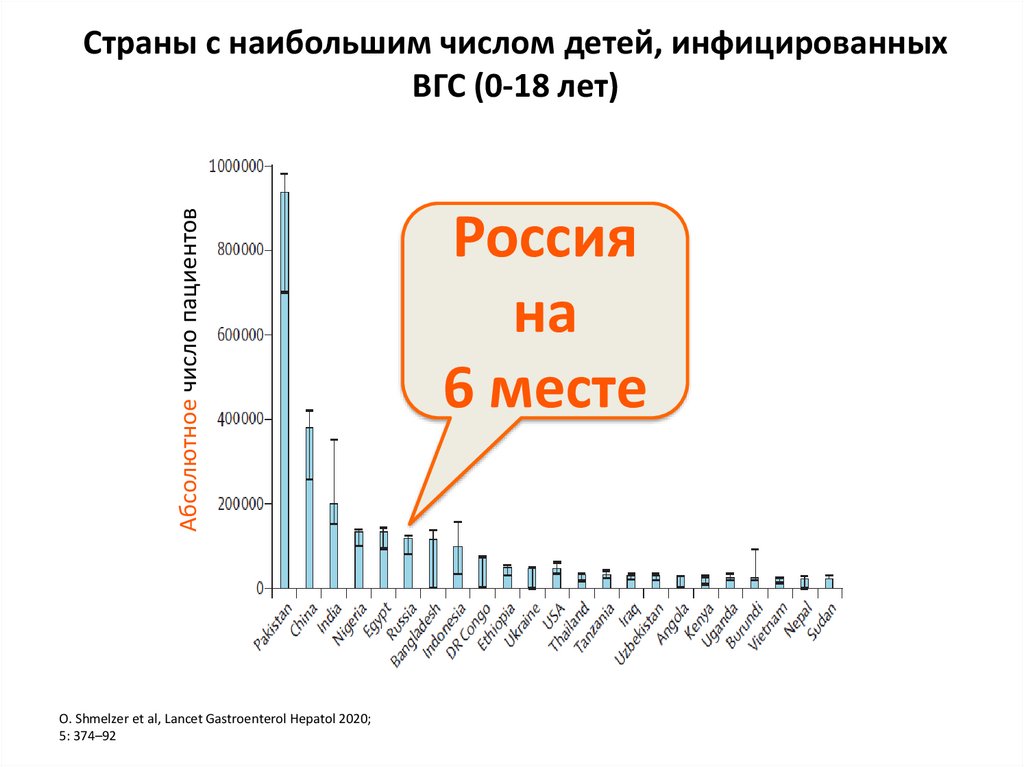
4. Страны с наибольшим числом детей, инфицированных ВГС (0-18 лет)
Абcолютное число пациентовСтраны с наибольшим числом детей, инфицированных
ВГС (0-18 лет)
О. Shmelzer et al, Lancet Gastroenterol Hepatol 2020;
5: 374–92
Россия
на
6 месте
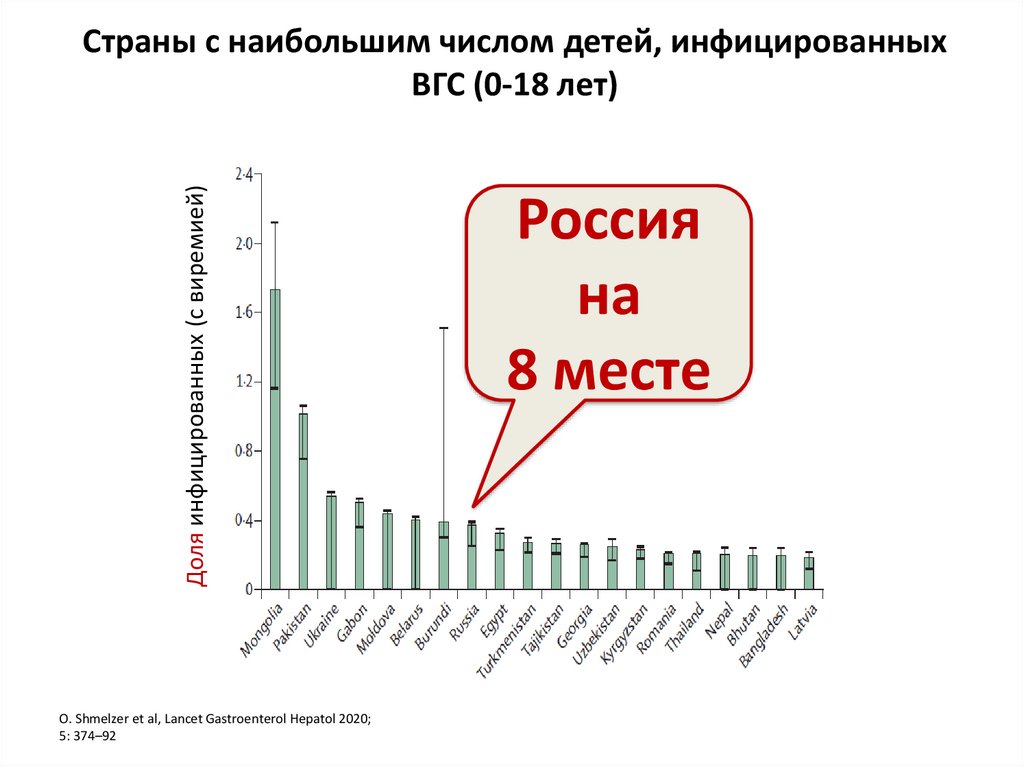
5. Страны с наибольшим числом детей, инфицированных ВГС (0-18 лет)
Доля инфицированных (с виремией)Страны с наибольшим числом детей, инфицированных
ВГС (0-18 лет)
О. Shmelzer et al, Lancet Gastroenterol Hepatol 2020;
5: 374–92
Россия
на
8 месте
6. Заболеваемость детей ВГ в РБ
• В Федеральном Регистре Вирусныхгепатитов на июль 2022 года состоит 89
детей с ХВГС.
• 3-11 лет – 65 детей
• 12-17 лет – 18 детей (20%).
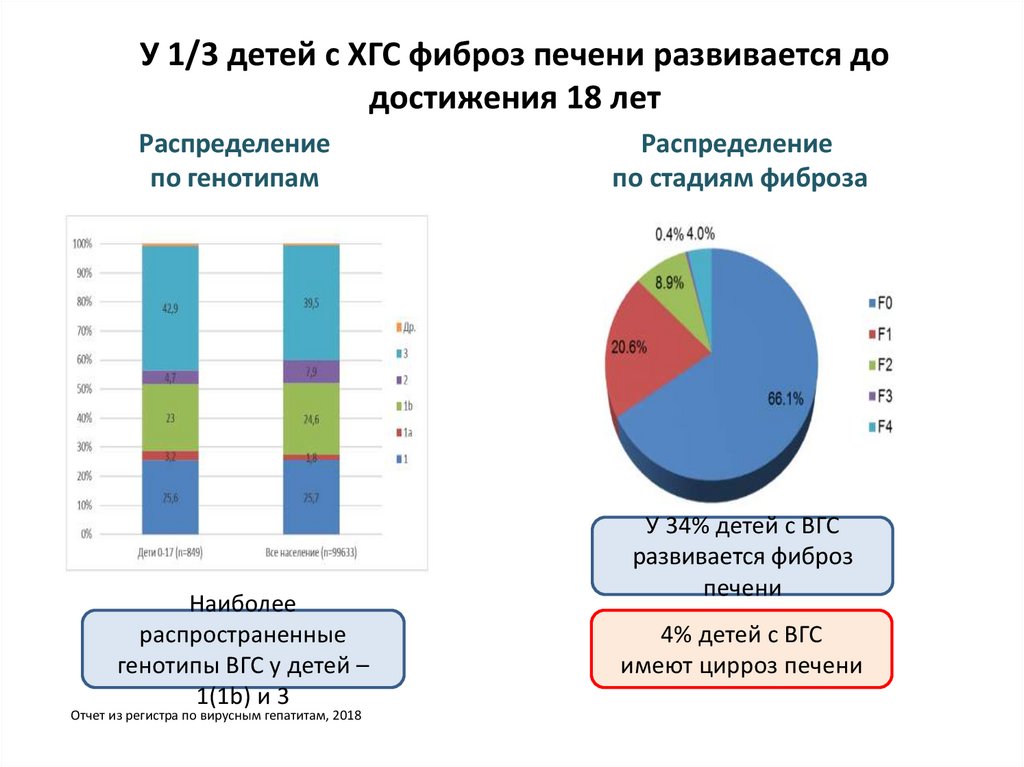
7. У 1/3 детей с ХГС фиброз печени развивается до достижения 18 лет
Распределениепо генотипам
Наиболее
распространенные
генотипы ВГС у детей –
1(1b) и 3
Отчет из регистра по вирусным гепатитам, 2018
Распределение
по стадиям фиброза
У 34% детей с ВГС
развивается фиброз
печени
4% детей с ВГС
имеют цирроз печени
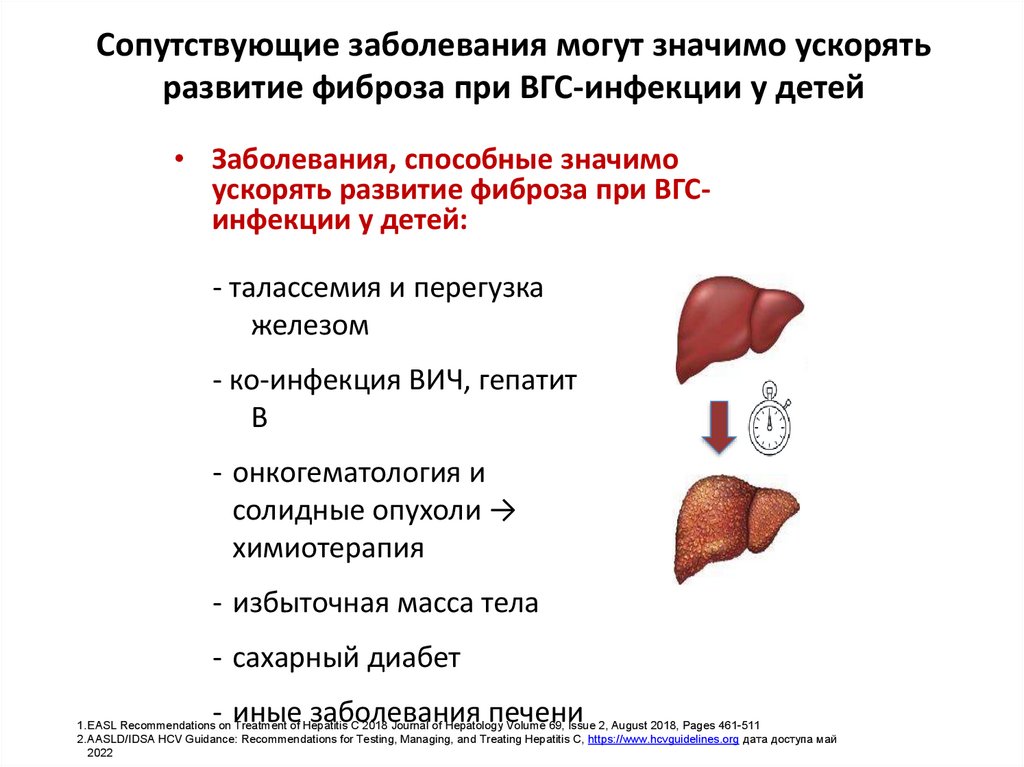
8. Сопутствующие заболевания могут значимо ускорять развитие фиброза при ВГС-инфекции у детей
• Заболевания, способные значимоускорять развитие фиброза при ВГСинфекции у детей:
- талассемия и перегузка
железом
- ко-инфекция ВИЧ, гепатит
В
- онкогематология и
солидные опухоли →
химиотерапия
- избыточная масса тела
- сахарный диабет
- иные заболевания печени
1.EASL Recommendations on Treatment of Hepatitis C 2018 Journal of Hepatology Volume 69, Issue 2, August 2018, Pages 461-511
2.AASLD/IDSA HCV Guidance: Recommendations for Testing, Managing, and Treating Hepatitis C, https://www.hcvguidelines.org дата доступа май
2022
9. Существует риск серьёзного повреждения печени вирусом гепатита С даже в детском возрасте
Pediatr Gastroenterol Hepatol Nutr. 2016 Jun; 19(2): 83–95.10. Гепатит С оказывает негативное влияние на психологические и физические показатели здоровья детей
• В рамках австралийского исследования получены результаты опроса19 детей 9-17 лет, инфицированных HCV в первый год жизни и их
родителей
• 15 детей заразились при переливании крови, 4 - от матерей
− При наличии ВГС-инфекции у детей
оценки по 9 из 11 показателям в
опроснике были значимо ниже,
особенно, ухудшение общего
состояния здоровья детей (49.9 vs 77.1;
P<0.001) и эмоционального состояния
родителей (45.6 vs 80.3; P<0.001)
− Оценка психического и
психосоциального состояния была
значимо ниже у инфицированных
детей 45.3 vs 49.6 и 44.0 vs 50.1
соответственно
− Дети отмечали ухудшение своей
физической формы (82.8% vs 94.4%)
J Gastroenterol Hepatol. 2008 Feb;23(2):226-30.
11. Не рекомендовано лечение детей любого возраста ИФН-содержащими режимами
Таблица 3. Рекомендации по лечению хронического вирусного гепатита С препаратами прямогопротивовирусного действия у подростков и детей в возрасте 3-11 лет
ПОДРОСТКИ
Документ
Уровень
подготовлен
Рекомендация
достоверности/доказательности
Лечение долно быть предложено всем
пациентам с диагнозом ХГС 12 лет и
Высокая достоверность и средняя
ВОЗ (14)
старше, вне зависимости от стадии
доказательность
заболевания
Высокая достоверность, средняя
Должны получать лечение все подростки
доказательность для ХГС генотипов 1 и 4.
EASL (15)
без цирроза или с компенсированным
Низкая достоверность и низкая
(Чайлд-Пью А) циррозом
доказательность для ХГС генотипов 2 и 3.
Если доступны ПППД, лечение
Высокая достоверность и средняя
AASLD (16)
рекомендовано всем пациентам 3 лет и
доказательность
старше
Лечение может быть назначено с 12SCG (17)
Нет информации
летнего возраста
Высокая достоверность и высокая
ESPGHAN (18)
Все дети с ХГС должны получать терапию
доказательность
Дети с возрасте 3-11 лет
Документ
Рекомендация
Уровень достоверности
подготовлен
Отложить лечение до 12-летнего
Условная рекомендация, очень низкая
ВОЗ (14)
возраста
доказательность
Лечение должно быть отложено до тех
пор, пока ПППД ни будут
Высокая достоверность и средняя
EASL (15)
зарегистрированы для данной группы
доказательность
пациентов
Консенсус экспертов, пациентские
Лечение детей с ХГС в возрасте 3-11 лет
разборы или стандарты лечения;
должно быть отложено до тех пор, пока
противоречивая доказательность. Три
AASLD (16)
безинтерфероновые режимы ни будут
режима ПППД были одобрены для
зарегистрированы для данной группы
данной возрастной группы после выхода
пациентов
публикации
SCG (17)
Не предоставлены
Лечение в данной возрастной группе
G. Indolfi et al, J Pediatr Gastroenterol Nutr. 2020 May;70(5):711-717.
сожет быть отложено там, там, где
Высокая достоверность и высокая
ESPGHAN (18)
доступны только пегилированные
доказательность
интерфероны и рибавирин в качестве
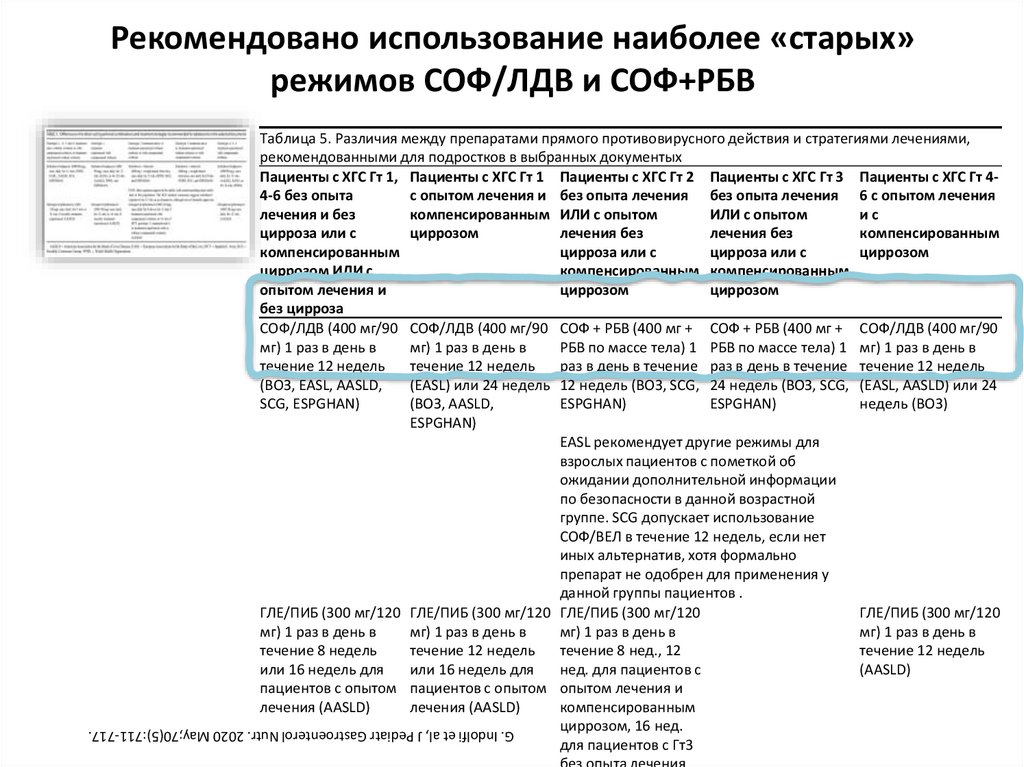
12. Рекомендовано использование наиболее «старых» режимов СОФ/ЛДВ и СОФ+РБВ
Таблица 5. Различия между препаратами прямого противовирусного действия и стратегиями лечениями,рекомендованными для подростков в выбранных документых
Пациенты с ХГС Гт 1, Пациенты с ХГС Гт 1 Пациенты с ХГС Гт 2 Пациенты с ХГС Гт 3 Пациенты с ХГС Гт 44-6 без опыта
с опытом лечения и без опыта лечения без опыта лечения 6 с опытом лечения
лечения и без
компенсированным ИЛИ с опытом
ИЛИ с опытом
ис
цирроза или с
циррозом
лечения без
лечения без
компенсированным
компенсированным
цирроза или с
цирроза или с
циррозом
циррозом ИЛИ с
компенсированным компенсированным
опытом лечения и
циррозом
циррозом
без цирроза
СОФ/ЛДВ (400 мг/90 СОФ/ЛДВ (400 мг/90 СОФ + РБВ (400 мг + СОФ + РБВ (400 мг + СОФ/ЛДВ (400 мг/90
мг) 1 раз в день в
мг) 1 раз в день в
РБВ по массе тела) 1 РБВ по массе тела) 1 мг) 1 раз в день в
течение 12 недель
течение 12 недель
раз в день в течение раз в день в течение течение 12 недель
(ВОЗ, EASL, AASLD,
(EASL) или 24 недель 12 недель (ВОЗ, SCG, 24 недель (ВОЗ, SCG, (EASL, AASLD) или 24
SCG, ESPGHAN)
(ВОЗ, AASLD,
ESPGHAN)
ESPGHAN)
недель (ВОЗ)
ESPGHAN)
EASL рекомендует другие режимы для
взрослых пациентов с пометкой об
ожидании дополнительной информации
по безопасности в данной возрастной
группе. SCG допускает использование
СОФ/ВЕЛ в течение 12 недель, если нет
иных альтернатив, хотя формально
препарат не одобрен для применения у
данной группы пациентов .
ГЛЕ/ПИБ (300 мг/120 ГЛЕ/ПИБ (300 мг/120 ГЛЕ/ПИБ (300 мг/120
ГЛЕ/ПИБ (300 мг/120
мг) 1 раз в день в
мг) 1 раз в день в
мг) 1 раз в день в
мг) 1 раз в день в
течение 8 недель
течение 12 недель
течение 8 нед., 12
течение 12 недель
или 16 недель для
или 16 недель для
нед. для пациентов с
(AASLD)
пациентов с опытом пациентов с опытом опытом лечения и
лечения (AASLD)
лечения (AASLD)
компенсированным
циррозом, 16 нед.
для пациентов с Гт3
без опыта лечения
G. Indolfi et al, J Pediatr Gastroenterol Nutr. 2020 May;70(5):711-717.
13. Рекомендовано использование ГЛЕ/ПИБ для абсолютного большинства пациентов
Таблица 5. Различия между препаратами прямого противовирусного действия и стратегиями лечениями,рекомендованными для подростков в выбранных документых
Пациенты с ХГС Гт 1, Пациенты с ХГС Гт 1 Пациенты с ХГС Гт 2 Пациенты с ХГС Гт 3 Пациенты с ХГС Гт 44-6 без опыта
с опытом лечения и без опыта лечения без опыта лечения 6 с опытом лечения
лечения и без
компенсированным ИЛИ с опытом
ИЛИ с опытом
ис
цирроза или с
циррозом
лечения без
лечения без
компенсированным
компенсированным
цирроза или с
цирроза или с
циррозом
циррозом ИЛИ с
компенсированным компенсированным
опытом лечения и
циррозом
циррозом
без цирроза
СОФ/ЛДВ (400 мг/90 СОФ/ЛДВ (400 мг/90 СОФ + РБВ (400 мг + СОФ + РБВ (400 мг + СОФ/ЛДВ (400 мг/90
мг) 1 раз в день в
мг) 1 раз в день в
РБВ по массе тела) 1 РБВ по массе тела) 1 мг) 1 раз в день в
течение 12 недель
течение 12 недель
раз в день в течение раз в день в течение течение 12 недель
(ВОЗ, EASL, AASLD,
(EASL) или 24 недель 12 недель (ВОЗ, SCG, 24 недель (ВОЗ, SCG, (EASL, AASLD) или 24
SCG, ESPGHAN)
(ВОЗ, AASLD,
ESPGHAN)
ESPGHAN)
недель (ВОЗ)
ESPGHAN)
EASL рекомендует другие режимы для
взрослых пациентов с пометкой об
ожидании дополнительной информации
по безопасности в данной возрастной
группе. SCG допускает использование
СОФ/ВЕЛ в течение 12 недель, если нет
иных альтернатив, хотя формально
препарат не одобрен для применения у
данной группы пациентов .
ГЛЕ/ПИБ (300 мг/120 ГЛЕ/ПИБ (300 мг/120 ГЛЕ/ПИБ (300 мг/120
ГЛЕ/ПИБ (300 мг/120
мг) 1 раз в день в
мг) 1 раз в день в
мг) 1 раз в день в
мг) 1 раз в день в
течение 8 недель
течение 12 недель
течение 8 нед., 12
течение 12 недель
или 16 недель для
или 16 недель для
нед. для пациентов с
(AASLD)
пациентов с опытом пациентов с опытом опытом лечения и
лечения
лечения (AASLD)
компенсированным
G. Indolfi et al, J Pediatr Gastroenterol
Nutr.(AASLD)
2020 May;70(5):711-717.
циррозом, 16 нед.
для пациентов с Гт3
без опыта лечения
14. СП 3.1.3112-13 (недействующий) Профилактика вирусного гепатита С
Диспансерное наблюдение:• Скрининг на антиHCV и РНК HCV в 2 мес.
жизни, 6 мес., 12 мес. и 18 мес. жизни.
Снятие с учета при отсутствии РНК в течение
2-х лет диспансерного наблюдения с
интервалом в 6 мес.
15. СанПиН 3.3686-21 «Санитарно-эпидемиологические требования по профилактике инфекционных болезней (с изменениями на 25 мая 2022
года)VII. Профилактика вирусных гепатитов В и С.
• РНК HCV (+) – есть гепатит С
• РНК HCV (-) – нет гепатита С
• ПВТ ХВГС – через 12 недель РНК HCV (-) –
излечение, гепатита С нет. Диспансерного
наблюдения нет, за исключением случаев с
F3-4 (КР «Хронический вирусный гепатит С»
2022)
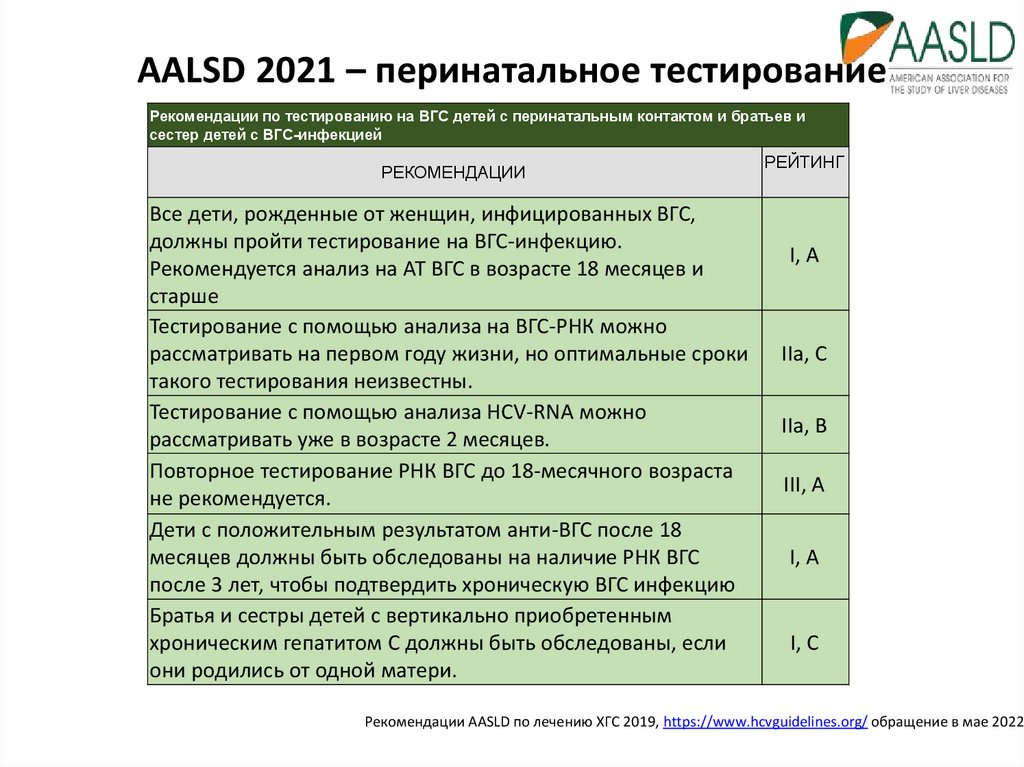
16. AALSD 2021 – перинатальное тестирование
Рекомендации по тестированию на ВГС детей с перинатальным контактом и братьев исестер детей с ВГС-инфекцией
РЕКОМЕНДАЦИИ
Все дети, рожденные от женщин, инфицированных ВГС,
должны пройти тестирование на ВГС-инфекцию.
Рекомендуется анализ на АТ ВГС в возрасте 18 месяцев и
старше
Тестирование с помощью анализа на ВГС-РНК можно
рассматривать на первом году жизни, но оптимальные сроки
такого тестирования неизвестны.
Тестирование с помощью анализа HCV-RNA можно
рассматривать уже в возрасте 2 месяцев.
Повторное тестирование РНК ВГС до 18-месячного возраста
не рекомендуется.
Дети с положительным результатом анти-ВГС после 18
месяцев должны быть обследованы на наличие РНК ВГС
после 3 лет, чтобы подтвердить хроническую ВГС инфекцию
Братья и сестры детей с вертикально приобретенным
хроническим гепатитом С должны быть обследованы, если
они родились от одной матери.
РЕЙТИНГ
I, A
IIa, C
IIa, B
III, A
I, A
I, C
Рекомендации AASLD по лечению ХГС 2019, https://www.hcvguidelines.org/ обращение в мае 2022
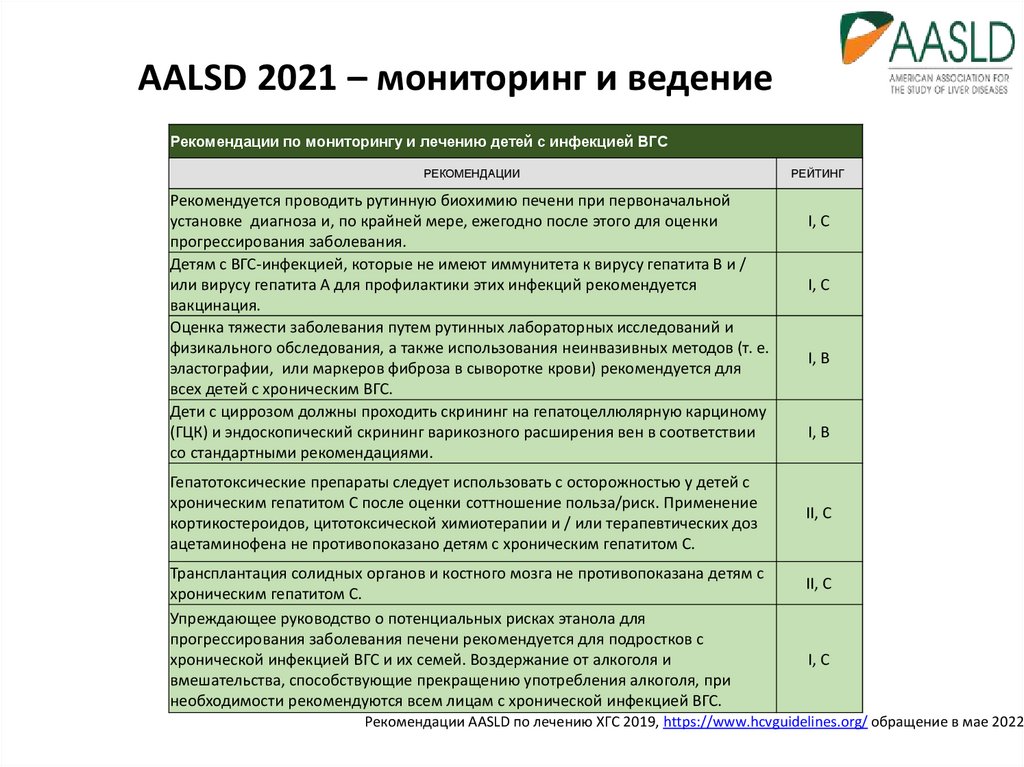
17. AALSD 2021 – мониторинг и ведение
Рекомендации по мониторингу и лечению детей с инфекцией ВГСРЕКОМЕНДАЦИИ
Рекомендуется проводить рутинную биохимию печени при первоначальной
установке диагноза и, по крайней мере, ежегодно после этого для оценки
прогрессирования заболевания.
Детям с ВГС-инфекцией, которые не имеют иммунитета к вирусу гепатита В и /
или вирусу гепатита А для профилактики этих инфекций рекомендуется
вакцинация.
Оценка тяжести заболевания путем рутинных лабораторных исследований и
физикального обследования, а также использования неинвазивных методов (т. е.
эластографии, или маркеров фиброза в сыворотке крови) рекомендуется для
всех детей с хроническим ВГС.
Дети с циррозом должны проходить скрининг на гепатоцеллюлярную карциному
(ГЦК) и эндоскопический скрининг варикозного расширения вен в соответствии
со стандартными рекомендациями.
Гепатотоксические препараты следует использовать с осторожностью у детей с
хроническим гепатитом С после оценки соттношение польза/риск. Применение
кортикостероидов, цитотоксической химиотерапии и / или терапевтических доз
ацетаминофена не противопоказано детям с хроническим гепатитом С.
Трансплантация солидных органов и костного мозга не противопоказана детям с
хроническим гепатитом С.
Упреждающее руководство о потенциальных рисках этанола для
прогрессирования заболевания печени рекомендуется для подростков с
хронической инфекцией ВГС и их семей. Воздержание от алкоголя и
вмешательства, способствующие прекращению употребления алкоголя, при
необходимости рекомендуются всем лицам с хронической инфекцией ВГС.
РЕЙТИНГ
I, C
I, C
I, B
I, B
II, C
II, C
I, C
Рекомендации AASLD по лечению ХГС 2019, https://www.hcvguidelines.org/ обращение в мае 2022
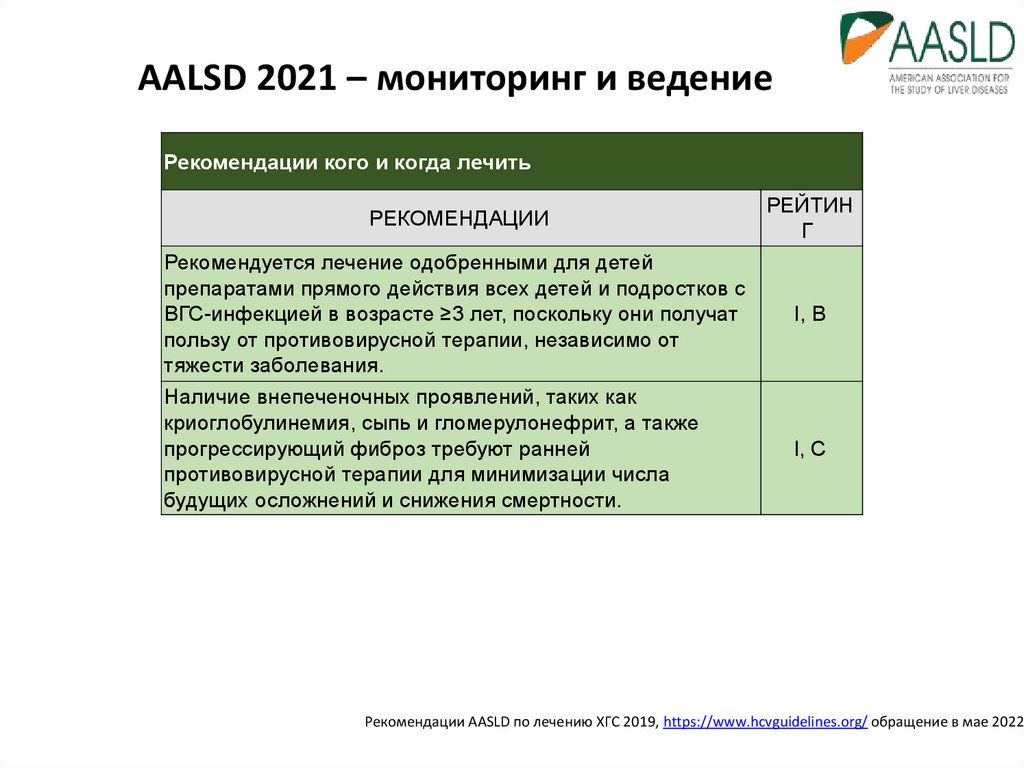
18. AALSD 2021 – мониторинг и ведение
Рекомендации кого и когда лечитьРЕКОМЕНДАЦИИ
Рекомендуется лечение одобренными для детей
препаратами прямого действия всех детей и подростков с
ВГС-инфекцией в возрасте ≥3 лет, поскольку они получат
пользу от противовирусной терапии, независимо от
тяжести заболевания.
Наличие внепеченочных проявлений, таких как
криоглобулинемия, сыпь и гломерулонефрит, а также
прогрессирующий фиброз требуют ранней
противовирусной терапии для минимизации числа
будущих осложнений и снижения смертности.
РЕЙТИН
Г
I, B
I, C
Рекомендации AASLD по лечению ХГС 2019, https://www.hcvguidelines.org/ обращение в мае 2022
19. В феврале 2019 в России впервые одобрена безинтерфероновая терапия ХГС у детей с 12 лет
26 февраля 2019 г. в РФбыло одобрено применение
комбинации
глекапревир/пибрентасвир
у детей с 12 лет
04 июня 2019 г. в РФ
было одобрено применение
софосбувира в сочетании с
рибавирином
у детей с 12 лет
19 февраля 2020 г. в РФ
было одобрено применение
комбинации
софосбувир/ледипасвир
у детей с 12 лет
28 октября 2020 г. в РФ
было одобрено применение
комбинации
софосбувир/велпатасвир
у детей с 12 лет
https://grls.rosminzdrav.ru/GRLS.aspx дата обращения май 2022
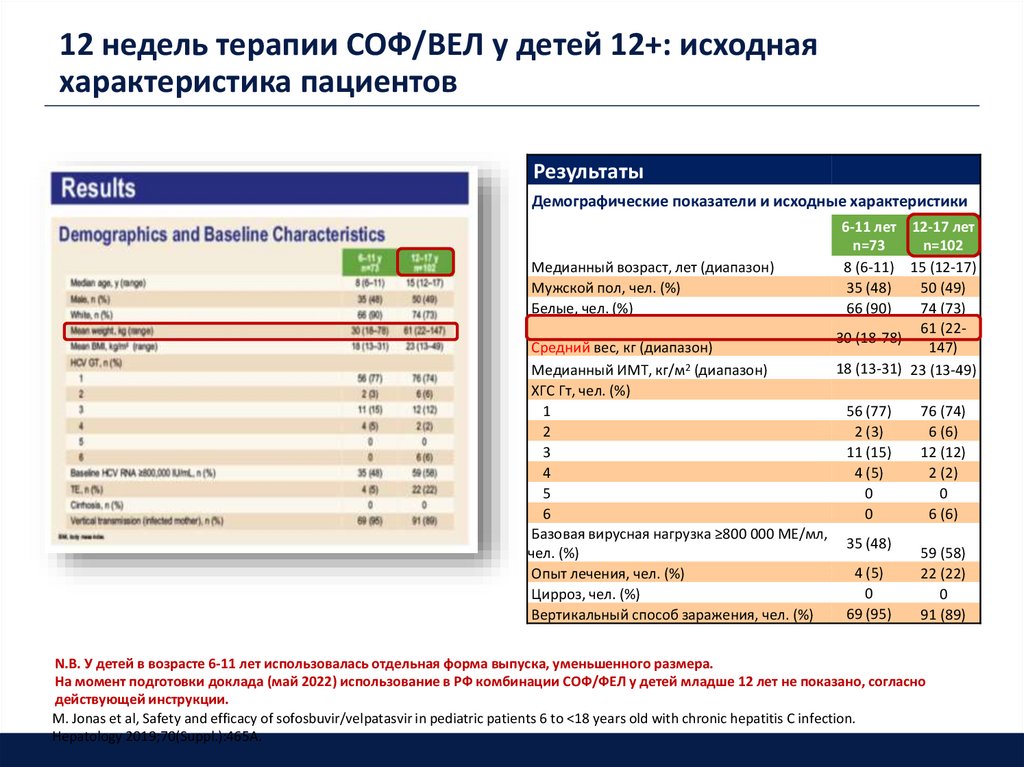
20. 12 недель терапии СОФ/ВЕЛ у детей 12+: исходная характеристика пациентов
РезультатыДемографические показатели и исходные характеристики
Медианный возраст, лет (диапазон)
Мужской пол, чел. (%)
Белые, чел. (%)
Средний вес, кг (диапазон)
Медианный ИМТ, кг/м2 (диапазон)
ХГС Гт, чел. (%)
1
2
3
4
5
6
Базовая вирусная нагрузка ≥800 000 МЕ/мл,
чел. (%)
Опыт лечения, чел. (%)
Цирроз, чел. (%)
Вертикальный способ заражения, чел. (%)
6-11 лет 12-17 лет
n=73
n=102
8 (6-11) 15 (12-17)
35 (48)
50 (49)
66 (90)
74 (73)
61 (2230 (18-78)
147)
18 (13-31) 23 (13-49)
56 (77)
2 (3)
11 (15)
4 (5)
0
0
35 (48)
4 (5)
0
69 (95)
76 (74)
6 (6)
12 (12)
2 (2)
0
6 (6)
59 (58)
22 (22)
0
91 (89)
N.B. У детей в возрасте 6-11 лет использовалась отдельная форма выпуска, уменьшенного размера.
На момент подготовки доклада (май 2022) использование в РФ комбинации СОФ/ФЕЛ у детей младше 12 лет не показано, согласно
действующей инструкции.
M. Jonas et al, Safety and efficacy of sofosbuvir/velpatasvir in pediatric patients 6 to <18 years old with chronic hepatitis C infection.
Hepatology 2019;70(Suppl.):465A.
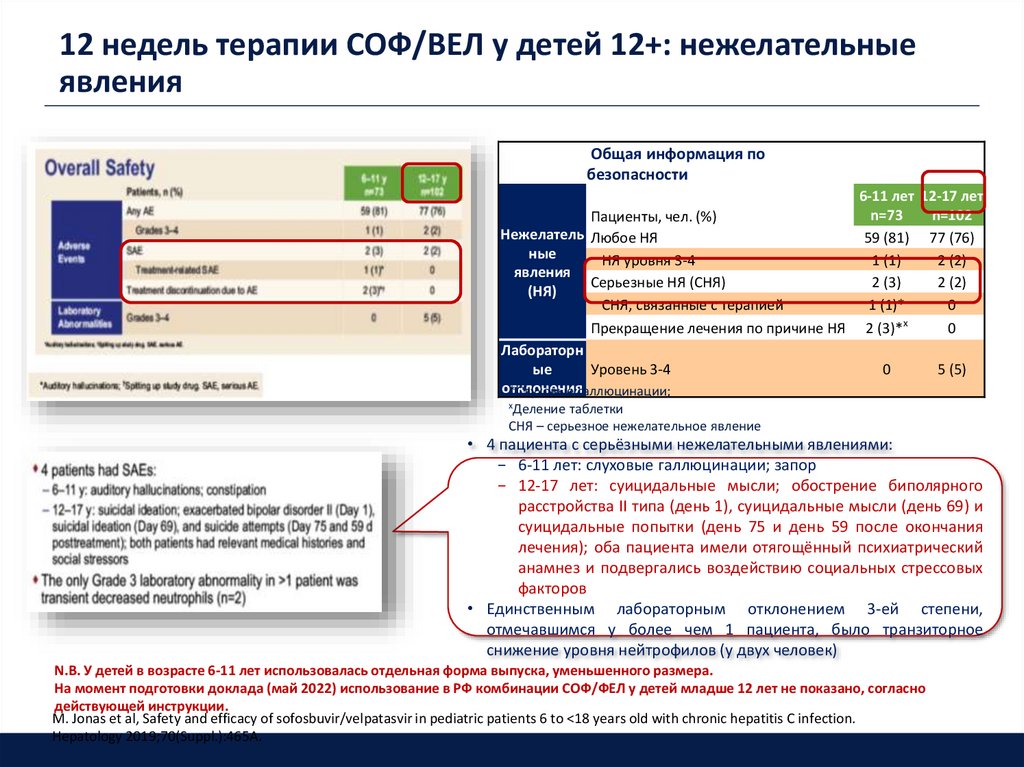
21. 12 недель терапии СОФ/ВЕЛ у детей 12+: нежелательные явления
Общая информация побезопасности
6-11 лет 12-17 лет
n=73
n=102
Пациенты, чел. (%)
Нежелатель Любое НЯ
59 (81) 77 (76)
ные
НЯ уровня 3-4
1 (1)
2 (2)
явления
Серьезные НЯ (СНЯ)
2 (3)
2 (2)
(НЯ)
СНЯ, связанные с терапией
1 (1)*
0
х
Прекращение лечения по причине НЯ 2 (3)*
0
Лабораторн
ые
Уровень 3-4
0
5 (5)
отклонения
*Слуховые галлюцинации;
хДеление
таблетки
СНЯ – серьезное нежелательное явление
• 4 пациента с серьёзными нежелательными явлениями:
− 6-11 лет: слуховые галлюцинации; запор
− 12-17 лет: суицидальные мысли; обострение биполярного
расстройства II типа (день 1), суицидальные мысли (день 69) и
суицидальные попытки (день 75 и день 59 после окончания
лечения); оба пациента имели отягощённый психиатрический
анамнез и подвергались воздействию социальных стрессовых
факторов
• Единственным лабораторным отклонением 3-ей степени,
отмечавшимся у более чем 1 пациента, было транзиторное
снижение уровня нейтрофилов (у двух человек)
N.B. У детей в возрасте 6-11 лет использовалась отдельная форма выпуска, уменьшенного размера.
На момент подготовки доклада (май 2022) использование в РФ комбинации СОФ/ФЕЛ у детей младше 12 лет не показано, согласно
действующей инструкции.
M. Jonas et al, Safety and efficacy of sofosbuvir/velpatasvir in pediatric patients 6 to <18 years old with chronic hepatitis C infection.
Hepatology 2019;70(Suppl.):465A.
22.
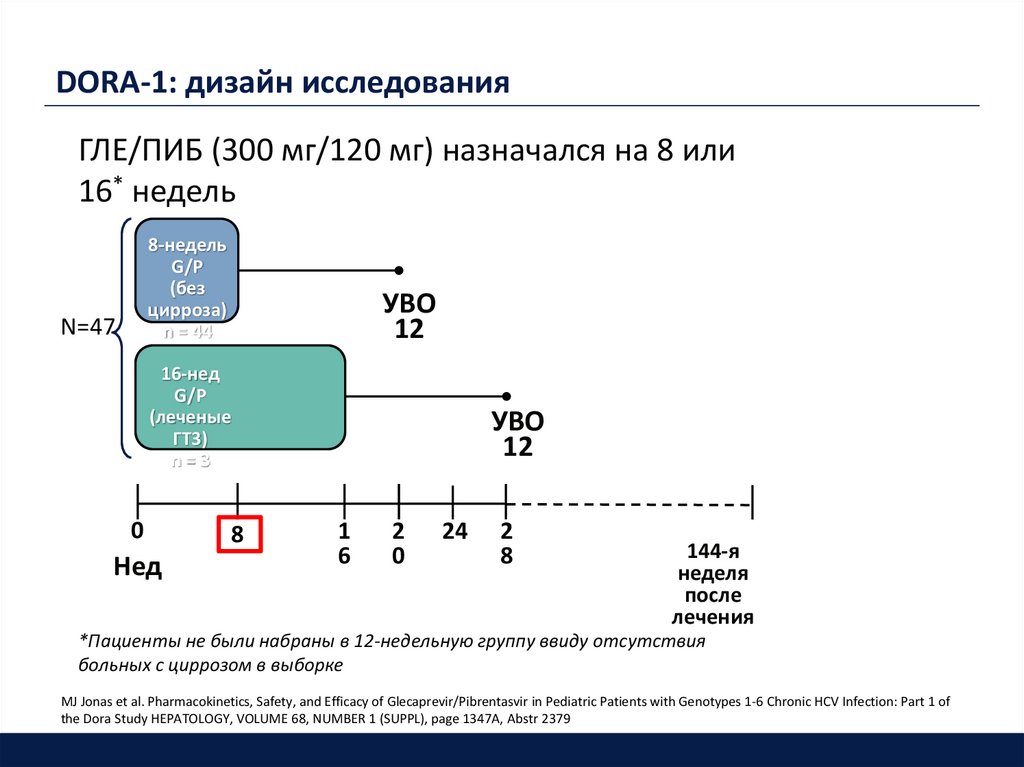
DORA-1: дизайн исследованияГЛЕ/ПИБ (300 мг/120 мг) назначался на 8 или
16* недель
8-недель
G/P
(без
цирроза)
n = 44
N=47
УВО
12
16-нед
G/P
(леченые
ГТ3)
n=3
0
Нед
8
УВО
12
1
6
2
0
24
2
8
144-я
неделя
после
лечения
*Пациенты не были набраны в 12-недельную группу ввиду отсутствия
больных с циррозом в выборке
MJ Jonas et al. Pharmacokinetics, Safety, and Efficacy of Glecaprevir/Pibrentasvir in Pediatric Patients with Genotypes 1-6 Chronic HCV Infection: Part 1 of
the Dora Study HEPATOLOGY, VOLUME 68, NUMBER 1 (SUPPL), page 1347A, Abstr 2379
23.
DORA-1: критерии включения/исключенияКритерии включения
Критерии исключения
• Возраст ≥12 – <18 лет
• Ко-инфекция с гепатитом B
• ХГС Гт 1–6 (РНК ВГС ≥1000
МЕ/мл)
• Декомпенсированный
цирроз (Child-Pugh B/C)
― Допускались
смешанные генотипы
ВГС
― Допускалась коинфекция с ВИЧ-1, на
стабильной АРТ,
совместимой с
ГЛЕ/ПИБ
MJ Jonas et al. Pharmacokinetics,
Safety, and Efficacy of Glecaprevir/Pibrentasvir in Pediatric Patients with Genotypes 1-6 Chronic HCV Infection: Part 1 of
the Dora Study HEPATOLOGY, VOLUME 68, NUMBER 1 (SUPPL), page 1347A, Abstr 2379
24.
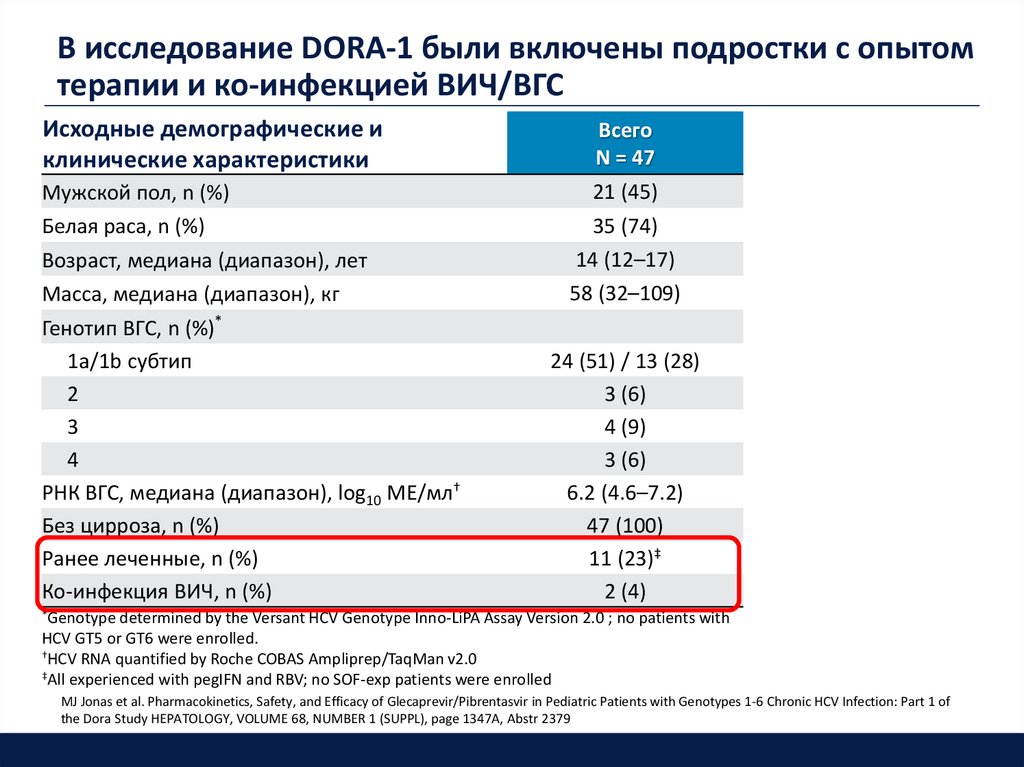
В исследование DORA-1 были включены подростки с опытомтерапии и ко-инфекцией ВИЧ/ВГС
Исходные демографические и
клинические характеристики
Мужской пол, n (%)
Белая раса, n (%)
Возраст, медиана (диапазон), лет
Масса, медиана (диапазон), кг
Генотип ВГС, n (%)*
1a/1b субтип
2
3
4
РНК ВГС, медиана (диапазон), log10 МЕ/мл†
Без цирроза, n (%)
Ранее леченные, n (%)
Ко-инфекция ВИЧ, n (%)
Всего
N = 47
21 (45)
35 (74)
14 (12–17)
58 (32–109)
24 (51) / 13 (28)
3 (6)
4 (9)
3 (6)
6.2 (4.6–7.2)
47 (100)
11 (23)‡
2 (4)
*Genotype
determined by the Versant HCV Genotype Inno-LiPA Assay Version 2.0 ; no patients with
HCV GT5 or GT6 were enrolled.
†HCV RNA quantified by Roche COBAS Ampliprep/TaqMan v2.0
‡All experienced with pegIFN and RBV; no SOF-exp patients were enrolled
MJ Jonas et al. Pharmacokinetics, Safety, and Efficacy of Glecaprevir/Pibrentasvir in Pediatric Patients with Genotypes 1-6 Chronic HCV Infection: Part 1 of
the Dora Study HEPATOLOGY, VOLUME 68, NUMBER 1 (SUPPL), page 1347A, Abstr 2379
25.
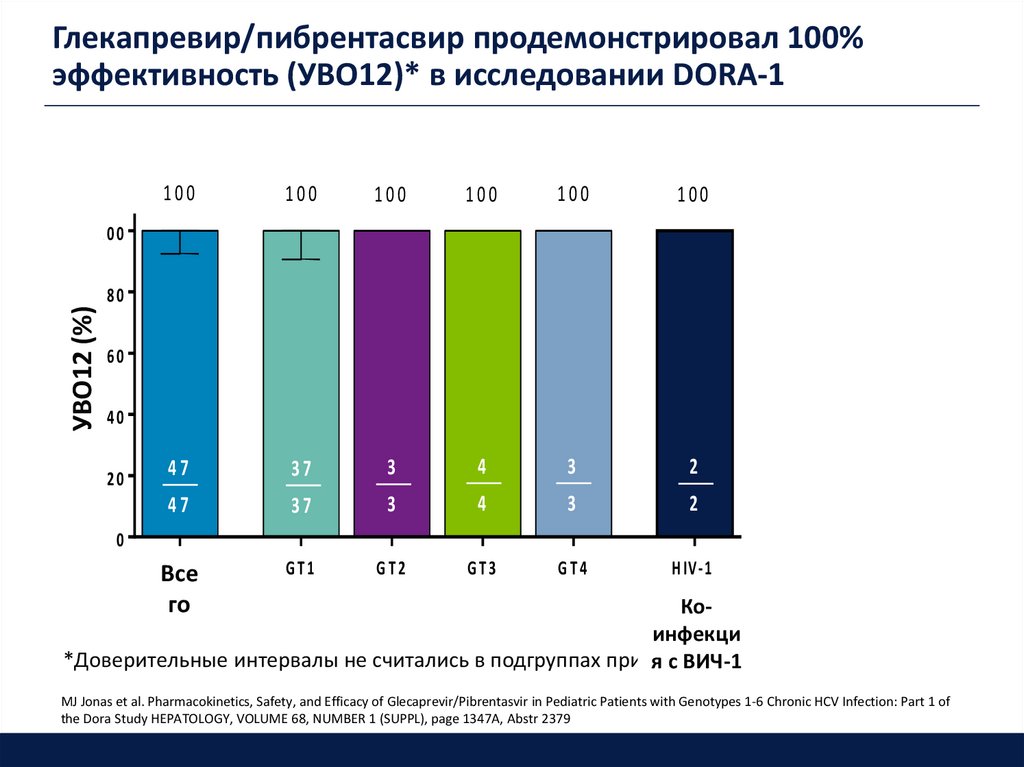
Глекапревир/пибрентасвир продемонстрировал 100%эффективность (УВО12)* в исследовании DORA-1
100
100
100
100
100
100
47
37
3
4
3
2
47
37
3
4
3
2
v e r a ll
OВсе
GT1
GT2
GT3
GT4
H IV -1
УВО12 (%)
% P a t ie n t s w it h S V R 1 2
100
80
60
40
20
0
го
fe c t e d
c o inКо-
инфекци
*Доверительные интервалы не считались в подгруппах при nя <с 10
ВИЧ-1
MJ Jonas et al. Pharmacokinetics, Safety, and Efficacy of Glecaprevir/Pibrentasvir in Pediatric Patients with Genotypes 1-6 Chronic HCV Infection: Part 1 of
the Dora Study HEPATOLOGY, VOLUME 68, NUMBER 1 (SUPPL), page 1347A, Abstr 2379
26.
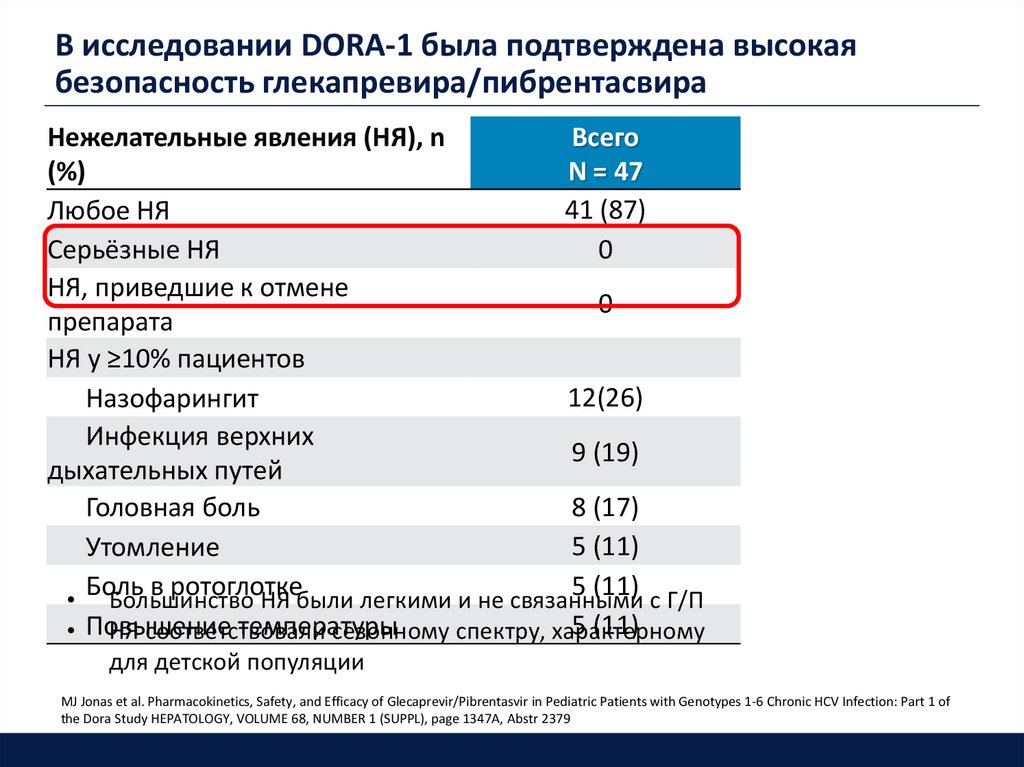
В исследовании DORA-1 была подтверждена высокаябезопасность глекапревира/пибрентасвира
Нежелательные явления (НЯ), n
Всего
(%)
N = 47
41 (87)
Любое НЯ
0
Серьёзные НЯ
НЯ, приведшие к отмене
0
препарата
НЯ у ≥10% пациентов
12(26)
Назофарингит
Инфекция верхних
9 (19)
дыхательных путей
8 (17)
Головная боль
5 (11)
Утомление
5 (11)
Боль в ротоглотке
• Большинство НЯ были легкими и не связанными с Г/П
5 (11)
температуры
• Повышение
НЯ соответствовали
сезонному спектру, характерному
для детской популяции
MJ Jonas et al. Pharmacokinetics, Safety, and Efficacy of Glecaprevir/Pibrentasvir in Pediatric Patients with Genotypes 1-6 Chronic HCV Infection: Part 1 of
the Dora Study HEPATOLOGY, VOLUME 68, NUMBER 1 (SUPPL), page 1347A, Abstr 2379
27.
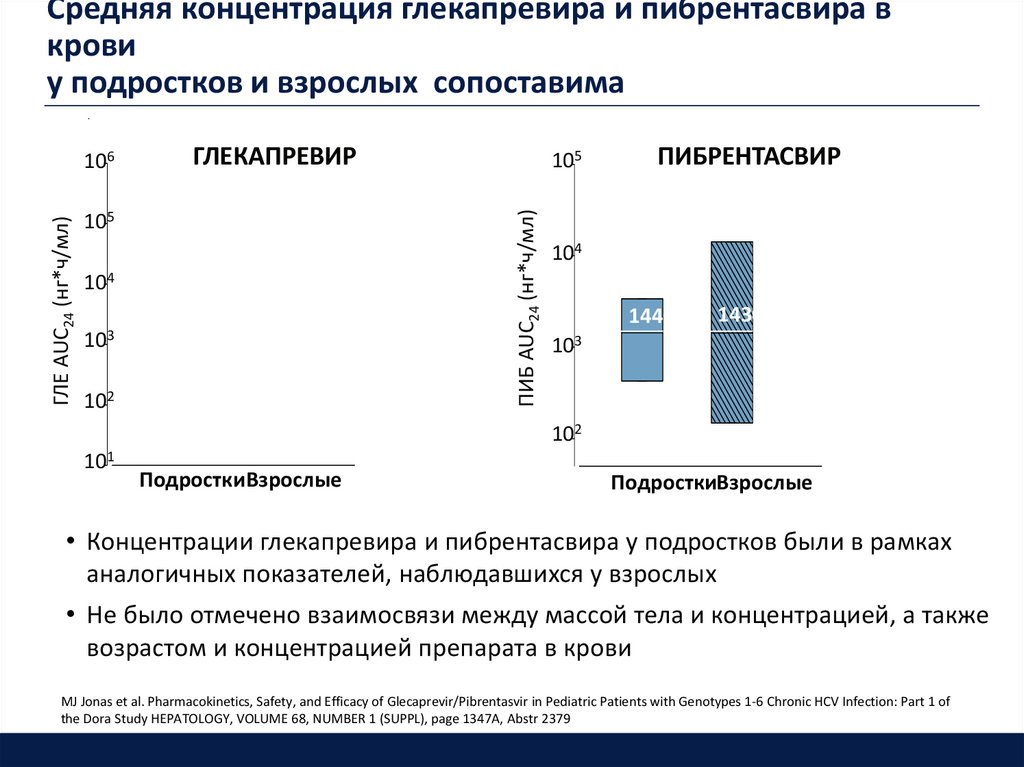
Средняя концентрация глекапревира и пибрентасвира вкрови
у подростков и взрослых сопоставима
ГЛЕКАПРЕВИР
105
104
4380
4800
103
102
105
ПИБ AUC24 (нг*ч/мл)
ГЛЕ AUC24 (нг*ч/мл)
106
ПИБРЕНТАСВИР
104
1440
1430
103
102
101
ПодросткиВзрослые
ПодросткиВзрослые
• Концентрации глекапревира и пибрентасвира у подростков были в рамках
аналогичных показателей, наблюдавшихся у взрослых
• Не было отмечено взаимосвязи между массой тела и концентрацией, а также
возрастом и концентрацией препарата в крови
MJ Jonas et al. Pharmacokinetics, Safety, and Efficacy of Glecaprevir/Pibrentasvir in Pediatric Patients with Genotypes 1-6 Chronic HCV Infection: Part 1 of
the Dora Study HEPATOLOGY, VOLUME 68, NUMBER 1 (SUPPL), page 1347A, Abstr 2379
28.
Резюме- 100% подростков достигли УВО12 включая пациентов с коинфекцией ВИЧ/ВГС
- Концентрация глекапревира и пибрентасвира у ВГСинфицированных подростков была сравнима с таковой у
взрослых пациентов
- Препарат хорошо переносился:
• не было отмечено серьёзных нежелательных явлений и
случаев отмены препарата
• профиль безопасности ГЛЕ/ПИБ у подростков соответствовал
таковому у взрослых
MJ Jonas et al. Pharmacokinetics, Safety, and Efficacy of Glecaprevir/Pibrentasvir in Pediatric Patients with Genotypes 1-6 Chronic HCV Infection: Part 1 of
the Dora Study HEPATOLOGY, VOLUME 68, NUMBER 1 (SUPPL), page 1347A, Abstr 2379
29. В апреле 2022 в России впервые одобрена безинтерфероновая терапия ХГС у детей с 3-х лет
18 апреля 2022 г. в РФбыло одобрено применение
комбинации
глекапревир/пибрентасвир
у детей с 3-х лет
https://grls.rosminzdrav.ru/GRLS.aspx дата обращения май 2022
30. DORA-2: критерии включения и исключения
Критерии включения• Возраст ≥3 – <12 лет
• ХГС Гт 1–6 (РНК ВГС ≥1000
МЕ/мл)
― Допускались смешанные
генотипы ВГС
― Допускалась ко-инфекция
с ВИЧ-1
на стабильной АРТ,
совместимой с ГЛЕ/ПИБ
Критерии исключения
• Ко-инфекция ВГВ
• Декомпенсированный
цирроз печени
(Child-Pugh B/C)
M.Jonas et al, Hepatology 2021 Jul;74(1):19-27.
31. DORA-2: режим дозирования в исследовании
Детская лекарственная форма:• предназначена для детей младше 12 лет и массой тела до 45 кг
• представляет собой небольшие покрытые оболочкой пеллеты/гранулы
ГЛЕ/ПИБ
• гранулы необходимо смешивать с мягкой пищей и принимать один раз в
день
Группа
Диапазоны веса
Доза (ГЛЕ/ПИБ)
Когорта 2 (9–<12 лет)
от ≥30 и до <45 кг
250 мг + 100 мг
Когорта 3 (6–<9 лет)
от ≥20 и до <30 кг
200 мг + 80 мг
Когорта 4 (3–<6 лет)
От ≥12 и до <20 кг
150 мг + 60 мг
Примечание: на слайде представлены итоговые терапевтические дозы,
у части детей в исследовании на этапе оценки фармакокинетики дозировки
препарата отличались
M.Jonas et al, Hepatology 2021 Jul;74(1):19-27.
32.
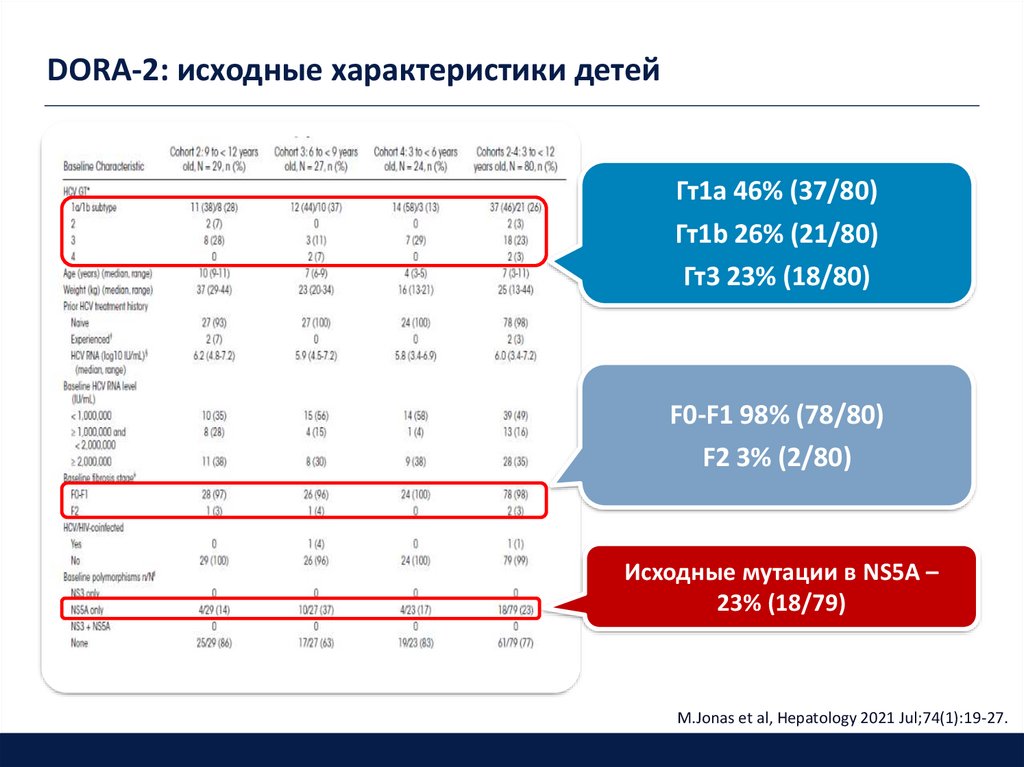
DORA-2: исходные характеристики детейГт1a 46% (37/80)
Гт1b 26% (21/80)
Гт3 23% (18/80)
F0-F1 98% (78/80)
F2 3% (2/80)
Исходные мутации в NS5A –
23% (18/79)
M.Jonas et al, Hepatology 2021 Jul;74(1):19-27.
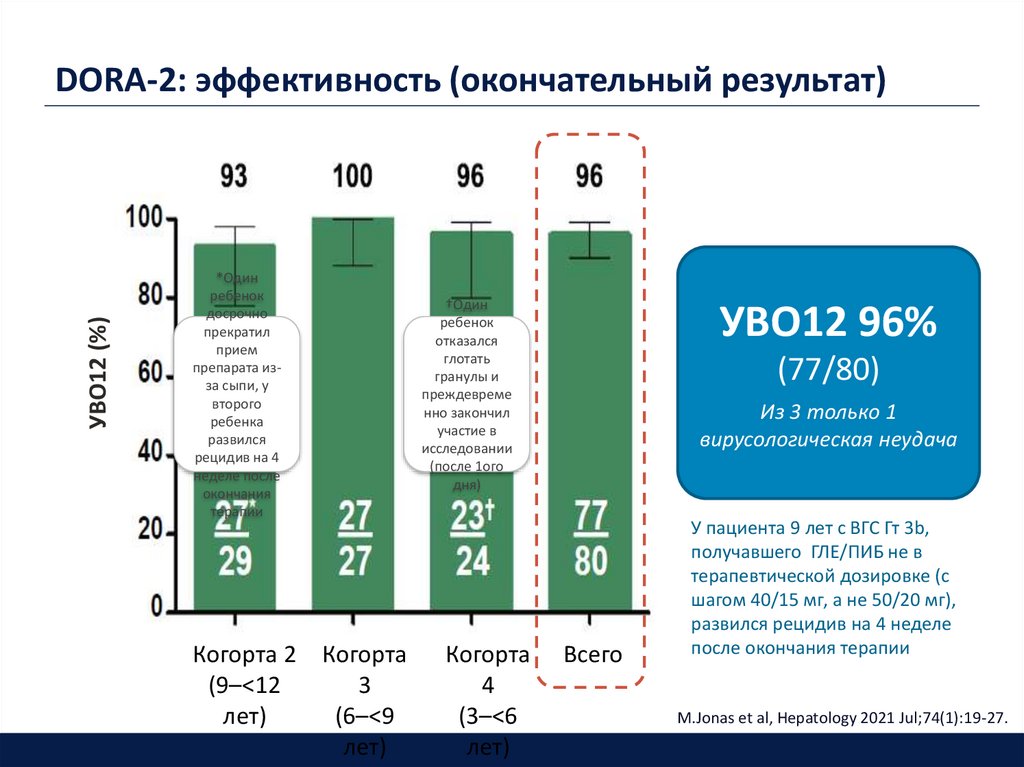
33. DORA-2: эффективность (окончательный результат)
УВО12 (%)DORA-2: эффективность (окончательный результат)
*Один
ребенок
досрочно
прекратил
прием
препарата изза сыпи, у
второго
ребенка
развился
рецидив на 4
неделе после
окончания
терапии
Когорта 2 Когорта
(9–<12
3
лет)
(6–<9
лет)
†Один
ребенок
отказался
глотать
гранулы и
преждевреме
нно закончил
участие в
исследовании
(после 1ого
дня)
Когорта
4
(3–<6
лет)
УВО12 96%
(77/80)
Из 3 только 1
вирусологическая неудача
Всего
У пациента 9 лет с ВГС Гт 3b,
получавшего ГЛЕ/ПИБ не в
терапевтической дозировке (с
шагом 40/15 мг, а не 50/20 мг),
развился рецидив на 4 неделе
после окончания терапии
M.Jonas et al, Hepatology 2021 Jul;74(1):19-27.
34. DORA-2: эффективность (окончательный результат)
100%
Эффективность среди
пациентов,
использовавших
терапевтическое
соотношение доз
ГЛЕ/ПИБ 50/20 мг и
прошедших полный
курс failure
терапии
No participants experienced virologic
on the final
GLE/PIB dose ratio of 50/20 mg, and no new HCV infections
or reinfections were reported.
M.Jonas et al, Hepatology 2021 Jul;74(1):19-27.
35. DORA часть 2: безопасность
Не было серьёзныхнежелательных
явлений,
связанных с
лечением
Из НЯ чаще всего встречались
(у >10% пациентов):
- Рвота 14% (11/80)
- Головная боль 14% (11/80)
- Диарея 10% (8/80)
M.Jonas et al, Hepatology 2021 Jul;74(1):19-27.
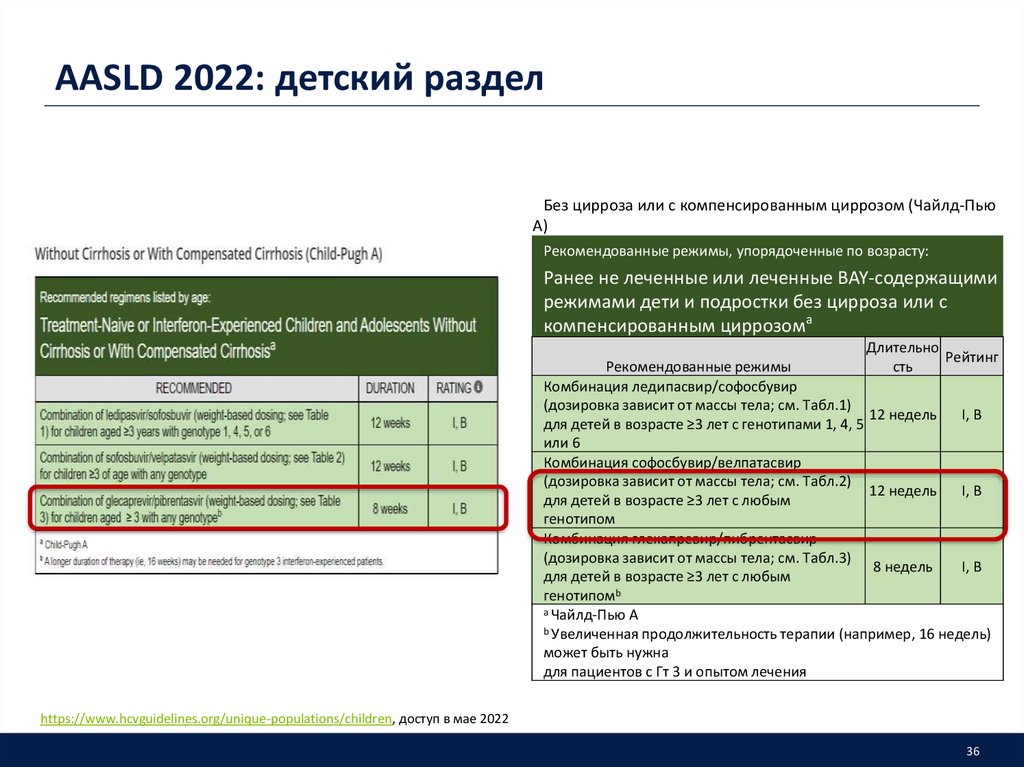
36. AASLD 2022: детский раздел
Без цирроза или с компенсированным циррозом (Чайлд-ПьюА)
Рекомендованные режимы, упорядоченные по возрасту:
Ранее не леченные или леченные BAY-содержащими
режимами дети и подростки без цирроза или с
компенсированным циррозома
Длительно
Рейтинг
Рекомендованные режимы
сть
Комбинация ледипасвир/софосбувир
(дозировка зависит от массы тела; см. Табл.1)
12 недель
I, B
для детей в возрасте ≥3 лет с генотипами 1, 4, 5
или 6
Комбинация софосбувир/велпатасвир
(дозировка зависит от массы тела; см. Табл.2)
12 недель
I, B
для детей в возрасте ≥3 лет с любым
генотипом
Комбинация глекапревир/пибрентасвир
(дозировка зависит от массы тела; см. Табл.3)
8 недель
I, B
для детей в возрасте ≥3 лет с любым
генотипомb
а Чайлд-Пью А
b Увеличенная продолжительность терапии (например, 16 недель)
может быть нужна
для пациентов с Гт 3 и опытом лечения
https://www.hcvguidelines.org/unique-populations/children, доступ в мае 2022
36
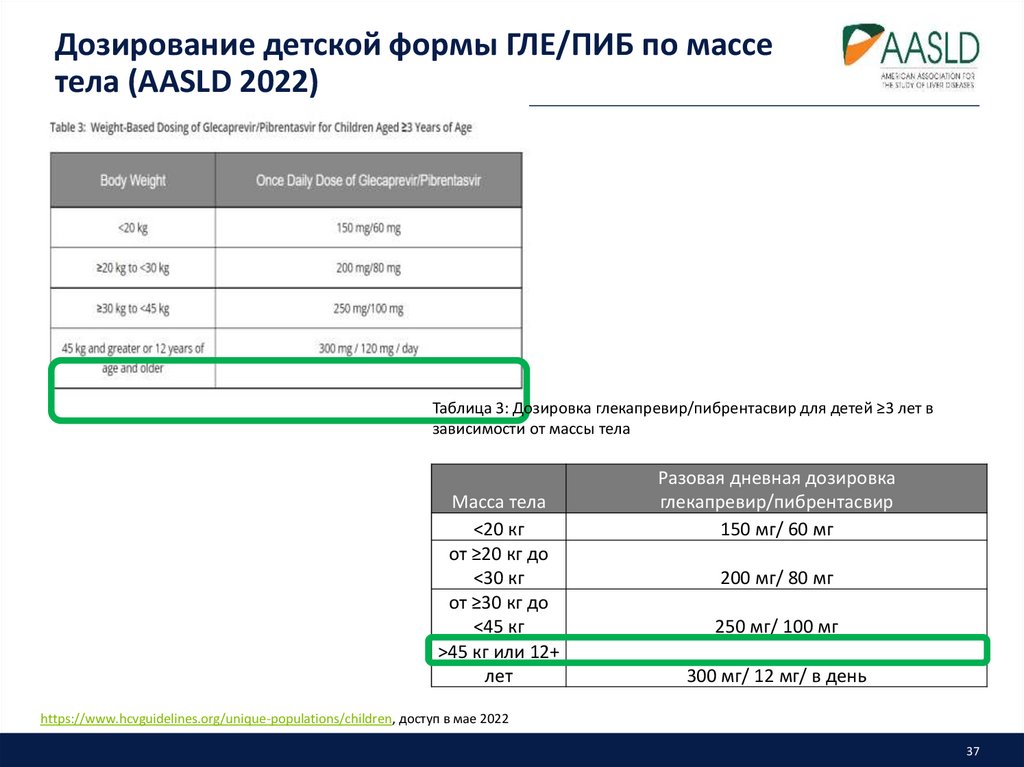
37. Дозирование детской формы ГЛЕ/ПИБ по массе тела (AASLD 2022)
Таблица 3: Дозировка глекапревир/пибрентасвир для детей ≥3 лет взависимости от массы тела
Масса тела
<20 кг
от ≥20 кг до
<30 кг
от ≥30 кг до
<45 кг
>45 кг или 12+
лет
Разовая дневная дозировка
глекапревир/пибрентасвир
150 мг/ 60 мг
200 мг/ 80 мг
250 мг/ 100 мг
300 мг/ 12 мг/ в день
https://www.hcvguidelines.org/unique-populations/children, доступ в мае 2022
37
38. Как выглядит Мавирет (гранулы, покрытые оболочкой, для детей)?
Отличная от взрослой упаковка~9 см
~2,4
см
*Одно саше препарата Мавирет в формате гранул, покрытых пленочной оболочкой, для
детей содержит 50 мг глекапревира (53 гранулы розового цвета) и 20 мг пибрентасвира (41
гранула жёлтого цвета)
Макет упаковки представлен компанией ООО «ЭббВи»
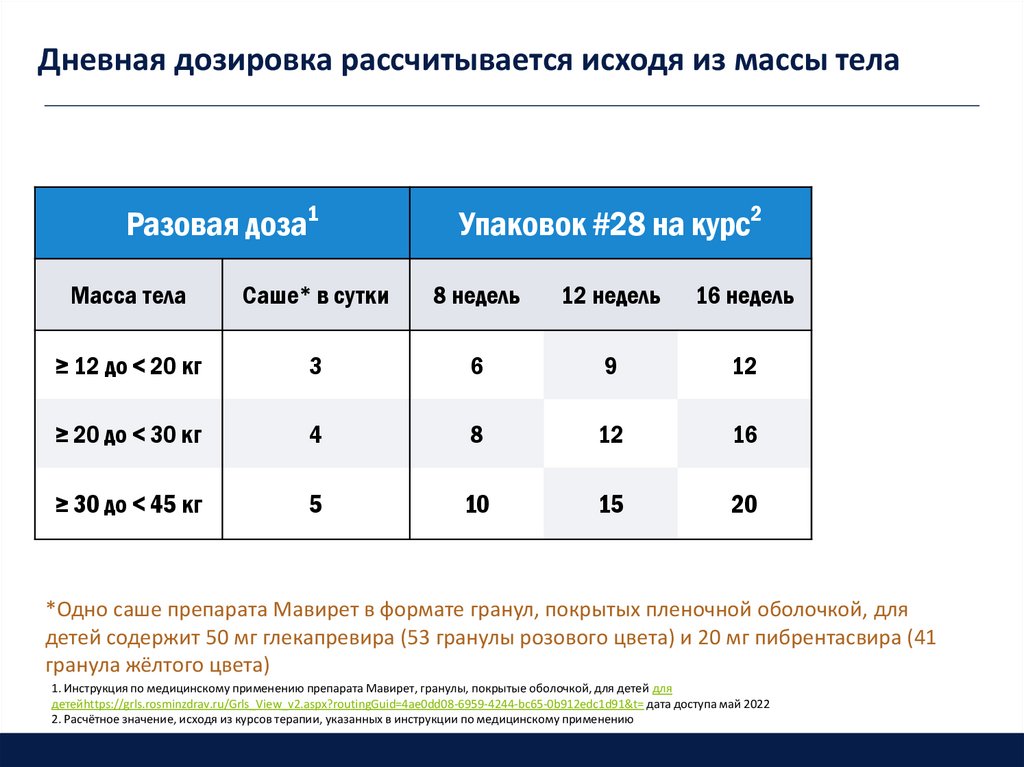
39. Дневная дозировка рассчитывается исходя из массы тела
Разовая доза1Упаковок #28 на курс2
Масса тела
Саше* в сутки
8 недель
12 недель
16 недель
≥ 12 до < 20 кг
3
6
9
12
≥ 20 до < 30 кг
4
8
12
16
≥ 30 до < 45 кг
5
10
15
20
*Одно саше препарата Мавирет в формате гранул, покрытых пленочной оболочкой, для
детей содержит 50 мг глекапревира (53 гранулы розового цвета) и 20 мг пибрентасвира (41
гранула жёлтого цвета)
1. Инструкция по медицинскому применению препарата Мавирет, гранулы, покрытые оболочкой, для детей для
детейhttps://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=4ae0dd08-6959-4244-bc65-0b912edc1d91&t= дата доступа май 2022
2. Расчётное значение, исходя из курсов терапии, указанных в инструкции по медицинскому применению
40. Перед тем, как дать Мавирет (гранулы) ребёнку, его нужно смешать с мягкой, не текучей едой
**
*
*
*
*
ВАЖНО!
Помимо продуктов,
используемых для
смешивания с
гранулами,
препарат Мавирет
также следует
применять
одновременно или
сразу после приема
пищи.
Продукты, с
которыми
смешивают
гранулы, не
заменяют
* Пример продукта. Не является рекламой указанной торговой марки
полноценный
Инструкция по медицинскому применению препарата Мавирет, гранулы, покрытые оболочкой, для детей для
прием пищи, с
детейhttps://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=4ae0dd08-6959-4244-bc65-0b912edc1d91&t= дата доступа май 2022
которыми следует
совмещать
41. Мавирет (гранулы) нельзя смешивать с едой, которая может стечь с ложки
Для совместного применения не подходят следующиепродукты:
✘ Жидкая или водянистая пища
✘ Яблочный соус
✘ Еда или жидкости, которые подверглись подогреву
или заморозке
✘ Хлеб или другие продукты, которые нужно жевать
✘ Другие виды йогурта, помимо греческого
ВАЖНО!
При смешивании
с текучей едой
препарат быстро
растворяется,
имеет горький
вкус и
становится
менее
эффективным.
Не следует
использовать
✘ Детское питание
продукты,
которые могут
✘ Пища, которая может стекать с ложки
вызвать
аллергическую
Инструкция по медицинскому применению препарата Мавирет, гранулы, покрытые оболочкой, для детей для
детейhttps://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=4ae0dd08-6959-4244-bc65-0b912edc1d91&t= дата доступа май 2022 реакцию у
ребёнка.
42. Другие особенности применения Мавирет (гранулы)
✘ Нельзя ломать гранулы, после разламывания они имеютгорький вкус
✘ Не следует хранить смесь, необходимо сразу дать её
ребёнку.
ВАЖНО!
Спустя 5 минут после приготовления смесь может
иметь горький привкус.
ВАЖНО!
Спустя 15 минут после приготовления препарат
может быть менее эффективным. Следует выбросить
смесь и приготовить новую.
Инструкция по медицинскому применению препарата Мавирет, гранулы, покрытые оболочкой, для детей для
детейhttps://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=4ae0dd08-6959-4244-bc65-0b912edc1d91&t= дата доступа май 2022
43. РЕЗЮМЕ
1. Прорыв в противовирусной терапии ХВГС в педиатрическойпрактике позволит охватит социально активные группы детского
населения с 3-х лет до 17 лет
2. Пангенотипные комбинации доступны на территории РФ и
возможны в рамках ОМС
3. Излечение детей с ХВГС профилактирует возможные осложнения
и серьезные проблемы во взрослой жизни.























 medicine
medicine