Similar presentations:
Желтухи и гепатиты у детей
1. Желтухи и гепатиты у детей
Шабалов Николай ПавловичРоссийская Военно-Медицинская Академия
Кафедра детских болезней имени М.С.
Маслова
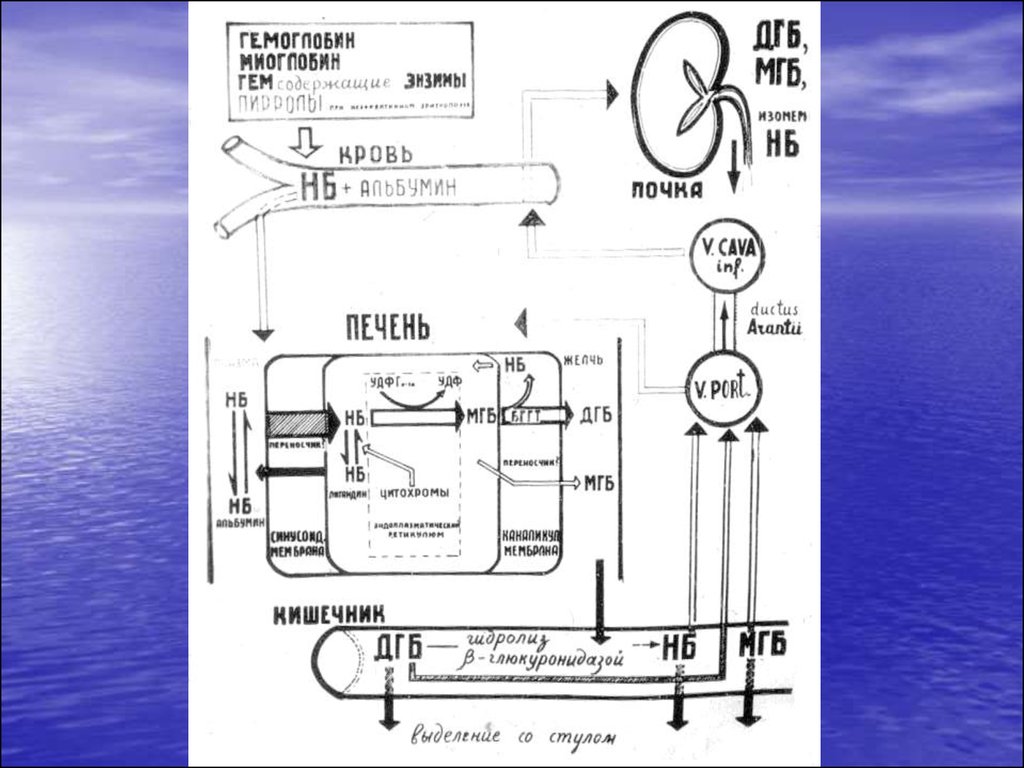
2. Желтуха – визуальное проявление гипербилирубинемии
Билирубин – конечный продукткатаболизма протопорфиринового
кольца гема. При распаде 1 г
гемоглобина образуется 34 мг
билирубина.
У взрослых желтуха появляется при
уровне билирубина более 25
мкмоль/л, у доношенных
новорожденных – 85 мкмоль/л, а у
недоношенных – 105 - 120 мкмоль/л.
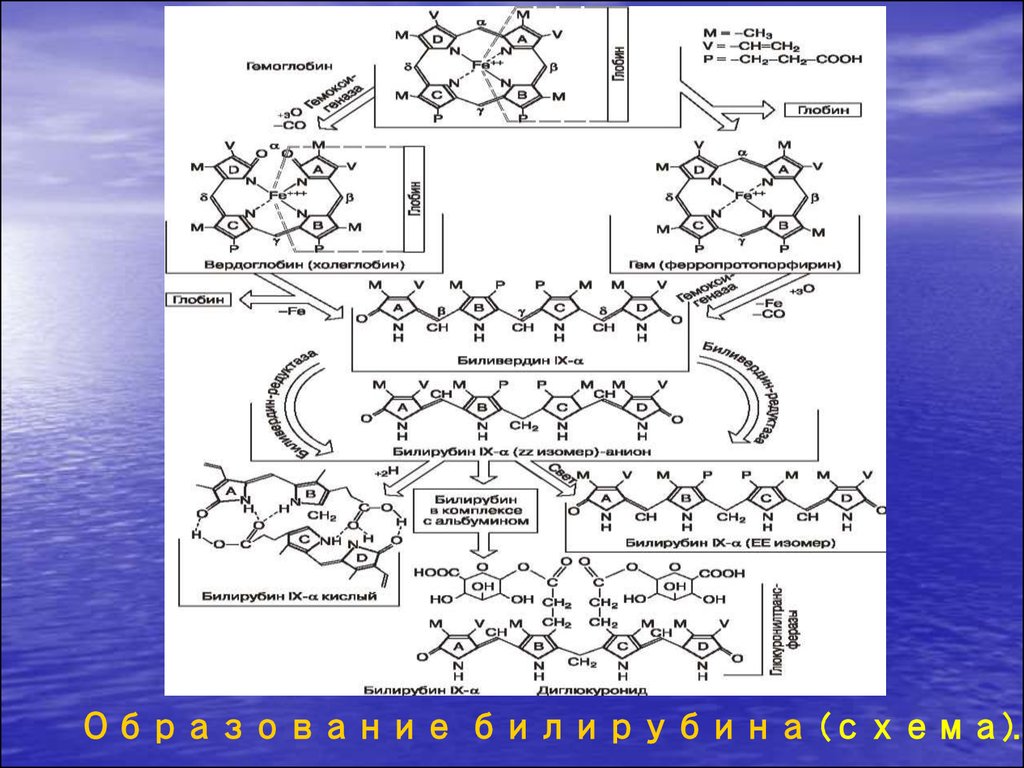
3.
Образование билирубина (схема).4. Частота желтух у новорождённых
По данным исследования,проведенного в США и
охватившего более 35 000
новорожденных, желтуха
развивается в течение первой
недели жизни у 65% детей, но
уровень билирубина в
сыворотке крови превышает 205–
221 мкмоль/л (12,0–12,9 мг%) лишь у 4,5–
6,2% доношенных новорожденных,
но у 10–20% детей с массой тела
при рождении менее 2500 г уровень НБ
может доходить до 257 мкмоль/л (15 мг%)
(Оски Ф., 1991).
5. Транзиторная (физиологическая) желтуха новорождённых
Причиной повышения уровня билирубина (Б), которое развивается у 100% здоровых детей послерождения является:
1.
2.
3.
1.
2.
1.
2.
3.
повышенное его образование (137–171 мкмоль/кг/сут., т.е. в
2–3 раза больше, чем у взрослых) из-за:
более короткой продолжительности жизни эритроцитов с фетальным
гемоглобином (70–90 дней – у новорожденных и 100–120 дней – у
взрослых),
высокого образования Б в катаболическую фазу обмена веществ из
неэритроцитарных источников гема (миоглобин, цитохромы печени и
др.),
выраженного неэффективного эритропоэза;
пониженная функциональная способность печени из-за:
временной недостаточности глюкуронил-трансферазной активности
печени, экскретирующей материнские гормоны у ребенка,
сниженной способности гепатоцита к захвату и экскреции Б;
повышенное поступление НБ из кишечника из-за:
повышенной (по сравнению со взрослыми) энтеро-гепатогенной
циркуляции билирубина (причем, часть билирубина из кишечника
избегает ее за счет открытого Аранциева протока),
высокой активности β-глюкуронидазы кишечной стенки,
стерильности кишечника.
6.
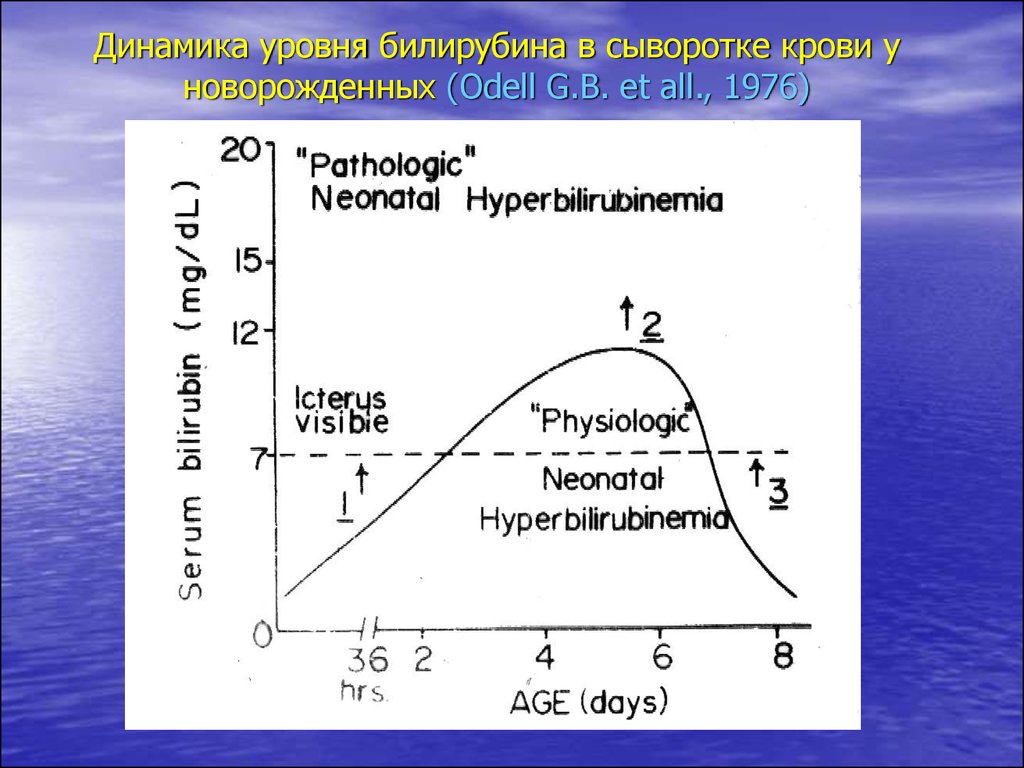
7.
Динамика уровня билирубина в сыворотке крови уноворожденных (Odell G.B. et all., 1976)
8. Физиологическая целесообразность транзиторной гипербилирубинемии новорождённых
Билирубин – антиоксидант испособен предотвращать избыточное
перекисное окисление липидов, что,
конечно, полезно в условиях
оксидантного стресса сразу после
рождения.
9. Важно помнить:
• физиологическая желтуха – диагноз исключенияпатологических желтух;
• у детей с патологическими желтухами только по клиникоанамнестическим данным (т.е. без привлечения
дополнительных лабораторных исследований) поставить
правильный диагноз можно лишь не более чем в 10–15%
случаев.
• Визуальная оценка степени желтушности кожных покровов
может привести к ошибке
(Американская академия педиатрии – ААП; Pediatrics 2004,
114:297-316).
10. Патологические желтухи имеют одну или несколько характерных черт:
• имеются при рожденииили появляются в
первые сутки либо на второй неделе жизни;
сочетаются с признаками гемолиза (анемия,
высокий ретикулоцитоз, в мазке крови –
ядерные эритроидные формы, избыток
сфероцитов – +++, ++++), бледностью, гепатоспленомегалией;
длятся более 1 нед. у доношенных и 2 нед. – у
недоношенных детей;
протекают волнообразно;
темп прироста (нарастания)
неконъюгированного билирубина (НБ, непрямой
билирубин) составляет >3,4 мкмоль/л/ч (0,2 мг%/ч)
или > 85 мкмоль/л/сут. (5 мг%/сут.);
уровень НБ в сыворотке пуповинной крови – >60
мкмоль/л (3,5 мг%) или 85 мкмоль/л (5 мг%) – в первые 12
ч жизни, 171 мкмоль/л (10 мг%) – на 2-е сутки жизни,
максимальные величины НБ превышают 221
мкмоль/л (12,9 мг%);
уровень билирубиндиглюкуронида (БДГ, прямой
билирубин) не должен превышать 20% от уровня общего Б, но при
использовании Vitros ( в прошлом Ektachem) системы (Ortho-Clinical Diagnostics,
Raritan,NJ) уровни БДГ более 1 мг% - аномальны (ААП, 2004). При определении по
11. Желтухи новорожденных (патогенетическая классификация)
НаследственныеПриобретенные
Повышенная продукция билирубина
Эритроцитарные мембранопатии
(микросфероцитоз, эллиптоцитоз и др.)
Эритроцитарные энзимодефициты
(глюкозо-6-фосфатдегидрогеназы,
пируваткиназы, гексокиназы и др.)
Гемоглобинопатии – дефекты
структуры (серповидноклеточная
анемия, М-гемоглобинемии и др.) и
синтеза гемоглобина (α, β, E-β, γталассемии), гема (врожденные
эритропорфирии)
Гемолитическая болезнь новорожденных
Секвестрация крови – кровоизлияния
(кефалогематома, под апоневроз, в мозг,
внутренние органы, экхимозы и др.) и синдром
заглоченной крови
Полицитемия
Лекарственный гемолиз (окситоцин материи,
витамин К в больших дозах, сульфаниламиды;
др.)
Повышенная энтеро-гепатогенная
циркуляция билирубина (пилоростеноз,
непроходимость кишечника и др.
Витамин Е-дефицитная анемия и
неонатальный пикноцитоз
Иммунопатологические болезни матери:
аутоиммунная гемолитическая анемия,
красная волчанка
12. Желтухи новорожденных (патогенетическая классификация) (продолжение)
НаследственныеПриобретенные
Пониженный клиренс билирубина (печеночные желтухи)
Дефект захвата билирубина и
конъюгации гепатоцитами (болезнь
Жильбера)
Дефекты конъюгации билирубина
(синдромы Криглера–Наджара I и II
типа, Люцей–Дрисколла)
Дефекты экскреции билирубина из
гепатоцита (синдромы Дубина–
Джонса, Ротора)
Симптоматические при
галактоземии, фруктоземии,
гиперметионинемии,
гипераммониемии и др.
Дефициты гормонов (гипотиреоз,
гипопитуитаризм) или их избыток
(желтуха материнского молока)
Энергетическая и водная депривация
(желтуха грудного вскармливания)
Инфекционные гепатиты
Токсические гепатиты (сепсис,
отравления, лекарственные)
Полное парентеральное питание
13. Желтухи новорожденных (патогенетическая классификация) (продолжение)
НаследственныеПриобретенные
Обструктивные - механические желтухи
Атрезия или гипоплазии внепеченочных
желчевыводящих путей фетального типа –
синдромальные аномалии желчных путей в
сочетании с другими пороками развития (синдром
Алажилля, «норвежский холестаз», трисомии по
13й, 18й, 21й парам аутосом, лепречаунизм
Семейные, несиндромальные холестазы (Байлера,
Мак Элфреша, с лимфедемой
«североамериканских индейцев»)
Симптоматические холестазы при
наследственных болезнях – муковисцидозе,
дефиците α1-антитрипсина, гемохроматозе,
гистиоцитозе Х, болезни Ниманна–Пика,
гликогенной болезни, печеночноцереброренальном синдроме (синдром
Цельвегера), адреногенитальном синдроме из-за
дефицита 3β-гидрооксистероиддегидрогеназы
Холестазы с расширением внутрипеченочных
желчных путей (болезнь Кароли, полицистная
болезнь, врожденный фиброз печени)
Атрезия или гипоплазии внепеченочных
желчных путей из-за перинатального
гепатита
Внутрипеченочные атрезии и
гипоплазии желчных путей при
перинатальном гепатите разной
этиологии, реакции «трансплантат –
против хозяина» - отечная форма ГБН
Стеноз общего желчного протока или
его киста, холедохолитиаз
Сдавление опухолями и другими
образованиями (кисты и др)
Синдром сгущения желчи, синдром
«желчной пробки»
Транзиторный холестаз в структуре
токсического гепатита и полиорганной
недостаточности при ССВО;
иатрогенный при переливании
препаратов крови, длительных
парентеральном питании и
антибактериальной терапии (и
массивной!), катетеризации пупочной
вены
14. Желтухи новорожденных (патогенетическая классификация) (продолжение)
Желтухи смешанного генеза с доминированием одного изкомпонентов
Транзиторная желтуха новорожденных
Неонатальная желтуха недоношенных
Сепсис
Внутриутробные инфекции (цитомегалия, токсоплазмоз,
листериоз и др.)
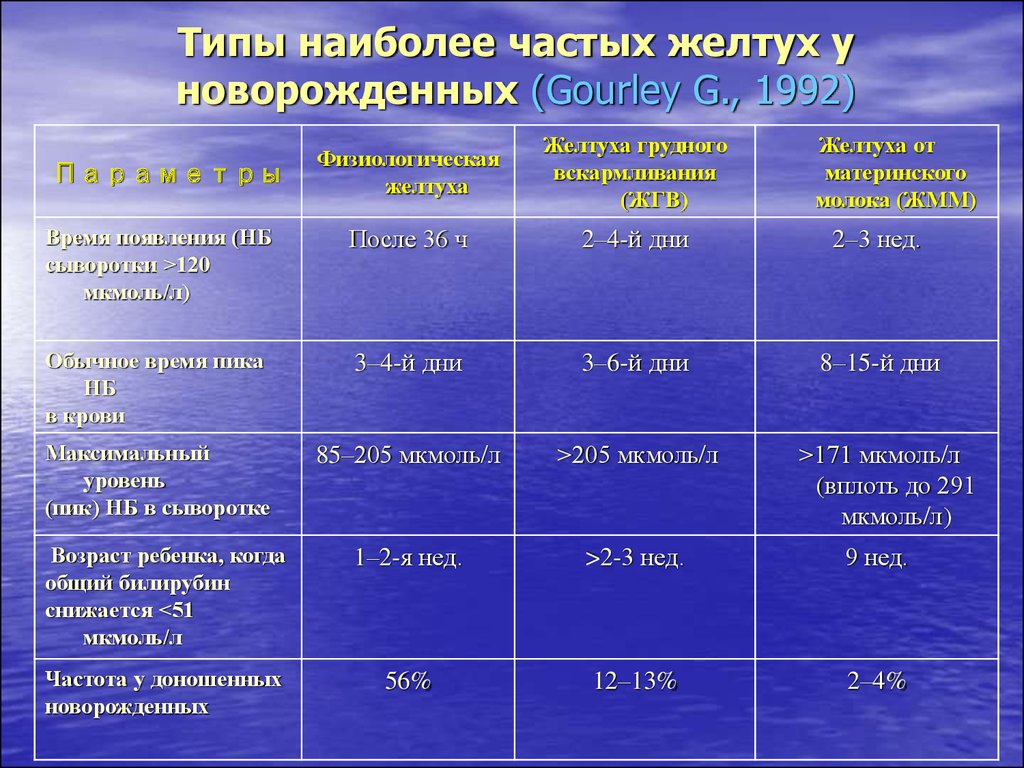
15. Типы наиболее частых желтух у новорожденных (Gourley G., 1992)
Физиологическаяжелтуха
Желтуха грудного
вскармливания
(ЖГВ)
Время появления (НБ
сыворотки >120
мкмоль/л)
После 36 ч
2–4-й дни
2–3 нед.
Обычное время пика
НБ
в крови
3–4-й дни
3–6-й дни
8–15-й дни
Максимальный
уровень
(пик) НБ в сыворотке
85–205 мкмоль/л
>205 мкмоль/л
>171 мкмоль/л
(вплоть до 291
мкмоль/л)
Возраст ребенка, когда
общий билирубин
снижается <51
мкмоль/л
1–2-я нед.
>2-3 нед.
9 нед.
Частота у доношенных
новорожденных
56%
12–13%
2–4%
Параметры
Желтуха от
материнского
молока (ЖММ)
16. Гемолитическая болезнь новорожденных (ГБН)
ГБН – заболевание, обусловленноеиммунологическим конфликтом из-за
несовместимости крови плода и матери по
эритроцитарным антигенам. ГБН в России
диагностируют приблизительно у 0,6%
всех новорожденных.
17. Гемолитическая болезнь новорожденных
Известно 14 основных эритроцитарных групповыхсистем, объединяющих более 100 антигенов, а
также многочисленные частные и общие с другими
тканями эритроцитарные антигены. Как правило,
эритроциты ребенка имеют какие-то отцовские
антигены, отсутствующие у матери. По данным Т.А.
Бушмариной (ГСПК СПБ, 2005) частота обнаружения
антиэритроцитарных антител во время беременности составляет
94%.
ГБН обычно вызывает несовместимость плода и
матери по резус или АВ0-антигенам (АВ > D >
Kell>c > C >E >e).
18. Гемолитическая болезнь новорожденных
Установлено, что антигенная система резус состоитиз 6 основных антигенов (синтез которых определяют
2 пары генов, расположенных на первой хромосоме),
обозначаемых либо C, c; D, d; E, e (терминология
Фишера), либо Rh', hr', Rhо, hrо, Rh'', hr''
(терминология Виннера). Резус-положительные
эритроциты содержат D-фактор (Rhо-фактор, по
терминологии Виннера), а так называемые резусотрицательные эритроциты его не имеют, хотя в них
обязательно есть (за редчайшими исключениями)
другие антигены системы резус.
Резус-положительные лица могут быть гомозиготы
(DD) – 44% или гетерозиготы (Dd) – 56%, поэтому
25% детей от резус-отрицательных матерей и резусположительных отцов будут резус-отрицательными.
19. Обозначение антигенов и соответствующих им антител системы резус
Авт
о
р
Fisher and
Race
Wiener
Антигены и
соответствующие им
антитела
C
анти-С
D
анти-D
E
анти-E
с
анти-c
d
анти-d
e
анти-e
rh’
анти- rh’
Rho
анти- Rho
rh’’
анти- rh’’
hr’
анти- hr’
Hro
анти- Hro
hr’’
анти- hr’’
20. Гемолитическая болезнь новорожденных
ГБН развивается в 1-3% случаев несовместимости плода иматери по АВО- и/или резус-антигенам.
Несовместимость по АВ0-антигенам,
приводящая к ГБН, обычно бывает при группе
крови матери 0(I) и группе крови ребенка A (II).
По данным американских акушеров, риск резусаллоиммунизации составляет 16%, если мать и
ребенок совместимы по АВ0-групповым
антигенам, и 1,5% – если они по ним не
совместимы. Если ГБН развивается при двойной
несовместимости ребенка и матери, т.е. мать 0(I)
Rh(0), а ребенок A(II) Rh(+) или B(III) Rh(+), то,
как правило, она обусловлена А или Вантигенами.
21. Гемолитическая болезнь новорожденных
Эритроциты плода регулярно обнаруживают вкровотоке матери, начиная с 16–18 нед. беременности.
Непосредственно перед родами фетальные
эритроциты можно найти в крови 75% беременных,
как правило, количество их небольшое – 0,1–0,2 мл.
Наиболее выраженная трансплацентарная трансфузия
происходит во время родов, но обычно опять-таки она
невелика – 3–4 мл крови плода.
Проникшие в кровоток матери эритроциты плода
(даже в количестве 0,1 мл), имеющие D-антиген,
отсутствующий у матери, приводят во время первой
беременности к синтезу вначале Rh-антител,
относящихся к иммуноглобулинам класса М, которые
через плаценту не проникают, а затем и антител
класса IgG, которые уже могут проникать через
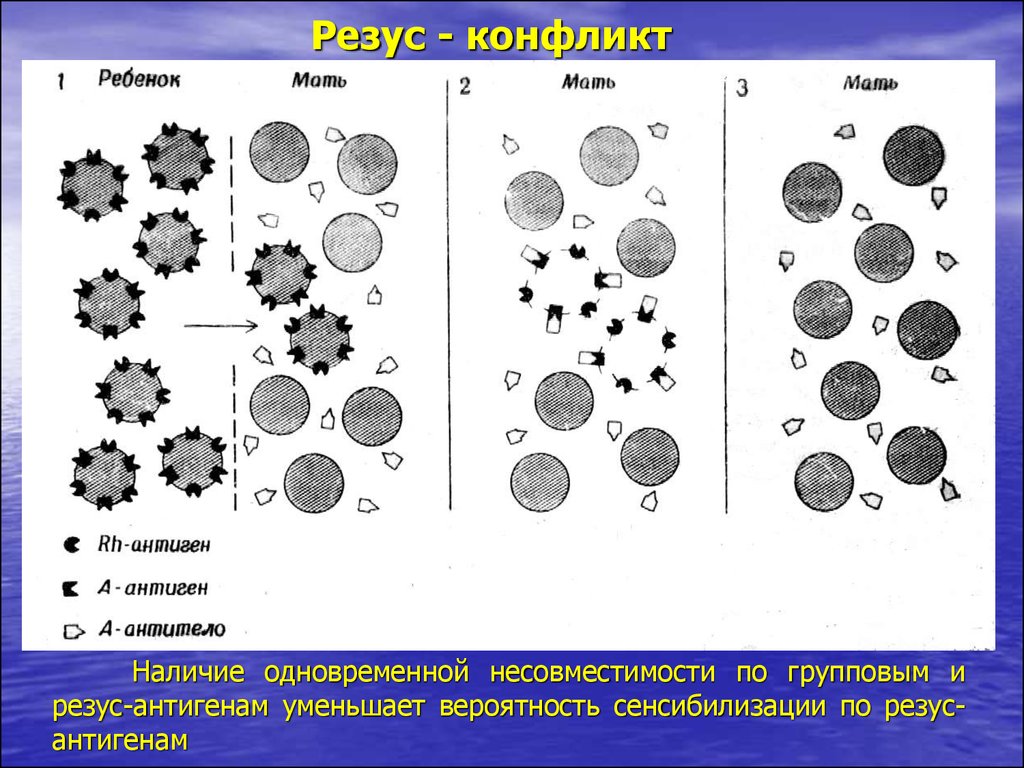
22.
Резус - конфликтВо время первой беременности и после нее происходит
сенсибилизация матери резус-антигенами ребенка
23.
Резус - конфликтПри последующей беременности резус-антитела проникают в
кровоток ребенка и вызывают гемолиз
24.
Резус - конфликтНаличие одновременной несовместимости по групповым и
резус-антигенам уменьшает вероятность сенсибилизации по резусантигенам
25. Гемолитическая болезнь новорожденных
Во время первой беременности из-за малого количестваэритроцитов плода у матери, а так же из-за активных
иммуносупрессорных механизмов, ибо первичный
иммунный ответ у беременной снижен, сенсибилизация
матери - незначительна, но после рождения ребенка и в
связи с большим количеством эритроцитов ребенка в
кровотоке матери, проникших туда в родах, и из-за снятия
иммуносупрессии происходит активный синтез резусантител.
Именно поэтому введение экзогенных резус-антител
(анти-D-иммуноглобулин) в течение 24–72 ч после родов
или аборта (D-антигены появляются у эмбриона в начале
второго месяца гестационного возраста) – эффективный
метод и снижения резус-сенсибилизации, и частоты резусГБН. В странах, где такая профилактика проводится,
частота резус-ГБН резко снизилась, например, в
Великобритании – на 95%.
26. Гемолитическая болезнь новорожденных
Естественные антитела у женщин с группойкрови 0(I) – α и β-агглютинины –
крупномолекулярные, относятся к
иммуноглобулинам класса М и через плаценту
не проникают. Иммунные анти-А и анти-В
антитела, проникающие через плаценту и
обусловливающие положительную прямую
пробу Кумбса, – иммуноглобулины класса G
(точнее G2, но они агглютинины и не вызывают
гемолиза, для этого необходимы антитела IgG1
и IgG3).
27. Тяжесть ГБН в зависимости от титра анти-D антител у матери
• Титр анти-D антител• Менее или 1 : 64
• 1 : 128 – 1 : 256
• 1 : 256 и более
• Форма ГБН
• Легкая форма
• Средней тяжести
• Высокий риск
тяжелой формы
28. Классификация ГБН
• вид конфликта (резус, АВ0, другие антигенныесистемы);
клиническая форма (внутриутробная смерть
плода с мацерацией, отечная, желтушная,
анемическая);
степень тяжести при желтушной и анемической
формах (легкая, средней тяжести и тяжелая);
осложнения (острая билирубиновая
энцефалопатия, ядерная желтуха, другие
неврологические расстройства; геморрагический
или отечный синдром, поражения печени, сердца,
почек, надпочечников, синдром «сгущения
желчи», обменные нарушения – гипогликемия и
др.);
сопутствующие заболевания и фоновые состояния
(недоношенность, внутриутробные инфекции,
асфиксия и др.).
29. Гипербилирубинемии новорождённых
Для неонатологов самым существенным является то, чтоизбыток неконъюгированного билирубина (НБ) может
откладываться в мозге новорождённого, обусловливая либо
транзиторную неврологическую дисфункцию, острую
билирубиновую энцефалопатию, либо перманентное
поражение нейронов мозга (ядерная желтуха).
Мозг новорожденного более чувствителен к токсическому
действию НБ (ядерная желтуха у взрослых развивается
лишь при уровне НБ в крови 684–770 мкмоль/л) вследствие
отсутствия в нем лигандина (специфический белок,
связывающий в цитоплазме НБ) и очень низкой активности
билирубин-оксигеназной системы, окисляющей НБ и
делающей его нетоксичным, большого содержания
ганглиозидов и сфингомиелина, к которым НБ имеет
большое сродство, сниженной способности очищения
цереброспинальной жидкости от билирубина, повышенной
проницаемости капилляров и большего внеклеточного
пространства в мозге.
30. Факторы риска билирубиновой энцефалопатии, реализации нейротоксичности НБ:
• повреждающие гематоэнцефалический барьер,повышающие его проницаемость: гиперосмолярность, в
том числе вследствие гипергликемии, тяжелый
респираторный ацидоз, кровоизлияния в мозг и его
оболочки, судороги, нейроинфекции, эндотоксинемия,
артериальная гипертензия;
• повышающие чувствительность нейронов к токсическому
действию НБ: недоношенность, тяжелая асфиксия
(особенно осложненная выраженной гиперкапнией),
гипотермия, голодание, тяжелые гипогликемия и анемия;
• снижающие способность альбумина прочно связывать
НБ: недоношенность, гипоальбуминемия, ацидоз,
инфекции, гипоксия или конкурирующие с НБ за места
для прочного связывания на альбумине внутрисосудистый гемолиз, повышенный уровень в крови
неэстерифицированных жирных кислот, некоторые
лекарства (сульфаниламиды, алкоголь, фуросемид,
дифенин, диазепам, индометацин и салицилаты,
метициллин, оксациллин, цефалотин, цефоперазон).
31. Гипербилирубинемии новорождённых
Билирубиновая энцефалопатия (БЭ) клиническиредко выявляется в первые 36 ч жизни, и обычно
ее первые проявления диагностируют на 3–6-й
день жизни. Характерны 4 фазы течения:
1) доминирование признаков билирубиновой
интоксикации – вялость, снижение мышечного
тонуса и аппетита вплоть до отказа от пищи,
«бедность» движений и эмоциональной окраски
крика (монотонный, неэмоциональный крик),
неполная выраженность рефлекса Моро (есть
только первая его фаза), ротаторный нистагм,
срыгивания, рвота, патологическое зевание,
«блуждающий взгляд»;
32. Гипербилирубинемии новорождённых
2)появление классических признаков ядерной
желтухи – спастичность, ригидность затылочных
мышц,
вынужденное
положение
тела
с
опистотонусом, негнущимися конечностями и
сжатыми в кулак кистями; периодическое
возбуждение
и
резкий
«мозговой»
высокочастотный крик, выбухание большого
родничка, подергивание мышц лица или полная
амимия,
крупноразмашистый
тремор
рук,
судороги;
симптом
«заходящего
солнца»;
исчезновение рефлекса Моро и видимой реакции
на сильный звук, сосательного рефлекса;
нистагм, симптом Грефе; остановки дыхания,
брадикардия,
летаргия,
иногда
повышение
температуры тела (лихорадка или гипертермия).
Прогрессирующее ухудшение неврологической
симптоматики обычно продолжается в течение
суток.
33. Гипербилирубинемии новорождённых
3)период
ложного
благополучия
и
исчезновения спастичности (начиная с середины
2-й
недели
жизни),
когда
создается
впечатление,
что
обратное
развитие
неврологической симптоматики приведет даже к
почти полной реабилитации ребенка;
34. Гипербилирубинемии новорождённых
4)период формирования клинической картины
неврологических осложнений начинается в конце
периода новорожденности или на 3–5м месяце
жизни: атетоз, хореоатетоз, параличи, парезы;
глухота;
детский
церебральный
паралич;
задержка
нейро-психического
развития;
дизартрия и др.
35. Гипербилирубинемии новорождённых
Важно подчеркнуть, что, по мнениюбольшинства
исследователей,
начальные
стадии
билирубинового
поражения
мозга
в
принципе
обратимы.
К
сожалению,
все
клинические симптомы первой фазы
БЭ
неспецифичны,
а
потому
разрабатываются инструментальные
подходы
к
её
диагностике.
В
частности,
предлагают
изучать
ответ мозгового ствола (ЭЭГ) на звук
разных
высот,
проводить
клиническую оценку ответа ребенка
на
резкий
звук,
оценивать
результаты
магнитно-резонансной
36. План обследования при подозрении на ГБН:
1.Определение группы крови и резус-принадлежности матери и
ребенка.
2.
Анализ периферической крови ребенка с оценкой мазка крови.
3.
Анализ крови с подсчетом количества ретикулоцитов, а при
возможности – определения уровня карбоксигемоглобина.
4.
Динамическое определение концентрации билирубина в сыворотке
крови ребенка.
5.
Иммунологические исследования, включая прямую реакцию Кумбса
(у детей от резус-отрицательных матерей желательно с пуповинной
кровью).
6.
При отягощенном по ГБН анамнезе и выявлении резус-антител в
высоком или нарастающем титре у беременной определение в
пуповинной крови уровня Б и постановка прямой пробы Кумбса
являются обязательными.
7.
Уровень альбуминов в сыворотке
крови
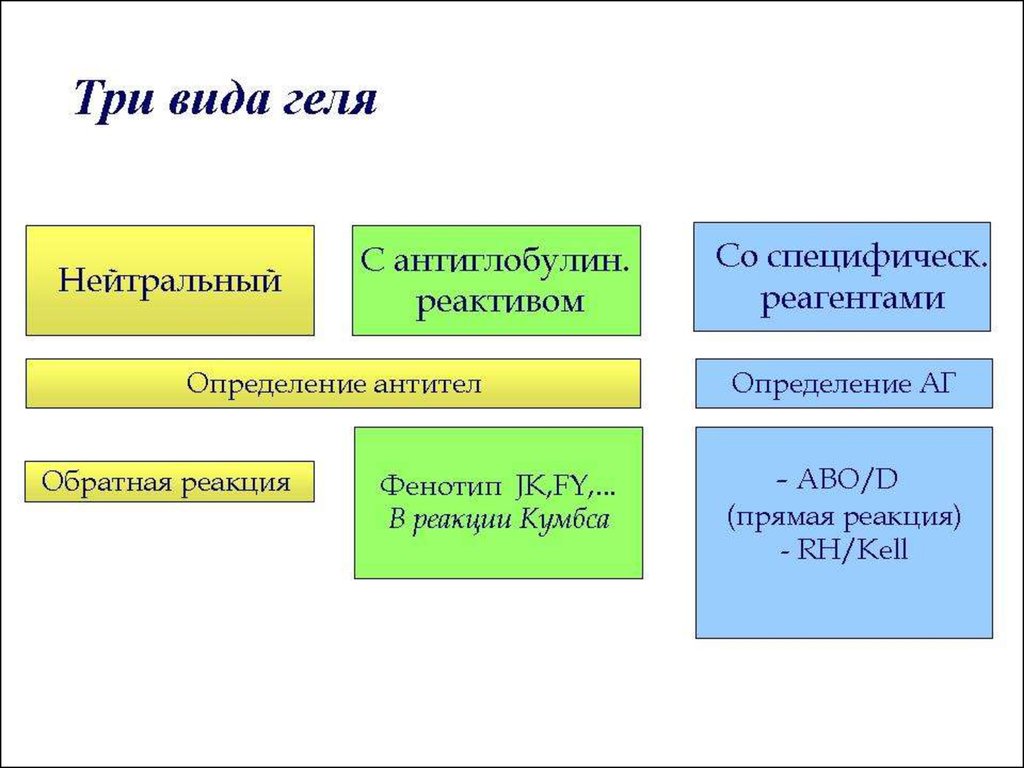
37. Преимущества гелиевых технологий (Т.А. Бушмарина, ГСКП, СПб, 2005)
Высокая чувствительность и специфичностьМинимальное количество крови
Выявление химеризма
Определение слабых вариантов антигенов
Возможность сохранения результатов
Используют ScanGel-систему c Diamed monoclonal или
Diamed polyclonal антителамии др. (Scandel и т.п.)
38.
39.
40. Эффективные методы лечения гипербилирубинемий новорожденных с позиций доказательной медицины
• Заменное переливание крови(плазмаферез)
• Фототерапия
• Вливание иммуноглобулинов
внутривенно при гемолитической
болезни новорожденных
41. Лечение новорождённых с непрямой гипербилирубинемией
Фототерапияв
настоящее время
наиболее широко используемый метод
консервативного
лечения
желтух
новорожденных с НБ в крови.
С момента предложения фототерапии для
терапии непрямых гипербилирубинемий у
новорожденных в 1957 г. Р.Дж. Кремером
(R.J.Cremer) и соавт. установлено, что это
практически совершенно безопасный и
эффективный метод лечения.
42. Эффективность фототерапии определяют четыре факта:
• Длина волны источника света. Наиболее эффективныспециальные лампы голубого флуоресцирующего света, ибо
билирубин абсорбируется максимально в районе голубого света
(около 450 нм).
Освещенность. Обычно источник света располагают на расстоянии
15–20 см над ребенком, и облучение должно быть не меньшим,
чем 5–6 мкВт/см2/нм, но лучший эффект достигается при
освещенности 10–11 мкВт/см2/нм.
Размер облучаемой поверхности. Чем обширнее поверхность
облучения, тем эффективнее фототерапия. Поэтому ребенок
должен быть полностью обнажен (прикрыты лишь глаза);
повреждающего эффекта фототерапии на половые железы не
установлено.
Постоянность или прерывистость. Считается, что фототерапия
должна проводиться непрерывно, но перерыв примерно на 1 ч
после 6–12 часовой экспозиции не снижает ее эффективности
(Halamek L.P., Stevenson D.K., 2002). Короткие перерывы делают
во время кормления и общения ребенка с семьей.
ААП (2004) рекомендует в любом отделении интенсивной терапии
периодически проверять эффективность источника света.
43. Фототерапия
Положительный эффект фототерапии заключается вувеличении экскреции билирубина из организма с
калом и мочой, уменьшении токсичности НБ и риска
ядерной желтухи при высоких непрямых
гипербилирубинемиях. Считается, что это связано с:
1. фотоокислением НБ с образованием
биливердина, дипирролов или монопирролов,
которые водорастворимы и выводятся из
организма с мочой и калом;
2. конфигурационными изменениями молекулы
НБ, 4Z, 15Zизомеров на 4Е, 15Е или 4Zизомеры
НБ, опять таки водорастворимые;
3. структурными изменениями молекулы НБ с
образованием люмибилирубина (фотобилирубин
II, циклобилирубин, люмибилирубин),
длительность полувыведения которого из крови
– 2 ч, тогда как 4Z, 15ZНБ – 12–15 ч. Все
упомянутые конфигурационные и структурные
изомеры НБ обнаруживают в моче у детей,
находящихся на фототерапии.
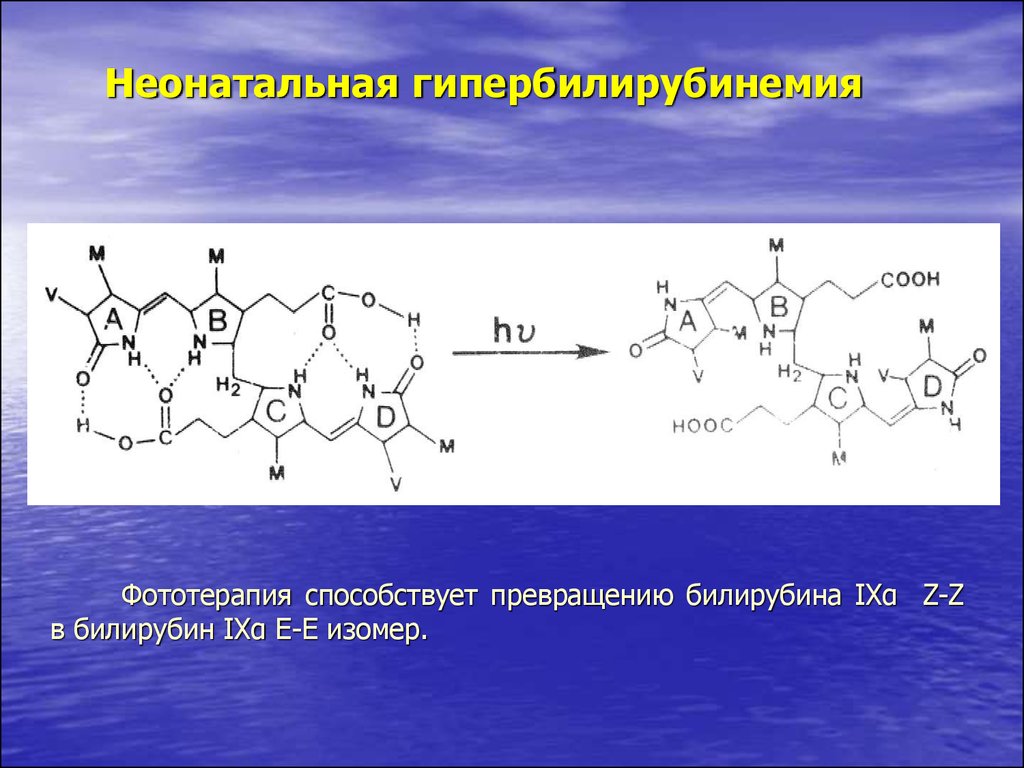
44.
Неонатальная гипербилирубинемияФототерапия способствует превращению билирубина IXα Z-Z
в билирубин IXα Е-Е изомер.
45. Фототерапия
Установлено, что чем больше площадь иинтенсивность
излучения,
тем
больше
образуется этих изомеров и тем эффективнее
фототерапия в плане гипобилирубинемического
эффекта.
Поэтому
есть
предложения
увеличивать мощность излучения до 25–30
мкВт/см2/нм, облучать ребенка и сверху и снизу
(используют специальные матрацы).
46.
47.
48. Фототерапия
Длительность фототерапии определяется ее эффективностью –темпами снижения уровня НБ в крови. Обычная длительность
фототерапии – 72–96 ч, но она может быть и меньшей, если
уровень НБ достиг физиологического для ребенка
соответствующего возраста. Крайне важно энтеральное питание
для улучшения эвакуации Б из кишечника.
Необходимость добавления к фототерапии инфузионной
терапии в настоящее время оспаривается и её рекомендуют
лишь детям с четкими признаками дегидратации.
49. Лечение новорождённых с непрямой гипербилирубинемией
Иммуноглобулины внутривенно. R.Goffstein, R.W.Cooke(2003),
обобщая
результаты
6
рандомизированных
контролируемых исследований использования внутривенного
введения иммуноглобулинов (ИГ) в высоких дозах в лечении
детей с резус или АВ0 ГБН, пришли к заключению, что такая
терапия снижает потребность в заменных трансфузиях,
длительность фототерапии и госпитализации, потребность в
гемотрансфузиях при поздней анемии после перенесенной ГБН.
Обычно достаточно одного введения в дозе 0,5-1 г/кг массы в
течение 2-х часов. Американская академия педиатрии - ААП
(Pediatrics 2004, 114:297-316) рекомендует назначать ИГ при
установленной ГБН и неэффективности фототерапии и уровнях
билирубина на 3 мг% более низких, чем служащих показанием
к ЗПК. Повторное введение можно рассматривать через 12
часов (если это необходимо).
50. Лечение новорождённых с непрямой гипербилирубинемией
Абсолютным показанием для обменного – заменногопереливания крови (ЗПК) в России у доношенных
детей долгие годы являлась гипербилирубинемия
выше 342 мкмоль/л, темп нарастания билирубина
выше 9,0 мкмоль/л/ч и уровень его в пуповинной
крови выше 60,0 мкмоль/л.
Появление
признаков
билирубиновой
энцефалопатии 2 стадии – абсолютное
показание к неотложному
ЗПК на любые
сутки жизни.
51. Показания к фототерапии и заменному переливанию крови у новорожденных детей 24-168 часов жизни в зависимости от массы тела при рождении (Н.Н.
Показания к фототерапии и заменному переливанию кровиу новорожденных детей 24-168 часов жизни в зависимости
от массы тела при рождении (Н.Н. Володин и соавт.,
«Протокол диагностики и лечения гипербилирубинемий у
новорожденных детей», 2006)
Масса тела при
рождении
( в граммах)
Фототерапия
ЗПК
Менее 1500
*85-140 мкмоль/л
*220-275 мкмоль/л
1500 - 1999
*140-200 мкмоль/л
*275-300 мкмоль/л
2000 - 2500
*190-240 мкмоль/л
*300-340 мкмоль/л
Более 2500
*255-295 мкмоль/л
*340-375 мкмоль/л
• *Минимальные значения билирубина являются показанием к началу
соответствующего лечения в случаях, когда на организм ребенка действуют
патологические факторы, повышающие риск билирубиновой энцефалопатии
52. Факторы риска поражения мозга при гипербилирубинемиях:
1) масса тела менее 1500 г;2) асфиксия при рождении или персистирующая гипоксия;
3) гипопротеинемия (общий белок сыворотки крови – менее
50 г/л);
4) гипогликемия (глюкоза крови – менее 2,6 ммоль/л);
5) анемия при рождении с содержанием гемоглобина менее
140 г/л;
6) появление желтухи в первые 5 ч жизни при резусконфликте и в первые 12 ч жизни – при АВ0-конфликте;
7) инфекции.
Кроме того, при резус-конфликте:
1) совпадение групп крови матери и ребенка по системе АВ0;
2) гемотрансфузии в анамнезе у матери и ГБН – у предыдущих
детей в семье;
3) осложненное течение беременности (инфекционные,
соматические заболевания, длительный гестоз).
53. Показания для заменного переливания крови (ЗПК) у детей 35 недель гестации и более (Американская академия педиатрии – ААП; Pediatrics 2004; 114:297-316)
54.
Показания для заменного переливания крови (ЗПК) удетей 35 недель гестации и более
(Американская академия педиатрии – ААП;
Pediatrics 2004; 114:297-316)
-Пунктирная линия для детей первых 24 часов жизни указывает на
неопределеннность вследствие широкого диапазона клинических
обстоятельств и широкого диапазона ответа на фототерапию
- Немедленное ЗПК показано детям с признаками острой билирубиновой
энцефалопатии (мышечная гипотония, гипертонус шейных мышц, опистотонус,
лихорадка, высокочастотный крик) даже если уровень билирубина снижается
- Факторы риска - изоиммунная ГБН, Г-6-ФД - дефицит, выраженная летаргия,
температурная нестабильность, сепсис, ацидоз
- Оценить соотношение уровня альбумина и билирубина
- Оценивать общий уровень билирубина, ибо прямой билирубин - не
эквивалент конъюгированного билирубина
- У детей 35-37 недель гестации (средний риск) надо индивидуализировать
уровень билирубина как показание для ЗПК
55. Катамнез детей с неонатальной гипербилирубинемией выше 25 мг% (428 мкмоль/л) (Thomas Newman et al., 2006// N. Engl. Med. J., 2006; 354: 1889-1990)
Катамнез детей с неонатальной гипербилирубинемиевыше 25 мг% (428 мкмоль/л)
(Thomas Newman et al., 2006// N. Engl. Med. J., 2006; 354: 1889-1990)
• Прослежен катамнез у 140 доношенных новорожденных, имевших уровень
билирубина более 25 мг% (428 мкмоль/л), из них 130 – с уровнем билирубина
428-511 мкмоль/л и 10 с уровнем билирубина более 513 мкмоль/л в возрасте 2х лет 132 (94%) и 5 лет (59%) в сравнении с рандомизированной группой
новорожденных (419), родившихся в те же годы (1995-1998). Длительность
гипербилирубинемии более 428 мкмоль/л у 75% была менее 6 часов и более
340 мколь/л 24 часов у 50% . Всех детей лечели с помощью фототерапии (ЗПК
у 5).
Случаев ядердной желтухи не было.
Достоверной разницы в обнаружении неврологических, поведенческих,
сензорных отклонений между группами не замечено, но 9 детей в группе детей
с гипербилирубинемиями имели более низкой коэффциент IQ сравнению с
группой сравнения.
Согласно J.F. Watchko (2006, там же) из 116 детей с ядерной желтухой,
зарегистрированных в США, у 90 (78%) - уровень билирубина был более 513
мкмоль/л, а у 59% - более 598 мкмоль/л. По приведенным им данным частота
гипербилирубинемий более 428 мкмоль/л – 1:700, а более 513 мкмоль/л – 1:10
000.
56. Заменное переливание крови
При резус-конфликте для ЗПК используют кровь той же группы, что и у ребенка,резус-отрицательную не более 2–3 дней консервации в количестве 160–170 мл/кг.
При АВ0-конфликте переливают кровь 0(I) с низким титром α, β-агглютининов, но
в количестве 250–400 мл, помня, что, как правило, на следующий день надо
сделать повторное ЗПК в том же объеме. Если у ребенка имеется одновременно
несовместимость по резус– и АВ0-антигенам, то обычно ГБН возникает по
групповым антигенам, а значит, ребенку надо переливать кровь 0(I) группы.
При ГБН с конфликтом по редким факторам для ЗПК используют донорскую
кровь, не имеющую «конфликтного» фактора.
Учитывая, что наиболее опасные осложнения ЗПК, связанные с инфекциями и
иммуносупрессией, обусловлены в основном лейкоцитами (в частности, ВИЧ и
герпетические вирусы тропны к лимфоцитам) в настоящее время для ЗПК
используют при Rh-конфликте отмытые и свежезамороженные Rhотрицательные эритроциты в свежезамороженной плазме (соотношение 2:1)
одногруппые ребенку или при групповой несовместимости свежезамороженные
О(I) группы эритроциты и плазму AB(IV) в том же соотношении.
Срок хранения свежезамороженных эритроцитов не более 72 часов
57. Заменное переливание крови
Упомянутый объем крови для ЗПК равен двум объемамциркулирующей крови (у новорожденных с средним ОЦК –
85 мл/кг массы тела), что обеспечивает при правильном
проведении ЗПК замену 85–90% циркулирующей у ребенка
крови. Уровень билирубина сыворотки крови после
правильно проведенного ЗПК обычно снижается на 50%.
Летальность при ЗПК колеблется в разных центрах от 0,1
до 0,5%.
58. Синдром «сгущения желчи»
Можетосложнять
течение
любой
желтухи
с
гиперпродукцией билирубина, а также длительное
парентеральное питание, приводящее к нарушению энтерогепатогенной циркуляции желчных кислот с последующим
уменьшением образования желчи, ее стазу и сладжу с
образованием камней. Характерный признак – появление
обесцвеченного стула у ребенка с неконъюгированной
гипербилирубинемией и повышение уровня БДГ более 25
мкмоль.
Провоцирующими
факторами
могут
быть
обезвоживание, назначение фуросемида, макролидов,
анаболических гормонов. Холестаз редко бывает полным и
длительным. Обычно через 1–4 дня он исчезает либо
спонтанно, либо под влиянием терапии («слепые
зондирования», физиотерапия - электрофорез сернокислой
магнезии на область печени, холекинетики - 5% растворы
сорбита или магния сульфата и др., спазмолитики - Но-шпа
и др.). Диагноз основан на совокупности анамнестических,
клинических и лабораторных обследований.
59. Болезнь Жильбера (GilbertA.N., 1858-1927, франц. терапевт) (БЖ - частота в популяции – 2–5%)
БЖ
наиболее
распространенная
из
наследственных
конъюгационных
желтух
форма и примерно половина больных имела
выраженную
желтуху
в
неонатальном
периоде. Подъем НБ в сыворотке крови у
таких больных не высокий; случаев ядерной
желтухи
не
описано.
Причина
гипербилирубинемии
снижение
проникновения НБ в гепатоцит (до 30% от
нормального) и одновременное некоторое
снижение
активности
глюкуронилтрансферазы
печени,
что
и
определяет положительный эффект терапии
фенобарбиталом – интенсивность желтухи
уменьшается или она исчезает. Болезнь
определяет ген, расположенный на 2-й паре
хромосом, состоящий из 5 экзонов, в первом
из
которых
при
БЖ
появляется
дополнительный динуклеотид (ТА – тимидин,
аденин).
Дефект
наследуется
по
данным
60. Синдром Криглера–Наджара.
Обусловлен отсутствием глюкуронилтрансферазы в печени (I тип) или
очень низкой ее активностью (II тип, активность около 4–5% нормы). При
дефекте I типа, наследующемся по аутосомно-рецессивному типу, желтуха
проявляется в первые дни жизни и неуклонно нарастает по
интенсивности. Ген, определяющий активность уридиндифосфатглюкуронилтрансферазы идентифицирован на 2й хромосоме и состоит из
5 экзонов, мутация в каждом из которых может привести к синдрому
Криглера–Наджара. НБ в сыворотке крови достигает 428 мкмоль/л и более,
в то время как в стуле уровень билирубина менее 10 мг% (при норме 50–
100 мг%). При биопсии печени находят полное отсутствие
глюкуронилтрансферазы. Типично развитие ядерной желтухи, отсутствие
эффекта от назначения фенобарбитала, но улучшение на фоне
фототерапии. По показаниям проводят ЗПК.
При синдроме Криглера–Наджара II типа неонатальная
гипербилирубинемия не столь тяжелая, и НБ обычно не превышает 376
мкмоль/л. Развитие ядерной желтухи возможно лишь в неонатальном
периоде. Дефект конъюгации билирубина обнаруживают обычно и у
одного из родителей (уровень НБ – 34–68 мкмоль/л). В ответ на терапию
фенобарбиталом гипербилирубинемия, желтуха уменьшаются (вплоть до
исчезновения), но после отмены лечения могут рецидивировать.
При обоих вариантах желтухи Криглера–Наджара показано и
назначение препаратов, уменьшающих гепато-энтерогенную циркуляцию
билирубина (агар-агар, холестирамин, энтеросорбенты). Разрабатываются
новые подходы к лечению желтухи Криглера–Наджара I типа – пересадка
61. Желтуха Люцея–Дрискола
• Желтуха Люцея–Дрискола– глубокий, но транзиторный,неонатальный дефект активности глюкуронилтрансферазы;
наследуется по аутосомно-рецессивному типу. Сыворотка
крови матерей таких детей содержит ингибитор активности
глюкуронилтрансферазы (в 4–10 раз более активный, чем в
сыворотке крови беременных женщин). Гипербилирубинемия
с НБ развивается в первые дни жизни, может быть очень
выраженной и привести к ядерной желтухе. Если
фототерапия, заменное переливание крови проведены во
время, то прогноз благоприятный, и желтуха исчезает
бесследно приблизительно к концу 2-й недели жизни, т.е.
ингибирующий конъюгацию билирубина фактор, вероятнее
всего, один из гормонов беременности.
Диагноз ставят на основании исключения других
гипербилирубинемий, анализа семейного анамнеза.
• Практически желтуха Люцея–Дрискола аналогична ЖГВ,
правда с гораздо более высокими уровнями НБ, и при учете
62. Острые гепатиты у детей
Ежегодно в конце прошлого века в РФ регистрировали около около
полумиллиона больных гепатитами В и/или С – носителей вируса. К
началу XXI века описано 8 вирусов гепатита: A, B, D, E, C, F, G, TTV.
Заболеваемость гепатитами А и В в 2006 году составила 15,6 на 100 000, т.е.
снизилась на 48%, а заболеваемость гепатитами В и С с парентеральным
механизмом передачи снизилась на 18,3 и 8,6% соответственно
Исторические аспекты:
Вспышки гепатитов описаны с XVII века
С.П. Боткин описал острый гепатит – гепатит А в настоящее время (по
предложению А.А. Киселя в нашей стране долго называвшейся
болезнью Боткина)
1912 г. – Cockanе доказал эпидемическую природу гепатита А
1964 г. – Blumberg выделил «австралийский» антиген сывороточного
гепатита (гепатит В) – Нобелевская премия (1977)
1973 г. – Feinstone описал морфологию вируса гепатита А
1980 г. – Rizzetto выделил гепатит D
1983 г. – М.С. Балаян и соавт. описали и выдели гепатит Е (ранее гепати
ни А, ни В с энтеральным путем передачи)
1989 г. - Choo C выделил вирус гепатита С (ранее гепатит ни А ни В)
1996 г. – Linnen выделил гепатит G
1998 г. - Okamotо выделил вирус гепатита TTV
63. Острые гепатиты в РФ (Г.Г. Онищенко, февраль 2007 г)
• Заболеваемость гепатитами А и В в 2006 годусоставила 15,6 на 100 000, т.е. снизилась на
48% по сравнению с 2005 годом
• Заболеваемость гепатитами В и С с
парентеральным механизмом передачи в 2006
году по сравнению с 2005 годом снизилась на
18,3 и 8,6% соответственно
64. Гепатит А
• Заболеваемость занимает 3-е место после ОРВИ и кишечныхинфекций и до 80% детей 12-14 лет имеют маркеры перенесенного
гепатита А. Отсюда: гепатит А – типичная «детская инфекция» и часто
больные – нераспознанные (безжелтушные формы).
Зарегистрированная заболеваемость в середине 90-х годов
составляла 235 на 100 000 населения (в 2000 году – 150), из них 60%
-дети (Учайкин В.Ф.).
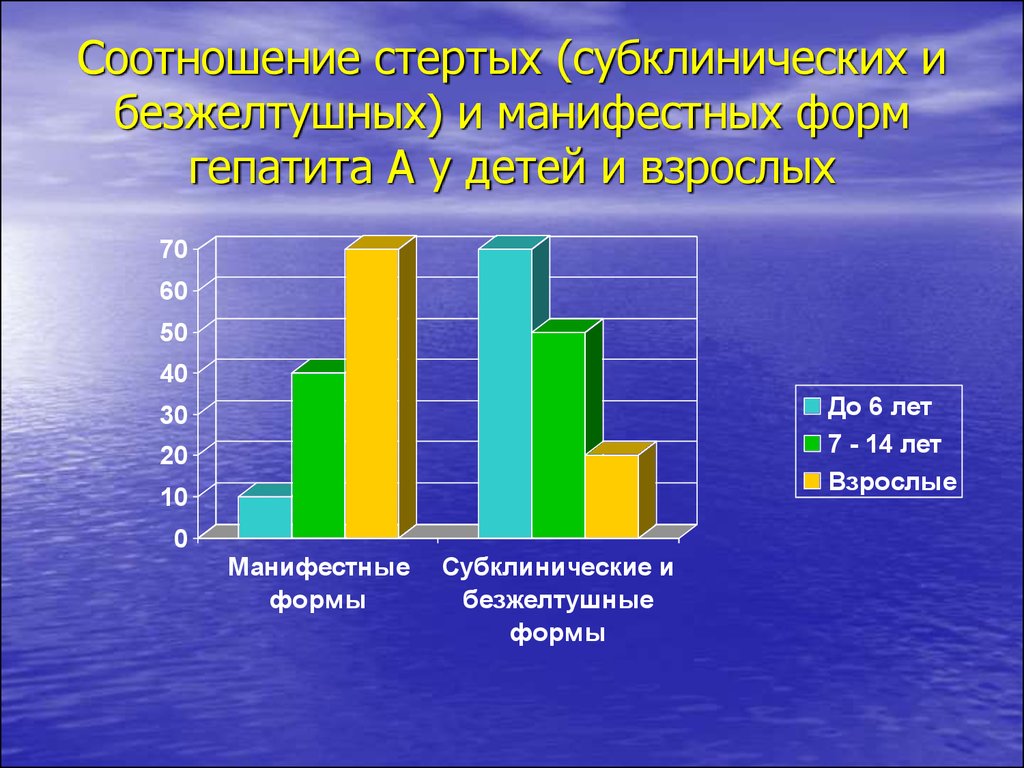
Субклинические и безжелтушные формы встречаются у 70-90% детей
до 6 лет, больных гепатитом А, 50-60% детей 6-14 лет и 20-30% взрослых, фульминантное течение - 0,01% (Учайкин В.Ф.).
В конце прошлого – начале нынешнего века заболеваемость
гепатитом А, как у детей так и у взрослых, существенно снизилась изза введения профилактической вакцинации.
Гепатит А – острая инфекция, имеющая циклическое течение,
оканчивающаяся через 1,5-3 месяца выздоровлением, и хронический
гепатит, вызванный вирусом гепатита А не описан.
Вполне возможно, что аномалии желчного пузыря, отмечающиеся
примерно у 15-20% взрослых, вызваны перенесенным в детстве
гепатитом А.
65. Соотношение стертых (субклинических и безжелтушных) и манифестных форм гепатита А у детей и взрослых
7060
50
40
До 6 лет
7 - 14 лет
Взрослые
30
20
10
0
Манифестные
формы
Субклинические и
безжелтушные
формы
66. Гепатит А у детей
• Вирус гепатита А – антропогенный РНК (капсид состоитиз 60 протомеров) пикорна-энтеровирус, быстро
инактивирующийся раствором формалина, хлороформа,
УФ-облучением и при кипячении в течение 5 минут, но
устойчив к замораживанию.
• Эпидемиология. Путь заражения фекально-оральный
(пища, вода) и тесный контакт. Парентеральный с
препаратами крови и трансплацентарный пути –
чрезвычайно редки. Инкубационный период 15-45 дней
(обычно около 30 дней). Вирус обнаруживают в крови и
испражнениях с середины инкубационного периода,
когда можно выявить и повышение активности в крови
АЛТ, АСТ, Ф-1-ФА. Максимальное выделение вируса во
второй половине инкубационного периода. В первые
дни желтушного периода вирус в крови и испражнениях
имеют 10-15% больных, а после 4-5 дня – лишь в
единичных случаях.
67. Гепатит А у детей
1.
2.
3.
4.
5.
Патогенез. В 1979 году было доказано, что в клеточной
культуре гепатоцитов in vitro вирус гепатита А не
оказывает цитопатогенного действия и, вероятно, этот
эффект in vivo Т-клеточными цитотоксическими
реакциями. С 3-ей недели после заражения можно
выявить специфические IgM - определяются и в
желтушном периоде, далее (~ через 3 месяца поле
заражения) можно обнаружить и специфические IgG.
Периоды болезни:
инкубационный,
начальный или продромальный (преджелтушный),
разгара или желтушный,
постжелтушный,
реконвалесценции.
68.
69. Гепатит А у детей
Клиника. Продромальный период.
Продолжительность – 3-8 дней (редко 9-12 или 1-2
дня). Симптомы (на 415 больных детей, США):
Темная моча ~ 95%
Утомляемость пониженный аппетит ~ 95%
Тошнота ~ 95%; рвота ~ 75%
Слабость ~ 80%; сонливость ~ 60%
Лихорадка ~ 80% (обычно в течение 1-3 дней)
Головная боль ~ 70%; раздражительность ~ 60%
Неприятные ощущения в животе и болезненность
края печени при пальпации– 70%
Побледнение кала ~ 60%; запор ~ 30%; зуд ~ 40%
Боли в мышцах ~ 60%; боли в суставах ~ 20%
Боль в горле, катаральные явления ~ 10-15%
70. Гепатит А у детей
1.
2.
3.
Клиника. Желтушный период
Продолжительность ~ 2-2 1/2 недели
(максимум желтухи ~ 7-10 дни)
Увеличение и болезненность края печени при
пальпации
Обесцвеченный кал
Уменьшение признаков интоксикации
Увеличение селезенки ~ 15%
Интенсивность желтухи (В.Ф. Учайкин):
Легкая (билирубин до 85 мкмоль/л) – 72%
Средней тяжести (85-170 мкмоль/л) – 23%
Тяжелая (более 171 мкмоль/л) – 5%
71. Гепатит А у детей
Клиника. Постжелтушный период
Медленное уменьшение размеров печени и
снижение активности индикаторов
печеночного цитолиза в крови
Период реконвалесценции
Постепенное исчезновение болезненности в
правом подреберье и неприятных ощущений в
животе.
72. Гепатит А у детей
Исходы гепатита А (В.Ф. Учайкин на 1158
больных):
Выздоровление через 1 месяц ~ 50%
Выздоровление через 2 месяца ~ 67%
Выздоровление через 3 месяца ~ 76%
Выздоровление через 6 месяцев ~ 88,4%
Остаточный фиброз печение через год ~ 4,5%
73. Гепатит А у детей
1.
2.
Диагностика
Выявление антигена вируса в крови – с середины
инкубационного и продромальном периоде
Выявление специфических IgM антител - с
середины инкубационного, продромальный и
желтушный периоды, нарастания титра
специфических IgG антител в постжелтушном
периоде
Повышение в крови активности печеночных
энзимов:
АЛТ, АСТ (АЛТ во много раз больше, чем АСТ)
Гепатоспецифических (фосфо-1-фруктоальдолаза,
уроканиназа, гамма-глютамил-трансфераза и др.)
Выявление признаков нарушения
белковосинтетической и других функций печени
74. Гепатит А у детей
Противоэпидемические мероприятия
Изоляция больного – не менее 30 дней от начала
болезни или 3-х недель от появления желтухи
Карантин на контактных (дошкольники и
школьники) – 35 дней с момента разобщения
Мероприятия в очаге: выделения засыпают сухой
хлорной известью на 1 час, горшки замачивают в
3% растворе хлорной извести на 30 минут, игрушки
и предметы ухода замачивают 1% раствором
хлорной извести на 1 час, влажная уборка 1%
раствором хлорамина, а белье, посуду, одежду
обеззараживают 30-минутными кипячением.
Мероприятия с контактными: в США принято
вводить контактным внутримышечно
иммуноглобулин в дозе 0,02 мл/кг массы (Red book,
2003)
75. Гепатит А у детей
Лечение• Легкие формы гепатита А при наличии соответствующих
условий можно лечить дома, ибо в желтушном периоде
больные эпидемиологически не опасны. Режим – постельный,
полупостельный. В диете используют преимущественно
молочно-растительные продукты и исключают тугоплавкие
жиры, бобовые, пряности, продукты промышленного
консервирования. Полезны – мед, соки и отвары фруктов,
овощей. Ограничения в диете ~ 3 месяца. Медикаментозная
терапия не показана. Выписка в школу ~ через 40 дней от
начала болезни, освобождение от занятий физкультурой ~ 6
месяцев.
• При выраженной интоксикации применяют энтеросорбенты
(Энтеродез 0,3 г/кг/сутки в 2-3 приема в промежутке между
приемами пищи; Энтеросгель и др.), при холестатическом
компоненте – урсодезоксихолиевую кислоту
в дозе 10-12
мг/кг/сутки, а при затяжном течении в комбинации с
стимуляторами интерфероногенеза (Циклоферон, Амиксин).
76. Гепатит А у детей
Профилактика• Вакцины Havrix-1440 ( фирма Smith-KlineBeecham), ГЕП-А (Россия) – инактивированный
штамм ослабленного вируса;
• Вакцинируют детей старше года и
иммунитет сохраняется на 1 год, но после
бустерного введения вакцины через 6-12
месяцев иммунитет сохраняется в течение
20 лет.
77. Гепатит В у детей
• Вирус гепатита В – ДНК вирус из группыгепаднавирусов
HBcAg –ядерный
сердцевинный
антиген
HBeAg – трансформированный HBcAg,
антиген
инфекционности
HBsAg - поверхностный
антиген (австралийский антиген)
78. Гепатит В у детей
• Заболеваемость детей ~ 9-10 на 100 000 в год. Вконце прошлого и в нашем веке снижается из-за
введения профилактической вакцинации.
• В мире в настоящее время около 2 млрд.
инфицированных вирусом гепатита В, а у 350 млн.
Выявлена хроническая форма.
• В России в 2002 г. было 7,4 миллионов больных
гепатитом В или носителей HBsAg.
• В Москве и Санкт-Петербурге носителей HBsAg
~ 4%, Западной Сибири – 10-15%.
• Вирус гепатита В очень стоек: при комнатной
температуре и в холодильнике сохраняется 6-12
месяцев, в 1-2% растворе хлорамина – 2 часа, 1,5%
растворе формалина - 7 суток, кипячении – более
10 минут, автоклавировании при 120 С – более 5
минут.
79. Гепатит В у детей
ЭпидемиологияПуть заражения:
• Парентеральный – трансфузии крови и её
препаратов, инъекции. Любые процедуры с
нарушением целостности кожных покровов и
слизистых оболочек (в том числе чистке зубов)
• Половой
• Трансплацентарный или контактный при
прохождении по инфицированным родовым
путям
Путь заражения среди детей с гепатитом В,
находившихся в конце 20-го века в клинике В.Ф.
Учайкина: 29,8% - при переливании крови или
плазмы, 45,25% - парентеральный, 25% - при
бытовых контактах.
80. Гепатит В у детей
Патогенез• Внедрение
• Проникновение в гепатоцит
• Размножение и выделение на
поверхность клетки и в кровь
Включение иммунных
реакций
Поражение внепеченочных
органов
Формирование иммунитета
2 пути вируса в гепатоците, предопределяемые
генетически: репликативный - инфекция,
интегрированный - вирусоносительство и
иммунопатологический процесс
81. Гепатит В у детей
Клиника (периоды болезни)
Инкубационный период – 60-180 дней и
длительность его зависит от дозы вируса,
полученной при инфицировании
Начальный период (преджелтушный) – от
нескольких часов до 2 недель (по В.Ф.
Учайкину – в среднем – 5 дней)
Желтушный ~ 3-5 недель (от7-10 дней – до
1,5-2 месяцев)
Реконвалесценции
82. Гепатит В у детей
Клиника (начальный период)Типично постепенное начало: нарастающие
вялость, слабость, повышенная утомляемость,
снижение аппетита, лихорадка ~ у трети
больных, неприятные ощущения и боли в
животе, тошнота, реже - мышечно-суставные
боли, катаральные явления со стороны
органов дыхания За 1-2 дня до появления
желтухи отмечают обесцвечивание кала и
потемнение мочи, которые иногда и бывают
первыми признаками болезни.
83. Гепатит В у детей
Клиника (желтушный период)Характеризуется постепенным (в течение недели)
нарастанием признаков интоксикации, желтухи,
плотности и размеров печени (в течение 2-х недель).
Интенсивность желтухи – стабильна в течение 5-10
дней и далее снижается. Увеличение селезенки
отмечают у 96% детей до года и ~ половины в более
старшем возрасте.
Интоксикация характеризуется признаками
ваготонии: брадикардией, снижением АКД,
угнетением ЦНС.
У 7-8% детей отмечают симметричные пятнистопапулезные высыпания на конечностях, ягодицах,
туловище (синдром Джонатти-Крости), иногда –
артралгии, геморрагии, гематурию, развитие
гломерулонефрита (иммунокомплексные поражения).
84. Гепатит В у детей
Клиника (течение по В.Ф.Учайкину)
Острое течение – 90%
Хронический гепатит В – 8%
Злокачественное (фульминатное) течение раньше исключительно у детей первого года жизни (~ у
14%), а теперь и у подростков-наркоманов
Носительство HBsAg встречается у 90% детей при
перинатальном инфицировании, у 30% - при
инфицировании в раннем детстве, в 2-8% - при
инфицировании школьников и взрослых. Риск
перехода носительства HBsAg в хронический гепатит
по данным разных авторов колеблется от 10 до 25%
Риск рака печени – среди хронических носителей
HBsAg, полученного в раннем детстве – 25%
85. Злокачественная форма гепатита В у детей
Преджелтушный период - 3-5 днейХарактеризуется острым началом с лихорадкой,
выраженными симптомами интоксикации
(вялость, адинамия, сменяющаяся периодами
беспокойства, возбуждения), диспепсическими
явлениями (срыгивания, рвоты, частый стул).
При появлении желтухи – возбуждение, рвота с
кровью, вздутие живота, тахикардия,
геморрагический синдром, олигурия, уменьшение
размеров печени (важный симптом
злокачественного течения). Возможно развитие
печеночных ком.
86. Злокачественная форма гепатита В у детей
Варианты печеночных ком:• Гипериммунная – развивается в первые 3-5
дней болезни и определяется
иммунокомплексным поражением (с IgM) и
гиперцитокинемией и резким повышением в
крови БАВ, ДВС-синдромом, отеком мозга.
• Распадная или эндогенная кома развивается к
конце первой - начале второй недели болезни
и определяется резко выраженной печеночной
недостаточностью и некрозом гепатоцитов
• Метаболическая, экзогенная кома – при
активации хронического гепатита и дельтаинфекции
87. Злокачественная форма гепатита В у детей
• Прекома – периоды возбуждения сменяютсяпериодами адинамии-сонливости, сутанности
сознания,«печеночный запах», тремор, судорожные
подергивания.
Кома I – стойкое отсутствие сознания и реакции на
осмотр, суженные зрачки, но сохраненная на
болевое раздражение, слабо реагирующие на свет,
нарушения глотания, нарастание «печеночного
запаха», геморрагического синдрома, олигурии,
печень у края реберной дуги.
Кома II- возникает через 1-2 суток, характеризуется
отсутствием реакции на болевые раздражения,
расширенными зрачками, не реагирующими на свет,
гипотонией, появлением периодического дыхания
типа Куссмауля или Чейн-Стокса.
88. Перинатальный гепатит В у детей
При перенесении матерью во время
беременности гепатита В вероятность
передачи вируса ребенку следующая:
Первый триместр – 0–6%
Второй триместр – 6-25%
Третий триместр – 67%
Клинические проявления врожденного
гепатита В обычно развиваются по окончанию
периода новорождённости.
89. Наблюдение за детьми от матерей носителей антител к HBsAg
Материнские антитела к HBsAg и HCV у ребенкаисчезают обычно к 3 месяцам (в 90% случаев), но
могут сохраняться до 6 месяцев и даже до 1-1,5
лет, что является ещё одним аргументом в пользу
передачи матерью ребенку своих лимфоцитов.
Согласно требованиям санитарноэпидемиологических правил детей, рожденных от
матерей инфицированных вирусами гепатита В и С
(в том числе и носителей антител) надо
обследовать повторно в 1, 3, 6 и 12 месяцев жизни
на наличие в крови антител и активность АлТ.
Однако, конечно же желательно в первые недели
жизни, в 1 и 3 месяца обследовать с помощью ПЦР
на наличие ДНК HBV и РНК HCV, ибо лишь
90. Наблюдение за детьми от матерей носителей антител к HBsAg
Многочисленные наблюденияпоказали, что кормление грудью детей,
родившихся от матерей
инфицированных вирусами гепатита В
и С не увеличивает вероятности
инфицирования ребенка и грудное
вскармливание нецелесообразно лишь
в случае HIV инфицирования матери
или большой вирусной нагрузки по
результата ПЦР диагностики у матери.
91. Гепатит В у детей (лечение)
• Интерферон альфа 1млн ЕД 1-2 раза в день – 15 дней идалее до 6 месяцев 2 раза в неделю в/м
• Отечественный интерферон Интераль 3 млн ЕД на кв. м
з раза в неделю 6 месяцев
• Применение парентеральных интерферонов в Англии
разрешено с 2х лет (Sherlock Sh., Dooley J., 2002). В
России разработан оригинальный препарат Виферон рекомбинантный интерферон α2β в сочетании с
витаминами Е и С, вводимый ректально. У детей первого
года жизни, инфицированных от больных матерей,
целесообразно использовать Виферон в свечах
(суточная доза 3 млн. МЕ/м2, 2 раза в день, 3 раза в
неделю). Показано, что эффективность и длительность
лечения зависит от сроков его назначения. Чем раньше
поставлен диагноз и начата терапия, тем больше
эффект и короче срок лечения. При начале лечения в
первые 2-4 месяца жизни эффективность терапии
составляет 67-80%, что в два раза выше тех, кому
92. Профилактика гепатита В
Введение вакцинации позволило в США снизить заболеваемостьгепатитом В в 2004 году по сравнению с 1990 на 94%
(Американская академия педиатрии, Red Book, 27 издание, 2006)
93. Профилактика гепатита В
• В 24 субъектах РФ получили 2 прививки противгепатита В от 80 до 100% жителей, подлежащих
вакцинации. Целью профилактики гепатита В в
России является снижение заболеваемости до 3
случаев на 100 000 населения в год, для чего
планируется привить в 2007 г. 15 млн. человек –
лиц молодого возраста от 18 до 35 лет, не
привитых ранее (Г.Г. Онищенко, МГ. 2006 20. 07)
94. Гепатит D
• Вирус является дельтачастицей диаметром35-37 нм, содержащий РНК,
паразитирует на HBsAg
• 2 варианта течения:
коинфекция, суперинфекция
• Частота при легком течении
гепатита В – 2,3%, средней
тяжести и тяжелом – 18%,
злокачественном – 54%
(В.Ф. Учайкин)
• Клиника – острый гепатит
после инкубационного
периода – 2-3 недели
95. Гепатит С (HCV)
Заболеваемость детей в 2000 году 2,5 на 100 000 (Т.В.Чередниченко). В Западной Европе и США – причина 95%
случаев хронического гепатита.
Распространенность носителей антител к HCV Москве и СПб –
0,5-3,5%, некоторых регионах 6-16%. В мире около 400 млн.
носителей HCV.
Вирус – РНК-содержащий из группы флавивирусов,
чувствительный к хлороформу и формалину, погибающий при
кипячении через 2 минуты. В СПб у детей доминируют 3а и 1а
вирусы (33 и 31%), в России у взрослых– 1b, чаще
вызывающий более тяжелое течение и исход в цирроз.
Эпидемиология: путь передачи - парентеральный (препараты
крови, инфицированные иглы и др.), вертикальный
(трансплацентарный), вероятен и половой. Уже через год 5080% наркоманов инфицированы HCV.
96. Риск инфицирования при переливании компонентов крови в России (В. Покровский, Е. Селиванов, Ю.Суханов, В. Максимов, 2006)
• 1 случай гепатита В на 5 000 трансфузий• 1 случай гепатита С на 2 000 трансфузий
• 1 случай ВИЧ-инфицирования на 600 000
Ориентировочно ежегодно в России переливают 7 млн. доз
компонентов крови, следовательно, число заболевших
ежегодно составляет:
Гепатит В – 1400
Гепатит С – 3500
ВИЧ-инфекция – 12 человек
Суммарные затраты на лечение посттрансфузионных
инфекций составляют 133,4 млн. $
97. «Особенности клинических проявлений и оптимизации терапии у больных с врожденными коагулопатиями, инфицированных вирусами гепатита В и С
«Особенности клинических проявлений и оптимизациитерапии у больных с врожденными коагулопатиями,
инфицированных вирусами гепатита В и С»
(канд дисс. О. Гарезина, СПб., РНИИ гематологии и
трансфузиологии, 2005)
Обследованы все 349 проживающих в Санкт-Петербурге
больных с врожденными коагулопатиями, получивших
трансфузионную терапию
• HBsAg обнаружен у троих пациентов с гемофилией А (0,86%)
• HCV-антитела выявлены у 211 пациентов (60,5%), но у 80,4%
взрослых больных гемофилией (у 160 з 190) и 30 и 42%
соответственно пациентов с болезнью Виллебранда.
Скрининг доноров на HBsAg начат в 1965 году, а на HCVантитела в 1993 году
О. Гарезина обследовала также 54 родственника (матери,
отцы, жены, дети, братья, сестры) инфицированных больных и
обнаружила HBs-антитела 41,4% и HCV-антитела у 11%, хотя
никому из них трансфузий не проводили. Вывод – заражение
родственников произошло бытовым путём.
98. Гепатит С
• Инкубационный период – 28 – 56 дней• Клиника – доминирует (у 80%) бессимптомное
течение. Антитела к HCV появляются через 832 недели от момента инфицирования.
Клиническое течение желтушного периода
напоминает течение гепатита А. У 20% –
острое течение и выздоровление, а ~ у 80% хронический гепатит, у 8-24% через 8-14 лет –
цирроз печени и еще через 10-15 лет у 1,510% - гепатоцеллюлярная карцинома.
Риск передачи HCV от матери к плоду – 5-7,5%
99. Идиопатический неонатальный гепатит (ИНГ)
Частота ИНГ составляет, по данным зарубежных авторов, 1:5000–10 000, авнутрипеченочная гипоплазия желчных путей без доказанного гепатита – 1
:
50 000–70 000 новорожденных. Семейный характер ИНГ встречается у 10–
15% больных.
Клиническая картина. Обычно дети с ИНГ (без или с внутри или
внепеченочными атрезиями и гипоплазиями желчных путей) рождаются
без желтухи, она появляется между 2-й и 4-й неделями жизни. Пеленки
после мочеиспускания темно-желтые. При типичном течении на 1–2-й
неделе появляется обесцвеченный стул. Интенсивность желтухи и
выраженность обесцвеченности стула могут колебаться день ото дня
(«флюктуирующая» желтуха); постепенно кожа приобретает сероватозеленоватый оттенок, а стул – глинистый цвет.
Гипербилирубинемия носит обычно смешанный генез, т.е. в крови высоки
уровни и билирубиндиглюкуронида, и НБ. Другими характерными
признаками являются увеличение печени с плотным ее краем (при
пальпации), увеличение живота (нередко с асцитом), нарушение общего
состояния (плохой аппетит, срыгивания, нарушения сосания и глотания,
низкая прибавка массы тела, мышечная гипотония, гипорефлексия,
вздутие живота, вялость и др.), увеличение селезенки, нередко
геморрагический синдром (следствие низкого синтеза печенью факторов
свертывания крови, тромбоцитопении). У отдельных больных в
клинической картине могут доминировать признаки холестаза, цитолиза
100. Идиопатический неонатальный гепатит (ИНГ)
ИНГ–
пролонгированная
конъюгированная
гипербилирубинемия без признаков генерализованного
вирусного заболевания и когда исключены верифицируемые
инфекционные агенты и специфические аномалии обмена
веществ. При биопсии печени у детей с ИНГ находят
интенсивную трансформацию гепатоцитов в многоядерные
гигантские клетки и потому заболевание иногда называют
неонатальным гигантоклеточным гепатитом. Гигантоклеточная
трансформация гепатоцитов не является специфической для
какого-то этиологического фактора и возникает при разрыве
латеральных
мембран
прилегающих
гепатоцитов
с
последующим снижением количества желчных канальцев и
прямой гипербилирубинемией (синдром «исчезновения
желчных протоков»). Присутствуют и некрозы гепатоцитов,
воспалительная реакция, но они могут быть транзиторными, а
гигантоклеточная трансформация гепатоцитов присутствует
много месяцев и даже лет.
101.
Неонатальный гигантоклеточный гепатит102.
Герпетическийгепатит
Г
103. Цитомегаловирусный гепатит
104.
Гепатит при врожденном сифилисе105.
Листериозный абсцесс печени106.
Последствия неонатальногогепатита
107.
Последствия неонатального гепатита108. Лечение при врожденном гепатите
Специфической терапии при ИНГ и других врожденныхгепатитах
не
разработано.
Оптимально
естественное
вскармливание.Исключение
составляют
матери
ВИЧинфицированные или с активным гепатитами В и С, а также
выделяющие с молоком вирус цитомегалии при у детей с ОНМТ
или при цитомегалии у ребенка. Стеаторея – типичное
проявление
холестаза.
При
этом
длинноцепочечные
триглицериды
усваиваются
очень
плохо,
тогда
как
среднецепочечные – неплохо. Поэтому выпускают смеси,
обогащенные среднецепочечными и ненасыщенными жирными
кислотами (НАН, Прегестимил, Алиментом, Портаген и др.).
Жиры этих смесей усваиваются лучше. При транзиторных
холестазах показаны препараты ферментов поджелудочной
железы (панкреатин, панзинорм и др.), улучшающие
утилизацию
жиров.
При
галактоземии,
фруктоземии,
тирозинемии используют элиминационные диеты.
109. Лечение при врожденном гепатите
• Глюкокортикоиды используют лишь при гепатите с УЗИпризнаками начинающегося фиброза, однако на холестаз у
детей с атрезиями желчных путей они положительного
эффекта не оказывают. Обычно назначают короткий курс
(7–10 дней при стартовой дозе 2 мг/кг/сут. на 3 дня с
быстрым ее снижением и отменой препарата). Длительные
курсы
глюкокортикоидов
снижают
регенеративные
процессы
в
печени
(уменьшается
количество
полиплоидных клеток, синтез белка и др.), усиливают
иммунодефицит, а значит, и репликацию вирусов. При
выраженном холестатическом синдроме в связи с
тенденцией к уменьшению костной массы кортикостероиды
абсолютно противопоказаны. Противопоказаны также и
анаболические стероиды
110. Лечение при врожденном гепатите
• Гепатотропныепрепараты
(Эссенциале,
Гептрал, Гепатофальк, Гепатек, Сирепар, Силибон
и
др.)
нередко
назначают
курсами
как
вспомогательную
терапию
при
ВГ.
Эффективность такого лечения не велика, ибо
оно не влияет на основные звенья патогенеза
ИНГ и ВГ – персистирование вируса и
иммунопатологию. Однако такие курсы вполне
показаны при токсических гепатитах (после
устранения или уменьшения до минимума
воздействия основной причины, вызвавшей
токсический гепатит).
При холестатических гепатитах показано назначение
препаратов урсодезоксихолиевой кислоты
в дозе 1012 мг/кг/сутки
111. Интерферонотерапия.
Используютотечественный
препарат
Виферон 1 (150 000 ЕД), ректально по две
свечи в сутки – 5 дней, затем 5 дней –
перерыв и далее повторный курс. Виферон –
рекомбинантный
интерферон
α2β
в
сочетании с витаминами Е и С. При ИНГ
доказанной
инфекционной
этиологии
Виферон назначают далее 3 раза в неделю
(по 2 свечи в сутки) в течение первого
полугодия жизни. Бесспорная полезность
такой терапии не доказана.
112. Хронические заболевания печени
Первичные заболевания печени
Врожденные
Наследственные пигментные гепатозы
Инфекционные (хронические гепатиты, циррозы,
паразитозы)
Токсические и лекарственные
Синдром Рея
Опухоли печени
Вторичные (симптоматические) болезни печени
Портальная гипертензия
Наследственные обменные заболевания печени
Застойная печень при болезнях ССС
Имммунопатологические болезни печени
113. Узловые звенья патогенеза ХГ (В.Ф. Учайкин и Б.А. Святский ,1998):
• •инфекция вирусами гепатитов С В и дельта;
длительная репликация вирусов на фоне повышенного
специфического антителогенеза по отношению к вирусным
антигенам (при сниженном синтезе интерферонов);
генетически детерминированная слабость Т-клеточного
иммунитета с дисбалансом иммунорегуляторных субпопуляций за
счет более значительного снижения функции Т-супрессоров;
дефицит макрофагальной активности;
действие эффекторных клеток на мембраны гепатоцитов с
экспрессированными вирусными антигенами, а также печеночноспецифический липопротеин;
активация в печени перекисного окисления липидов и
лизосомальных протеиназ;
включение печени в аутоиммунный процесс;
дополнительное значение могут иметь нарушения
внутрипеченочной гемодинамики, а также нарушение
микроциркуляции вследствие чего развивается состояние
внутрипеченочной гипоксии
114. Хронический гепатит (ХГ)
ХГ – воспалительное заболевание печени,
длящееся более 6 месяцев
Этиология. Вызывают вирусы гепатита В, С, В+D,
аутоиммунный гепатит, токсический или
лекарственно-индуцированный гепатит.
Классификация:
По этиологии
По активности (минимальная, умеренная,
выраженная, неактивный)
По выраженности морфологических изменений
(перипортальный фиброз, внутридольковая
дегенерация, воспаление в перипортальных
трактах)
По стадиям фиброза
По фазам развития вируса (репликации, интеграции)
115. Хронический гепатит (лечение)
• Показания для использования парентерального -интерферона, активирующего естественные киллеры
(Реаферон, Интрон А. Вэллферон, Пегинтрон и др.)
Острые гепатиты В и С
Хронические гепатиты В и С
Обнаружение РНК HCV в ПЦР
Противопоказания для использования -интерферона:
Абсолютные:
Психозы, эписиндромы в настоящее время или а анамнезе
Выраженные нейтро- и тромбоцитопении
Декомпенсированный цирроз печени
Возраст до 2-х лет
Относительные:
Декомпенсированный сахарный диабет
Аутоиммунные заболевания
116. Хронический гепатит (лечение)
• Стандартное лечение, рекомендуемое Международнымконсенсусом гепатологов (Париж,1999): 3 млн МЕ на метр
поверхности тела 3 раза в неделю в течение 12 месяцев у
детей любого возраста старше 2-х лет подкожно,
внутримышечно или внутривенно (см. инструкцию к
препарату).
• Предикторы эффективности ИФН-терапии при ХГ
Не 1-ый генотип вируса
Сравнительно малая (до 3-х лет) длительность
инфекции
Высокая активность аминотрансфераз (АлАТ) перед
началом
терапии
Низкая вирусная нагрузка (число колоний РНК HCV в
ПЦР
менее 2 млн)
Горизонтальный (в отличие от вертикального - от
117. Хронический гепатит (лечение)
• Почти у всех больных после первых 3-5инъекций ИНФ возникает гриппоподобная
реакция: повышается температура до
лихорадочных цифр, появляется головная
боль и ломота в суставах и мышцах.
Эффективность монотерапии препаратами
ИНФ составляет: у детей с ХГ В - 40-60%, ХГ С
1b при генотипе HCV - 20-35%, 2а и 3а
генотипе - 70-80%
118. Хронический гепатит (лечение)
• Комбинированная терапия показана при:Предположении о низкой активности
терапии ИНФ
Неэффективности ранее проводимой
терапии ИНФ
При отсутствии ответа на терапию ИНФ в
течение 3-6 месяцев или развитии рецидива.
Варианты комбинированной терапии
Препараты ИНФ + Ремантадин + препараты
урсодеоксихолиевой кислоты (Урсофальк,
Урсосан и др.)
Препараты ИНФ + препараты рибавирина
(Ребетол) + препараты урсодеоксихолиевой
кислоты
119. Хронический гепатит (лечение)
• Дозы:• Ремантадин – 5,0 мг/кг/сутки внутрь на два приема
в течение 6 месяцев
Ламивудин – 3-4 мг/кг/сутки внутрь на два приема в
течение 3-6 месяцев
Рибавирин – 10,6 мг/кг/сутки на два приема внутрь
утром и вечером в течение 3-6 месяцев
Урсодеоксихолиевая кислота – 10-15 мг/кг/сутки на
2-3 приема в течение 12 месяцев
Комбинированная терапия увеличивает
эффективность лечения больных с ХГ по данным
разных авторов до 85-95%.
120. Аутоиммунный ХГ (ХАГ)
ХАГ– прогрессирующее воспалительное заболеваниепеченочной ткани неизвестной этиологии характеризующееся
наличием различных аутоантител разной специфичности в
сыворотке крови и гипергаммаглобулинемией. Аутоиммунный
гепатит I типа асоциирован с наличием у больного HLA-AI-B8-DR3
или 4 а II типа – B14 DR3 C4A-DQ.
ХАГ протекает как активный хронический гепатит с выраженной
гипергаммаглобулинемией очень высоким уровнем IgG и какими
либо внепеченочными иммунопатологическими (аутоиммунными)
расстройствами: аутоиммунным тиреоидитом неспецифическим
язвенным колитом синовитами диффузным токсическим зобом
артралгиями или артритами легочными инфильтратами
эритемами гемолитической анемией тромбоцитопенической
пурпурой поражениями сердца и др.
Лечение сводится к назначению глюкокортикоидов и
иммуносупрессоров.
121. Галактоземия
Галактоземия – наследственная аномалия обмена веществ Заболевание может
быть связано с аномальным синтезом двух ферментов. Наследуется по аутосомнорецессивному типу.
Частота составляет около 1:40 000–50 000 новорожденных.
Патогенез. Накопление в крови галактозы или галактозо-1-фосфата определяет
развитие гепатотоксичности, умственной отсталости и катаракты (накопление
галактиола).
Клиника. Желтуха обычно появляется на 2–3-й день жизни, гипербилирубинемия
непрямая; чуть позднее (на 5–6-й день жизни) выявляются гепатомегалия, рвота,
большие потери массы тела, летаргия или приступы гипогликемий, судорог и
изредка спленомегалия, диарея. В этот момент катаракта еще отсутствует, но в
хрусталике можно видеть как бы «тучки», «капли воды». Очень часто у таких детей
развивается сепсис, вызванный обычно кишечной палочкой. Этот вариант течения
типичен для детей с нулевой активностью галактозо-1-фосфатуридилтрансферазы.
При других вариантах, когда активность фермента определяется (до 10% от нормы)
или при дефиците галактокиназы в периоде новорождённости дети могут
выглядеть здоровыми, и лишь на первом году жизни развиваются катаракта,
увеличение печени с постепенным развитием цирроза, но без умственной
отсталости.
Диагноз ставят на основании обнаружения сахара в моче (галактозурия),
аминоацидурии, повышения уровня в крови галактозо-1-фосфата или галактозы,
резкого
снижения
в
эритроцитах
активности
галактозо-1фосфатуридилтрансферазы
или
галактокиназы.
Лечение
–
кормление
безмолочными смесями, т.е. не содержащими лактозу (дисахарид, состоящий из













































































































 medicine
medicine








