Similar presentations:
Взаимодействие электромагнитного излучения
1.
2. Взаимодействие электромагнитного излучения
Свет слеванет света
свет падает нормально
3.
• Взаимодействие электромагнитного излучения– Типы взаимодействия
Поглощение
Отражение
Пропускание
Рассеяние
Преломление
поглощение
пропускание
отражение
рассеяние
преломление
– Каждое взаимодействие может раскрыть определенные
свойства материи
– При применении электромагнитного излучения различной
частоты можно получать различную информацию
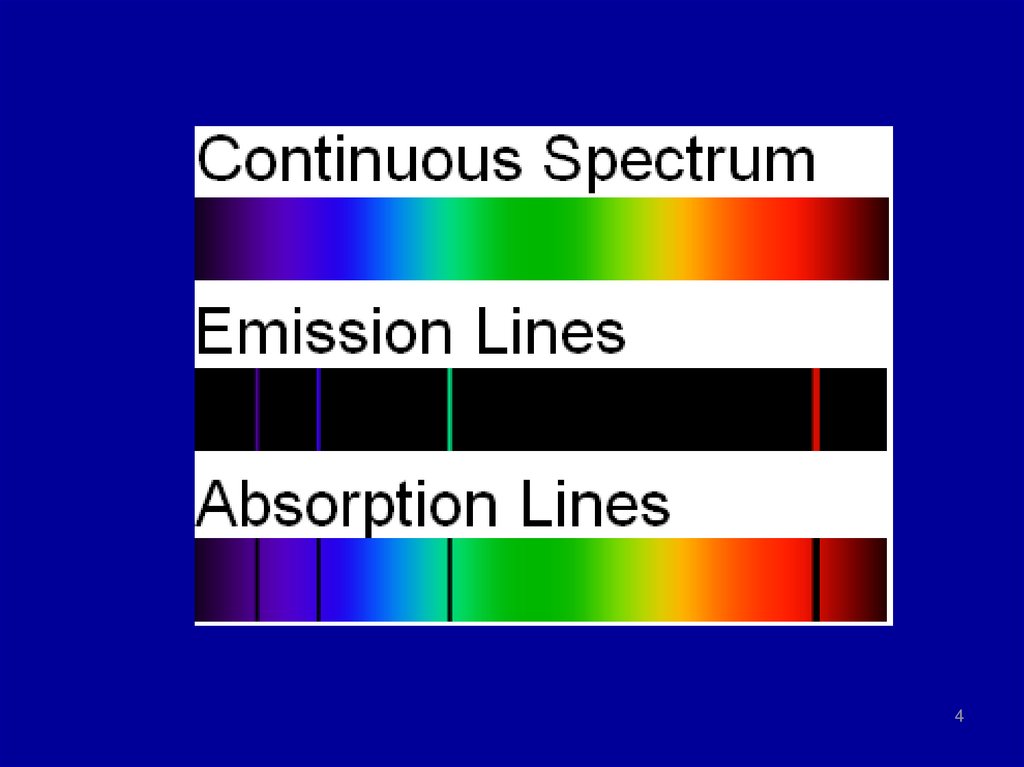
4.
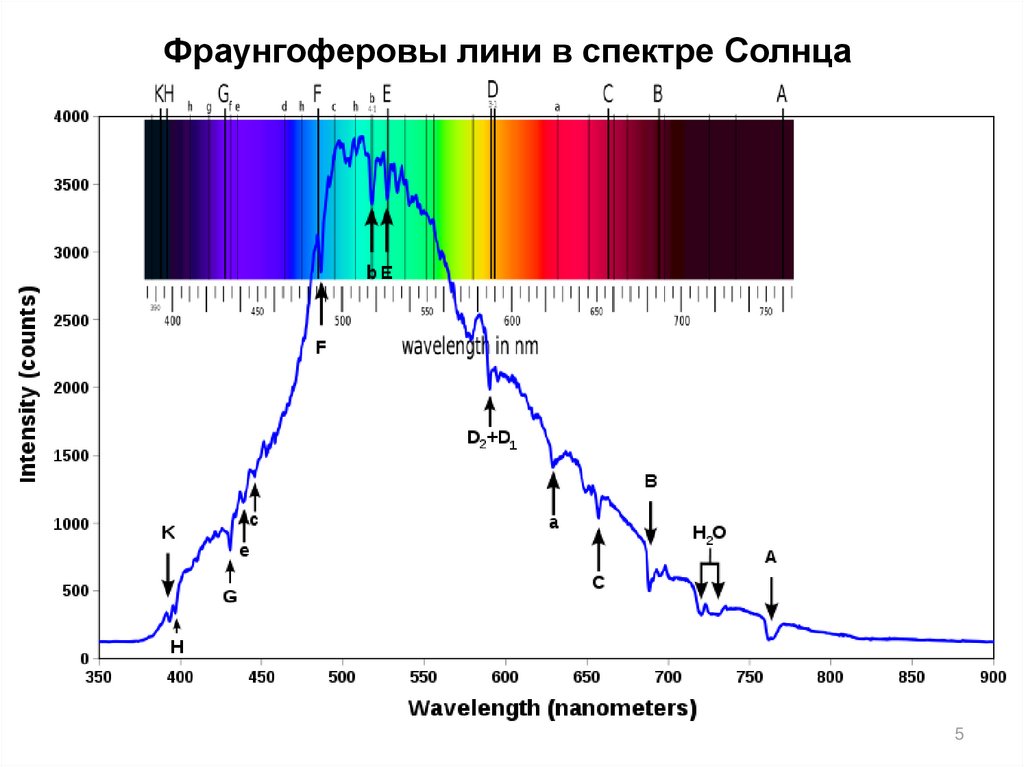
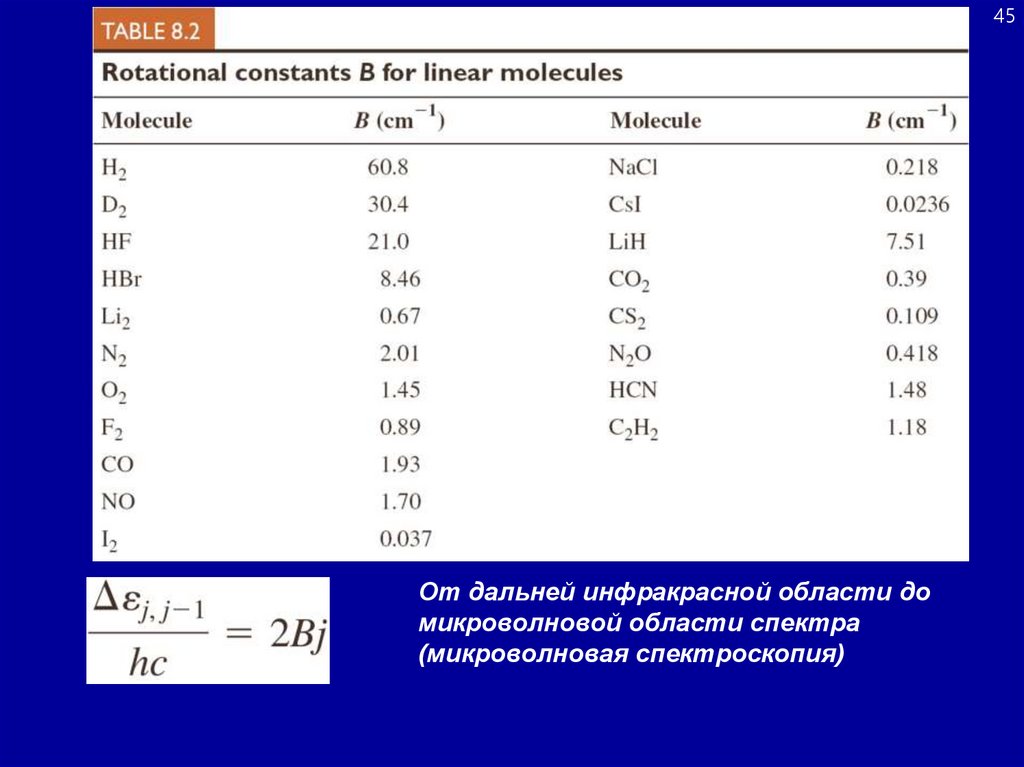
45.
Фраунгоферовы лини в спектре Солнца5
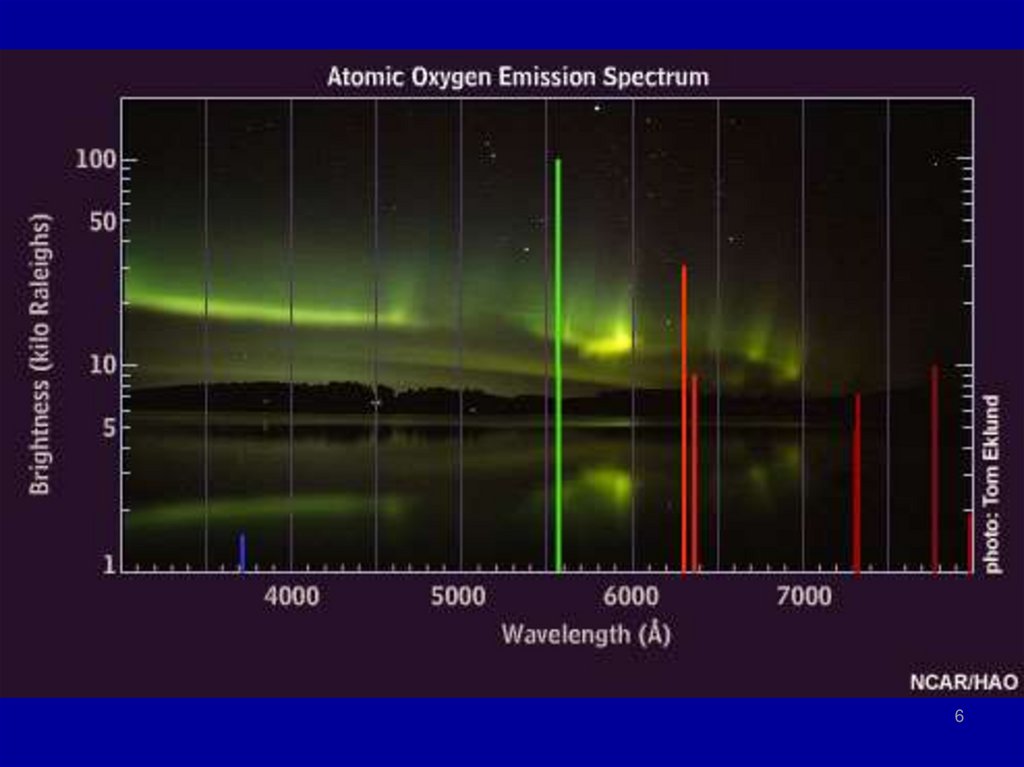
6.
67.
Copyright © 2010 R. R. Dickerson &Z.Q. Li
7
8. Молекулярные спектры
• Движение и энергия молекул– Молекулы колеблются и вращаются все время, два
основных режима вибрации время
• растяжение - изменение длины связи
(высокие v)
• изгиб - изменение угла связи (нижняя у)
(другие возможные сложные типы
растяжения и изгиба: ножницы / качалка /
скручивания
-Молекулы, как правило, находятся в основном
состоянии (S0)
S (синглет) - два спин электронной пары имеют
разное направление
T (триплет) - два электронных спинов имеют одно
и то же направление
v4
v3
v2
v1
S2
S1
– После возбуждения молекул могут переходить на
высокие E состояния (S1, S2, T1 и т.д.), которые
связаны с определенными уровнями энергии
– Переход от высоких состояний Е в низкие
происходит засчет поглощения фотона; переход от
низких до высоких состояний Е может привести к
испускания фотонов
v4
v3
v2
v1
T1
v4
v3
v2
v1
S0
v4
v3
v2
v1
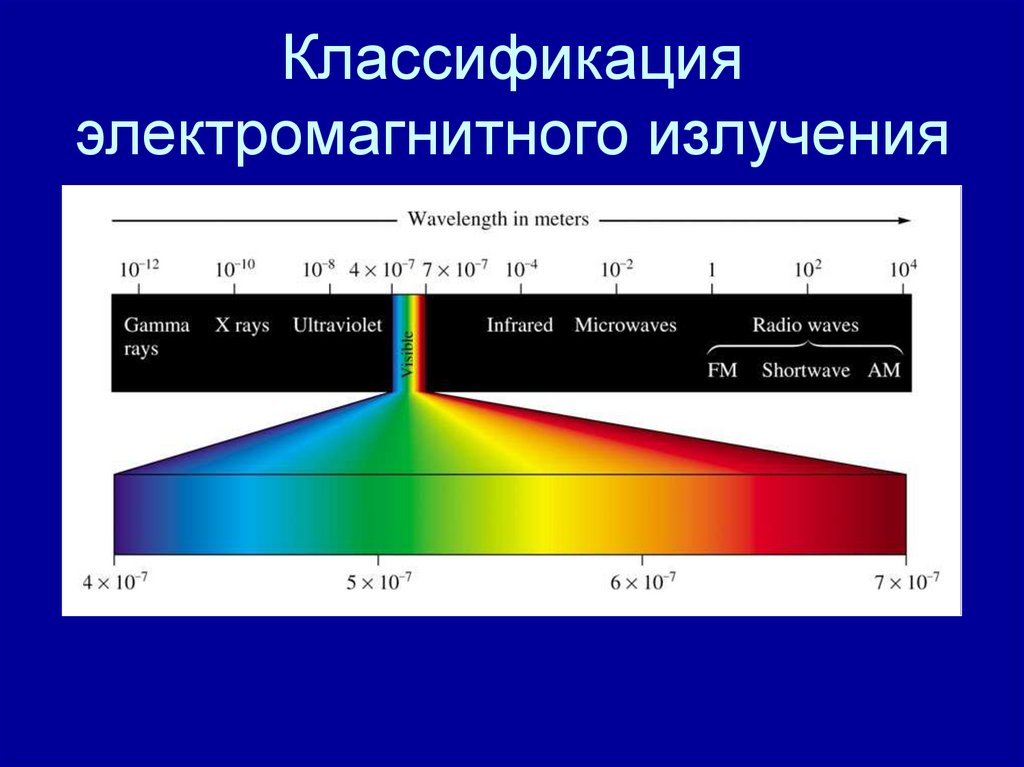
9. Классификация электромагнитного излучения
10. Спектр электромагнитного излучения
•Космические лучилучи
•X-лучи
Энергия
•Ультрафиолетовый
•Видимый
•Инфракрасный
•микроволны
•Радио волны
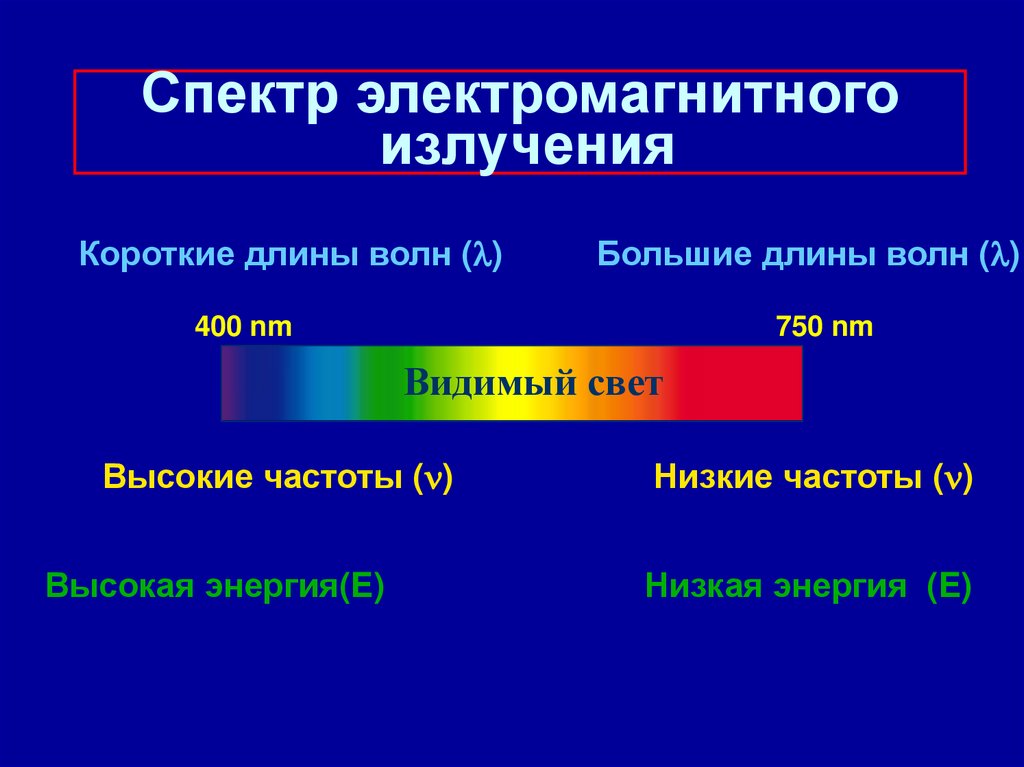
11. Спектр электромагнитного излучения
Короткие длины волн ( )Большие длины волн ( )
400 nm
750 nm
Видимый свет
Высокие частоты ( )
Высокая энергия(E)
Низкие частоты ( )
Низкая энергия (E)
12.
Электромагнитное излучениеV = Волновое число (cm-1)
= Длина волны
C = Скорость радиации (constant) = 3 x 1010 cm/sec.
u = частота излучения (cycles/sec)
V =
u
=
C
Энергия фотона:
h (константа Планка) = 6.62 x 10- (Erg sec)
27
E = h u= h
C
u =
C
C = u
13.
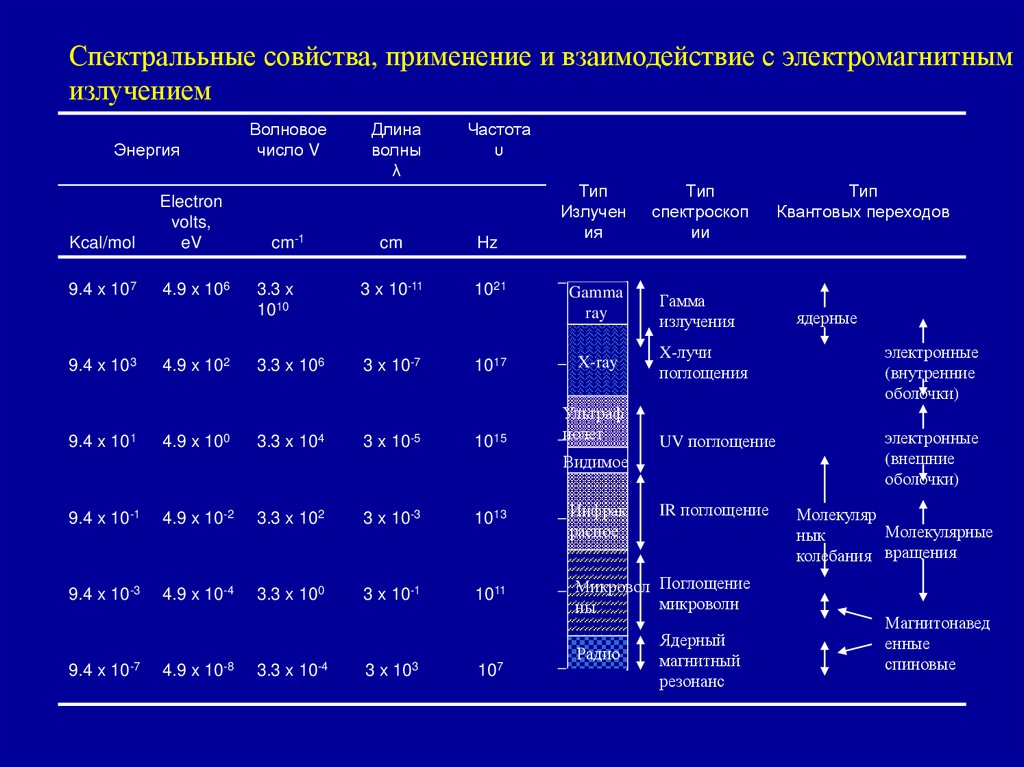
Спектралььные совйства, применение и взаимодействие с электромагнитнымизлучением
Энергия
Kcal/mol
Electron
volts,
eV
9.4 x 107
4.9 x 106
9.4 x 103
9.4 x 101
4.9 x 102
4.9 x 100
Волновое
число V
cm-1
Длина
волны
λ
Частота
υ
cm
Hz
3.3 x
1010
3 x 10-11
1021
3.3 x 106
3 x 10-7
3.3 x 104
3 x 10-5
Тип
Излучен
ия
Тип
спектроскоп
ии
Gamma
ray
Гамма
излучения
1017
X-ray
1015
Ультраф
иолет
4.9 x 10-2
3.3 x 102
3 x 10-3
1013
9.4 x 10-3
4.9 x 10-4
3.3 x 100
3 x 10-1
1011
9.4 x 10-7
4.9 x 10-8
3.3 x 10-4
3 x 103
107
Инфрак
расное
электронные
(внутренние
оболочки)
UV поглощение
электронные
(внешние
оболочки)
IR поглощение
Микровол Поглощение
микроволн
ны
Радио
ядерные
X-лучи
поглощения
Видимое
9.4 x 10-1
Тип
Квантовых переходов
Ядерный
магнитный
резонанс
Молекуляр
Молекулярные
нык
колебания вращения
Магнитонавед
енные
спиновые
14.
Поглощение и излучение излученияБудем считать, что атом(или молекула) имеет два уровня, Ei и
Ek
E
k
Энергетические уровни
молекулы Ei
Ei
Прямой излучательный переход между этими состояниями
связан с фотоном частоты ν: hν = ΔE = Ek – Ei
Рассмотрим:
Каковы возможные радиационные переходы?
Какова вероятность такого перехода?
Как измениться число фотонов при переходе?
15. Поглощение
Коэффициент Эйнштейна дляпоглощения B12
• Спонтанный переход
при котором атом
или молекула
поглощает фотон
излучения
• Поглощение фотона
вызывает переход
атома или молекулы
в возбужденное
состояние
16.
Ekhν
Ei
«Идет» один фотон энергии hν
Вероятность перехода: dPik/dt = Bik ρ(ν)
dPik /dt вероятность поглощения молекулой фотонов в одну
секунду
Bik коэффициент Эйнштейна для вынужденного поглощения
ρ(ν) спектральная плотность энергии (число фотонов частоты
ν в единице объема )
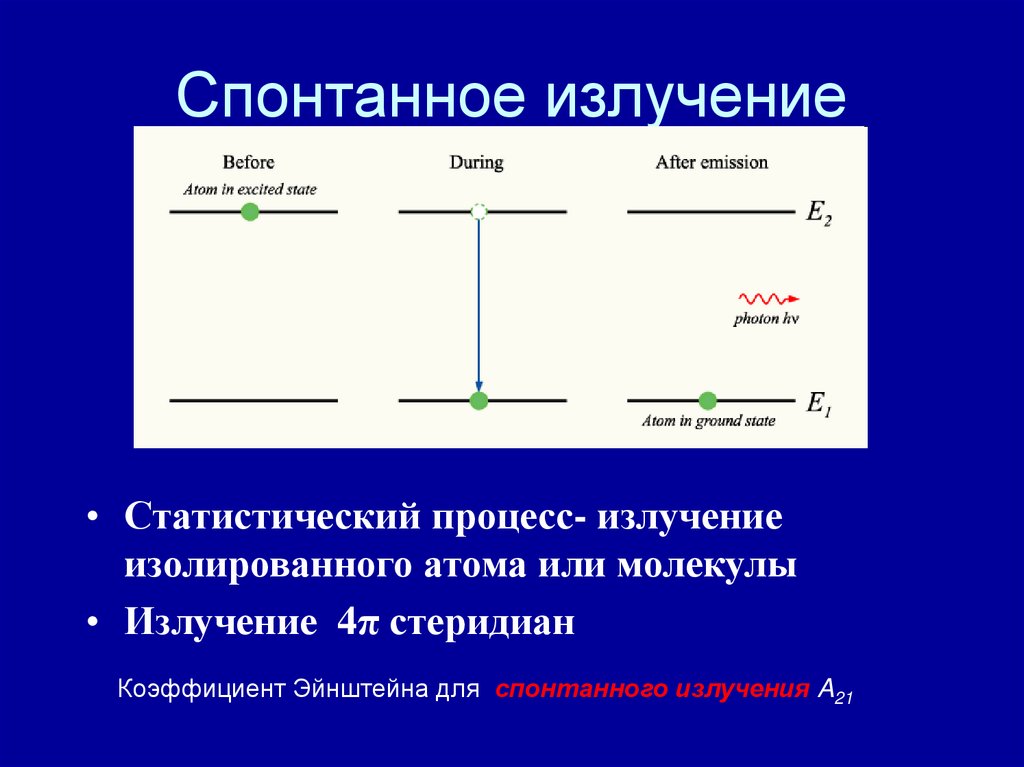
17. Спонтанное излучение
• Статистический процесс- излучениеизолированного атома или молекулы
• Излучение 4π стеридиан
Коэффициент Эйнштейна для спонтанного излучения A21
18.
Молекула с Ek спонтанно переходит на Ei излучая фотон впроизвольном направлении
Ek
hν
Ei
Еще один фотон с энергией hν (произвольная фаза и направление)
Вероятность перехода dPki/dt = Aki
dPki /dt is вероятность излучения возбужденной молекулы в
секунду
Aki коэффициент Эйнштейна спонтанного излучения (или
вероятность спонтанных переходов)
Спонтанное излучение не зависит от присутствия других
фотонов в среде
19. Стимулированное излучение
E2h
2h
E1
Коэффициент Эйнштейна для вынужденного излучения Bul
20.
Фотон соответствующей частоты вызывает переход от Ek кhν
Ei
Ek
hν
Ei
Еще один фотон с энергией hν . Новый фотон имеет ту же частоту, фазу и
направление как исходный фотон
Вероятность перехода dPki/dt = Bki ρ(ν)
dPki /dt есть вероятность в секунду возбужденной молекулы испускания
фотона
Bki является коэффициент Эйнштейна индуцированного излучения
21.
Соотношение между Bik и Bki:Коэффициенты Эйнштейна индуцированного поглощения и излучения
непосредственно связаны через вырождение gX, для каждого уровня х:
Bik = (gk/gi) Bki
В случае, когда каждый уровень имеет такое же вырождение (gi = gk),
коэффициенты Эйнштейна индуцированного поглощения и испускания
идентичны
–Другими словами, вероятность индуцированного излучения является такой
же, как индуцированного поглощения
Aki =
Bki
c
3
ki
2 3
ВЫРОЖДЕНИЕ ЭНЕРГЕТИЧЕСКИХ УРОВНЕЙ — существование двух
или более стационарных состояний квантовой системы (атома, молекулы)
с одинаковыми значениями энергии.
22.
23.
24.
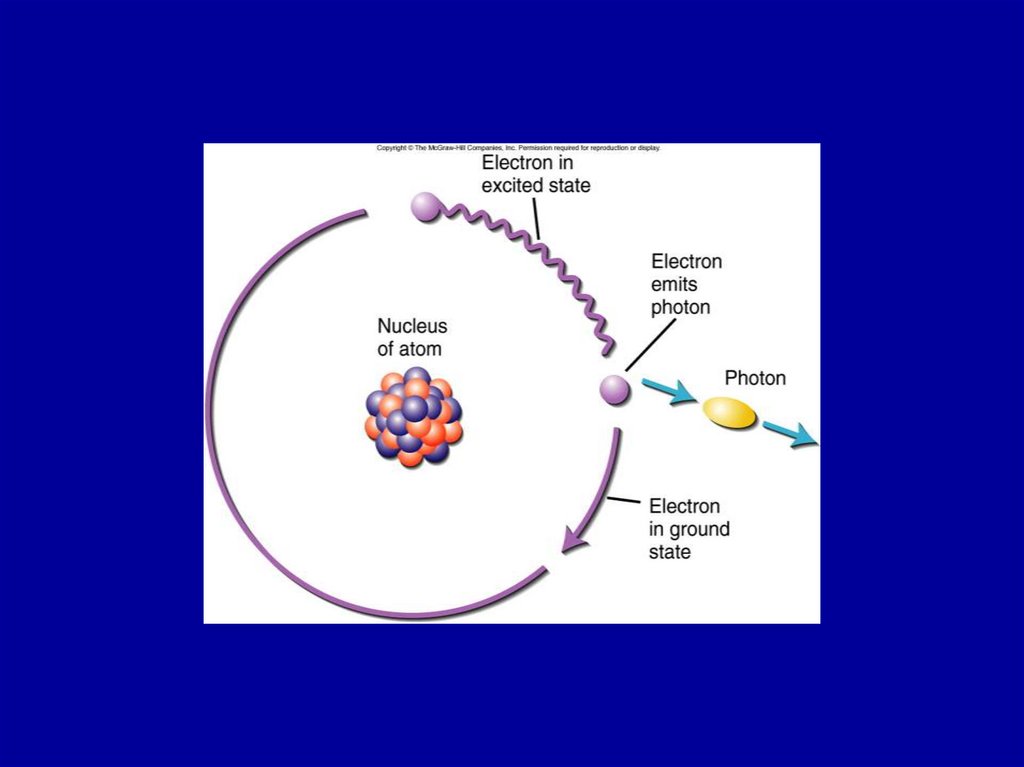
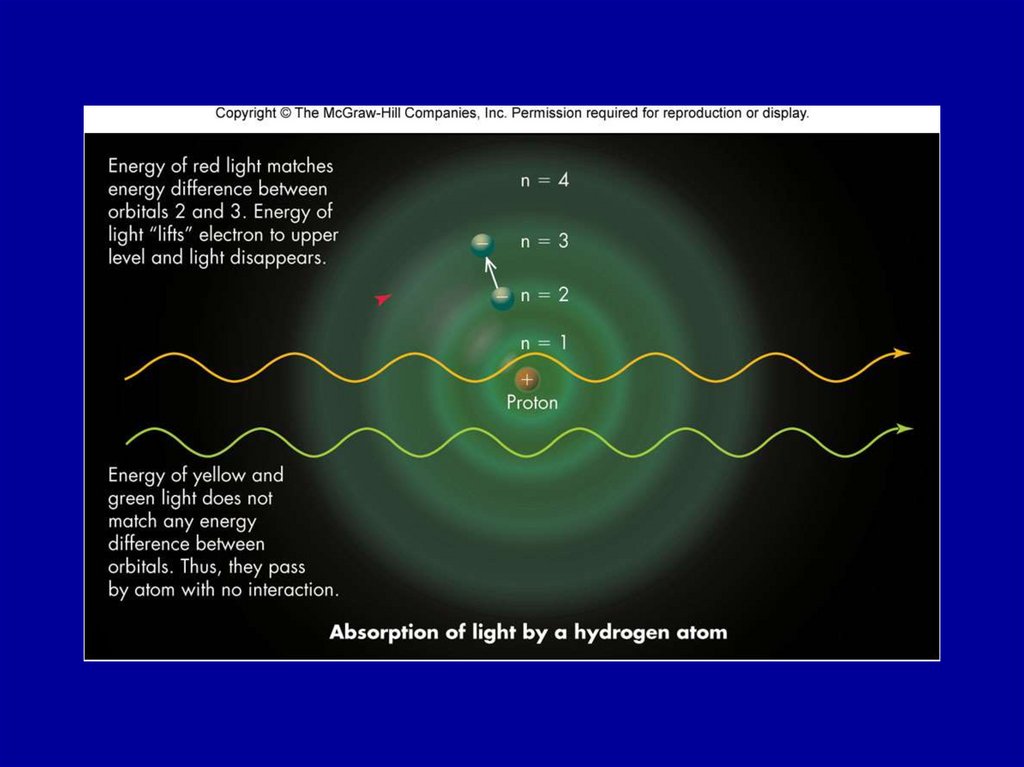
Figure 21.325. Figure 21.3
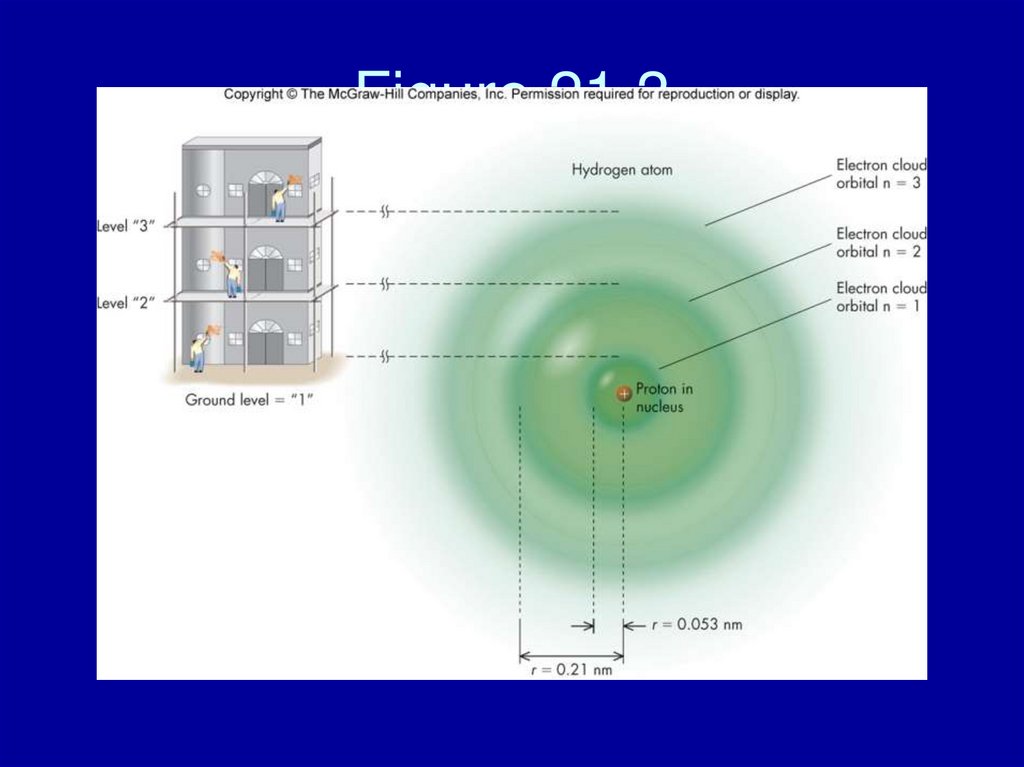
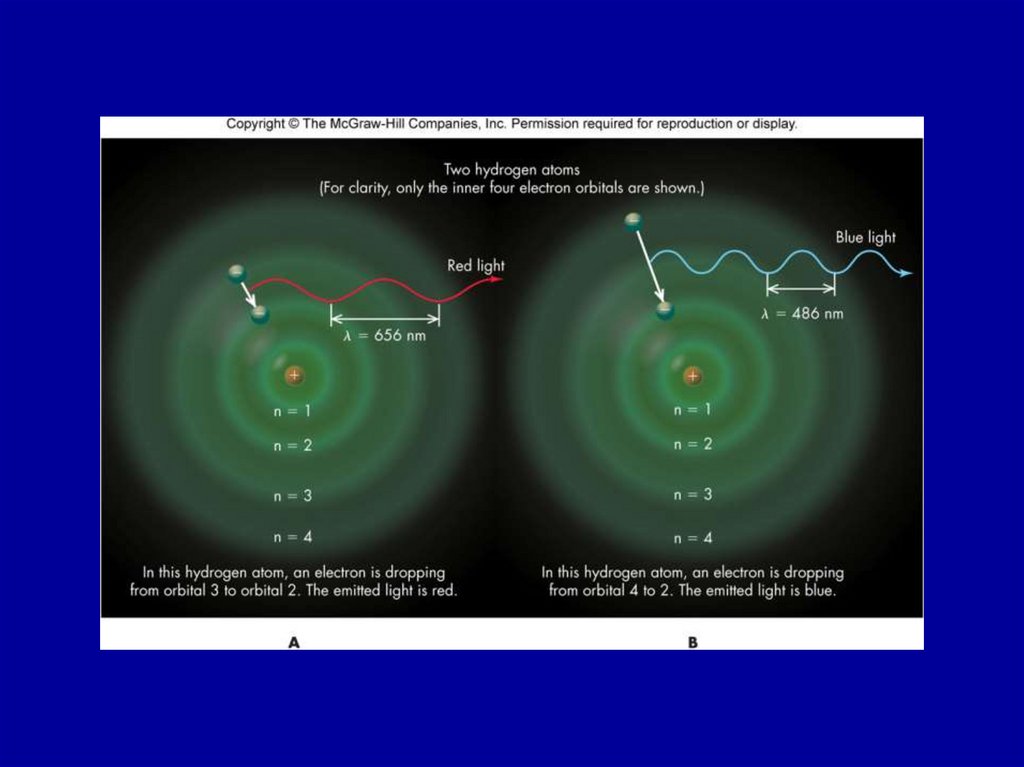
Figure 21.426. Figure 21.4
27.
28.
Какие виды состояний?•электроннные
UV-Vis
•колебательные
инфракрасные
•Вращательные
микроволны
•Спин ядра
радиочастоты
29. Какие виды состояний?
• ПриближениеБорна-Оппенгеймера
является
предположение,
что
электронное движение и движение ядер
в молекуле может быть отделена .
• Это приводит к тому, что молекулярные
волновые функции, которые даны в
терминах электронного позиций (ri) и
ядерных позиций (Rj):
molecule(rˆi , Rˆ j ) = electrons(rˆi , Rˆ j ) nuclei ( Rˆ j )
30.
Колебательные состояния•Колебательной моды также могут
возбуждаться .
•Тепловые колебательные
движения
•также, колебания в молекулах
могут возникать под
действием света светом .
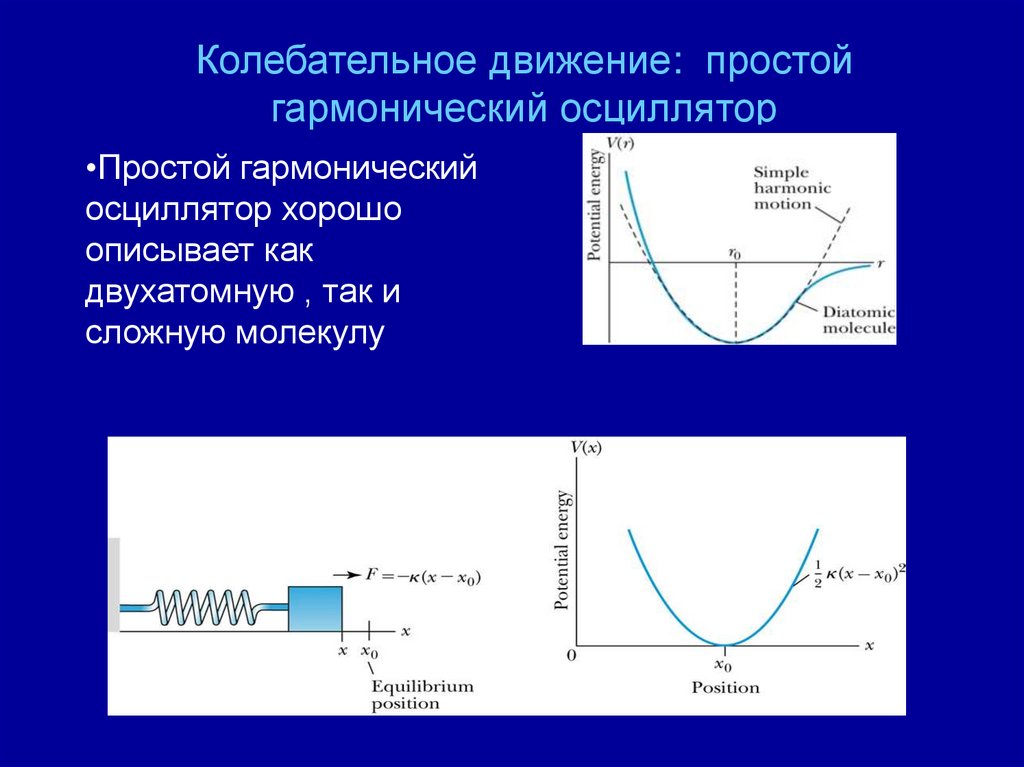
•Предположим, что два атома точечных масс связанных
безмассовой пружиной совершают простые
гармонические колебания
31. Колебательные состояния
Колебательное движение: простойгармонический осциллятор
•Простой гармонический
осциллятор хорошо
описывает как
двухатомную , так и
сложную молекулу
32. Колебательное движение: простой гармонический осциллятор
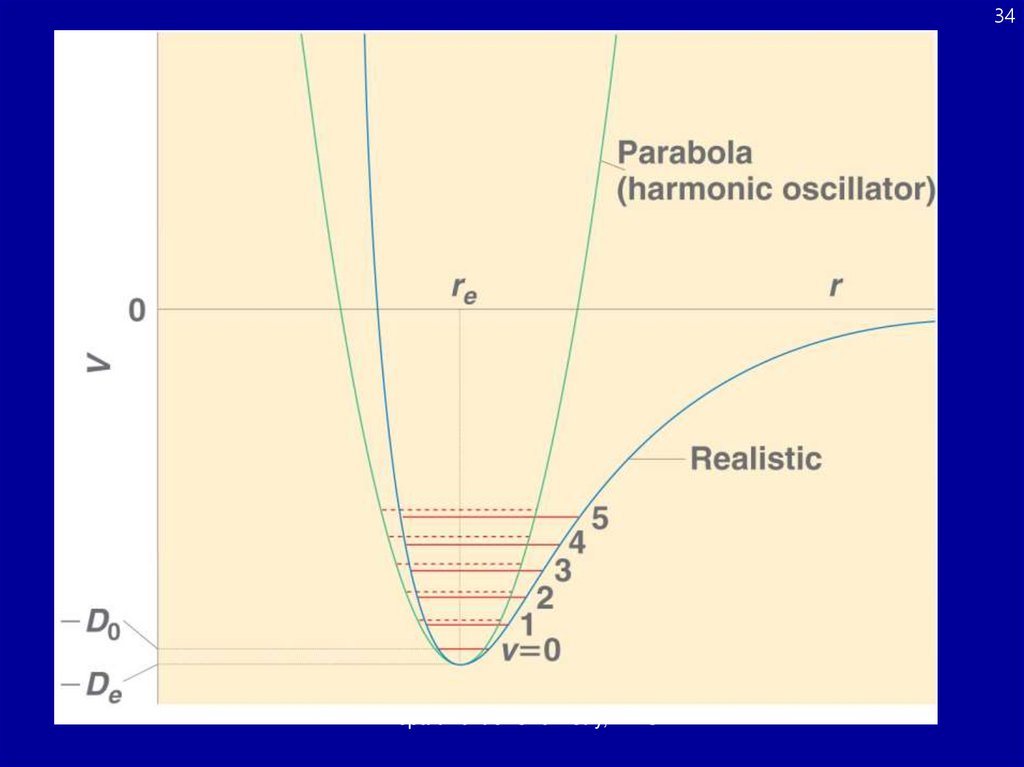
Колебательные состоянияЭнергетические
уровни квантовомеханического
осциллятора
Правило отбора для
колебательного перехода:
Dv = ±1
Только для спектральной
линии !
отклонения от идеальной
параболического потенциала
позволяют другие переходы,
называюмые обертонами, но они
гораздо слабее,
33. Колебательные состояния
34Department of Chemistry, KAIST
34.
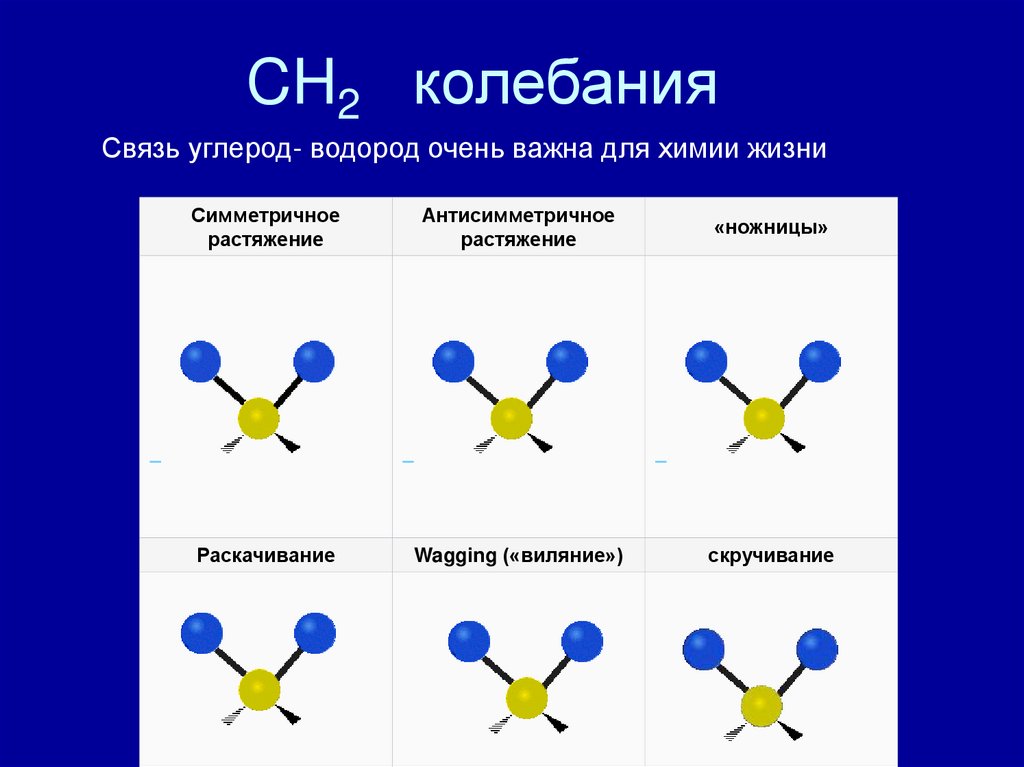
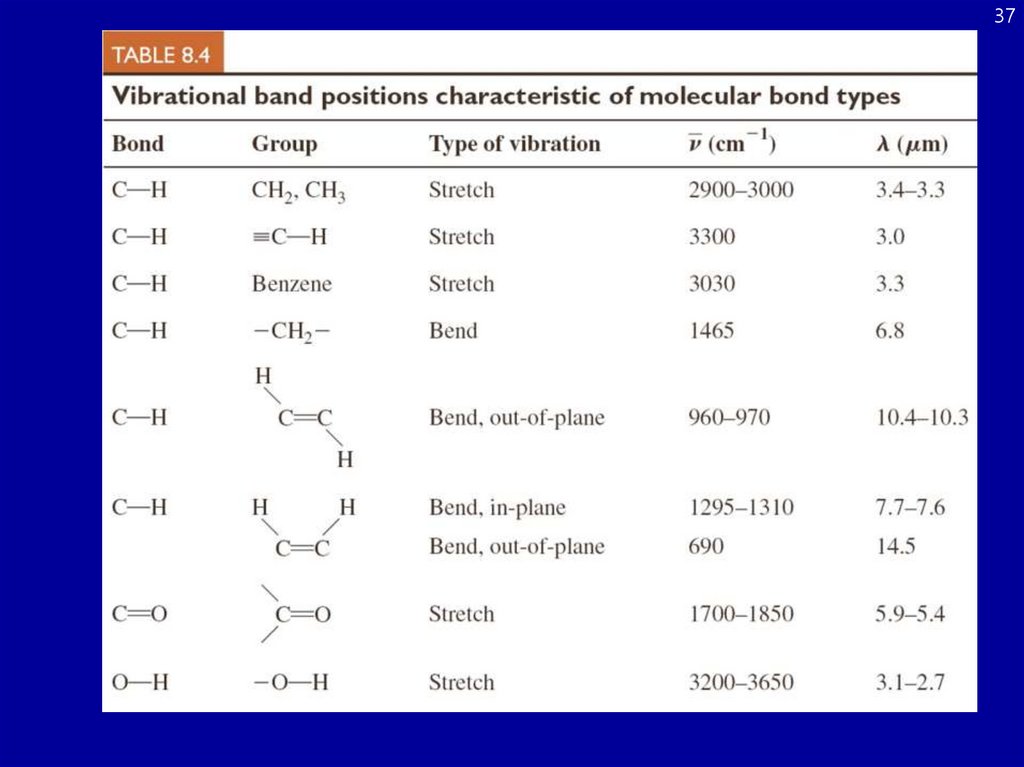
CH2 колебанияСвязь углерод- водород очень важна для химии жизни
Симметричное
растяжение
Антисимметричное
растяжение
«ножницы»
Раскачивание
Wagging («виляние»)
скручивание
35. CH2 колебания
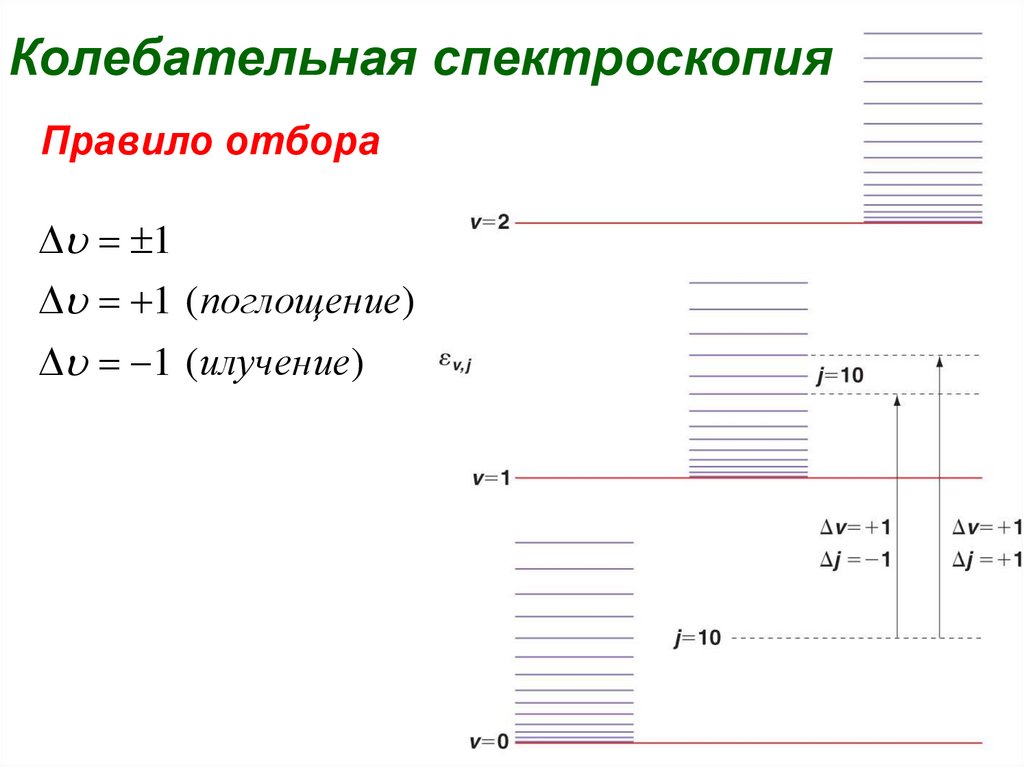
36Колебательная спектроскопия
Правило отбора
Du = 1
Du = 1 (поглощение)
Du = 1 (илучение)
36.
3737.
Вращательные состояния•Двухатомную молекулу можно рассматривать как
два атома соединенные невесомым жестким
стержнем (модель твердого ротатора).
•В чисто вращательные системы, кинетическая
энергия выражается через угловой момент L и
инерции вращения I .
2
Erot
L
=
2I
38. Вращательные состояния
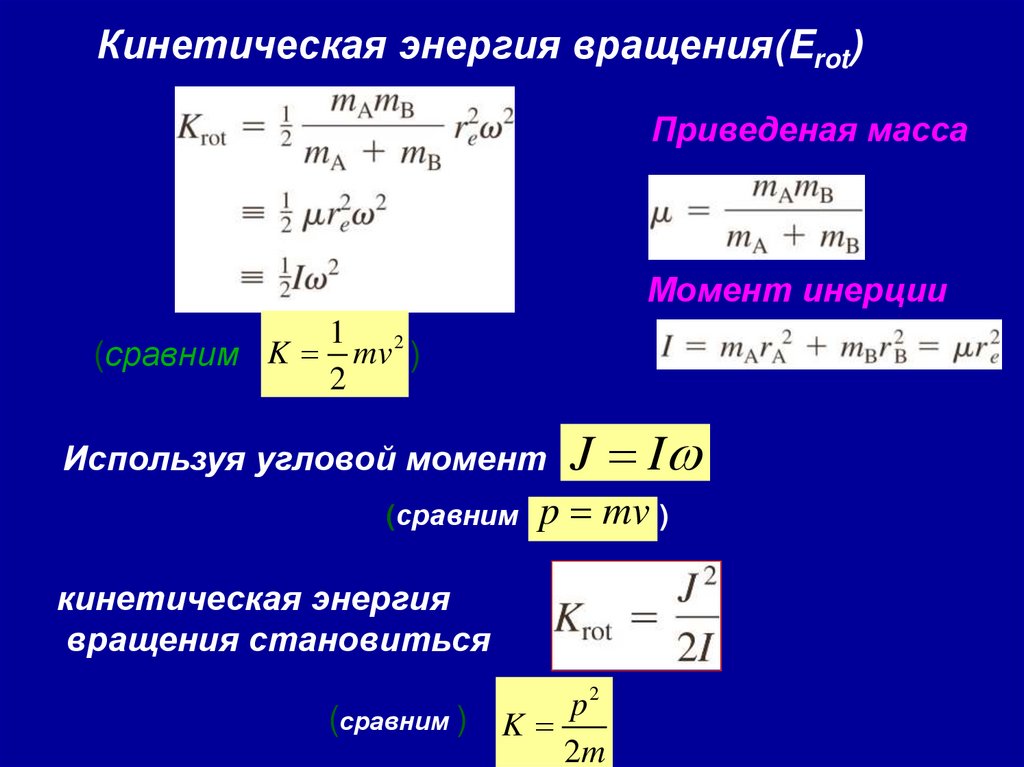
re = rA + rBКинетическая энергия вращения (Erot)
где ω угловая скорость , dθ/dt
39.
Кинетическая энергия вращения(Erot)Приведеная масса
Момент инерции
(сравним K =
1 2
mv )
2
Используя угловой момент
(сравним
J = I
p = mv )
кинетическая энергия
вращения становиться
(сравним )
p2
K=
2m
40.
41Период вращения
Для Krot = kBT
Для типичной молекулы при комнатной температуре
rot 10 12 s = 1 ps
(одна пикосекунда)
41.
Квантование энергии вращенияV=0
: Ψ(2π + θ) = Ψ(θ)
Из решения уравнения Шредингера для
вращательного движения,
Энергия вращательных уровней
Циклическое граничное условие
Вращательные уровни энергии в волновых числах (cm-1)
(B =
h
8 cI
2
)
42.
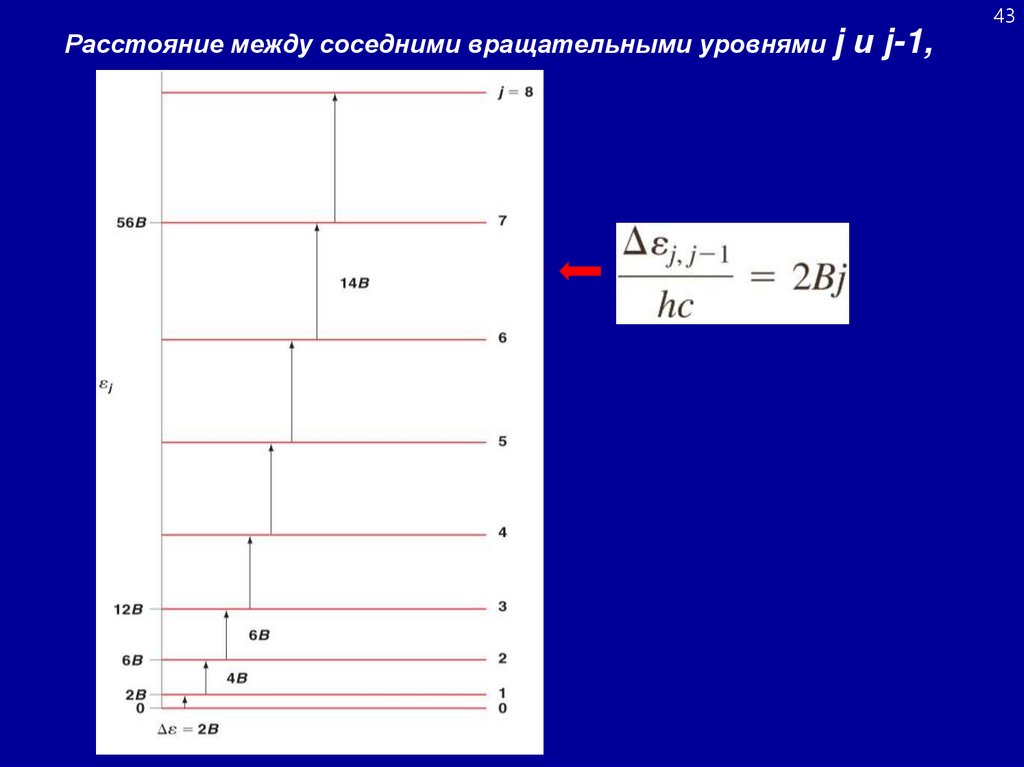
Расстояние между соседними вращательными уровнями jи j-1,
43
43.
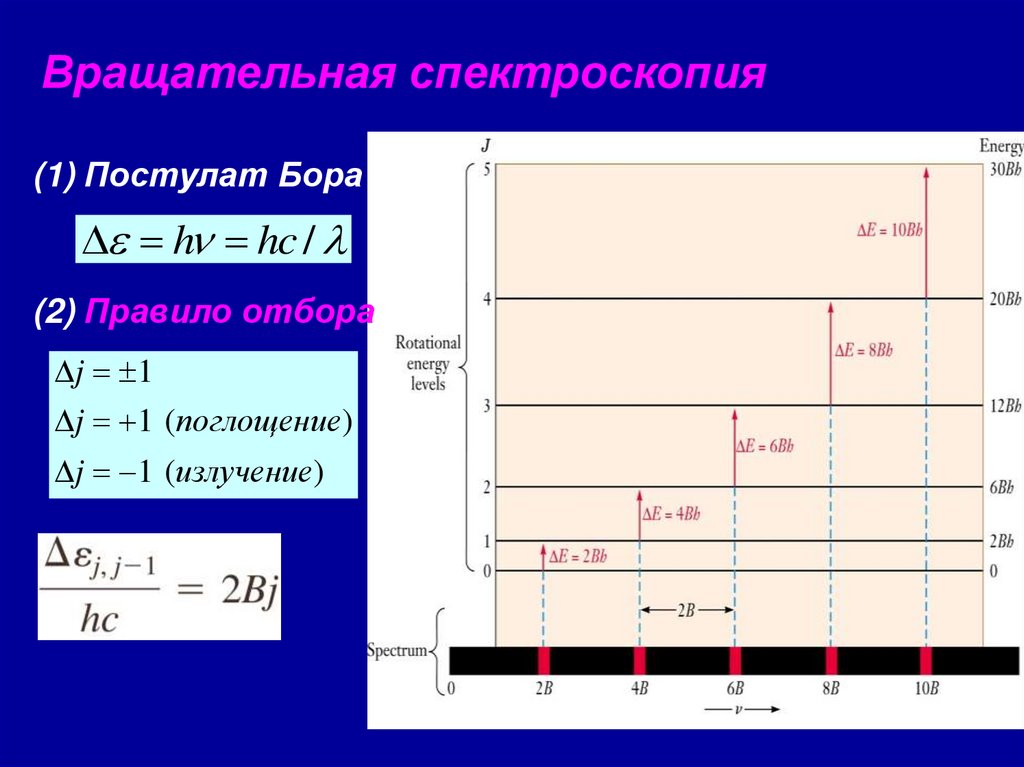
Вращательная спектроскопия(1) Постулат Бора
D = h = hc /
(2) Правило отбора
Dj = 1
Dj = 1 (поглощение)
Dj = 1 (излучение)
44.
45От дальней инфракрасной области до
микроволновой области спектра
(микроволновая спектроскопия)
45.
Комбинация колебания ивращения
E = Erot Evibr =
E ph =
2
2I
=
(
2
( 1) 1
n
2I
2
1)( 2) ( 1)
2
2
3 2 = ( 1)
2I
I
2
2
46. Комбинация колебания и вращения
DEувеличивается
линейно с ℓ.
•Многие переходы
запрещены
правилами отбора,
которые требуют Dℓ
= ±1 и D n = ±1
47. Комбинация колебания и вращения
Комбинация колебаний и вращений•Спектр излучения (и поглощения) спектр меняется в зависимости от
величины ℓ.
•Чем выше начальный энергетический уровень, тем больше энергия
фотона.
•Колебательная энергия больше вращательной. Для двух атомной
молекулы эта разница энергий приводит к полосатой структуре.
•Однако, интенсивность линий зависит от населенности состояний и
правил отбора для колебаний .
Dn = 3
Dn = 2
Dn = 1
Длина волны →
Dn = 0
48. Комбинация колебаний и вращений
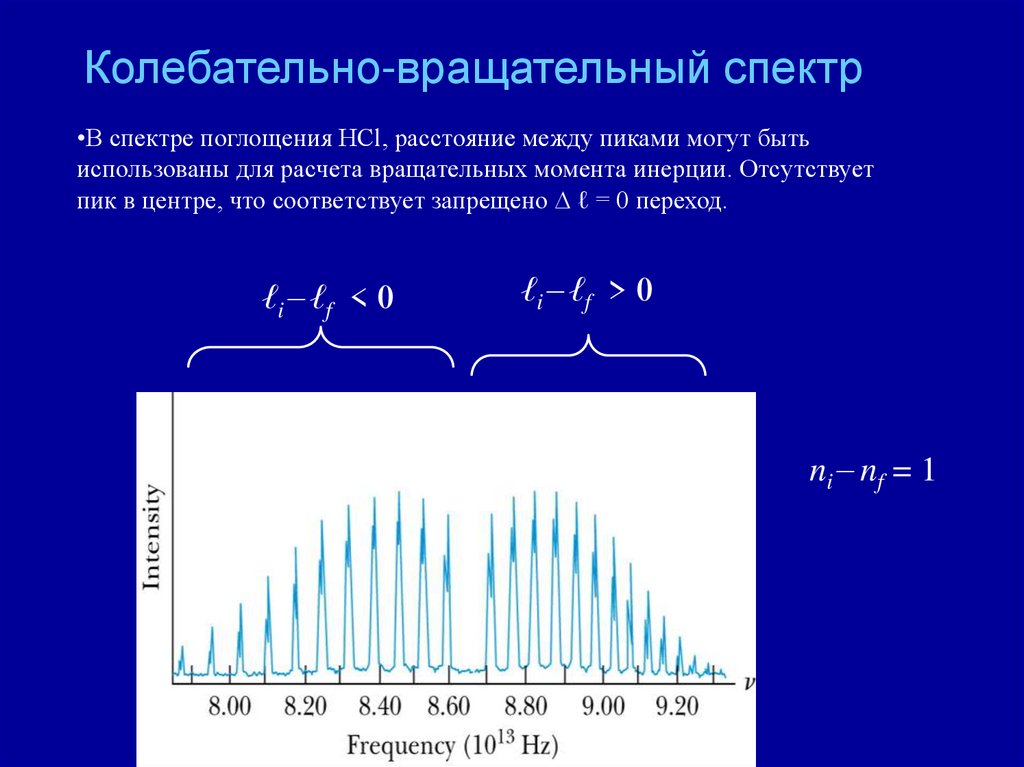
Колебательно-вращательный спектр•В спектре поглощения HCl, расстояние между пиками могут быть
использованы для расчета вращательных момента инерции. Отсутствует
пик в центре, что соответствует запрещено D ℓ = 0 переход.
ℓi ℓf < 0
ℓi ℓf > 0
ni nf = 1
49. Колебательно-вращательный спектр
Частоты движений в атомах и молекулах•Электроны вибрируют в своем
движении вокруг ядра
Высокая частота: ~1014 –
1017колебаний в секунду.
•Колебания ядер в молекулах по
отношению друг к другу
•промежуточная частота :
~1011 - 1013 колебаний в секунду.
•Вращение ядер в молекулах
•Низкая частота: ~109 – 1010
колебаний в секунду.
50. Частоты движений в атомах и молекулах
51«Включим» электронные энергетические уровни
Eобщ = Eядерн + Eэлектр
= Eкол + Eвращ + Eэлектр
51.
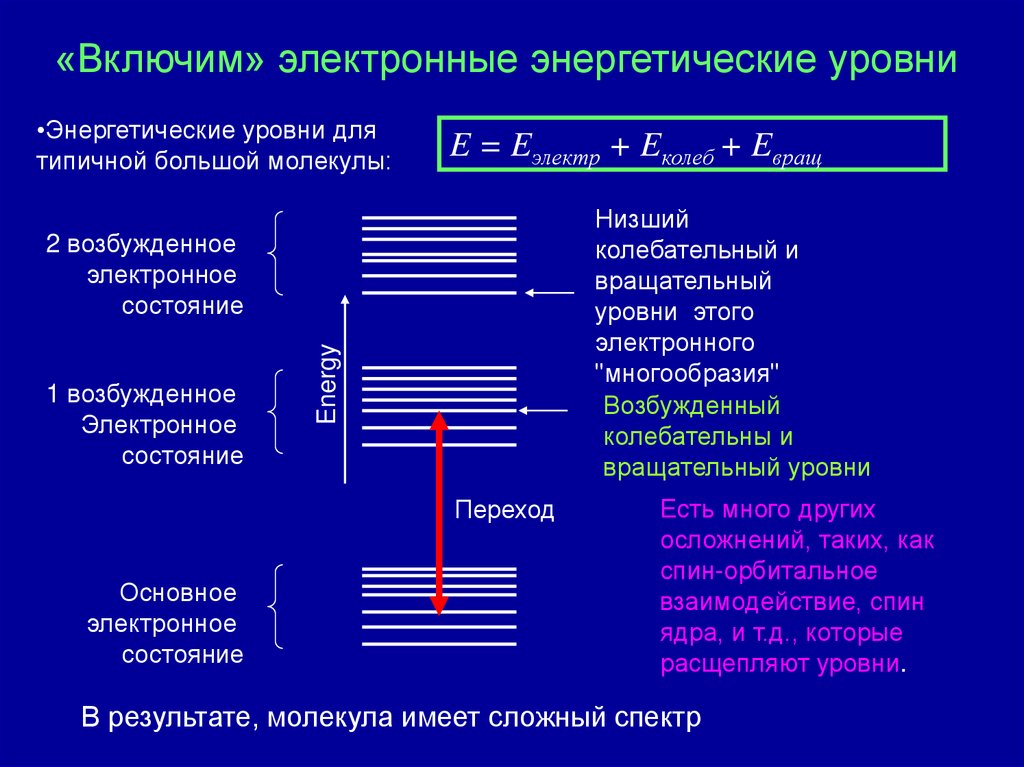
«Включим» электронные энергетические уровни•Энергетические уровни для
типичной большой молекулы:
E = Eэлектр + Eколеб + Eвращ
Низший
колебательный и
вращательный
уровни этого
электронного
"многообразия"
Возбужденный
колебательны и
вращательный уровни
1 возбужденное
Электронное
состояние
Energy
2 возбужденное
электронное
состояние
Переход
Основное
электронное
состояние
Есть много других
осложнений, таких, как
спин-орбитальное
взаимодействие, спин
ядра, и т.д., которые
расщепляют уровни.
В результате, молекула имеет сложный спектр
52. «Включим» электронные энергетические уровни
53.
Спектр поглощения молекулыV = колебательное
квантовое число
J =вращательное
квантовое число
54. Спектр поглощения молекулы
Формирование спектров55. Формирование спектров
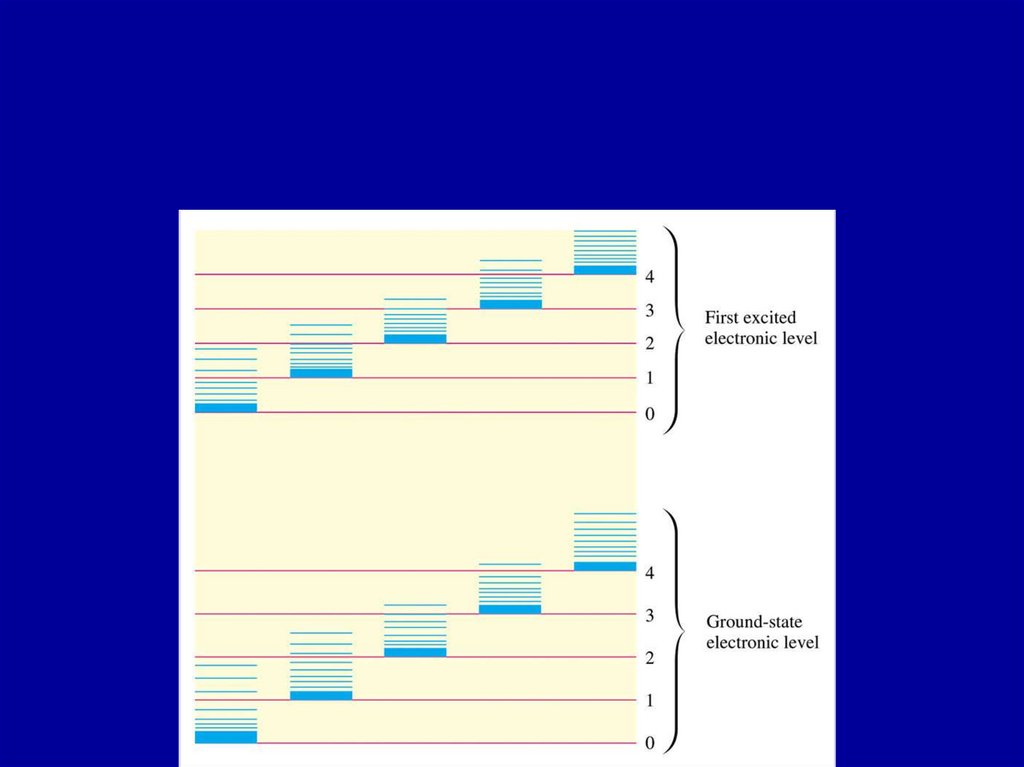
Молекулярная спектроскопияЭлектронные переходы: UV-visible
Колебательные переходы: IR
Вращательные переходы :
E
Электронные
Колебательная
Вращательная
56. Молекулярная спектроскопия
ЭНЕРГЕТИЧЕСКИЕ ПЕРЕХОДЫМОЛЕКУЛЫ
1. Возбуждение молекулы: переход молекулы
из основного (S0) на один из возбужденных
синглетных уровней по схеме:
S0 + hν→ S1(Vn) (процесс А)
может произойти только в том случае, если
энергия фотонов падающего излучения равна
энергии перехода с уровня So на более высокий
уровень
или
подуровень
синглетного
состояния.
57.
2. Внутренняя конверсия: молекула оченьбыстро (~ 10-13 с) переходит с колебательного
подуровня Vn(S1) на основной возбужденный
уровень S1 с выделением избыточной энергии в
форме тепла:
Vn(S1) → S1+ Q (процесс B)
58.
3. Молекула в возбужденном состоянии S1 можетрасходовать оставшуюся энергию возбуждения по одному
из трех механизмов:
3.1. Колебательная релаксация: передать энергию в форме
тепла при столкновении с другой :
S1 → S0 + Q (процесс С)
59.
3.2. Флуоресценция: «испускания» (выделение) энергии ввиде кванта электромагнитного излучения:
S1 → S0+ hν (процесс D)
60.
3.3. Интеркомбинационная конверсия: перейти на какойлибо подуровень триплетного уровня, обладающий почтитакой же энергией:
S1 → Vn(T1) + Q (процесс E)
61.
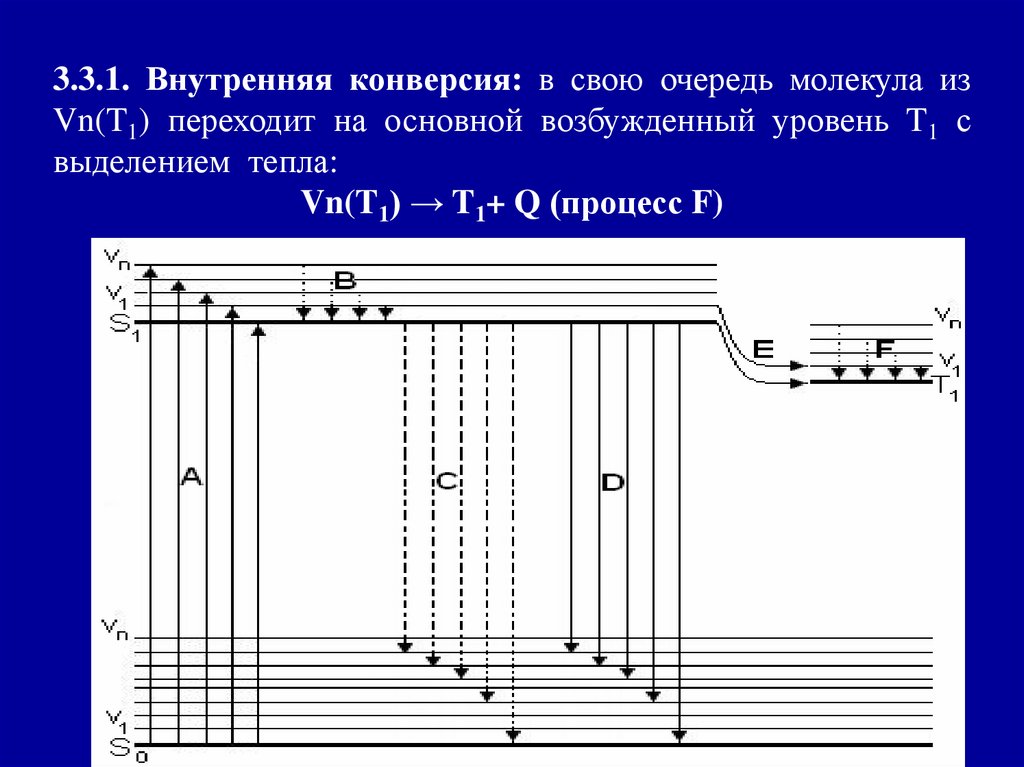
3.3.1. Внутренняя конверсия: в свою очередь молекула изVn(T1) переходит на основной возбужденный уровень T1 с
выделением тепла:
Vn(T1) → T1+ Q (процесс F)
62.
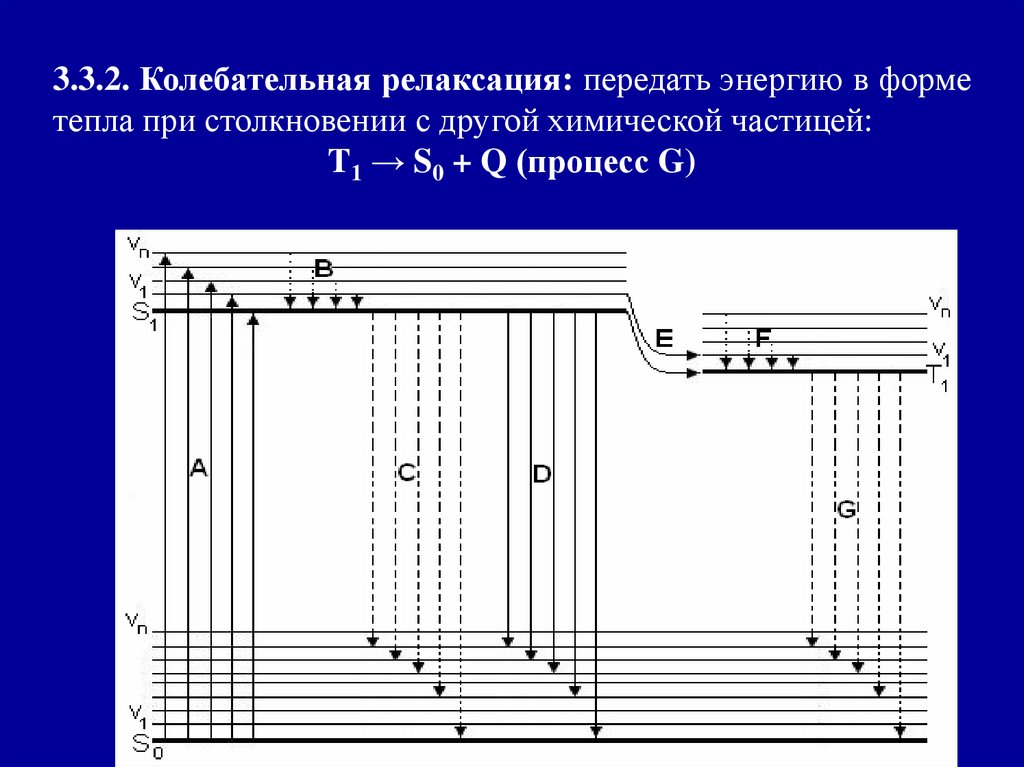
3.3.2. Колебательная релаксация: передать энергию в форметепла при столкновении с другой химической частицей:
T1 → S0 + Q (процесс G)
63.
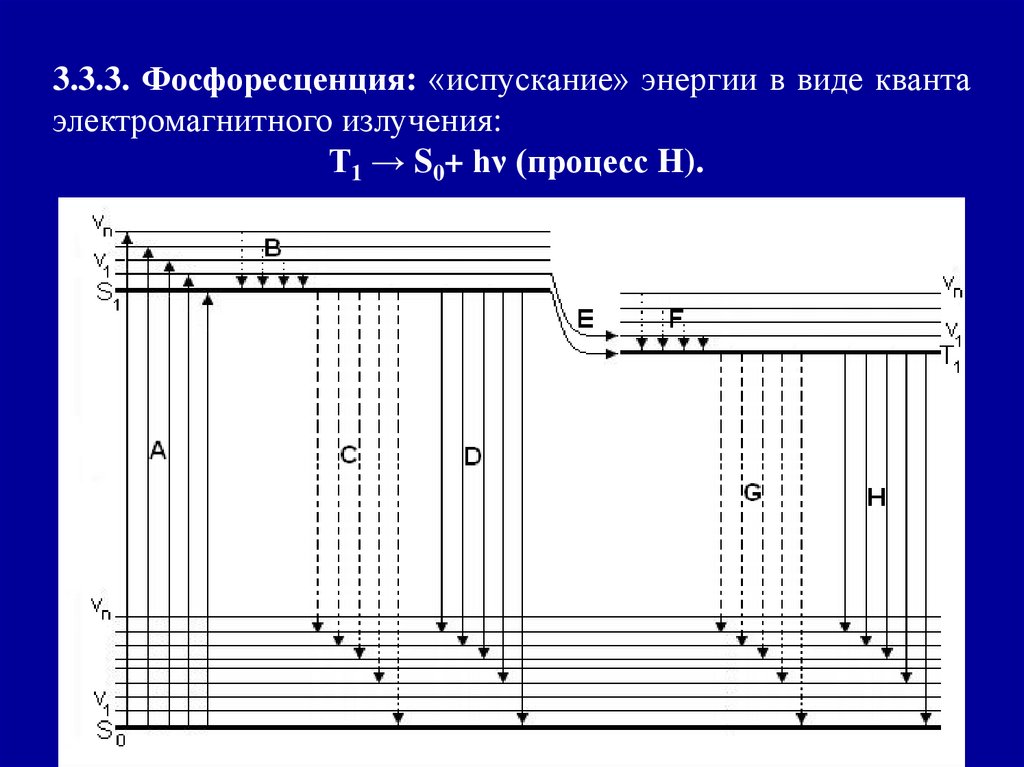
3.3.3. Фосфоресценция: «испускание» энергии в виде квантаэлектромагнитного излучения:
Т1 → S0+ hν (процесс H).




































 physics
physics








