Similar presentations:
Люминесценция. Свечение
1. Лекция 6
2.
Люминесценция – свечение атомов,молекул, ионов и других более сложных
комплексов, возникающее в результате
электронного
перехода
частицах
их
при
в
этих
возвращении
возбужденного состояния в основное
из
3.
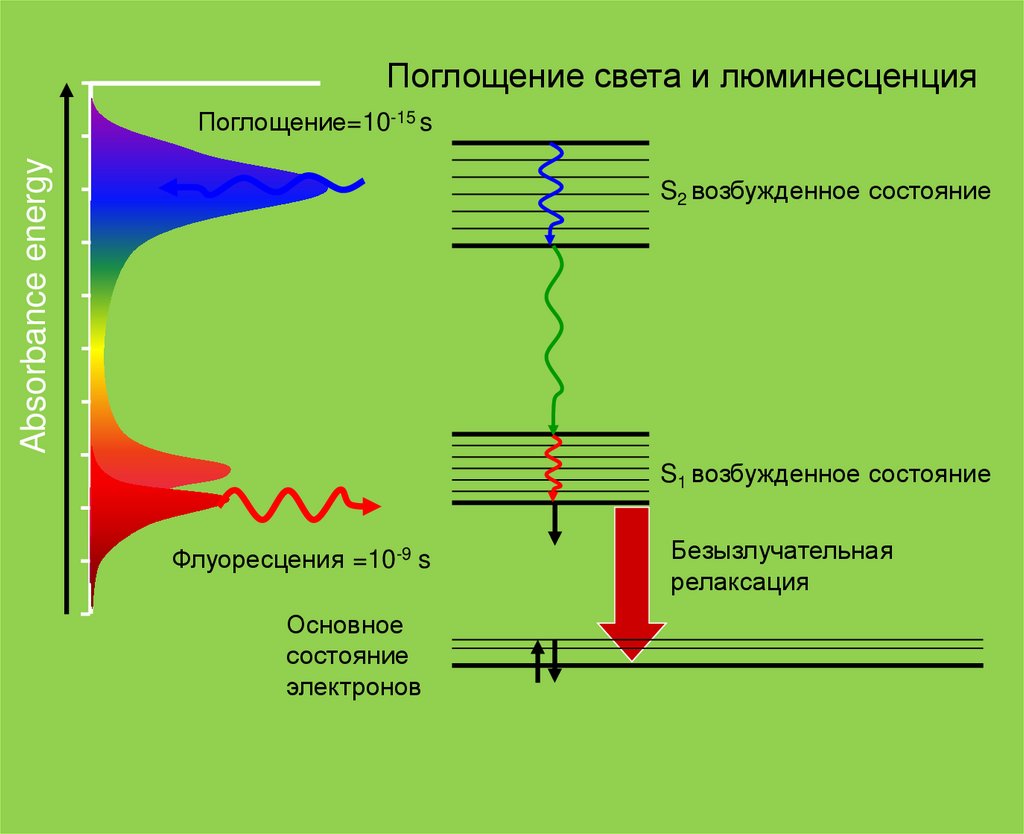
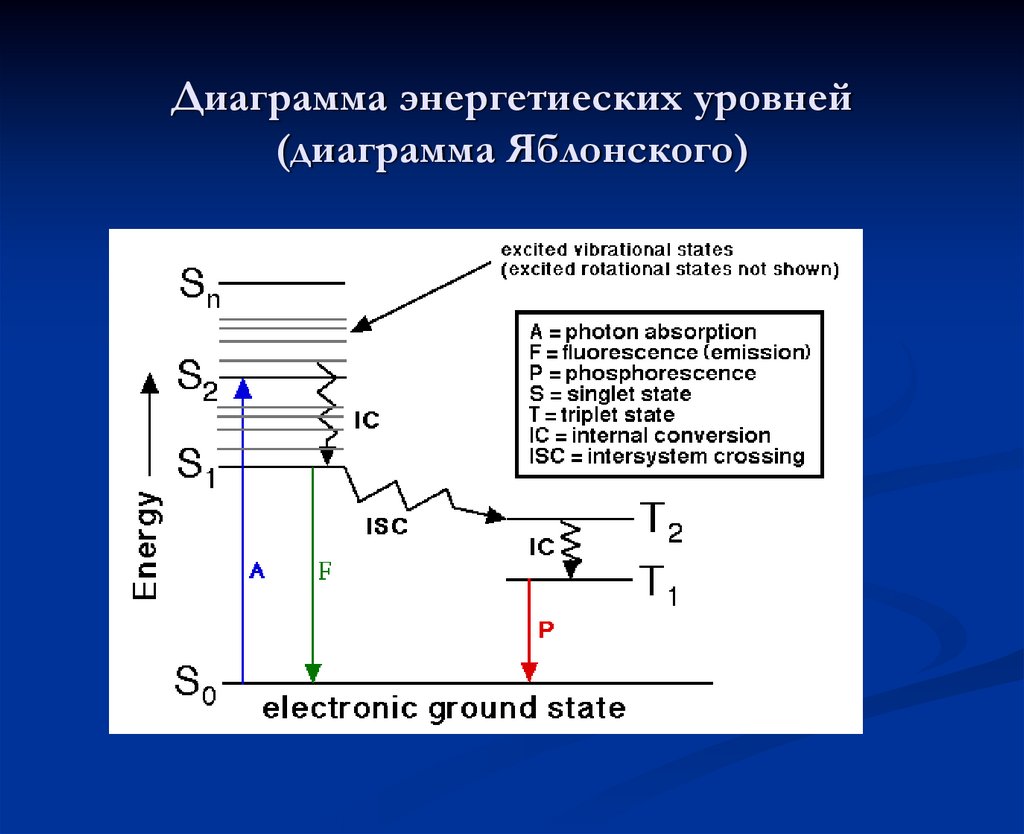
Поглощение света и люминесценцияAbsorbance energy
Поглощение=10-15 s
S2 возбужденное состояние
S1 возбужденное состояние
Флуоресцения =10-9 s
Основное
состояние
электронов
Безызлучательная
релаксация
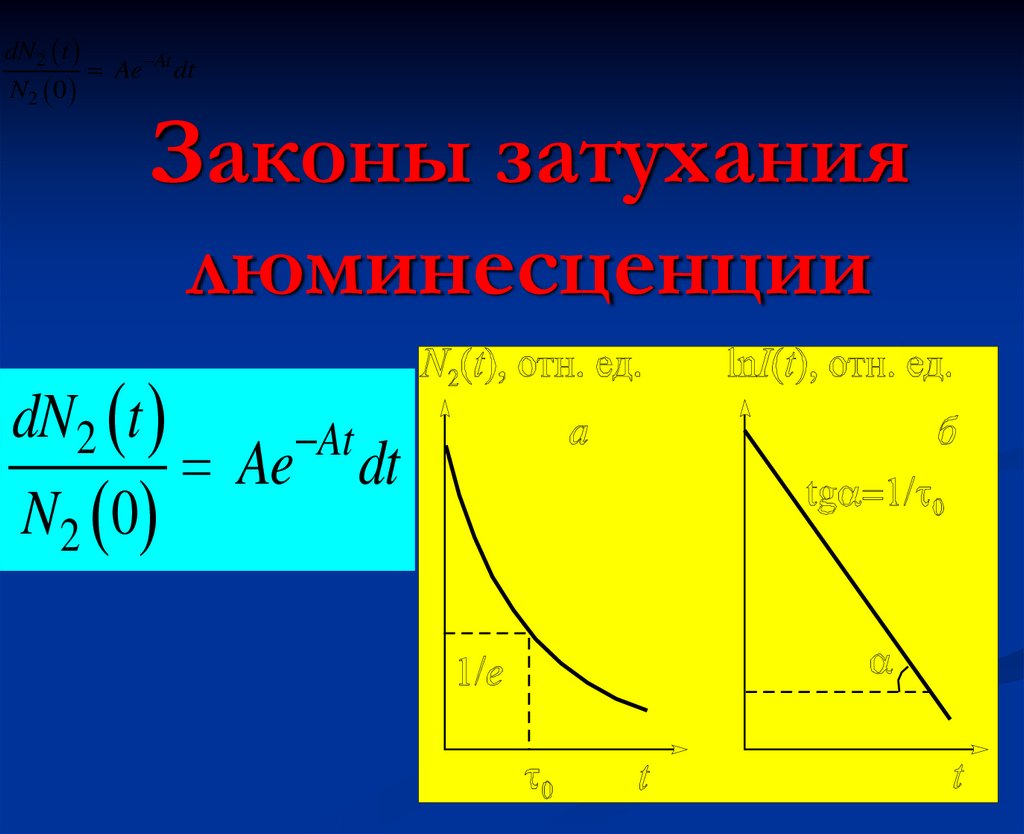
4. Законы затухания люминесценции
dN2 tN2 0
Ae At dt
Законы затухания
люминесценции
dN2 t
N2 0
Ae
At
dt
5. Законы затухания люминесценции
dN2 tN2 0
Ae At dt
Законы затухания
люминесценции
1
A
6.
dN2 tN2 0
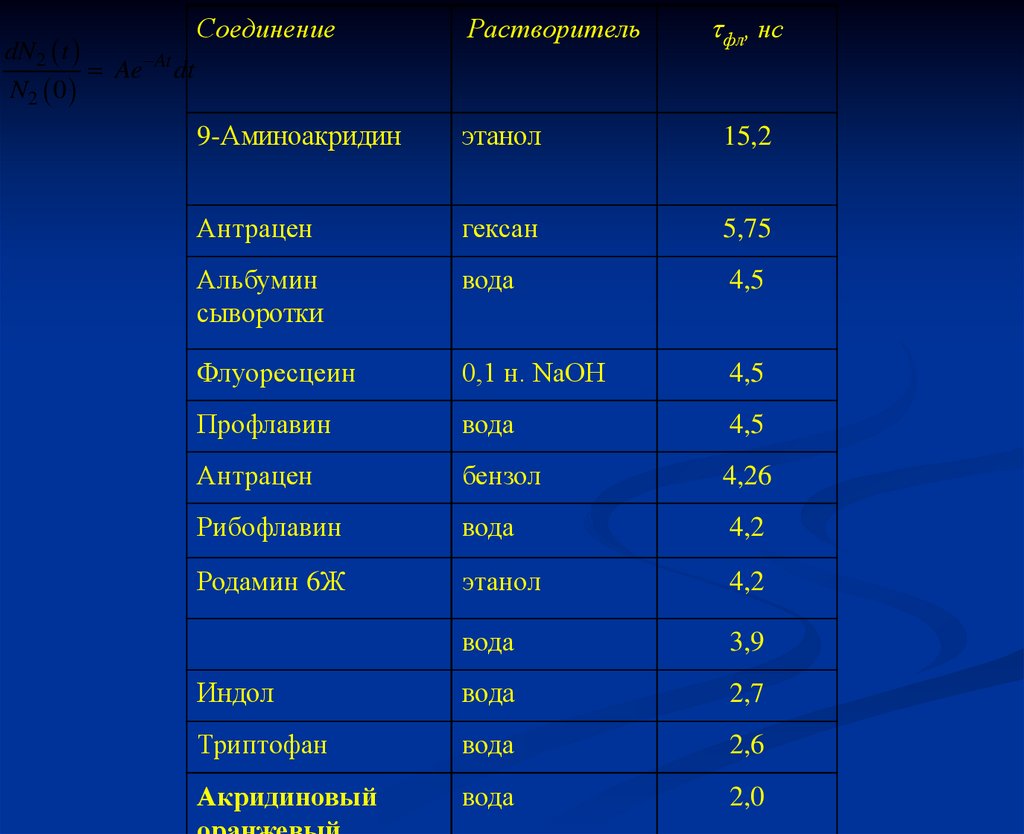
фл, нс
Соединение
Растворитель
9-Аминоакридин
этанол
15,2
Антрацен
гексан
5,75
Альбумин
сыворотки
вода
4,5
Флуоресцеин
0,1 н. NaOH
4,5
Профлавин
вода
4,5
Антрацен
бензол
4,26
Рибофлавин
вода
4,2
Родамин 6Ж
этанол
4,2
вода
3,9
Индол
вода
2,7
Триптофан
вода
2,6
Акридиновый
вода
2,0
Ae At dt
7.
dN2 tAe At dt
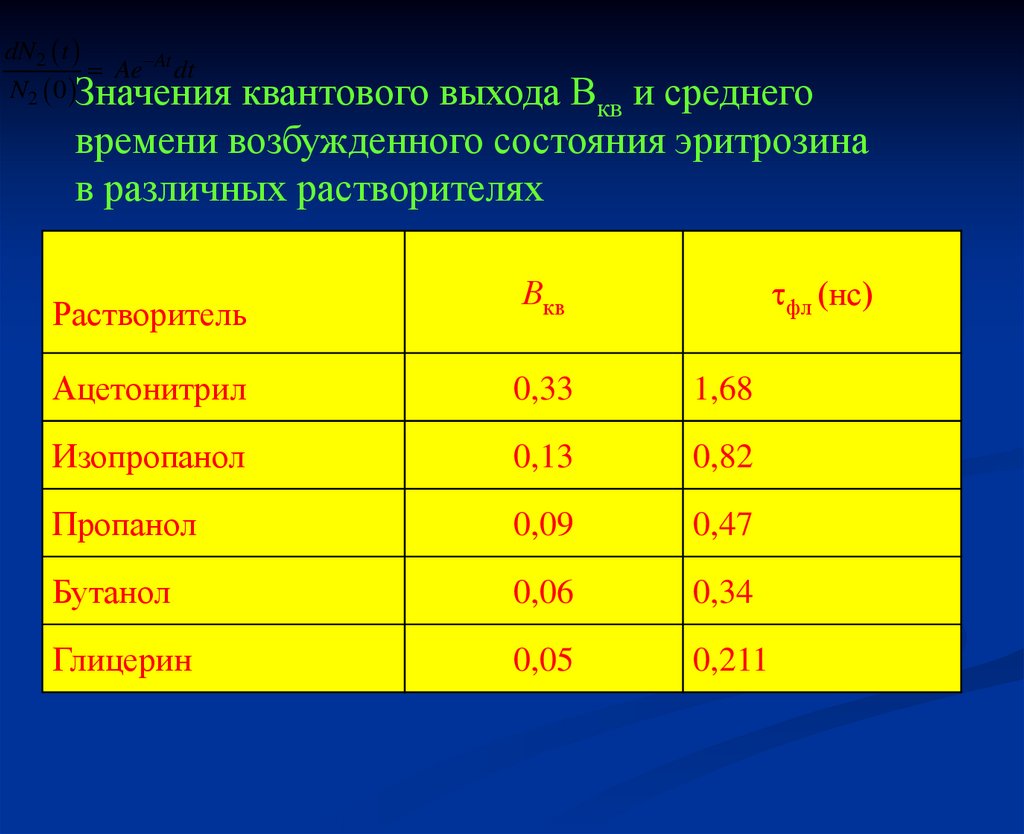
N2 0 Значения
квантового выхода Вкв и среднего
времени возбужденного состояния эритрозина
в различных растворителях
фл (нс)
Растворитель
Вкв
Ацетонитрил
0,33
1,68
Изопропанол
0,13
0,82
Пропанол
0,09
0,47
Бутанол
0,06
0,34
Глицерин
0,05
0,211
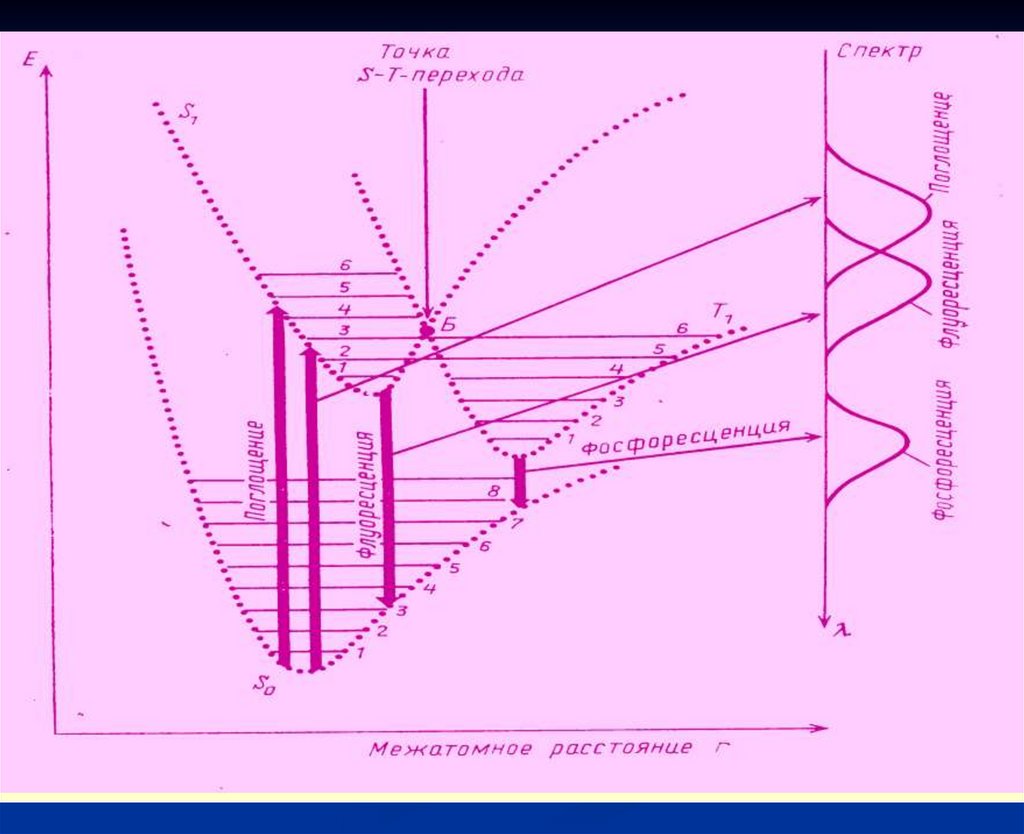
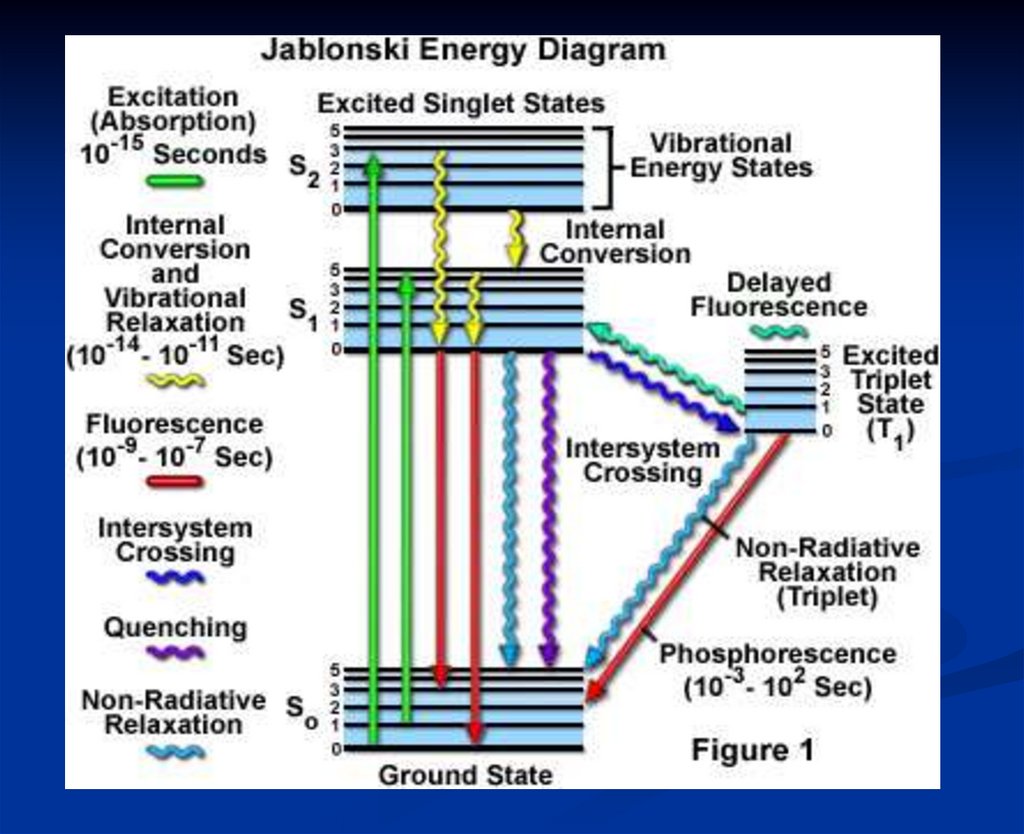
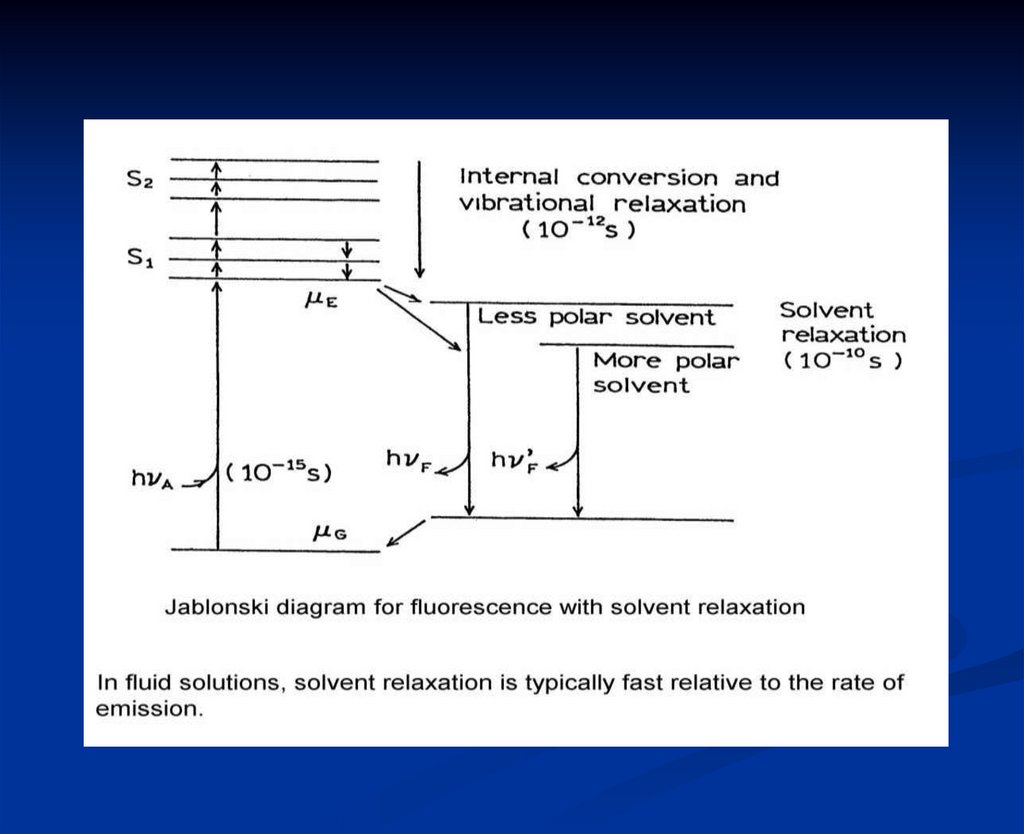
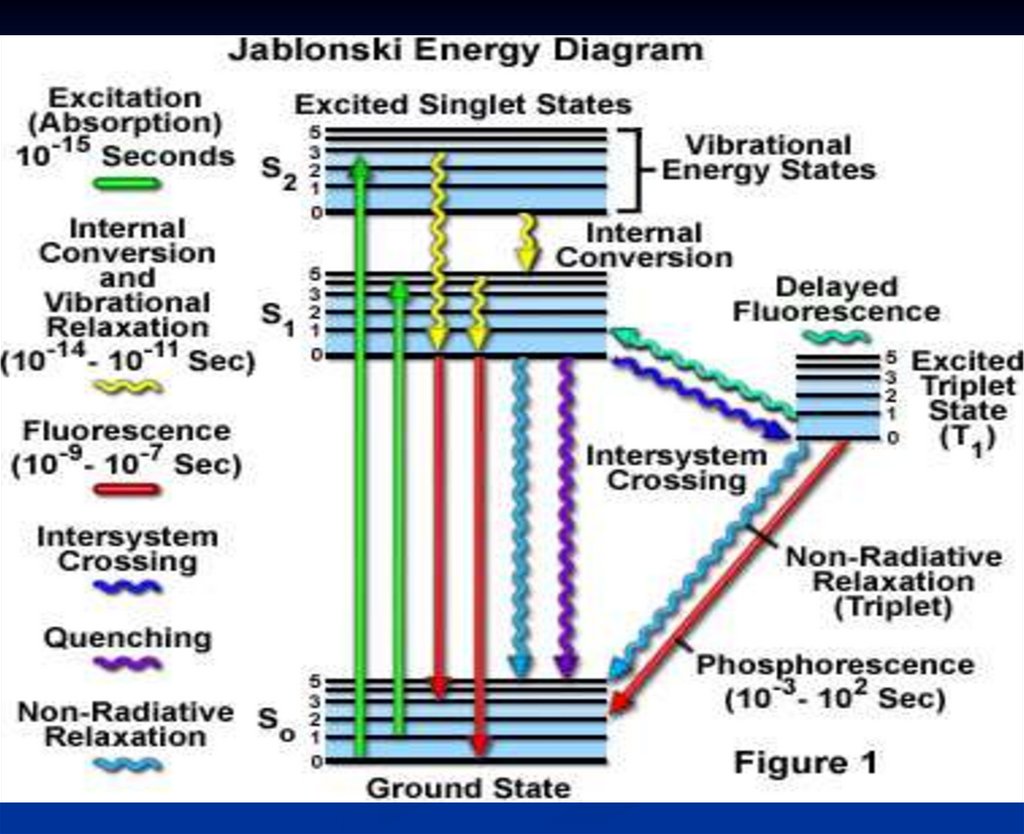
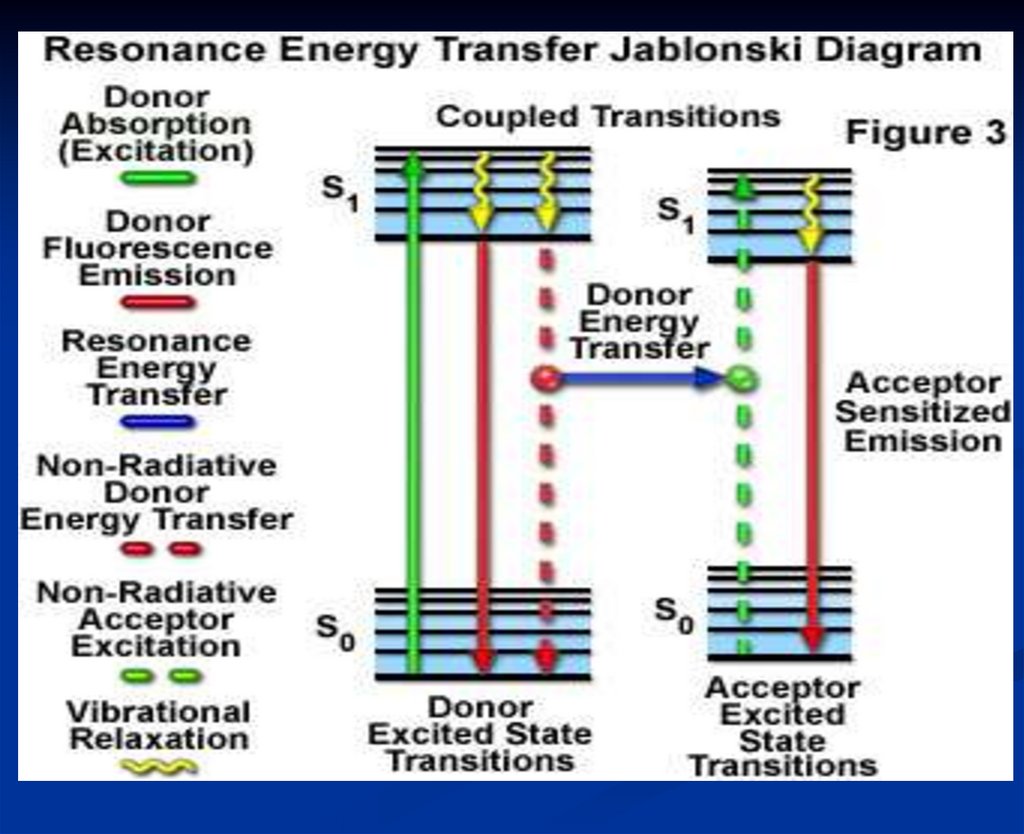
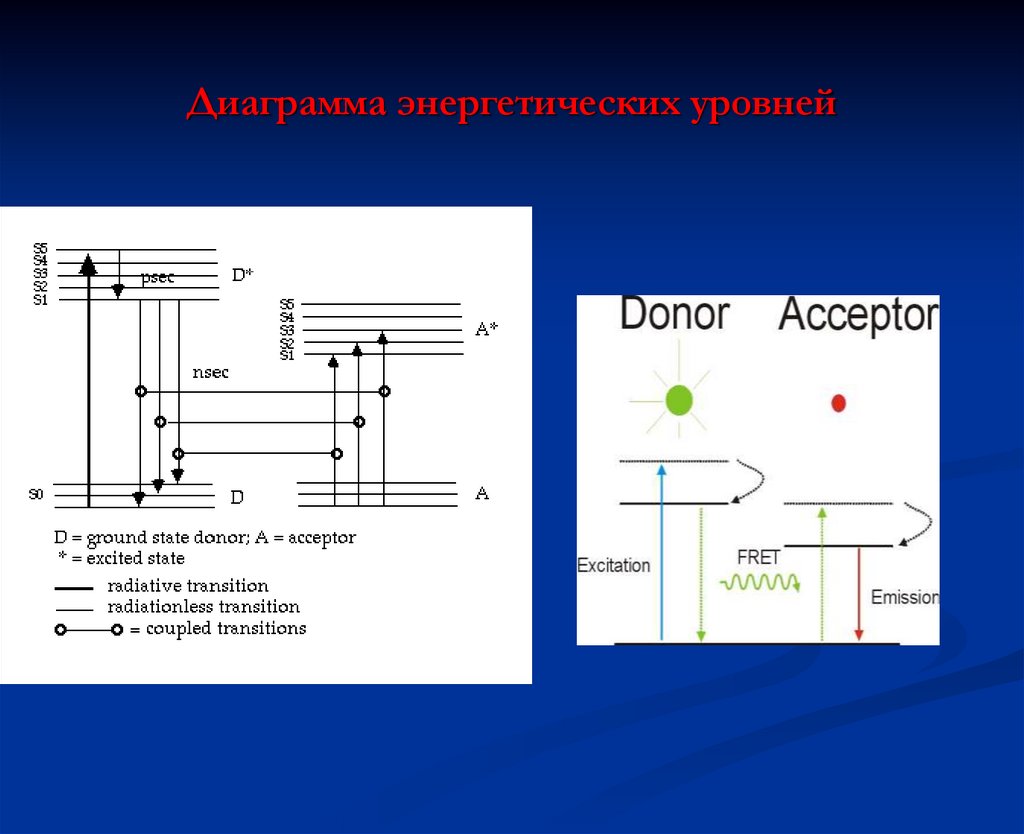
8. Диаграмма энергетиеских уровней (диаграмма Яблонского)
9. Длительные процессы свечения
Фосфоресценция .Внутренняя иинтекомбинационная конверсия
S0 hv S1 T1 S0 hvфос
10. Фосфоресценция
11.
Процессhv0 + S0 S1 (возбуждение),
Iвозб
S1 ◠◡◠◡ S0 + тепло
(внутренняя конверсия)
kвк [S1 ]
S1 ◠◡◠◡ T1 + тепло
(интеркомбинационная
конверсия)
KST [S1 ]
T1 ◠◡◠◡ S0 + тепло
(интеркомбинационная
конверсия)
KT [T1 ]
T1 S0 + hvфос
(фосфоресценция),
Kфос [T1]
S1 S0 + hvфл
(флуоресценция),
Kфл [S1 ]
(замедленная
флуоресценция)
Kе [T1 ]
12.
13.
Квантовый выход флуоресценцииF
Число фотонов флуоресценции
Число фотонов поглощенных
F
k F k ic
kF
k isc k pd k d
kF = излучение(S1 S0)
kic = внутренняя конверсия
(S1 S0)
kisc = интеркомбинационная
конверсия (S1 T1)
kpd = предиссоциация
kd = диссоциация
14.
Диактивациоонные процессы:a) Колебательная релаксация: столкновение
растворителя
- l излучения > l возбуждения (Стоксов
сдвиг)
- колебательная релаксация эффективна и
идет на нижние колебательные уровни
электронного состояния с 10-12s или меньше.
- значительно короткое время жизни чем
электронного возбужденного состояния
- флуоресценция происходит с низжнего
колебательного уровня электронного
возбужденного состояния, но может
происходить на верхние колебательные
уровни основного состояния.
b) Внутренняя конверсия:
- пересечение e- с нижним электронным
состоянием.
-диссоциация: прямое возбуждение
(поглощение) колебательного
состояния с достаточной энергии для
разрыва связи
-предиссоциация: релаксация
колебательного состояния to vibrational
state of низшего электронного состояния с
достаточным количеством энергии
разорвать связь
- переход S1 на S0
- эффективный,поэтому многие вещества не
флуоресцирует
- -особенно вероятный, если колебательные
уровни двух электронных состояний
пересекаются, может привести к
предиссоциации или диссоциации.
15.
c)Внешняя конверсия:Дизактивация благодаря
столкновению с растворителем
(столкновительное тушение)
Уменьшение столкновений
увеличивается флуоресценция
или фосфоресценции
Уменьшается температура и /или
увеличивается вязкость
Уменьшается концентрация
тушителя
d) Интеркомбинационные переходы:
-Спин электрона «переворачивается»
- Изменение мультиплетности в молекуле
(синглет на триплет)
- увеличиваются, если колебательные уровни
перекрываются
- вероятен, если молекула содержит тяжелые
атомы (I, Br)
e) Фосфоресценция:
переход с триплетного электронного
состояния в основное с излучением
фотона
16. Влияние внутри и межмолекулярных взаимодействий на люминесценцию
17.
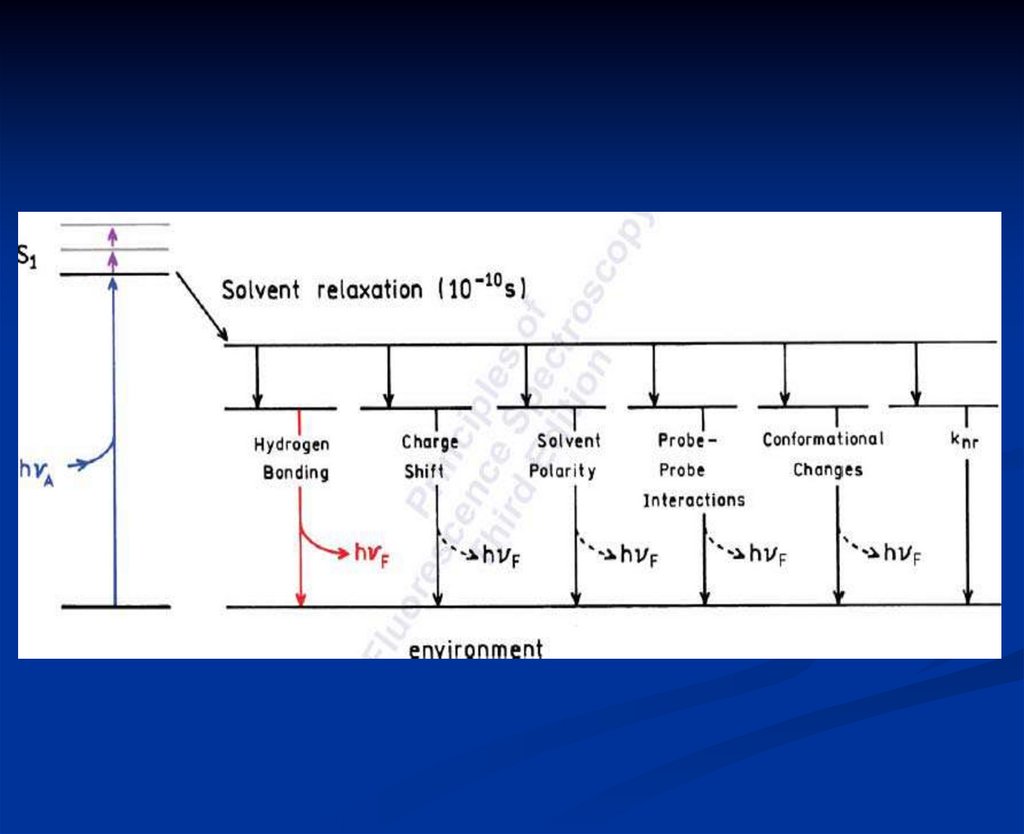
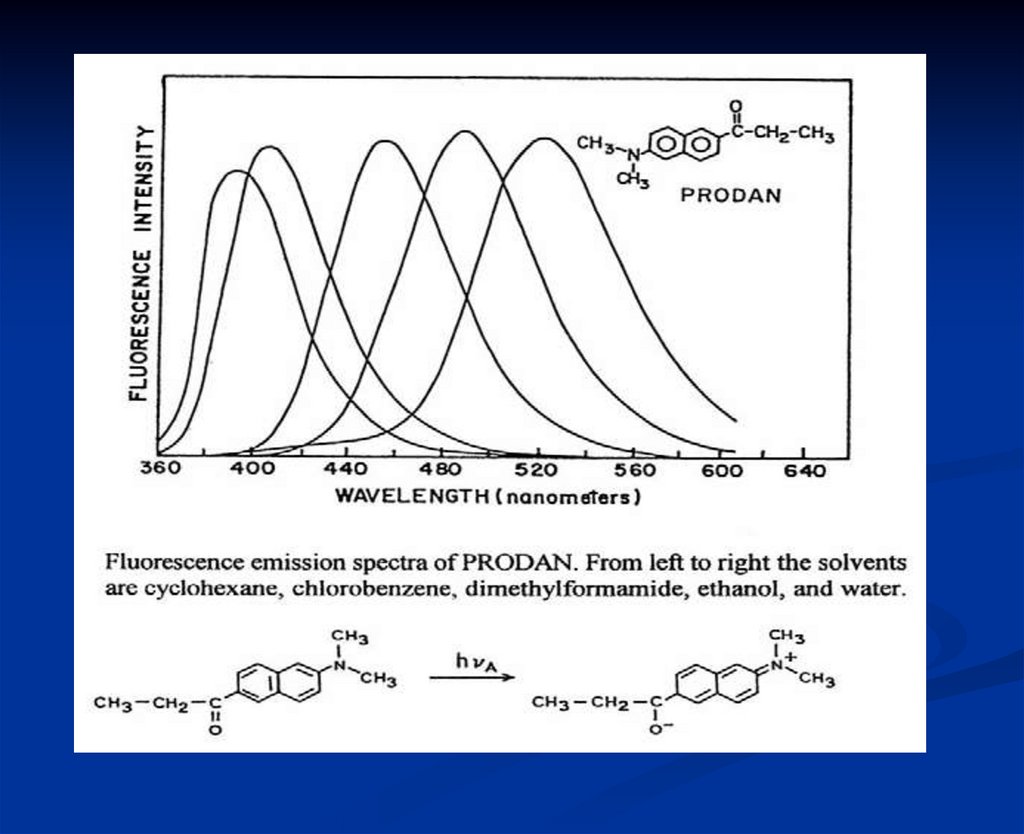
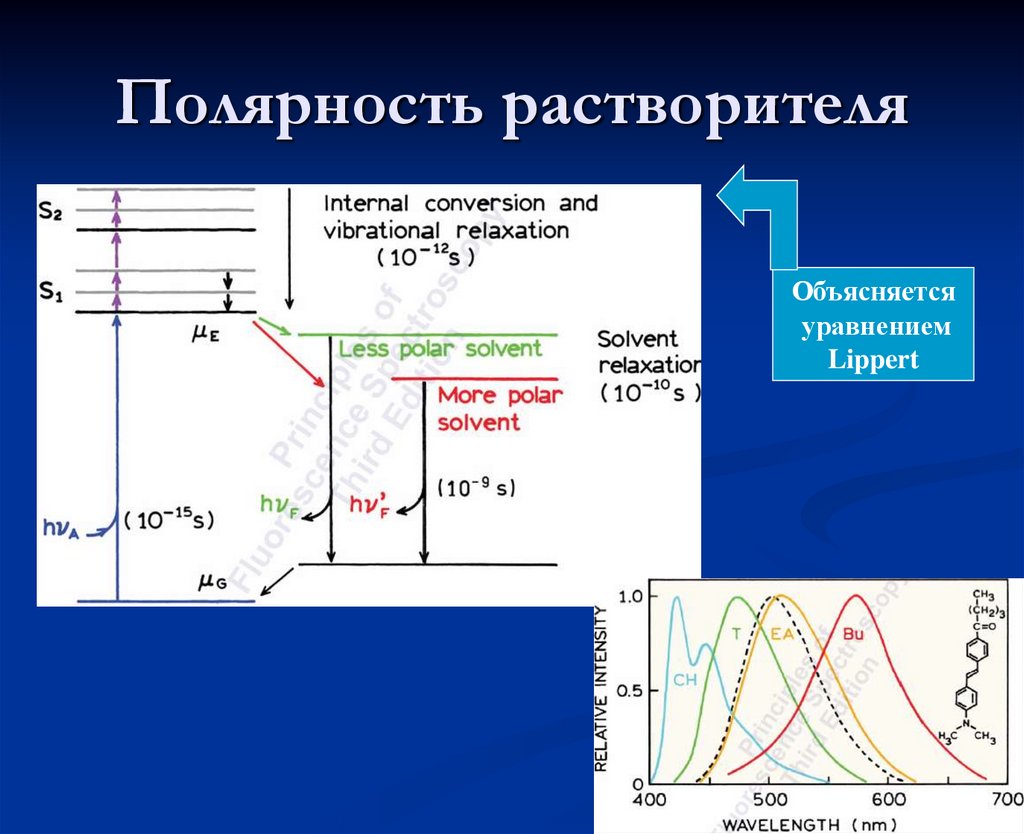
Эффекты растворителя и окружающейсреды на спектры флуоресценции
Полярность и вязкость растворителя
Скорость релаксации растворителя
Конформационные изменения в молекуле-активаторе
Жесткость локального окружения
Внутренний перенос заряда
Перенос протона и реакции в возбужденном состоянии
Взаимодействие между молекулами-активатора
Изменение скоростей излучательного и
безызлучательного переходов
18.
19. Молекулярные процессы в конденсированной фазе
•Диффузия•Релаксация
•Сольватация
•Перенос заряда (электрон и
протон)
•Растворитель: активный
участник – энергия, трение,
сольватация
Молекулярная
временная шкала
Диффузия D~10-5cm2/s
Электронные 10-16-10-15s
Колебания 10-14s
Колебательная
релаксация 1-10-12s
Химические реакции
xxxxxxxxx1012-10-12s
Вращения 10-12s
Время столкновения
10-12s
20.
21.
22.
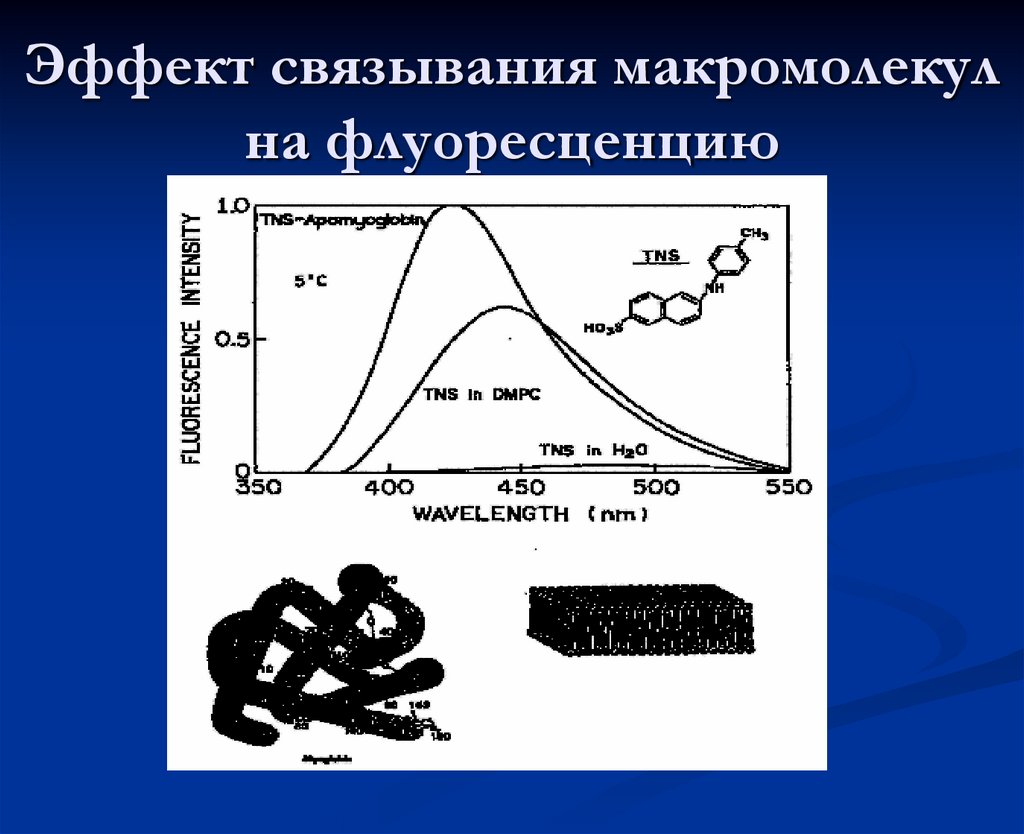
Полярность растворителя23. Эффект связывания макромолекул на флуоресценцию
24.
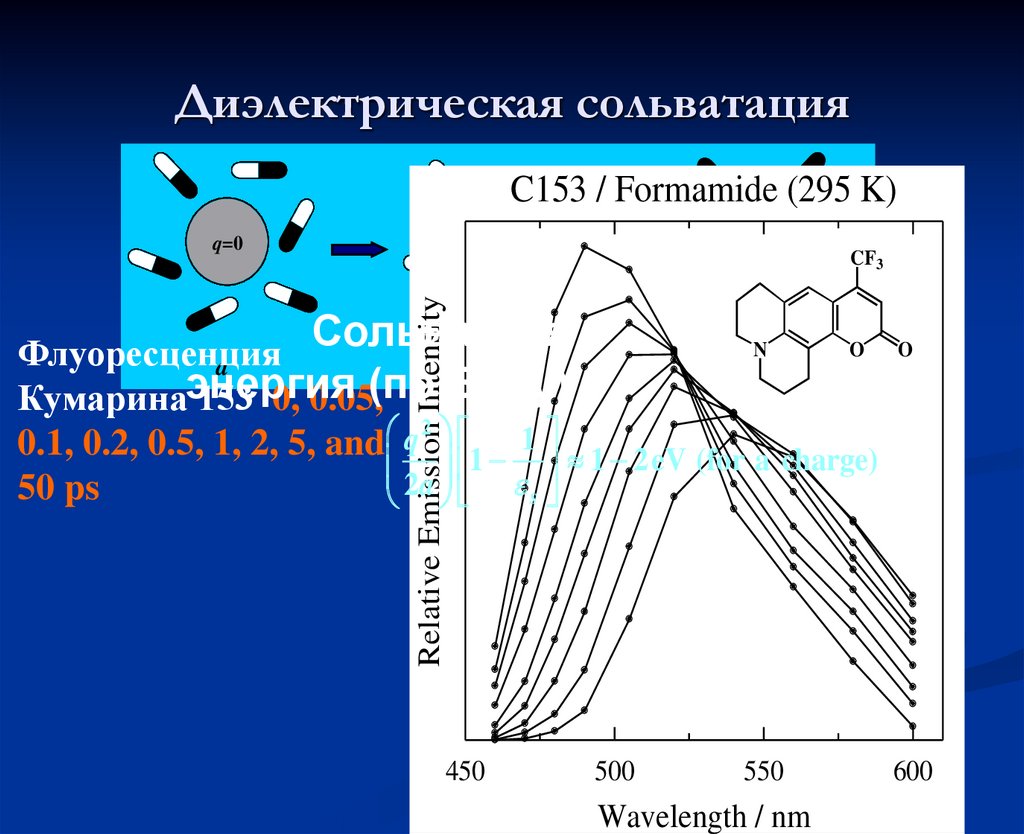
25. Диэлектрическая сольватация
C153 / Formamide (295 K)q=0
q=+e
Relative Emission Intensity
q=+e
Сольватная
CF3
N
O
Флуоресценция
a
b
c
энергия
(по
Бору)
Кумарина 153 0, 0.05,
2
0.1, 0.2, 0.5, 1, 2, 5, and q 1 1 1 2eV (for a charge)
2
a
50 ps
s
450
500
550
Wavelength / nm
O
600
26.
Существует три вида ван-дерваальсовых (универсальных)взаимодействий:
1 2 1
ор 6 2
Ориентационные
i 1 ri 3 kT
N
Индукционные
N
инд
1
6
i 1 ri
Дисперсионные
g
дисп
N
a
1
6
n 1 ri
3I u0 I v0
2
0
a
0
2 Iv Iu
где r – расстояние между молекулами активатора и растворителя,
a поляризуемость молекул растворителя,
I u0(v–) потенциал ионизации молекул активатора (растворителя).
27. Полярность растворителя
Объясняетсяуравнением
Lippert
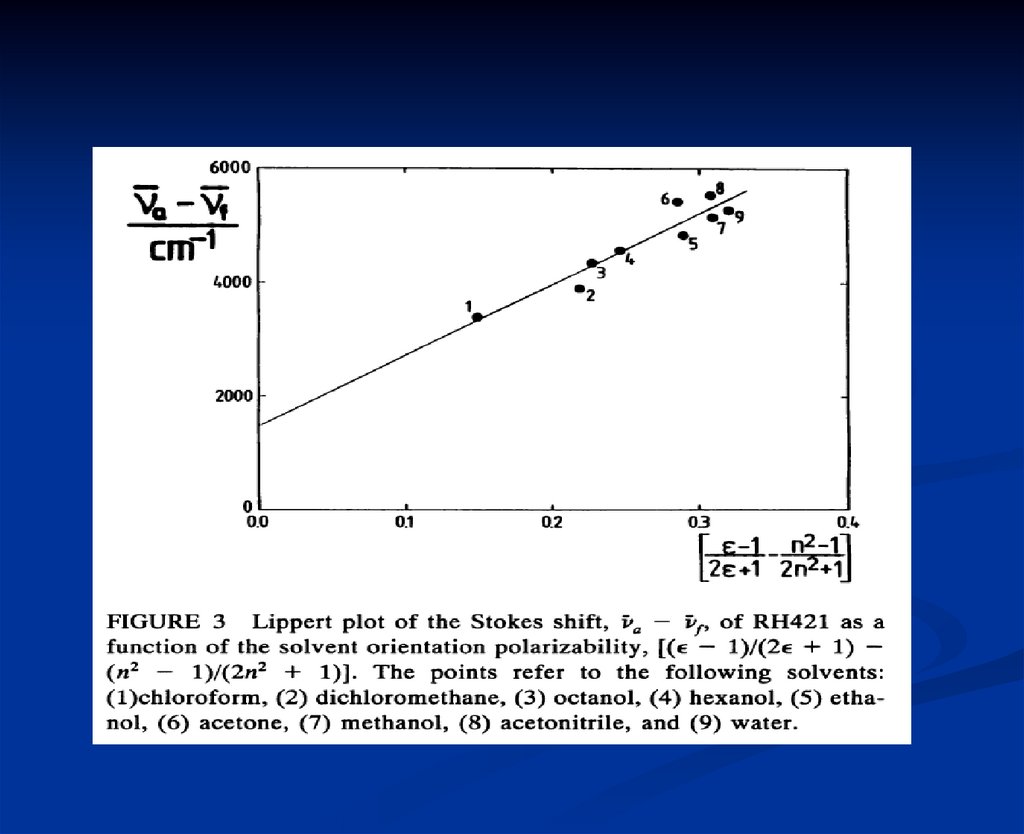
28. Уравнение Lipperta
2RA a 3 Ff
2 1
n2 1
2
E G const
2 2 1
2
hca
2n 1
Уравнение Lipperta
2 1 n2 1
2
A F
E
G const
2 2 1
2
hca
2n 1
Ориентационная поляризуемость
Энергия диполя в электрическом поле
Edipole R
R- электрическое поле (реактивное)
индуцированное диполем
f- поляризуемость растворителя
a- радиус полости
R
2
a
3
f
29. Поляризуемость растворителя: подвижность электронов растворителя и дипольного моменте молекул растворителя
Высокочастотная поляризуемостьf(n)
n2 1
2n 2 1
- перераспределения электронов растворителя
Низкочастотная поляризуемость
1
f
2 1
-переориентация диполей растворителя
1
n2 1
Df
2
2 1 2 n 1
Ориентационная
поляризуемость
вода
этанол
гексан
78,3
24,3
1,89
n
1,33
1,35
1,37
Df
0,32
0,30
0,001
30.
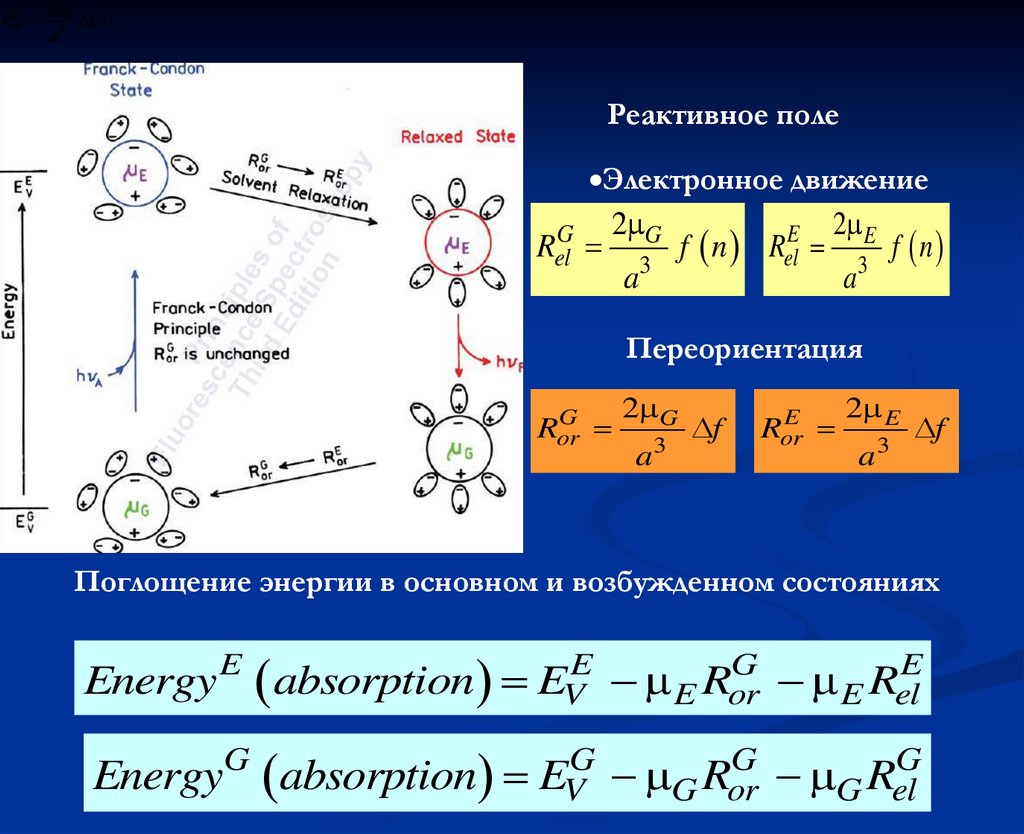
GRel
or
2 GG
a33
D
f f n
Реактивное поле
Электронное движение
RelG
2 G
a
3
f n RelE
2 E
a
f n
3
Переориентация
G
Ror
2 G
a
3
Df
E
Ror
2 E
a
3
Df
Поглощение энергии в основном и возбужденном состояниях
G
Energy E absorption EVE E Ror
E RelE
G
EnergyG absorption EVG G Ror
G RelG
31.
DEhc
DE
hc
Энергия поглощения
hc A hc A V
G
E G Ror
E
E Rel
G
G Rel
Энергии двух уровней для излучения
Energy E emission EVE E RorE E RelE
EnergyG emission EVG G RorE G RelG
Энергия излучения
hc F hc F V
A F
E
E G Ror
E
E Rel
1
E G RorG RorE const
hc
G
G Rel
32.
A F2
hca 2
E
G G Df E Df const
A F
A F
2
hca
2Df
hca
2
1 n2 1
Df
2
2 1 2 n 1
2
E G G Df
E G
2
const
E Df const
33.
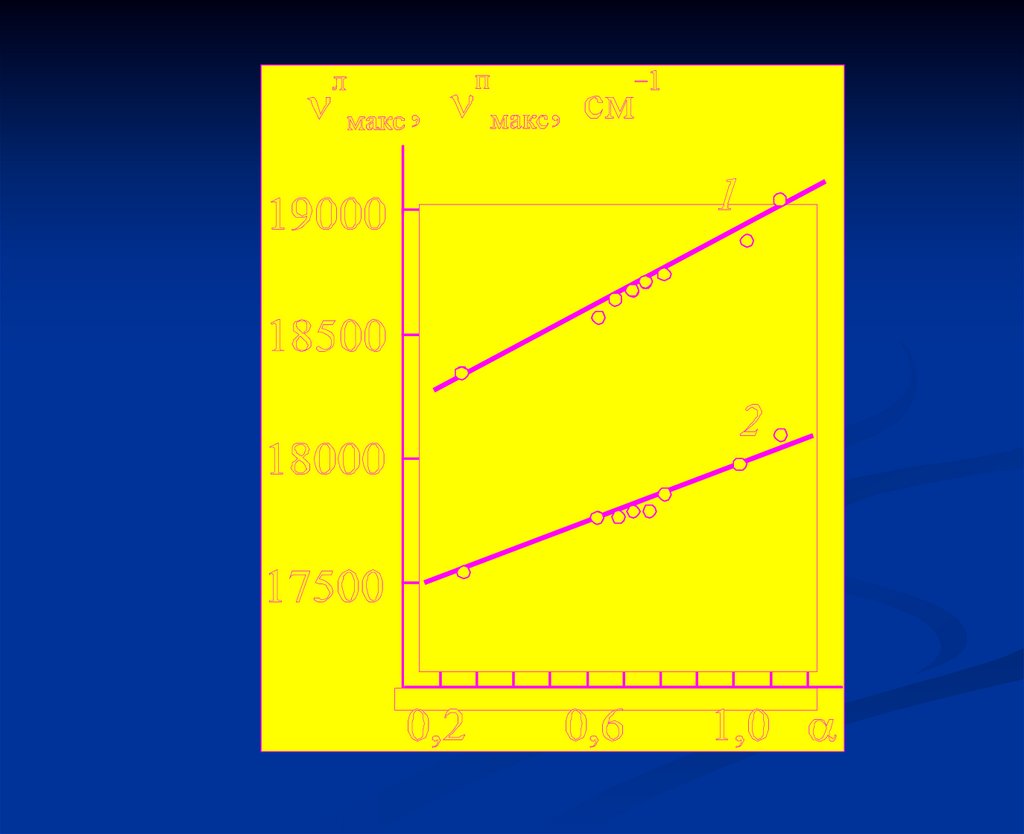
34. Специфические взаимодействия
35.
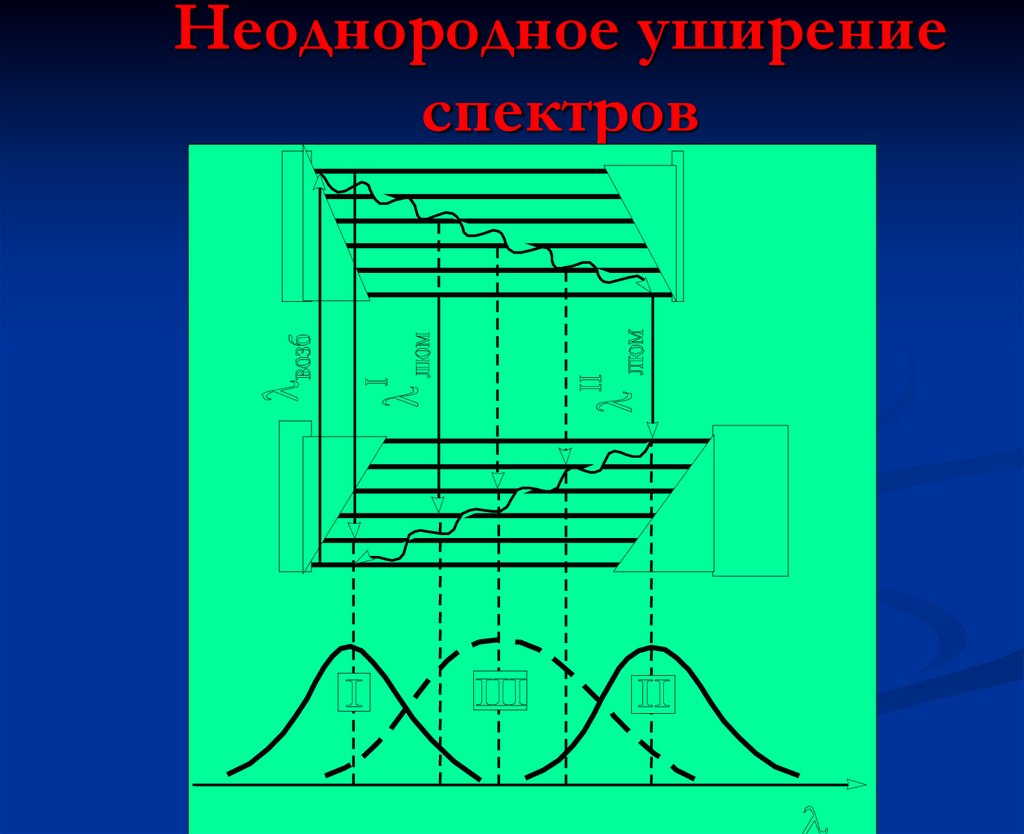
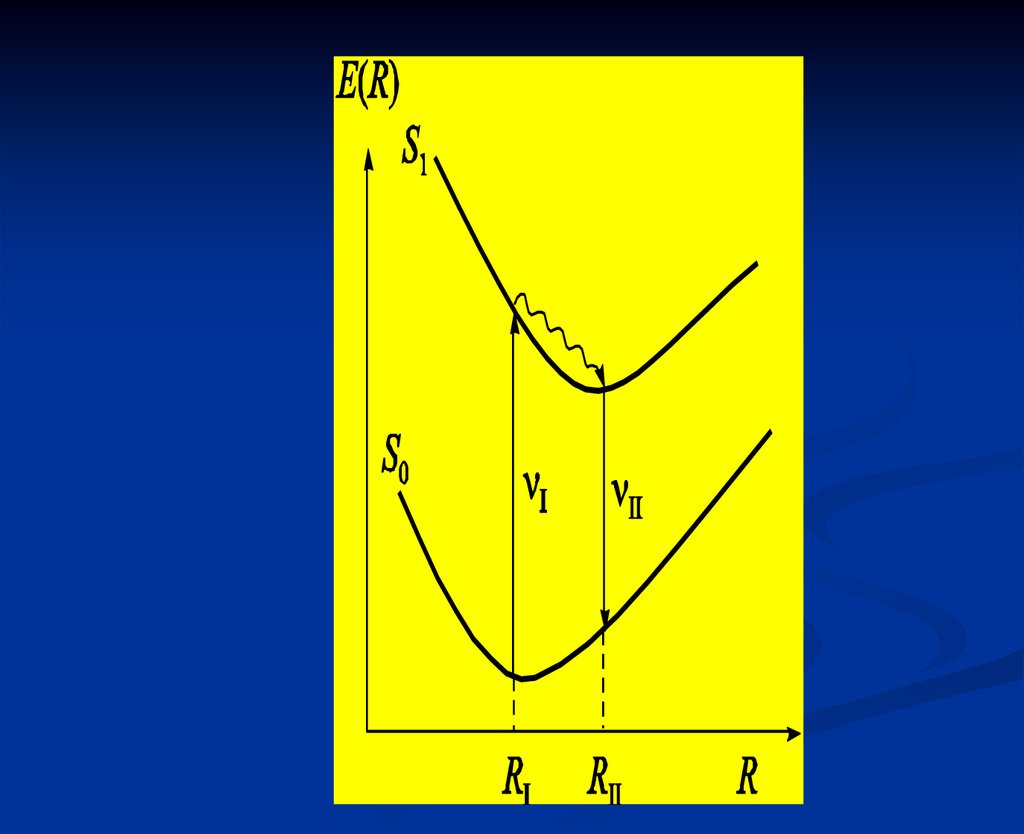
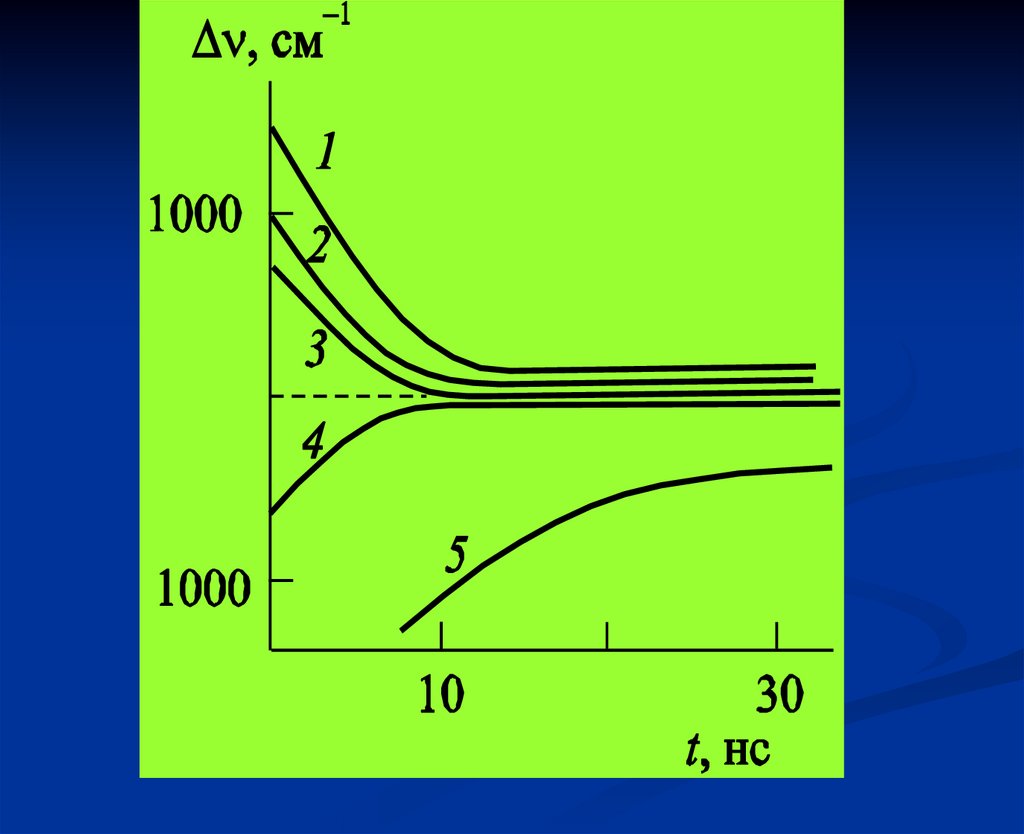
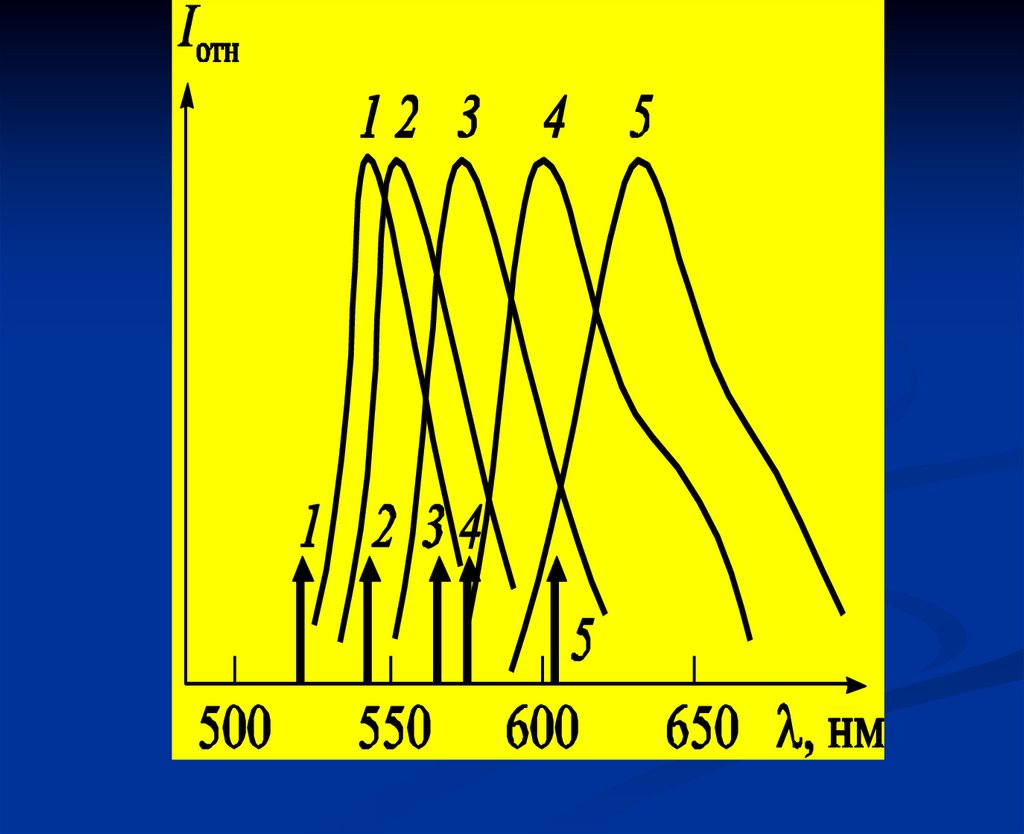
36. Неоднородное уширение спектров
37.
38.
39.
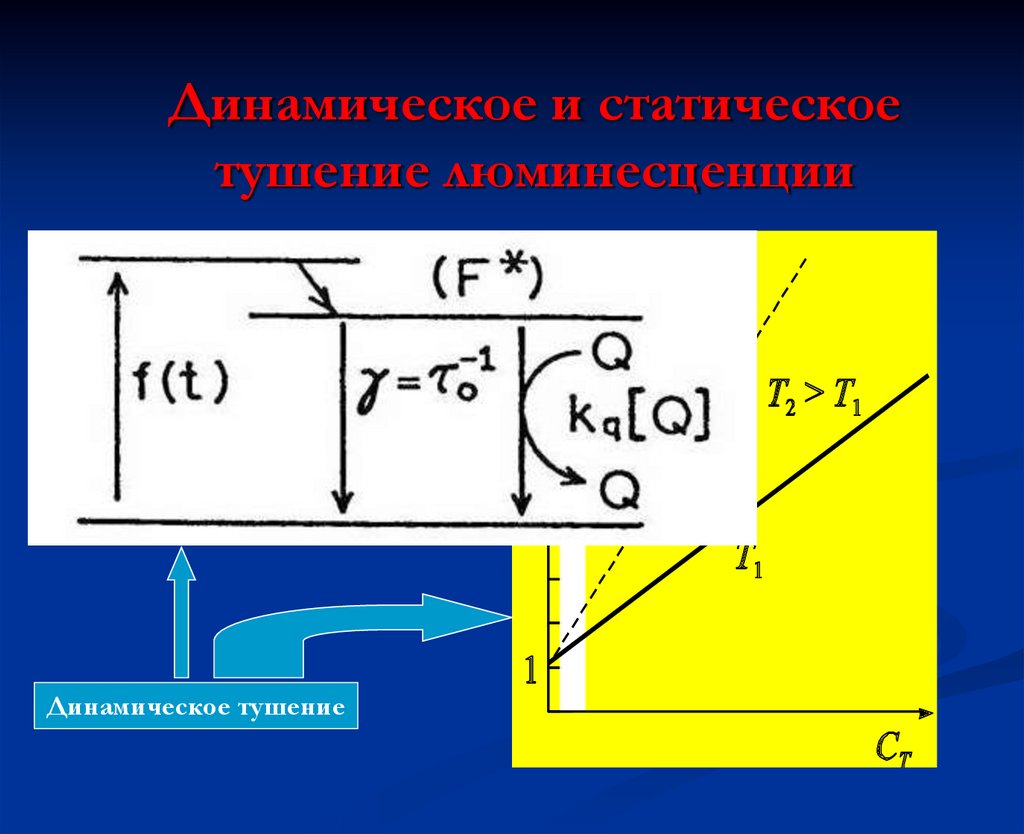
40. Динамическое и статическое тушение люминесценции
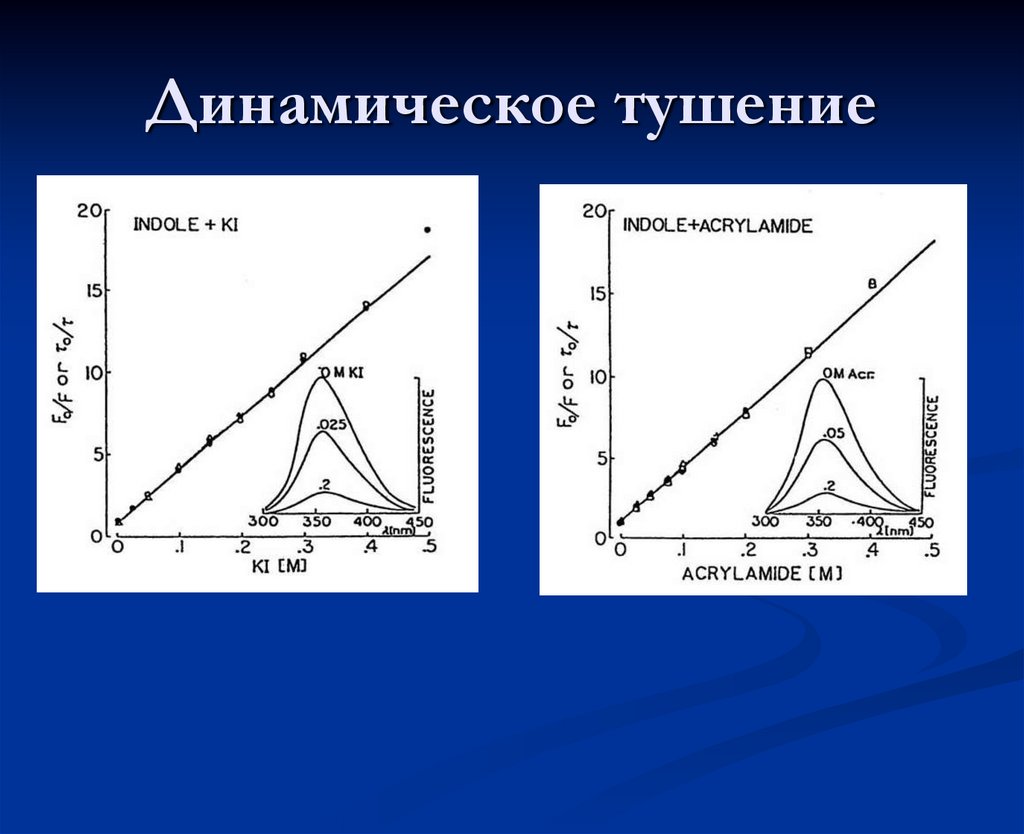
Динамическое тушение41. Динамическое тушение
42.
Динамическое и статическоетушение люминесценции
Статическое тушение
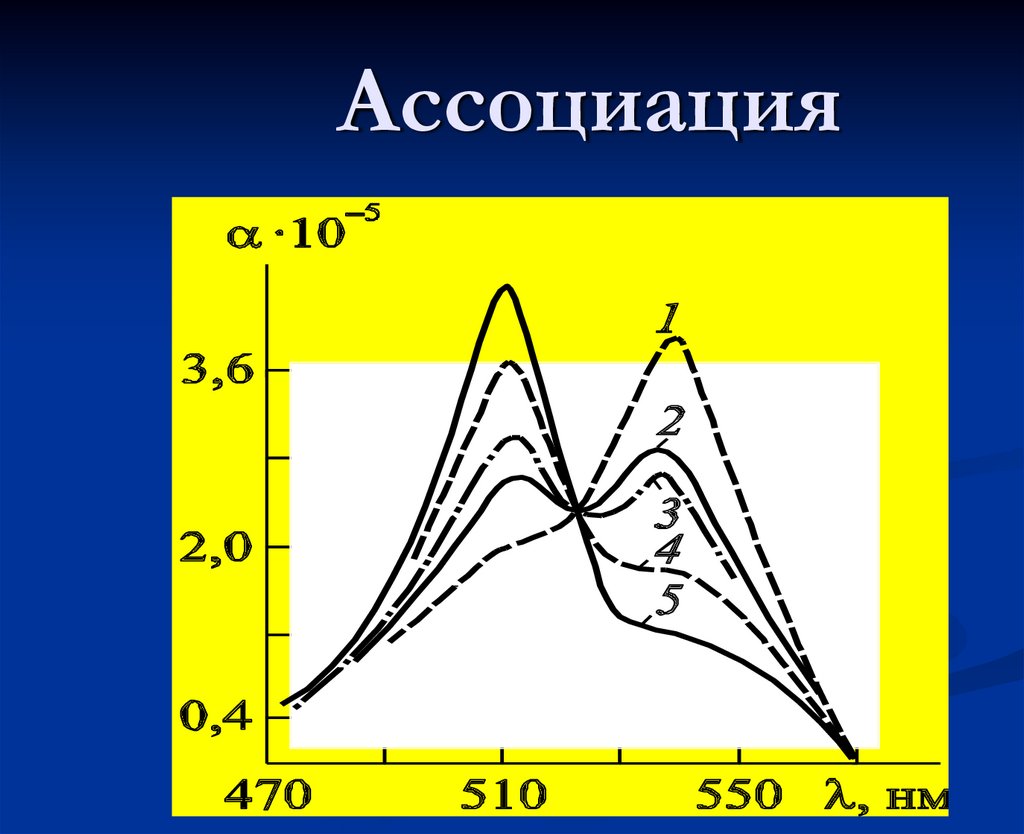
43. Ассоциация
44. Сравнение динамического и статического тушения
Для динамического и статическоготушения флуоресценции
наблюдается одинаковая
зависимость от концентрации
тушителя !!!
45.
ФлуоресценцияМолекулы могут излучать свет большей длны
волны, чем длина волны возбуждающего света
D + hv E
D*
ki
D
kf
D + hv F
46.
Квантовый выход QОтношение числа фотонов
излучающих к числу фотонов
поглощенных
Время жизни
Среднее время между
временем возбуждения и
временем возвращения в
основное состояние
47.
ПРОЦЕССЫ ПЕРЕНОСАЭНЕРГИИ ЭЛЕКТРОННОГО
ВОЗБУЖДЕНИЯ
48.
49.
ФлуоресценцияМолекулы могут излучать свет большей длны
волны, чем длина волны возбуждающего света
D + hv E
D*
ki
D
kf
D + hv F
50.
Квантовый выход QОтношение числа фотонов
излучающих к числу фотонов
поглощенных
Время жизни
Среднее время между
временем возбуждения и
временем возвращения в
основное состояние
51.
ДонорАкцептор(ы)
52. ПЭЭВ
53.
НАЗВАНИЕ?Флуоресцентный резонансный перенос энергии
или
Ферстеровский резонансный перенос энергии E
(FRET -ПЭЭВ)
?? is it resonance ??
Fluorescence Energy Transfer (FET)
or
Förster Energy Transfer (FET)
(D*,A)—>(D,A*)
-----------------------------------------------------------------
54. Диаграмма энергетических уровней
55.
Реакционная схемаD- донор A- акцептор
hv e,d,f – энергия фотона для процессов
K di,ai – безызлучательные константы затухания
K d – излучательная константа затухания для донора в отсуствии акцептора
K a – излучательная константа затухания для акцептора
K t – скорость передачи энергии
56.
Квантовый выход донора в присутствииакцептора Q
Квантовый выход донора Q в присуствии (Qda) и
отсутствии акцептора and (Qd)
57.
Эффективность ПЭЭВ EИзмерение интенсивности
флуоресценции донора с акцептором
(Qda) и без него (Qd).
Используя время жизни донора в
присутствии акцептора (Tda) и
отсуствии акцептора (Td)
где
58.
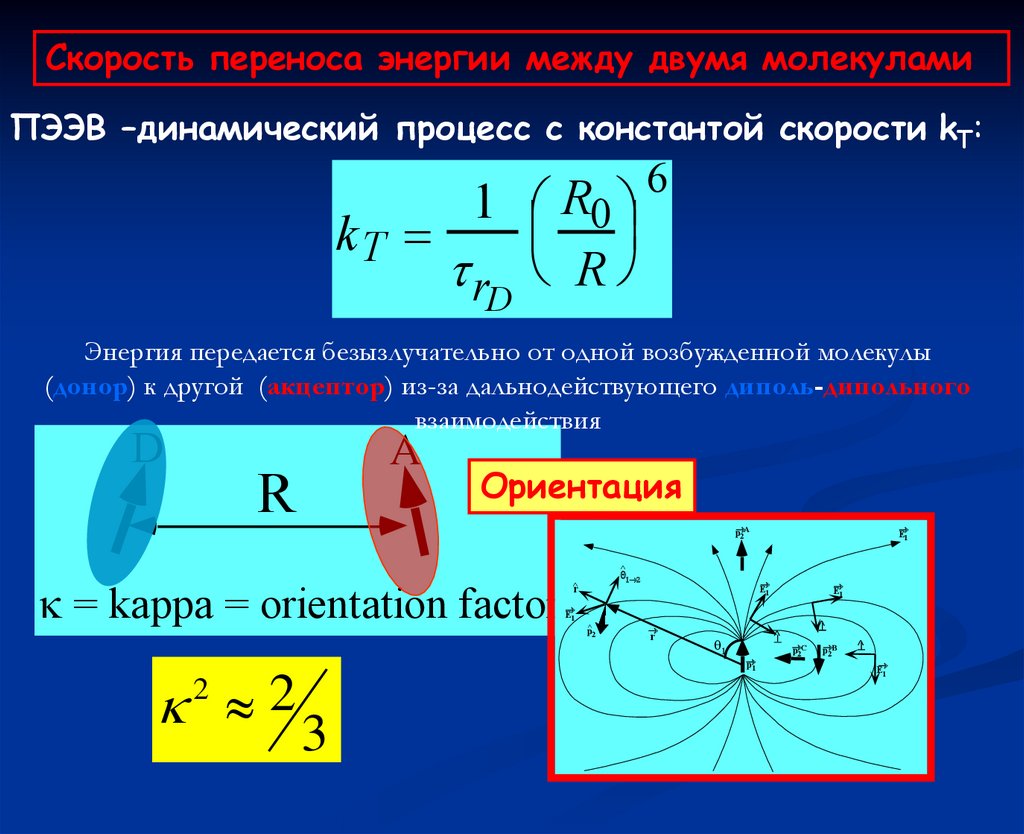
Скорость переноса энергии между двумя молекуламиПЭЭВ –динамический процесс с константой скорости kT:
6
R
1 0
kT
rD R
Энергия передается безызлучательно от одной возбужденной молекулы
(донор) к другой (акцептор) из-за дальнодействующего диполь-дипольного
взаимодействия
D
R
A
Oриентация
= kappa = orientation factor
23
2
A
p
2
^
^r
E1
^
p
2
E1
E1
r
E1
p1
p2C
B
p
2
E1
59.
Fritz LondonVan der Waals interaction
Quantum Theory: London, 1930; London, 1937
2nd order perturbation theory
Fluctuating Induced-Dipole-Induced-Dipole
1 R
6
60.
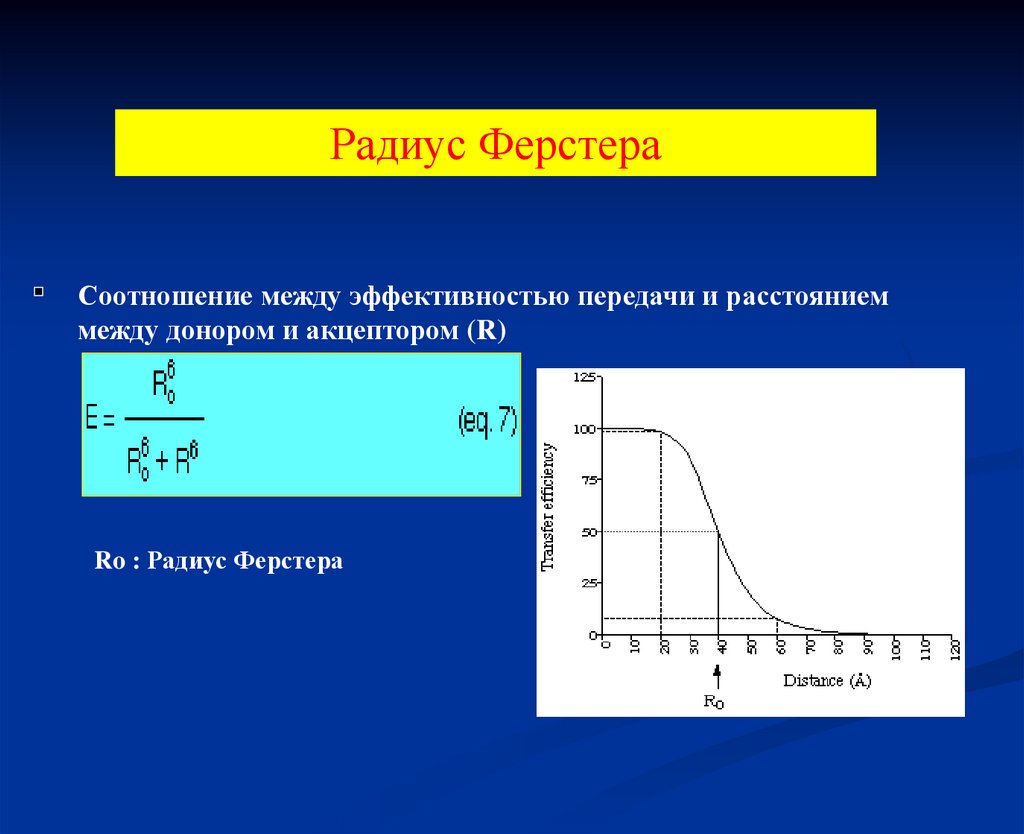
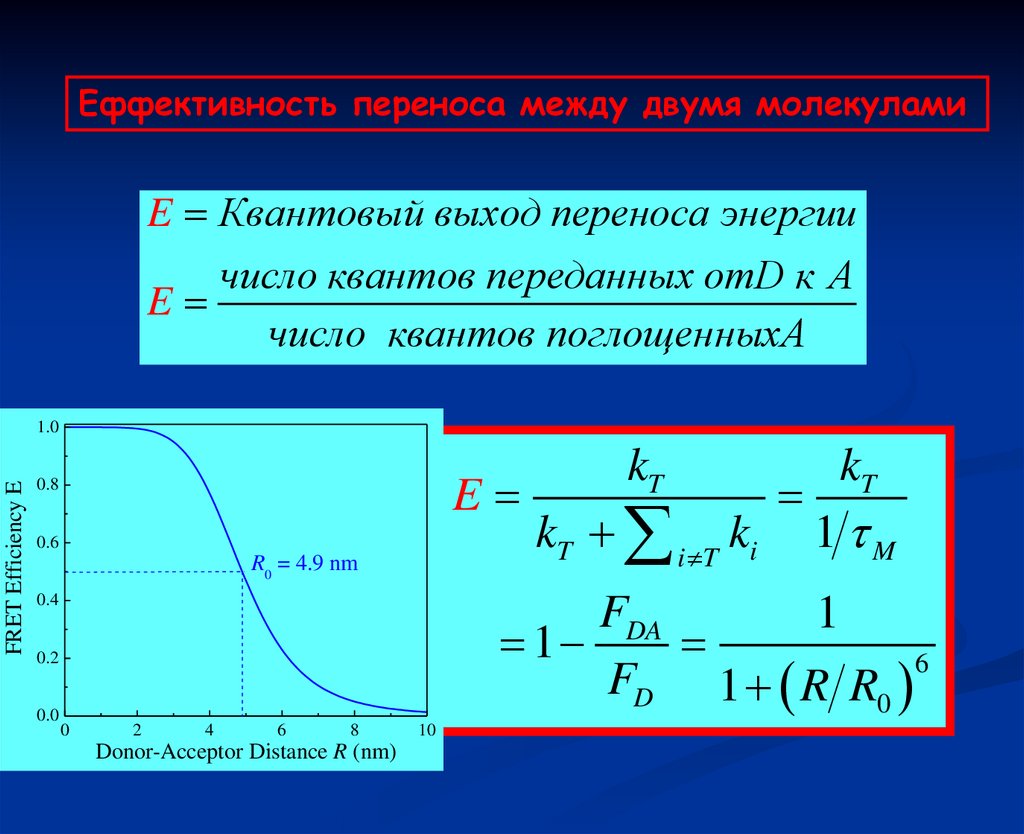
Радиус ФерстераСоотношение между эффективностью передачи и расстоянием
между донором и акцептором (R)
Ro : Радиус Ферстера
61.
Ro может быть вычисленQd : квантовый выход донора,
n : коэффициент преломления среды
Nav : число Авагадро (Nav= 6.02 x 1023 per mole)
Kappa2 : ориентационный фактор
J : интеграл перекрытия
62.
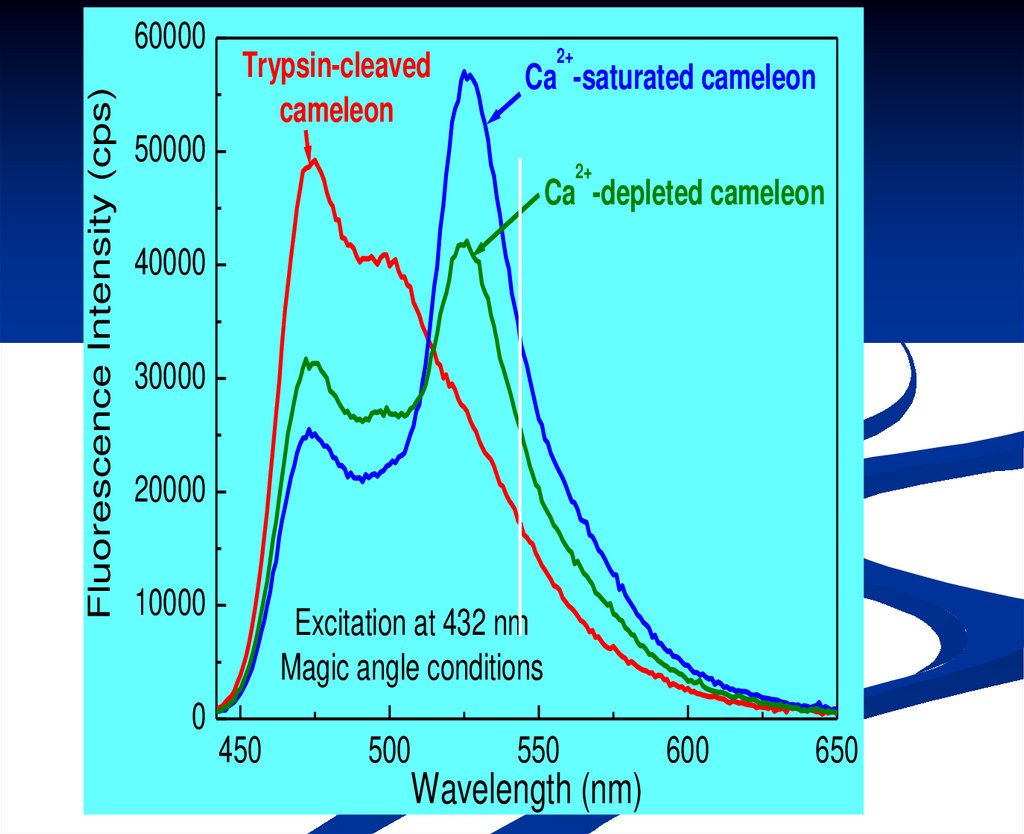
Fluorescence Intensity (cps)60000
Trypsin-cleaved
cameleon
2+
Ca -saturated cameleon
50000
2+
Ca -depleted cameleon
40000
30000
20000
10000
0
Excitation at 432 nm
Magic angle conditions
450
500
550
Wavelength (nm)
600
650
63.
Eффективность переноса между двумя молекуламиE Квантовый выход переноса энергии
число квантов переданных отD к A
E
число квантов поглощен ныхA
FRET Efficiency E
1.0
E
0.8
0.6
R0 = 4.9 nm
0.4
kT i T ki
kT
1 M
FDA
1
1
6
FD 1 R R0
0.2
0.0
kT
0
2
4
6
8
Donor-Acceptor Distance R (nm)
10
64.
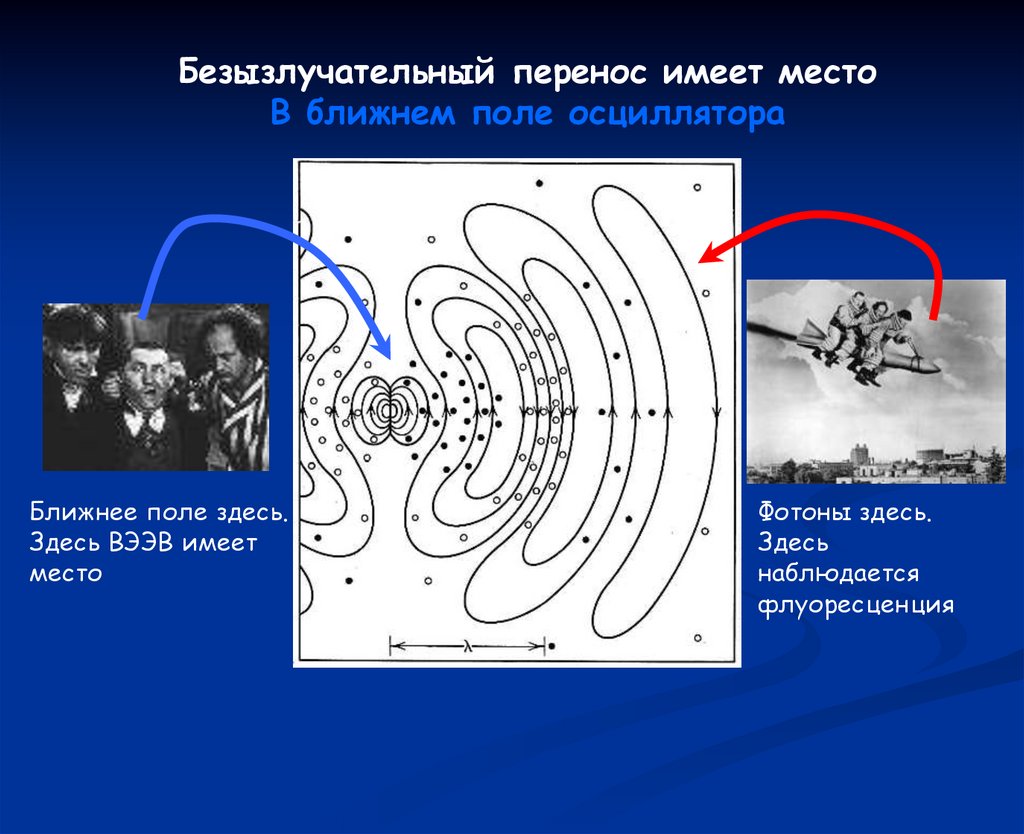
Безызлучательный перенос имеет местоВ ближнем поле осциллятора
Ближнее поле здесь.
Здесь ВЭЭВ имеет
место
Фотоны здесь.
Здесь
наблюдается
флуоресценция
65.
Дваоссцилирующих
диполя
D
A
R
= kappa = orientation factor
• Энергия взаимодейстия,Eia , между двумя идентичными диполями is
(|ближнее поле осциллирующего диполя| = поле неподвижного диполя):
1
Электрическое поле D:
ED 2 3 3 D Rˆ
n R
1
Энергия взаимодействия: Eia A ED 2 3
n R
of μ A in E D
E1
^
p
2
A
p
2
E1
E1
r
A D 3 A Rˆ D Rˆ
^
^r
Kappa!
Rˆ D
E1
p1
p2C
B
p
2
E1
66.
DR
A
= kappa = orientation factor
Ориентационный
фактор:
ˆ A ˆ D 3 ˆ A Rˆ ˆ D Rˆ
E t nf , D 2cos 1 Rˆ sin 1 ˆ1 0 n2 1 R3 exp i t Rn c
if
D A
Eнергия взаимодействия Eia A ED 2 n 2 R 3